Л. В. Щербакова практикум по аналитической химии барнаул 2004 министерство образования российской федерации алтайский государственный университет химический факультет практикум
| Вид материала | Практикум |
- Практикум Владивосток 2004 Министерство образования и науки Российской Федерации Владивостокский, 628.95kb.
- Практикум Ярославль, 2004 Министерство образования и науки РФ ярославский государственный, 885.94kb.
- Министерство Образования Российской Федерации Московский Государственный Университете, 1997.23kb.
- А. М. Горького Кафедра алгебры и дискретной математики Щербакова В. А. Лабораторный, 418.72kb.
- Анализ воды, 505.46kb.
- Российской Федерации Министерство образования и науки Российской Федерации Государственный, 343.55kb.
- Учебно-практическое пособие Хабаровск, 2001. Министерство образования Российской Федерации, 2795.36kb.
- Практикум ростов-на-Дону 2008 министерство образования и науки российской федерации, 1352.33kb.
- Учебное пособие Министерство общего и профессионального образования Российской Федерации, 936.13kb.
- Российской Федерации Уральский Государственный Университет им. А. М. Горького Философский, 1670.87kb.
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Комплексоны – это аминополикарбоновые кислоты. Например, нитрилотриуксусная кислота:
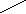 CH2-COOH
CH2-COOH
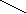 HOOC-CH2-+NН CH2-COOH ,
HOOC-CH2-+NН CH2-COOH , Этилендиаминтетрауксусная кислота (ЭДТУ):
H
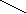
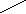 OOC-CH2 CH2-COOH
OOC-CH2 CH2-COOH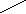
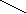 НN+- CH2-CH2-+NН
НN+- CH2-CH2-+NНH
 OOC-CH2 CH2-COOH
OOC-CH2 CH2-COOHМолекула ЭДТА содержит четыре способных к диссоциации атома водорода. В растворах имеют место следующие равновесия:
H4Y = H3Y- +H+;
H3Y- = H2Y2- +H+;
H2Y2- = HY3- +H+;
HY3- = Y4- +H+;
В сравнительно кислых растворах (рН 2) две отрицательно заряженные карбоксильные группы протонируются с образованием кислот-катионов H5Y+ и H6Y2+
H6Y2+ = H5Y+ +H+;
H5Y+ = H4Y +H+;
В обычных комплексонометрических титрованиях формы H5Y+ и H6Y2+ практически не присутствуют.
ЭДТУ быстро и стехиометрично реагирует с ионами металлов, однако она малорастворима в воде и поэтому применяют ее двунатриевую соль – этилендиаминтетраацетат натрия (ЭДТА, комплексон III или трилон Б, сокращенно Na2H2Y).
При титровании ЭДТА солей металлов-комплексообразователей в заключительной стадии определения протекают следующие реакции:
Na2H2Y = 2 Na+ + H2Y2-
Me2+ + H2Y2- = MeY2-+ 2H+
Me3+ + H2Y2- = MeY-+ 2H+
Ионы металлов, независимо от заряда, реагируют с ЭДТА в соотношении 1:1.
Лабораторная работа №2
Определение содержания магния(II)
Комплексонометрическое определение ионов магния основано на реакции:
Mg2++ H2 Y2-= MgY2- + 2H+
Реагенты:
ЭДТА 0,0500 М раствор;
Аммиачная буферная смесь с рН 10;
Индикатор эриохром черный Т.
Выполнение определения
1. Готовят 250 мл 0,0100 М раствора комплексона III (трилона Б) из 0,0500 М раствора.
2. Получают у преподавателя исследуемый раствор соли магния (II) в мерную колбу вместимостью 100,0 мл. Разбавляют до метки дистиллированной водой.
3. Бюретку заполняют раствором комплексона III.
4. Пипеткой Мора отбирают аликвоту исследуемого раствора (10,00 мл) и помещают ее в колбу для титрования.
5. В эту же колбу добавляют мерным цилиндром 5 - 7 мл аммиачной буферной смеси и 20 - 30 мг индикатора (смесь эриохрома черного Т с хлоридом натрия 1:100) на кончике шпателя.
6. Титруют исследуемый раствор соли магния комплексоном III до перехода винно-красной окраски в синюю. В конце титрования раствор комплексона III по одной капле так, чтобы красноватый оттенок совершенно исчез.
7. Результат анализа рассчитывают по формуле:
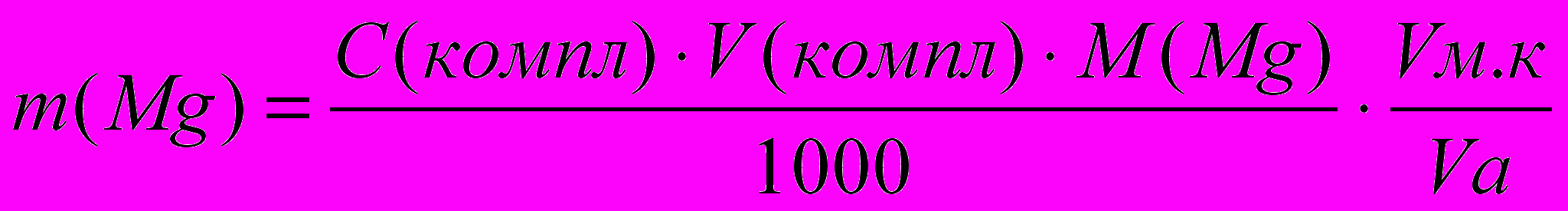
где C компл. - концентрация комплексона III
V компл. - объем раствора комплексона, пошедшего на титрование
V а - объем аликвоты исследуемого раствора соли магния
V м.к. - объем мерной колбы с исследуемой задачей
M(Mg) - молярная масса эквивалента иона магния в данной реакции.
Лабораторная работа №3
Определение общей жесткости воды
Жесткость воды обусловлена наличием в ней солей кальция и магния. Ее выражают числом миллиграм-эквивалентов кальция и магния в 1литре. Тяжелые металлы титруются совместно с кальцием и магнием, поэтому их перед титрованием осаждают сульфидом натрия или диэтилдитиокарбаминатом натрия. Практически все ионы, присутствуюшие в воде, можно замаскировать триэтаноламином; не маскируются катионы щелочных металлов, кальция и магния.
Реагенты:
ЭДТА 0,0500 М раствор;
Аммиачная буферная смесь с рН 10;
Индикатор эриохром черный Т.
Выполнение определения
- В колбу для титрования вводят пипеткой 50 мл исследуемой воды и приливают 5-7 мл аммиачной буферной смеси.
- Вносят в раствор на конце шпателя 20 – 30 мг сухой смеси индикатора эриохрома чёрного Т с хлоридом натрия.
- Титруют воду 0,0100 М раствором комплексона III до перехода винно-красной окраски в синюю. В конце титрования раствор комплексона III прибавляют по 1 капле. Добиваются, чтобы красноватый оттенок совсем исчез. Повторяют титрование 3 раза, усредняют объем титранта. Общую жёсткость воды (в ммоль-экв Са2+ и Mg2+ на 1 л) вычисляют по формуле

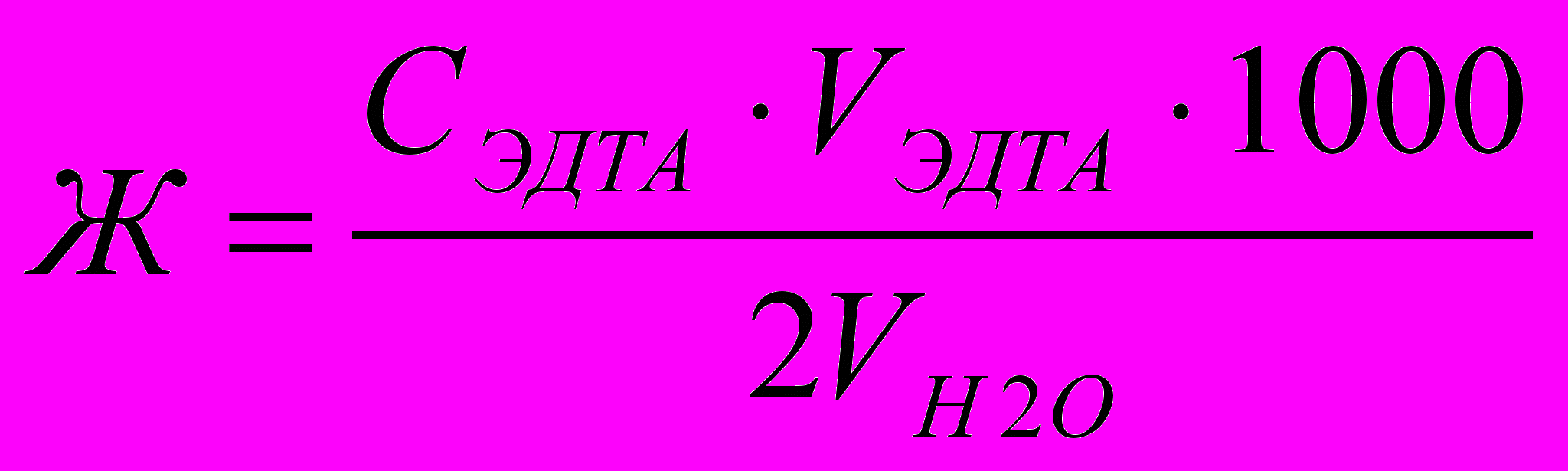 ,
,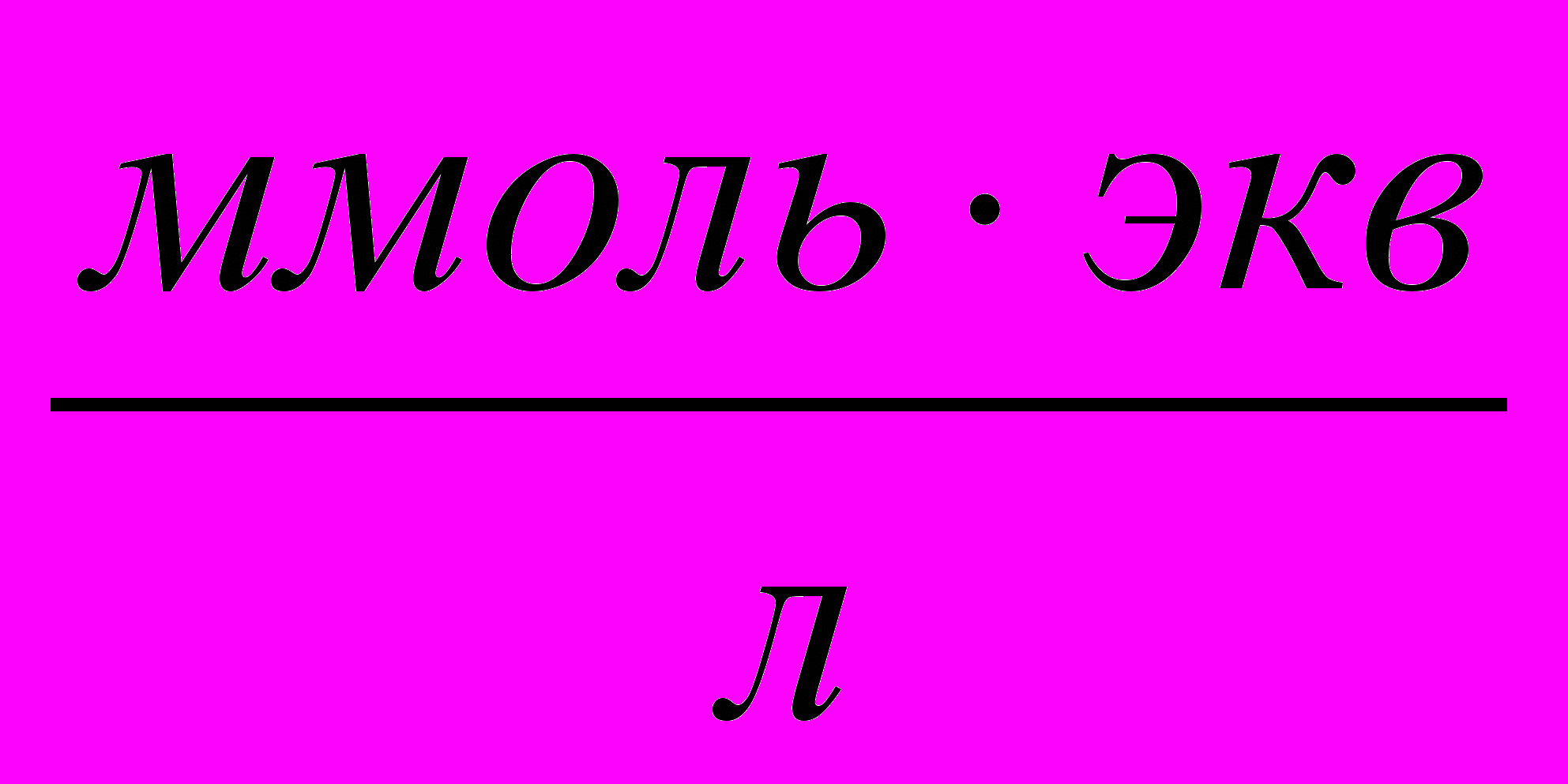
где: СЭДТА – молярная концентрация раствора комплексона III;
VЭДТА – объём рабочего раствора комплексона III, затраченный на титрование, мл;
VН2О – отобранный для определения объём воды, мл.
Лабораторная работа №4
Определение содержания железа(III)
В сильнокислой среде при рН<0,9 комплексонат железа (Ш) образуется в соответствии с уравнением:
Fe3++ H2Y2- =Fe Y-+2H+
Комплексонат железа (II) менее устойчив, чем комплексонат железа(III) и крайне неустойчив по отношению к окислителям. Уже кислородом воздуха он окисляется до комплексоната железа (III). Комплексонометрически определяют только железо (III). В качестве металлоиндикаторов используют тайрон, салициловую или сульфосалициловую кислоты, гидроксамовые кислоты. Эти индикаторы в растворах бесцветны, но образуют с железом (III) интенсивно окрашенные комплексы: красного цвета с тайроном, фиолетового цвета с салициловой или сульфосалициловой кислотами, сине-фиолетового с гидроксамовой кислотой.
Реагенты:
ЭДТА, 0,0500 М стандартный раствор;
Металлоиндикатор: сульфосалициловая кислота, 25%-ный водный раствор;
НСI, 1М, 2М растворы и концентрированная с пл.1,17 г/мл;
НNO3, концентрированная с пл. 1,4 г/мл;
NH3, 10%-ный раствор.
Выполнение определения
- Анализируемый раствор в мерной колбе вместимостью 100,0 мл разбавляют до метки дистиллированной водой и хорошо перемешивают.
- Аликвотную часть 10,00 мл пипеткой переносят в коническую колбу для титрования вместимостью 100 мл, вводят 5 мл концентрированной НСl и 2 мл концентрированной HNO3 для окисления железа (II).
- Помещают колбу на водяную баню и нагревают 3 - 5 мин, не допуская бурного кипения, до оранжево-желтой окраски раствора.
- Колбу снимают с бани и охлаждают. Осторожно нейтрализуют содержимое раствором аммиака. Аммиак вводят по каплям до перехода лимонно-желтой окраски в желтую (появляется слабая неисчезающая муть). Затем вводят 1 - 2 капли 2М НCI, 1 мл 1М НС1, разбавляют дистиллированной водой до 50 мл и нагревают почти до кипения.
- В горячий раствор добавляют 4 - 5 капель раствора сульфосалициловой кислоты и титруют раствором ЭДТА до изменения окраски раствора из фиолетовой в желтую или лимонно-желтую. Вблизи конечной точки титрования раствор ЭДТА прибавляют медленно и следят, чтобы раствор во время титрования оставался горячим.
- Результат анализа рассчитывают по формуле:
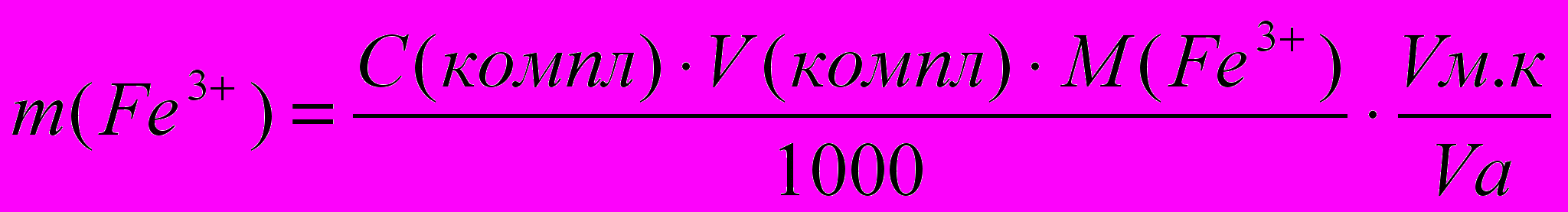
Если в растворе присутствуют только ионы железа (III), то определение можно проводить по следующей методике:
- Анализируемый раствор в мерной колбе вместимостью 100,0 мл разбавляют до метки дистиллированной водой и хорошо перемешивают.
- Аликвотную часть 10,00 мл пипеткой переносят в коническую колбу для титрования вместимостью 100 мл.
- В раствор добавляют 4 – 5 капель раствора сульфосалициловой кислоты и титруют раствором ЭДТА до изменения окраски раствора из фиолетовой в желтую или лимонно-желтую. Вблизи конечной точки титрования раствор ЭДТА прибавляют медленно.
Лабораторная работа №5
Определение содержания меди(II)
Ионы меди образуют с ЭДТА комплексы голубого цвета с константой устойчивости 6,3 . 1018 (ионная сила 0,1; 20 °С). Условия прямого титрования меди определяются выбранным металлоиндикатором. В присутствии мурексида, образующего комплекс с медью зеленовато-желтого цвета, титрование можно проводить на холоде при рН 6 (условная константа устойчивости комплексоната меди при рН 6 равна 1,4 . 1014).
Реагенты:
ЭДТА, 0,0500 М стандартный раствор;
Металлоиндикатор мурексид (смесь с хлоридом натрия в соотношении 1:100);
0,3% раствор NH3.
Выполнение определения
- Анализируемый раствор разбавляют водой до метки в мерной колбе вместимостью 100,0 мл (содержит 100 — 200 мг меди) и перемешивают.
- Отбирают пипеткой 10,00 мл раствора в коническую колбу для титрования вместимостью 100 мл, прибавляют 20 мл дистиллированной воды, 10 мл раствора аммиака, 20 – 30 мг (на кончике шпателя) индикатора и титруют раствором ЭДТА до изменения окраски в чисто-фиолетовую.
- Измеряют объем ЭДТА и вводят 2 - 3 капли раствора NH3. Если цвет раствора остается фиолетовым, титрование прекращают; если после добавления аммиака окраска изменилась в желтую или желто-зеленую, продолжают титрование раствором ЭДТА до устойчивой фиолетовой окраски.
- Результат анализа рассчитывают по формуле:

ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ
Окислительно-восстановительное титрование (редокститрование) – метод титриметрического определения веществ, основанный на изменении редокс-потенциала системы при протекании окислительно-восстановительной реакции в процессе титрования. Методы титрования растворами окислителей объединяют в группу оксидиметрии, на титровании растворами восстановителей – редуциметрии. Методы также классифицируют в зависимости от природы титранта, например метод, основанный на окислении перманганатом, называется перманганатометрия, на окислении иодом – иодометрия, на окислении бихроматом – бихроматометрия; на восстановлении аскорбиновой кислотой – аскорбинометрия, на восстановлении соединениями титана(III) – титанометрия и т.д. Широкое применение методов окислительно-восстановительного титрования в практике обусловлено многими их достоинствами, среди которых – высокая точность, хорошая воспроизводимость, экспрессность и т.д. Для обнаружения конечной точки титрования применяют безиндикаторный, индикаторные и инструментальные методы. Примером безиндикаторного метода может служить фиксирование конечной точки титрования по появлению или исчезновению розовой окраски титруемого раствора в перманганатометрии. В индикаторном способе применяют специфические и окислительно-восстановительные индикаторы. Специфические индикаторы – это вещества, которые образуют интенсивно окрашенные соединения с одним из компонентов окислительно-восстановительной системы, например, при титровании иода используют специфический индикатор – крахмал, образующий темно-синее соединение с I3- - ионами. Окислительно-восстановительные индикаторы(ред-окс-индикаторы) – это соединения, способные к окислению или восстановлению, причем их окисленная и восстановленная формы имеют разную окраску. Такими индикаторами чаще являются органические соединения, например дифениламин и его производные. В качестве ред-окс – индикаторов также применяют комплексы органических соединений с металлами, способными изменять степень окисления. Например, таким индикатором является ферроин, комплекс Fe(II) с 1,10-фенантролином, переходящий при окислении в комплекс Fe(III) с 1,10-фенантролином. Интервал перехода окраски индикаторов должен лежать внутри скачка титрования. Инструментальные методы регистрации конечной точки титрования – это, например, методы фотометрии, потенциометрии и т.д.
Лабораторная работа №6
Определение пероксида водорода
Определение основано на титровании пероксида водорода перманганатом калия по реакции:
5Н2О2 + 2 MnО4-+ 6Н+ = 5О2 + 2Mn2+ + 8H2O.
Перманганат калия не удовлетворяет требованиям, предъявляемым к первичным стандартам, поэтому необходимо провести стандартизацию раствора, то есть определить его концентрацию. В качестве установочных веществ применяют щавелевую кислоту, оксалат натрия, оксалат аммония и др.
I. Стандартизация раствора перманганата калия по оксалату натрия
Взаимодействие между оксалат-ионами и перманганат-ионами протекает в несколько стадий, процесс отражает суммарное уравнение:
5С2O42-+2MnO4-+16H+=2Mn2++8H2O+10CO2,
Это уравнение в полной мере не описывает процесс, хотя исходные и конечные продукты соответствуют приведенным в уравнении. Для начала реакции, необходимо присутствие в растворе хотя бы следов Мn2+. Пока в растворе концентрация Мn2+ недостаточна, реакция между МnО4-. и С2О42- протекает очень медленно, когда же концентрация Мn2+ достигает определенной величины, реакция протекает с большой скоростью.
