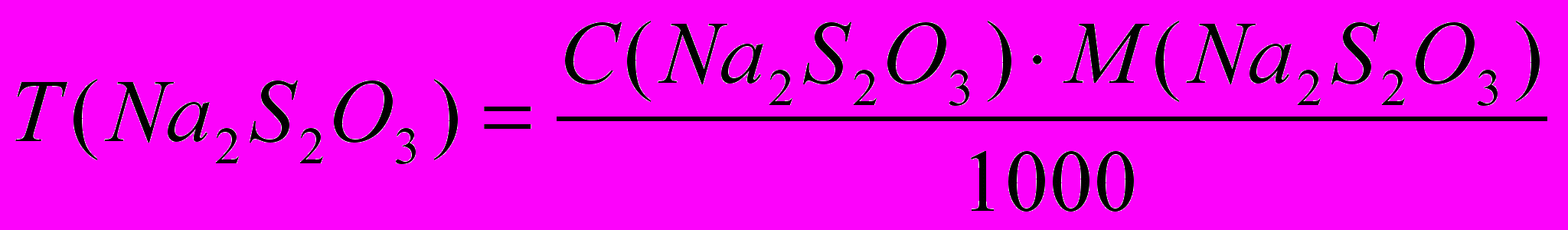Л. В. Щербакова практикум по аналитической химии барнаул 2004 министерство образования российской федерации алтайский государственный университет химический факультет практикум
| Вид материала | Практикум |
- Практикум Владивосток 2004 Министерство образования и науки Российской Федерации Владивостокский, 628.95kb.
- Практикум Ярославль, 2004 Министерство образования и науки РФ ярославский государственный, 885.94kb.
- Министерство Образования Российской Федерации Московский Государственный Университете, 1997.23kb.
- А. М. Горького Кафедра алгебры и дискретной математики Щербакова В. А. Лабораторный, 418.72kb.
- Анализ воды, 505.46kb.
- Российской Федерации Министерство образования и науки Российской Федерации Государственный, 343.55kb.
- Учебно-практическое пособие Хабаровск, 2001. Министерство образования Российской Федерации, 2795.36kb.
- Практикум ростов-на-Дону 2008 министерство образования и науки российской федерации, 1352.33kb.
- Учебное пособие Министерство общего и профессионального образования Российской Федерации, 936.13kb.
- Российской Федерации Уральский Государственный Университет им. А. М. Горького Философский, 1670.87kb.
Реагенты:
оксалат натрия Na2C2O4, 0,0200 M (1/2 Na2C2O4) стандартный раствор;
серная кислота, H2SO4, 1M раствор;
перманганат калия, KMnO4, 0,02 М (1/5 КMnO4) раствор.
Выполнение определения:
В колбу для титрования вместимостью 100 мл помещают 10 мл H2SO4 и нагревают до 80 – 900С. В горячий раствор пипеткой вносят аликвоту 10,00 мл стандартного раствора оксалата натрия и титруют раствором перманганата калия. В начале титрования следующую каплю раствора перманганата калия прибавляют лишь после того, как совершенно исчезнет окраска от предыдущей капли. Затем, увеличив скорость приливания титранта, титруют до появления устойчивой в течении 30 с бледно-розовой окраски. По результатам 3 титрований находят средний объем титранта и рассчитывают концентрацию перманганата калия.
II. Определение пероксида водорода
Реагенты:
стандартизированный раствор КМпО4;
1 М раствор H2SO4.
Выполнение определения:
В мерную колбу вместимостью 100,0 мл вносят аликвоту пероксида водорода с таким расчетом, чтобы получить примерно 0,02 М раствор, разбавляют дистиллированной водой до метки. В колбу для титрования вместимостью 100 мл вносят пипеткой 10,00 мл полученного раствора пероксида водорода, прибавляют 10 мл 1М Н2SO4 и титруют раствором перманганата калия до появления бледно-розовой окраски. Появившаяся окраска должна быть устойчива в течение 30 с. Первые капли перманганата обесцвечиваются медленно, затем реакция (по мере накопления в растворе Мn2+) протекает быстро.
По результатам титрования рассчитывают концентрацию пероксида водорода, результат определения представляют в масс %.
Расчет результатов анализа:
Массу пероксида водорода в 10 мл исходного раствора вычисляют по формуле:
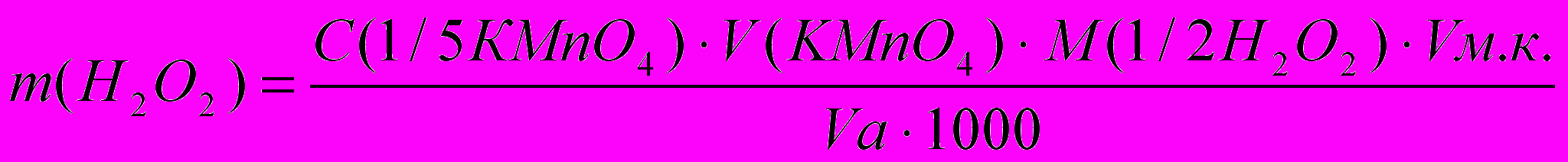
Зная плотность раствора Н2О2 (например, 1 г/мл), рассчитывают массу исходного раствора перекиси водорода
Например, m’ (Н2О2) = 10 мл 1 г/мл = 10 г

Лабораторная работа N 7
Бихроматометрическое определение содержание железа
В бихроматометрии стандартным является раствор бихромата калия. В кислой среде бихромат-ион является сильным окислителем, его применяют для определения восстановителей, сам он восстанавливается до иона Cr 3+:
Cr2O7 2- + 14H+ + 6e = 2Cr 3+ + 7H2O,
E0 (Cr2O72-/2Cr 3+) = 1.33 B.
При титровании бихроматом калия применяют окислительно-восстановительные индикаторы – дифениламин, дифенилбензидин и другие.
Реакция между бихромат-ионами и железом (II) протекает в соответствии с уравнением:
Cr2O7 2- + 14H+ + 6Fe 2+ ↔ 2 Cr 3+ + 6Fe 3+ + 7H2O
В процессе титрования повышается концентрация ионов железа (III), потенциал системы Fe3+/Fe2+ возрастает, это приводит к преждевременному окислению индикатора (дифениламина). Если к титруемому раствору прибавить фосфорную кислоту, то окраска индикатора резко изменится в конечной точке титрования. Фосфорная кислота понижает окислительно-восстановительный потенциал системы Fe3+ /Fe 2+ , образуя устойчивый комплекс с ионами железа (III).
Растворы солей железа (II) содержат ионы железа (III), поэтому перед титрованием ионы железа (III) необходимо восстановить. Для восстановления применяют металлы (цинк, кадмий), SnCl2, H2S, SO2 и другие восстановители.
Приготовление стандартного раствора бихромата калия
Рассчитывают навеску бихромата калия, необходимую для приготовления 250 мл (200 мл) 0.02 М раствора. Навеску взвешивают на технохимических весах, а затем уточняют массу на аналитических весах. Аккуратно, при помощи воронки, переносят навеску в мерную колбу вместимостью 250 (200) мл, растворяют в небольшом количестве дистиллированной воды и разбавляют до метки. Рассчитывают концентрацию бихромата калия, исходя из уточненной навески. Полученным раствором титруют раствор, содержащий железо(II).
Реагенты:
Бихромат калия, K2Cr2O7 0,020 М , (1/6 K2Cr2O7), стандартный раствор;
Хлороводородная кислота, HCl, концентрированная, пл. 1.17 г/мл;
Серная кислота, H2SO4, концентрированная, пл. 1.84 г/мл;
Фосфорная кислота, H3PO4, концентрированная, пл. 1.7 г/мл;
Защитная смесь(смесь кислот H2SO4 и H3PO4);
Цинк металлический, гранулированный;
Индикатор дифениламин, 1%-ый раствор в концентрированной Н2SO4.
Выполнение определения
Аликвотную часть анализируемого раствора 10.00 мл пипеткой вносят в колбу для титрования вместимостью 100 мл, добавляют 7 – 10 мл защитной смеси (или 3 – 4 мл H2SO4 и 5 мл H3PO4), 15 – 20 мл дистиллированной воды , 2 капли раствора индикатора дифениламина и титруют раствором бихромата калия до появления интенсивной фиолетовой окраски.
По результатам трех титрований рассчитывают содержание железа и проводят статистическую обработку результатов анализа.
Расчет результатов анализа:
Массу железа рассчитывают по формуле:

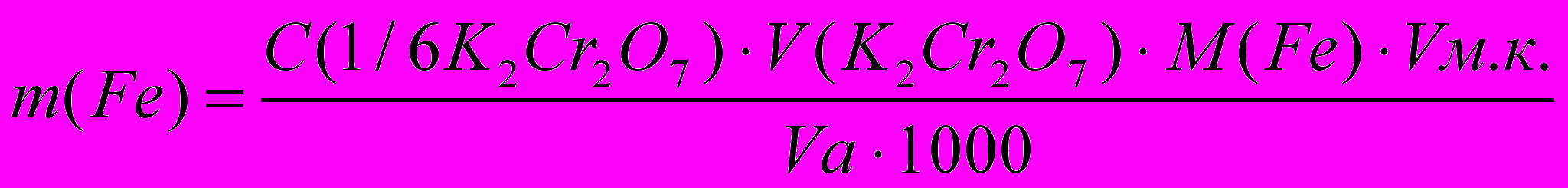
где С (1/6К2Сг207) – молярная концентрация эквивалента бихромата калия.
Vа – объем аликвоты исследуемого раствора соли железа.
M(Fe) – молярная масса эквивалента железа в данной реакции.
Vм.к. – объем мерной колбы.
Лабораторная работа N 8
Иодометрическое определение содержания меди
Иод является более сильным окислителем (Е0 (I 3- /3I-) = + 0.53 B) по сравнению с ионами меди (II) (E0 (Cu 2+ /Cu +) = +0.167 B; E0(Cu 2+ /Cu↓) = +0.34 B). Ионы меди(II) не могут быть определены прямым или обратным иодометрическими методами титрования, они находятся в максимально окисленной форме. Для определения ионов меди (II) применяют косвенное иодометрическое титрование, основанное на взаимодействии ионов Cu 2+ с иодид-ионами, сопровождающееся окислением ионов иода до элементного состояния:
2Cu 2+ + 4I - = 2CuI + I2,
и с последующим титрованем образовавшегося в эквивалентном количестве элементного иода стандартизованным раствором тиосульфата натрия:
I2 + 2S2О3 2- = 2I- + S4О6 2-
M(Cu) = 63,546 г/моль
n(Cu 2+) = n(I2) = n(Na2S203.5H20)
I. Стандартизация раствора тиосульфата натрия
Тиосульфат натрия не удовлетворяет предъявляемым к стандартным веществам требованиям, его раствор нельзя приготовить по точной навеске. Наиболее простым и достаточно точным методом определения титра раствора тиосульфата натрия является косвенный иодометрический метод. В основе метода - окислительно-восстановительная реакция, протекающая между бихроматом калия и иодидом калия в кислой среде, сопровождающаяся выделением эквивалентного количества элементного иода:
К2Сr2О7 + 6KI + 7H2SО4 = 3I2 + Сr2(SO4)3 + 7Н2О + 4K2SО4
или Сr2О7 2- + 6I- + 14Н+ = 3I2 + 2Cr3+ + 7Н2О
М(1/6К2Сr207)= (М(К2Сr207))/6 = 294,19/6 = 49,03
Выделившийся иод оттитровывают стандартизируемым раствором тиосульфата натрия:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
I2 + 2S2О3 2- = 2I- + S4O6 2-
M(Na2S2О3.5H2О)= Mr(Na2S2О3 5H2О) = 248,18/1 = 248,2
По количеству тиосульфата натрия, израсходованного на титрование выделившегося иода, вычисляют титр и молярную концентрацию эквивалента раствора тиосульфата натрия.
Реагенты:
Бихромат калия, K2Cr2O7, 0,020 М (1/6 K2Cr2O7), стандартный раствор;
Тиосульфат натрия, Na2S2О3*5H2О, 0,02 М раствор;
Серная кислота, 4 М раствор;
Иодид калия,KI, 20%-ный раствор;
Индикатор – крахмал.
Выполнение определения
Для выполнения работы можно использовать ранее приготовленный раствор бихромата калия. Рассчитывают навеску тиосульфата натрия, необходимую для приготовления 250 (200) мл 0,02 М раствора. Навеску тиосульфата натрия берут на технохимических весах и аккуратно переносят в мерную колбу вместимостью 250 (200) мл. Растворяют в небольшом количестве дистиллированной воды и разбавляют до метки. В бюретку помещают раствор тиосульфата натрия. В колбу для титрования мерным цилиндром отмеривают 5 мл 20 %-ного раствора иодида калия, 5 мл 2 М раствора серной кислоты. К полученной смеси прибавляют аликвоту (10,00 мл) раствора бихромата калия. Для завершения реакции смесь оставляют на 5 минут в темноте. Затем приступают к титрованию раствора тиосульфатом натрия. Сначала титруют без индикатора, когда окраска раствора из темно-бурой перейдет в бледно-желтую (соломенную), прибавляют 5 – 6 капель раствора крахмала и продолжают титровать до перехода синей окраски в бледно-зеленую от одной капли раствора тиосульфата натрия. Последние капли прибавляют медленно, хорошо перемешивая раствор. Проводят не менее 3-х параллельных титрований, фиксируя объемы, пошедшие на каждое титрование.
Расчет результатов анализа:
Количества тиосульфата и бихромата эквивалентны. Молярную концентрацию эквивалента и титр тиосульфата натрия рассчитывают по формулам: