Л. В. Щербакова практикум по аналитической химии барнаул 2004 министерство образования российской федерации алтайский государственный университет химический факультет практикум
| Вид материала | Практикум |
- Практикум Владивосток 2004 Министерство образования и науки Российской Федерации Владивостокский, 628.95kb.
- Практикум Ярославль, 2004 Министерство образования и науки РФ ярославский государственный, 885.94kb.
- Министерство Образования Российской Федерации Московский Государственный Университете, 1997.23kb.
- А. М. Горького Кафедра алгебры и дискретной математики Щербакова В. А. Лабораторный, 418.72kb.
- Анализ воды, 505.46kb.
- Российской Федерации Министерство образования и науки Российской Федерации Государственный, 343.55kb.
- Учебно-практическое пособие Хабаровск, 2001. Министерство образования Российской Федерации, 2795.36kb.
- Практикум ростов-на-Дону 2008 министерство образования и науки российской федерации, 1352.33kb.
- Учебное пособие Министерство общего и профессионального образования Российской Федерации, 936.13kb.
- Российской Федерации Уральский Государственный Университет им. А. М. Горького Философский, 1670.87kb.
Лабораторная работа №2
Прямое потенциометрическое определение содержания натрия(I)
Цель работы. Сформулировать самостоятельно.
Задание. Определить концентрацию натрия (рNa, mNa+) в определяемом растворе методом градуировочного графика, освоить технику прямой потенциометрии, провести статистическую обработку полученных результатов анализа, сформулировать выводы.
Теоретическое введение. Теоретические основы прямой ионометрии, ее виды, возможности, погрешности определений (см. учебную литературу и лекции).
Обоснование методики: Метод основан на зависимости потенциала стеклянного натриевого ионоселективного электрода от логарифма концентрации (активности) ионов натрия в водных растворах.
Метод предназначен для определения натрия в пределах рNa 0 … 4, т.е. в пределах концентраций 1…1×10-4 М. Определению натрия не мешают равные количества К+, десятикратные количества Li+, NH4+, стократные количества Mg2+, Ca2+, Ba2+ и анионы Cl-, Br-, I-, NO3-, ClO-, HCO3-, CO32-, SO42-, OH- и т.д. Ионы водорода мешают определению натрия (I).
Натрий (I) можно определить непосредственно в щелочных и нейтральных растворах, кислые растворы необходимо нейтрализовать.
Экспериментальная часть
Аппаратура:
иономер любой модификации;
стеклянный натриевый ионоселективный электрод ЭСЛ-51Г-05, выдержанный в 0,1 М растворе хлористого калия в течение 8…..24 часов;
хлоридсеребряный электрод сравнения ЭВЛ-1М3, заполненный насыщенным раствором хлористого калия;
электромагнитная мешалка.
Реактивы и посуда:
Хлорид натрия, NaCl, с концентрацией 0,1 моль/л раствор;
стаканчик вместимостью 100 мл – 2 шт;
мерная колба вместимостью 100 мл – 4 шт;
пипетка вместимостью 10,0 мл.
Выполнение работы.
Приготовление стандартных растворов: Исходный раствор хлорида натрия готовят из фиксанала с концентрацией 0,1000 М. Растворы 0,01; 0,005; 0,001;0,0005 М готовят разбавлением дистиллированной водой 0,1000 М раствора хлорида натрия в мерных колбах вместимостью 100 мл.
Построение градуировочного графика. Для построения градуировочного графика используют серию из 5 растворов с концентрацией 0,1…0,0005 М. Концентрация исследуемого раствора должна находиться в пределах концентраций градуировочного графика.
Значения потенциала (Е) натриевого ионоселективного электрода в мВ для градуировочного графика в системе координат Е (мВ) – рNa регистрируют, начиная с наименьшей концентрации.
Электродную систему погружают в раствор, и после установления постоянного показания прибора (через 2 – 3 минуты), заносят значения потенциала в таблицу. Электроды после каждого измерения высушивают фильтровальной бумагой и затем погружают в раствор с более высокой концентрацией.
Все определения проводятся при постоянной температуре 20 – 25°С. По полученным данным строится градуировочный график в системах координат Е (мВ) – рNa (зависимость Э.Д.С. от логарифма концентрации ионов натрия).
Порядок проведения измерений:
После построения градуировочного графика электродную ячейку промывают дистиллированной водой, электроды высушивают фильтровальной бумагой и погружают в ячейку с исследуемым раствором при той же температуре, что и при измерении значений Е для градуировочного графика.
- Через 2 – 3 минуты записывают показания прибора (Е, мв) и находят соответствующие значения молярной концентрации натрия (I) по градуировочному графику.
Расчеты.
Рассчитать массу натрия в граммах, провести статистическую обработку полученных результатов.
Лабораторная работа №3
Определение содержания меди(II) методом потенциометрического титрования диэтилдитиокарбаминатом натрия
Цель работы. Изучить теоретические основы потенциометрического титрования, способы нахождения точки стехиометричности (т.с.), освоить потенциометрическое титрование ионов меди диэтилдитиокарбаминатом натрия.
Задание. Провести потенциометрическое титрование меди (II) диэтилдитиокарбаминатом натрия с индикаторным электродом из серебра и определить как он функционирует в процессе титрования до т.с., в т.с., после т.с., записать соответствующие электродные системы, электродные реакции и уравнения расчетов потенциала. Определить содержание меди (II) по интегральной, дифференциальной кривым титрования и расчетным методом. Провести статистическую обработку результатов анализа. Оценить погрешность определения.
Теоретическое введение. Изучить учебную литературу и лекции.
Обоснование методики: В основе определения Си2+ лежит реакция образования внутрикомплексного малорастворимого соединения меди темно-коричневого цвета:
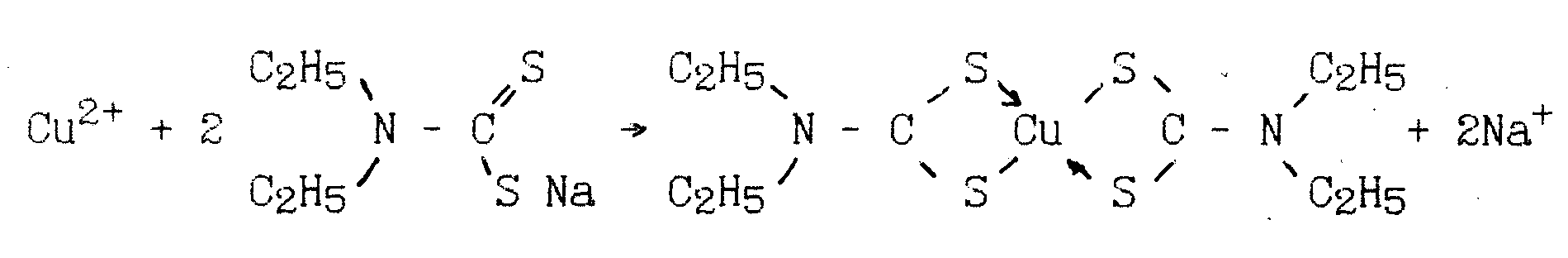
Диэтилдитиокарбаминат натрия малоустойчив в кислой среде, поэтому титрование проводят при рН = 4 – 6 (создается добавлением ацетата натрия (калия)).
Ацетат натрия добавляют в титрационный сосуд. Потенциал индикаторного электрода из Ag реагирует на изменение концентрации ионов Cu2+ и [(С2Н5)2 NCS2]-. B растворе меди он положителен, а после добавления избытка диэтилдитиокарбамината – отрицателен.
Экспериментальная часть
Аппаратура:
потенциометрическая установка рН-340;
индикаторный электрод из серебра;
насыщенный хлоридсеребряный электрод сравнения ЭВА – 1М3;
электролитический ключ, заполненный насыщенным раствором KNO3;
электромагнитная мешалка.
Посуда и реактивы:
стакан для титрования вместимостью 50 мл – 3 шт.;
бюретка вместимостью 25 мл;
пипетка вместимостью 10,0 мл;
мерная колба вместимостью 100,0 мл;
диэтилдитиокарбаминат натрия, C5H10NS2Na, 0,1000 М раствор;
ацетат натрия (калия), CH3COONa (CH3COOK).
Выполнение работы.
Аликвоту (10,00 мл) раствора соли меди переносят в стакан для титрования, добавляют 2 - 3 г СНзСООNа до рН = 4 – 5 (проверяют с помощью индикаторной бумаги) и разбавляют дистиллированной водой до объема 25 мл.
- Индикаторный электрод из серебра перед каждым титрованием обрабатывают мелом и протирают фильтровальной бумагой.
- Погружают в титруемый раствор индикаторный электрод из серебра и электролитический ключ, соединенный с хлоридсеребряным электродом сравнения.
- Титрование выполняют раствором диэтилдитиокарбамината натрия, приливая его при ориентировочном (грубом) титровании по 0,5 мл до скачка потенциала и две-три порции после скачка. Скачок наблюдается в отрицательной области потенциалов, поэтому переключатель «род работы» надо устанавливать с «+ Мв» на «- Мв».
- Выполняют титрование меди еще 3 раза, приливая раствор диэтил-дитиокарбамината натрия перед точкой стехиометричности по 0,1мл. Данные заносят в таблицу.
   V, мл V, мл | Е, мВ | Е | V | E/ Δ V |
| | | | | |
где, V - объем добавленного титранта (раствора диэтилдитиокарбамината натрия), мл
Е – показания рН-метра, мВ
Е и V - разность потенциала и разность объема титранта между двумя показаниями рН-метра.
По результатам титрования (табл) строят кривые титрования (интегральную и дифференциальную) и находят стехиометричный объем титранта, пошедшего на титрование, определяют массу меди (II) в граммах.
Расчеты. Массу меди рассчитывают через титр по определяемому веществу, который находят перед титрованием.
 ;
; 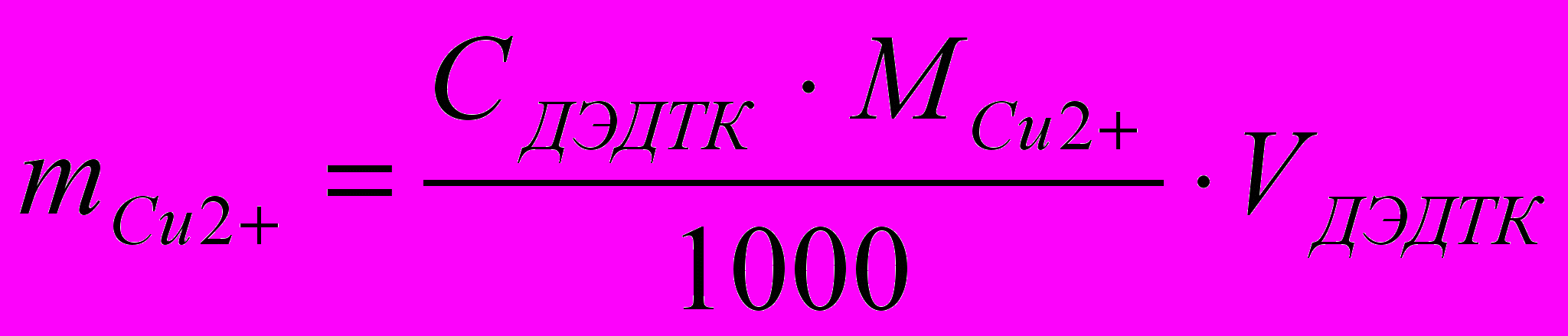
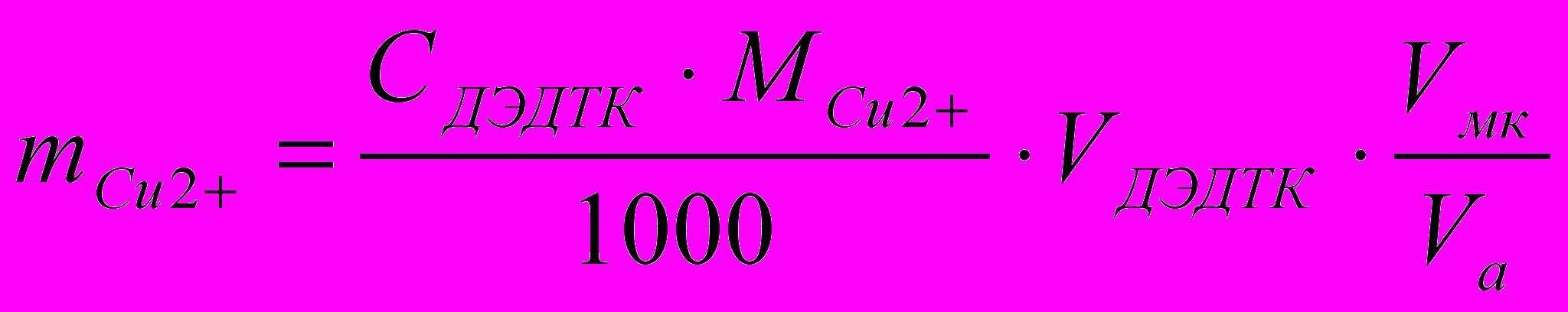 ,
,где: ТДЭДТК/Cu2+ - титр по определяемому веществу;
СДЭДТК – молярная концентрация эквивалента титранта, указать f;
М – молярная масса эквивалента меди (II), указать f;
Vмк – объем мерной колбы;
Vа – объем аликвоты.
Лабораторная работа №4
Определение содержания хлороводородной и борной кислот при совместном присутствии методом потенциометрического титрования
Цель работы. Изучить и освоить различные способы проведения потенциометрического титрования и способы нахождения т.с. Ознакомиться с техникой потенциометрического титрования смеси двух протолитов.
Задание. Провести потенциометрическое титрование смеси хлороводородной и борной кислот раствором щелочи.
Теоретическое введение. Изучить учебную литературу и лекции.
Обоснование методики. Анализ смесит хлороводородной и борной борноглицериновой или борноманнитовой) кислот основан на потенциометрическом титровании их смеси до достижения значения рН (Е) растворов, отвечающих рН т.с. хлороводородной (рН1) и борноманнитовой (борноглицериновой) (рН2) кислот.
Константа диссоциации борной кислоты (K(Н3ВО3) = 10-9) настолько мала, что сильная кислота в ее присутствии может быть количественно оттитрована щелочью. Борная кислота не титруется из-за малого значения константы диссоциации. Титрование возможно при Ка 10-8 или при степени протекания аналитической реакции более 99,71%. По завершении титрования HCl в этот же раствор вносят глицерин или маннит. При этом борная кислота образует комплексную борно-глицериновую (борноманнитовую) кислоту, обладающую относительно большой константой диссоциации (Ка = 10-5).
Экспериментальная часть
Аппаратура:
рН-метр (любой модификации);
стеклянный ионоселективный электрдЭЛС;
хлоридсеребряный электрод сравнения ЭВА – 1М3;
электромагнитная мешалка.
Посуда и реактивы:
химические стаканчики вместимостью 100 мл или 50 мл – 3 шт;
мерная колба вместимостью 100 мл;
гидроксид натрия NaOH, 0,100 н. раствор
глицерин
стандартные растворы HCl и H3BO3.
Выполнение работы.
Смесь HCl и H3BO3 в колбе вместимостью 100 мл разбавляют до метки дистиллированной водой.
Определяют рН1 и рН2, отвечающие за титрование HCl и H3BO3, соответственно. Для этого аликвоту испытуемого раствора (10 мл) переносят в стакан для титрования и разбавляют небольшим количеством воды. Погружают в раствор стеклянный индикаторный электрод и хлоридсеребряный электрод сравнения и проводят ориентировочное титрование с градиентом приливания 0,5 мл. После первого скачка титрования, соответствующего титрованию хлороводородной кислоты, приливают 5 – 10 мл глицерина (или вводят 1 г маннита) и тщательно перемешивают до полного растворения. Продолжают титрование до обнаружения второго скачка титрования, отвечающего за титрование борно-глицериновой (или борно-маннитовой) кислоты. Результаты
титрования записывают в таблицу:
| V, мл | РН | рН |
| | | |
Затем выполняют точное титрование в тех же условиях, с градиентом приливания 0,1 мл в области скачка титрования. По результатам данного титрования определяют значение рН1 и рН2, величины которых показывают до какой величины рН в дальнейшем следует титровать хлороводородную кислоту в присутствии H3BO3 (рН1) и борно-глицериновую кислоту (рН2).
Далее выполняют еще два титрования до заданных значений рН1 и рН2, приливая титрант вблизи рН1 и рН2 по каплям. Записывают объем титранта, израсходованный на титрование хлороводородной кислоты (V1) и общий объем стандартного раствора щелочи (Vобщ.). Объем титранта пошедший на титрование борно-глицериновой кислоты находят по разности Vобщ. – V1.
Расчеты. Содержание HCl и H3BO3 во взятом для титрования объеме испытуемого раствора рассчитывают по формуле:
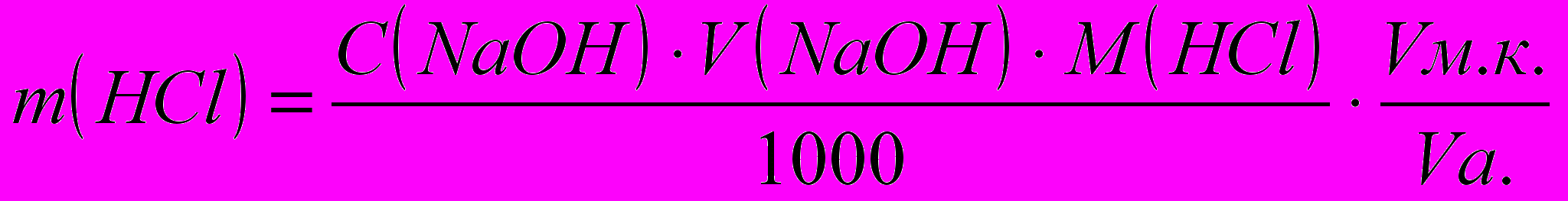
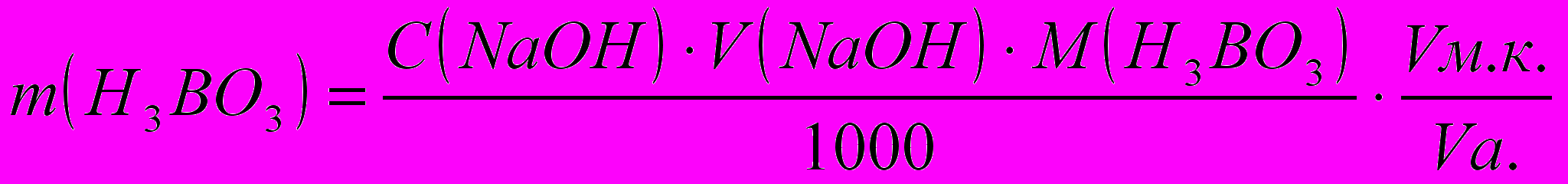
Лабораторная работа №5
Определение содержания азотной кислоты и нитрата аммония при совместном присутствии методом кондуктометрического титрования
Цель работы: Изучить и освоить теоретические основы прямой кондуктометрии и кондуктометрического титрования, рассмотреть факторы, влияющие на подвижность ионов в растворе, освоить кондуктометрическое титрование.
Задание. Провести кондуктометрическое титрование смеси HNO3 и NH4NO3, построить кривые титрования, определить m(HNO3) и m(NH4NO3), провести статистическую обработку результатов анализа.
Теоретическое введение. (Изучить учебную литературу и лекции)
Обоснование методики. Определение основано на последовательном взаимодействии со щелочью кислот и солей слабых оснований:
H+ + NO3- + Na+ + OH- = Na+ + NO3- + H2O
NH4+ + NO3- + Na+ + OH- = Na+ + NO3- + NH3 H2О
При титровании раствором NaOH смеси HNO3 и NH4NO3 сначала нейтрализуется сильная кислота HNO3, а затем в реакцию вступает NH4NO3. На кривой кондуктометрического титрования фиксируются две т.с. При титровании HNO3, до первой т. с., наиболее подвижные ионы водорода связываются с образованием H2O и электропроводность понижается. После этого ион NH4+ связывается с образованием слабого основания. Так как подвижность ионов NH4+ выше, чем ионов Na+, NO3-, Cl-, электропроводность до второй т. с. продолжает падать, но менее резко, чем до первой точки стехиометричности. После второй т. с. электропроводность резко повышается, так как она лимитируется концентрацией подвижных ионов ОН-.
Экспериментальная часть.
Аппаратура.
- кондуктометр любой модификации;
- электроды – две платиновые пластинки S = 1 см2, расположенные на расстоянии 1см и жестко скрепленные для поддержания неизменной постоянной сосуда (l/S);
- магнитная мешалка.
Посуда и реактивы:
Раствор NaOH, 1,00 М;
Стакан вместимостью 100-150 мл – 2 шт.;
Пипетка вместимостью 10 мл;
Бюретка вместимостью 25 мл.
Выполнение работы.
Отбирают аликвоту анализируемого раствора 10,00 мл и переносят ее в стакан для титрования. Рабочая часть электрода до переливного отверстия электрода должна быть покрыта раствором. Для этого в ячейку для титрования добавляют дистиллированной воды до общего объема 40 – 50 мл, так чтобы раствора находилась в средней части шкалыприбора.
- Проводят кондуктометрическое титрование смеси HNO3 и NH4NO3 1,000 М раствором NaOH. Регистрируют показания прибора после введения каждой порции титранта (0,5 мл.), строят кривые титрования в координатах удельная электропроводность – объем титранта. На каждом линейном участке прямой должно быть не менее 5 – 6 точек. Если их при ориентировочном (грубом) титровании больше или меньше, то объем приливания соответственно увеличивают или уменьшают.
- По изломам на кривой титрования определяют точки стехиометричности.
- Титрование проводят 3 раза. Данные заносят в таблицу:
-
Vтитр, мл.
c, См. см-1
По формулам титриметрического анализа рассчитывают содержание HNO3 и NH4NO3:
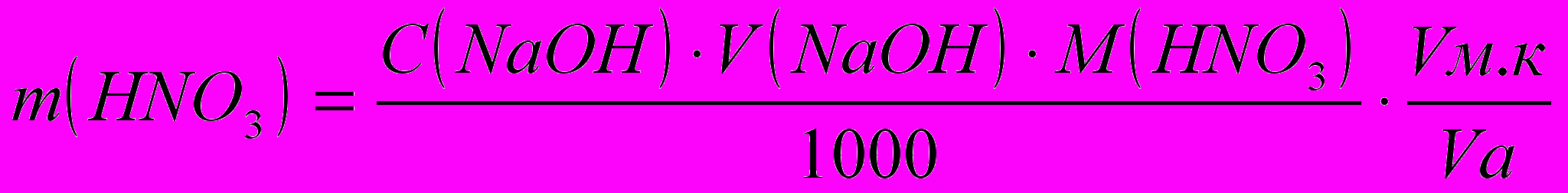 ,г
,г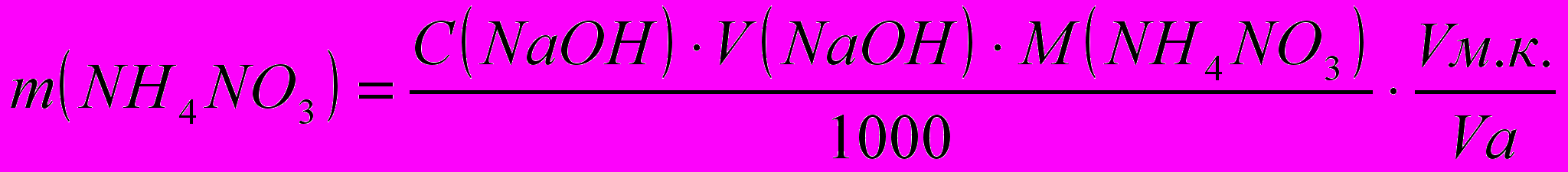 ,г
,ггде С - молярная концентрация эквивалента,
М – молярная масса эквивалента HNO3 и NH4NO3,
Vм.к. – объем мерной колбы,
Vа. – объем аликвоты
Проводят статистическую обработку результатов.
Лабораторная работа №6
Определение содержания хлорид-ионов методом кулонометрического автоматического титрования
Цель работы. Изучить и освоить и освоить теоретические основы кулонометрических методов анализа и кулонометрического титрования.
Задание. Провести кулонометрическое титрование ионов хлора электрогенерированными ионами серебра с биамперометрической фиксацией т.с. в автоматическом режиме. Определить концентрацию хлорид-ионов в мг-экв/л и в граммах. Провести статистическую обработку результатов анализа.
Теоретическое введение. См. учебную литературу и лекции.
Обоснование методики. Определение проводится на кулонометрическом титраторе типа: Т – 201. Прибор состоит из трех блоков: блока стабилизированного тока Б-С, блока индикации БИ – 1 и титровального стенда.
В основу работы прибора положен принцип кулонометрического образования титранта и биамперометрической индикации конечной точки титрования.
В приборе используются две пары серебряных электродов: индикаторные и генераторные. Индикаторные электроды служат для определения конечной точки титрования. На них подается напряжение поляризации, при этом в цепи электродов устанавливается определенный ток (мА), величина которого зависит от ионного состава раствора. Генераторные электроды генерируют титрант в процессе электролитического анодного растворения: Ag – e ® Ag+, образующиеся ионы серебра вступают в реакцию с хлорид – ионами в процессе титрования: Ag+ + Cl- ® AgCl.
В конце титрования появляются свободные ионы Ag+, которые вызывают деполяризацию индикаторных электродов. В результате этого в цепи резко увеличивается ток, что вызывает срабатывание релейной системы, которая разрывает цепь питания генераторных электродов и останавливает секундомер – титрование законч
