Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика Донецьк 2011
| Вид материала | Документы |
СодержаниеВластивості розчинів електролітів. Електрична провідність розчинів електролітів. Цілі навчання Граф логічної структури теми “Властивості розчинів електролітів. Електрична провідність” |
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 222.17kb.
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 215.57kb.
- Лекція хімічна кінетика, 315.26kb.
- Тема: Химический комплекс Украины в современных условиях, 176.49kb.
- 1. Хімічна термодинаміка в тнр основні поняття хіміко-технологічного процесу. Стехіометричні, 147.66kb.
- Програма вступних іспитів з дисципліни "Технічна електрохімія" для бакалаврів за напрямком, 324.77kb.
- Конспект лекцій для студентів спеціальностей 091605 «Хімічна технологія високомолекулярних, 1882.89kb.
- О. М. Науменко. Хімічна освіта в школі: екскурс в історію // К.: Шкільний світ, 131.41kb.
- І. Фізико-математичне відділення Секція, 96.5kb.
- Загальна програма з математики для підготовки до тестування на 2-ий курс радіофізичного, 24kb.
Заняття 10
Властивості розчинів електролітів. Електрична провідність розчинів електролітів.
Актуальність теми
Електроліти - речовини, розчини яких здатні проводити електричний струм. Під властивостями розчинів електролітів розуміють специфічні властивості цих розчинів, пов'язані з утворенням в них іонів, сольватацією іонів і межіонними взаємодіями. Електроліти часто застосовують для приготування розчинів з певними фізико-хімічними характеристиками: ступенем дисоціації, константою дисоціації, добутком розчинності та ін. Ці характеристики визначають кондуктометричним методом, який засновано на вимірюванні ектропровідності розчинів. Електрохімія має велике теоретичне і прикладне значення. Кондуктометрія широко використовуються в у фармацевтичному аналізі. Вивчення таких явищ, як біологічна трансформація, іонний транспорт, має велике значення для розуміння механізмів перетворення енергії, перенесення електронів, іонів в живих організмах, що, у свою чергу, грає важливу роль в дослідженнях механізмів дії лікарських речовин.
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть рівноваг в розчинах електролітів для подальшого використання таких знань - умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Інтерпретувати властивості розчинів електролітів.
2. Інтерпретувати електричну провідність розчинів електролітів.
3. Розраховувати електричну провідність розчинів електролітів і оцінювати отримані результати.
Зміст навчання
Перелік теоретичних питань:
- Поняття сили електроліту. Здатність молекул електролітів дисоціювати, оборотність дисоціації.
- Ступінь дисоціації. Константа дисоціації.
- Колигативні властивості розчинів електролітів.
- Питома, молярна, іонна електропровідність електролітів.
- Розрахунок електричної провідності розчинів електролітів.
- Застосування даних електропроводності розчинів електролітів у фармації.
Граф логічної структури теми “Властивості розчинів електролітів. Електрична провідність”
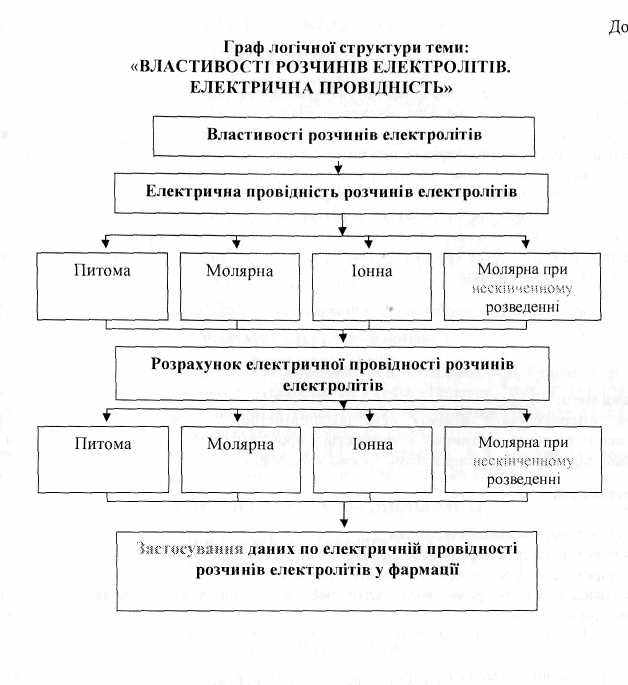
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. - С. 111-150.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. - Харьків: Вид-во НФАУ „Золоті сторінки", 2001. - С. 80-84.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачньш, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного- Харьков.: Издательство УкрФА «Прапор», 2005.- С. 111-150.
Орієнтовна основа дії
Алгоритм рішення задач. Див. Заняття 1.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Для визначення ступеня дисоціації слабкого електроліту методом кондуктометрії, експериментально потрібно вимірювати:
А. Константу дисоціації електроліту
В. Добуток розчинності електроліту
С. Граничну молярну електропровідність електроліту
D. Електрорушійну силу
Е. Опір розчину
Тест 2
рН середовища інструментальним методом можна зміряти використовуючи прилад:
А. Хроматограф
В. Кондуктометр
С. Іонометр
D. Полярограф
Е. Поляриметр
Тест 3
Для кількісного визначення Со2+ в суміші з Мn2+ полярографічним методом вимірюють:
А. Потенціал полуволни
В. Силу струму
С. Час утримання
О. Висоту полярографічної хвилі
Е, Об'єм утримання
Тест 4
Ідентифікація аналізованих компонентів методом газорідинної хроматографії проводиться з використанням фізіко-хімічного параметра:
А. Час утримування
В. Швидкість руху іонів
С. Потенціал напівхвилі
D. Питоме поглинання
Е. Екстінкція
Тест 5
Визначте граничну молярну електричну провідність для NH4ОН при 25°С, якщо граничні молярні електричні провідності КС1, КОН та NН4СІ при цій температурі дорівнюють відповідно 14,99; 27,18 та 14,99 См-м2/кмоль.
А. 27,18 См-м2/кмоль.
B. 7,18 См-м2/кмоль.
C.2700,18 См-м2/кмоль.
D.207,18 См-м2/кмоль.
E. 2 См-м2/кмоль.
Тест 6
Питома електрична провідність водного розчину з массовою часткою КI 5% (р = 1.035 г/мл). який використовується при гіпертиреозі, при 18°С дорівнює 3,38 См/м. Розрахуйте молярну електричну провідність цього розчину і ступінь дисоціації КІ, якщо граничні молярні електричні провідності іонів К+ і Cl- дорівнюють відповідно 6,39 і 6,65 См-м2/кмоль.
А. 10,83 См-м2/кмоль; 0,83.
B. 100,83 См-м2/кмоль; 0,83.
C.10,83 См-м2/кмоль; 1.
D.10 См-м2/кмоль; 0.
E. 0,83 См-м2/кмоль; 0,83.
Еталони відповідей до рішення цільових навчальних завдань: тест 5-А, тест 6-А.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
