Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика Донецьк 2011
| Вид материала | Документы |
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 222.17kb.
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 215.57kb.
- Лекція хімічна кінетика, 315.26kb.
- Тема: Химический комплекс Украины в современных условиях, 176.49kb.
- 1. Хімічна термодинаміка в тнр основні поняття хіміко-технологічного процесу. Стехіометричні, 147.66kb.
- Програма вступних іспитів з дисципліни "Технічна електрохімія" для бакалаврів за напрямком, 324.77kb.
- Конспект лекцій для студентів спеціальностей 091605 «Хімічна технологія високомолекулярних, 1882.89kb.
- О. М. Науменко. Хімічна освіта в школі: екскурс в історію // К.: Шкільний світ, 131.41kb.
- І. Фізико-математичне відділення Секція, 96.5kb.
- Загальна програма з математики для підготовки до тестування на 2-ий курс радіофізичного, 24kb.
Заняття 9
Колігативні властивості розбавлених розчинів. Реальні розчини
Актуальність теми
Властивості розчинів визначаються характером міжмолекулярних взаємодій. Істотне значення можуть мати водневий зв'язок, асоціація, сольватація, дисоціація, хімічна взаємодія. Властивості розчинів, які не залежать від природи (складу і хімічної будови) розчиненої речовини, а залежать тільки від його молярної концентрації, називають колігативними. Кожною з цих властивостей користуються для визначення молярної (молекулярної) маси, ступеня дисоціації, показника асоціації, розчиненої речовини методами тонометрії, ебуліометрії, кріометрії і осмометрії. Кріометрія застосовується також для кількісного визначення домішок.
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть фазових рівноваг в рідких розчинах для подальшого використання таких знань - умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Інтерпретувати суть закону Рауля.
2. Інтерпретувати колігативні властивості розчинів і методи їх експериментального визначення.
3. Розраховувати колигативні властивості розчинів і оцінювати отримані результати.
Зміст навчання
Перелік теоретичних питань:
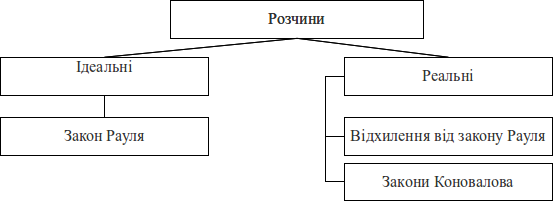
- Типи розчинів: рідкі, ідеальні, розбавлені, реальні, неелектролітів, електролітів.
- Ізотонічний коефіцієнт Вант-Гоффа для розчинів електролітів.
- Склад розчинів. Способи виразу концентрацій компонентів розчинів. Масова частка. Молярна частка. Моляльність. Молярність.
- Закон Рауля і його слідства.
- Рівняння для двокомпонентних розчинів.
- Рівняння для багатокомпонентних розчинів.
- Колігативні властивості розбавлених розчинів. Методи експериментального визначення колігативних властивостей. Пониження тиску насиченої пари розчинника. Підвищення температури кипіння. Ебулеометрічний метод. Пониження температури замерзання. Кріометричний метод.
- Осмотичний тиск. Осмометрія.
- Розрахунок колігативних властивостей розбавлених розчинів. Пониження тиску насиченої пари розчинника. Підвищення температури кипіння. Пониження температури замерзання.
- Застосування методів ебуліометрії, кріометрії і осмометрії у фармації.
Граф логічної структури теми “Колігативні властивості розбавлених розчинів”
Д
жерела інформації
Основна література:
1. Фізична і колоїдна хімія/В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Зазаг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. - С. 100-110.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. — Харьків: Вид-во НФАУ „Золоті сторінки", 2001. — С. 68-80.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ВИ. Кабачньш, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.- Харьков.: Издательство УкрФА «Прапор», 2005.- С.100-110.
Орієнтовна основа дії
Алгоритм виконання досліду „Визначення температури замерзання речовини"
1. Стакан заповнюють охолоджуючою сумішшю, приготованою з подрібненого льоду, солі (3: 1 ) і невеликої кількості води.
2. Збирають прилад для вимірювань, що складається з ємності з охолоджуючою сумішшю, пробірки закріпленою в штативі і термометра.
3. У пробірку наливають рідину і занурюють в охолоджуючу суміш.
4. У цю ж пробірку опускають заздалегідь перевірений термометр, причому нижній резервуар термометра повинен бути повністю занурений у воду.
5. Через кожних 30 сек. записують свідчення замерзання рідини.
6. Визначають температуру замерзання рідини за декількома свідченнями термометра, що повторюються.
7. Для точності експерименту дослідження проводять кілька разів.
Алгоритм виконання досліду “Визначення молярної маси неелектроліту”
1. Готують розчин сахарози.
2. Визначають температуру замерзання розчинника та приготованого розчину.
3. Визначають молярну масу неелектроліту.
4. Результати вимірювань і розрахунків заносять в таблицю. Роблять висновок.
Алгоритм виконання досліду “Визначення ізотонічного коефіцієнта, ступеня електролітичної дисоціації і осмотичного тиску електроліту у водному розчині”
1. Готують розчин хлориду натрію у дистильованій воді.
2.. Визначають температуру замерзання розчинника та розчину.
3. Розраховують моляльність розчину.
4. За рівнянням Вант-Гофа розраховують ізотонічний коефіцієнт і ступінь електролітичної дисоціації за рівнянням.
5. Знаходять осмотичний тиск при температурі досліду.
6. Осмотичний тиск досліджуваного розчину при температурі 273 К, порівнюють з осмотичним тиском при 310 К (фізіологічна температура).
7. На підставі отриманих результатів розрахунку роблять висновок про ізотонічність досліджуваного розчину і плазми крові.
8. Результати вимірювань заносять в таблицю.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Розчини електролітів є лікарськими препаратами. Яке максимальне значення ізотонічного коефіцієнта для розчина MgSO4?
A. 5
B. 4
C. 3
D. 2
E. 7
Тест 2
Який осмотичний тиск повинны мати розчини, які використовують в медицині в якості замінників крові?
A. 770-800 кПа
B. 200-300 кПа
C. 300-400 кПа
D. 500-600 кПа
E. 900-1000 кПа
Тест 3
Приготовлені водні розчини NaCl, Al2(SO4)3, KJ сечовины и гексаметилентетраміна однакової моляльності. Який з перерахованих розчинів кристалізується при найнижчій температурі?
A. Розчин NaCl
B. Розчин Al2(SO4)3
C. Розчин KJ
D. Розчин сечовини
E. Розчин гексаметилентетраміна
Тест 4
Серед перерахованих водних розчинів лікарських препаратів з однаковою молярністю максимальна температура кипіння відповідає розчину:
A. Промедола
B. Нікотинаміда
C. Сульфата натрія
D. Резорцина
E. Йода
Тест 5
Для визначення молярної маси нових лікарських речовин, а також оцінки ізотонічної концентрації може бути використаний метод
A. Потенціометрії
B. рН-метрії
C. Калориметрії
D. Кріоскопії
E. Кондуктометрії
Еталони відповідей до рішення цільових навчальних завдань: тест 1-D.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
