Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика Донецьк 2011
| Вид материала | Документы |
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 222.17kb.
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 215.57kb.
- Лекція хімічна кінетика, 315.26kb.
- Тема: Химический комплекс Украины в современных условиях, 176.49kb.
- 1. Хімічна термодинаміка в тнр основні поняття хіміко-технологічного процесу. Стехіометричні, 147.66kb.
- Програма вступних іспитів з дисципліни "Технічна електрохімія" для бакалаврів за напрямком, 324.77kb.
- Конспект лекцій для студентів спеціальностей 091605 «Хімічна технологія високомолекулярних, 1882.89kb.
- О. М. Науменко. Хімічна освіта в школі: екскурс в історію // К.: Шкільний світ, 131.41kb.
- І. Фізико-математичне відділення Секція, 96.5kb.
- Загальна програма з математики для підготовки до тестування на 2-ий курс радіофізичного, 24kb.
Заняття 13
Молекулярна кінетика. Каталіз
Актуальність теми
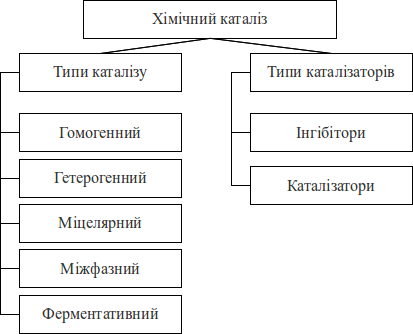
Каталіз - виборче прискорення одного з можливих термодинамічно дозволених напрямків хімічної реакції під дією каталізатора, який багаторазово вступає в проміжну хімічну взаємодію з учасниками реакції і відновлює свій хімічний склад після кожного циклу проміжних хімічних взаємодій. Каталізатор змінює механізм реакції на енергетично більш вигідний. Каталізатор утворює з молекулою одного з реагентів проміжну сполуку, в якій ослаблено хімічні зв'язки. Це полегшує його реакцію з другим реагентом. Важливо зазначити, що каталізатори прискорюють оборотні реакції, як в прямому, так і в зворотному напрямках. Явище каталізу поширене в природі (більшість процесів, що відбуваються в живих організмах, є каталітичними) і широко використовується в техніці, фармації.
Цілі навчання
Загальна мета:
УМІТИ: Інтерпретувати поняття молекулярної кінетики та каталізу для застосування їх у фармації.
Конкретні цілі:
УМІТИ:
- Визначати порядок і молекулярність реакції.
- Розрізняти різні типи каталізу.
Зміст навчання
Перелік теоретичних питань:
- Поняття молекулярності реакції.
- Порядок реакції.
- Методи визначення порядку реакції.
- Поняття каталізатора і інгібітору.
- Типи каталізу.
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.-Харків.: Вид-во УкрФА «Прапор», 1999.-С. 151-174.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. - Харьків: Вид-во НФАУ „Золоті сторінки", 2001. - С. 88-109.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачньїй, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.- Харьков.: Издательство УкрФА «Прапор», 2005.- С.151-174.
Граф логічної структури теми
О
рієнтовна основа дії
Алгоритм рішення задач. Див. Заняття 1.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Одним з факторів, що впливають на збільшення виходу лікарської речовини в процесі його синтезу, є зниження енергії активації реакції. Цьому сприяє:
A. Додавання каталізатора
B. підвищення температури
C. зниження температури
D. збільшення концентрації
E. зменшення концентрації
Тест 2
Що називається молекулярної реакції?
A. Сума стехіометрічніх коефіцієнтів учасників реакції
B. Число частинок, які вступають в дану хімічну реакцію
C. Число часток, що беруть участь в елементарному акті хімічної реакції
D. Порядок реакції
E. Кількість молекул продуктів реакції
Тест 3
Вкажіть порядок і молекулярної реакції кислотного гідролізу етилацетату
A. Мономолекулярна, першого порядку
B. Бімолекулярна, другого порядку
C. Бімолекулярна, третього порядку
D. Бімолекулярна, псевдопершого порядку
E. Мономолекулярна, другого порядку
Тест 4
Ферменти широко використовуються у фармації в якості лікарських препаратів. Яке основна відмінність ферментів від небіологічних каталізаторів?
A. висока універсальність
B. мала універсальність
C. Висока специфічність дії і селективність
D. висока дисперсність
E. висока гомогенність
Тест 5
У яких випадках збігаються порядок і молекулярної хімічних реакцій?
A. збігаються завжди
B. Не збігаються ніколи
C. Тільки для складних багатостадійних реакцій.
D. Тільки для простих одинстадійних реакцій
E. Для ферментних реакцій
Еталони відповідей до рішення цільових навчальних завдань:
тест 1-А, тест 2- С, тест 3-D, тест 4- С, тест 5 - D.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
Заняття 14
Колоквіум за темою: «Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика»
Актуальність теми
Розповсюдженою лікарською формою є розчини. Тому майбутньому провізору важливо мати уяву про колігативні властивості розчинів. Електрохімія необхідна для розуміння методу потенціометрії, основ роботи електродів. Хімічна кінетика описує перебіг хімічної реакції, що важливо для розуміння технологічних процесів виробництва ліків, та біохімічних аспекті їх дії.
Цілі навчання
Загальна мета: вміти продемонструвати знання-уміння за темою.
Конректні цілі:
ВМІТИ:
- Інтерпретувати теоретичний матеріал за темою.
- Розрахувати параметри досліджуваних явищ з теми.
Теоретичні питання для самопідготовки:
- Типи розчинів: рідкі, ідеальні, розбавлені, реальні, неелектролітів, електролітів.
- Ізотонічний коефіцієнт Вант-Гоффа для розчинів електролітів.
- Склад розчинів. Способи виразу концентрацій компонентів розчинів. Масова частка. Молярна частка. Моляльність. Молярність.
- Закон Рауля і його слідства.
- Рівняння для двокомпонентних розчинів.
- Рівняння для багатокомпонентних розчинів.
- Колігативні властивості розбавлених розчинів.
- Методи експериментального визначення колігативних властивостей. Розрахунок колігативних властивостей розбавлених розчинів.
- Осмотичний тиск. Осмометрія.
- Застосування методів ебуліометрії, кріометрії і осмометрії у фармації.
- Поняття сили електроліту. Здатність молекул електролітів дисоціювати, оборотність дисоціації.
- Ступінь дисоціації. Константа дисоціації.
- Колигативні властивості розчинів електролітів.
- Питома, молярна, іонна електропровідність електролітів.
- Розрахунок електричної провідності розчинів електролітів.
- Застосування даних електропроводності розчинів електролітів у фармації.
- Класифікація електродів.
- Електродні потенціали.
- Гальванічний елемент.
- Електро рушійна сила (ЕРС).
- Водневий показник рН. Іонний добуток води. Гідроксильний показник рОН.
- Метод потенціометричного визначення рН. Електродна система. Калібрування шкали потенціометра. Виконання вимірювань величини ЕРС або рН.
- Чим визначається швидкість хімічних реакцій?
- Фактори що впливають на швидкість хімічної реакції.
- Швидкість гомогенних хімічних реакцій і методи її вимірів.
- Молекулярність і порядок реакції.
- Кінетичні рівняння реакцій 1-го і 2-го порядків. Константа швидкості реакцій 1-го і 2-го порядків.
- Температурний коефіцієнт реакції і його особливість для біохімічних процесів.
- Енергія активації. Рівняння Арреніуса.
- Класифікація хімічних реакцій за механізмом.
- Кінетична класифікація хімічних реакцій.
- Методи визначення швидкості хімічних реакцій.
- Залежність швидкості хімічних реакцій від температури.
- Залежність швидкості хімічної реакції від концентрації реагентів.
- Поняття молекулярності реакції.
- Порядок реакції. Методи визначення порядку реакції.
- Поняття каталізатора і інгібітору.
- Типи каталізу.
Джерела інформації
Основна література:
Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во УукФА „Прапор”, 1999.
Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во НФАУ „Золоті сторінки”, 2001.
Лекції з фізичної та колоїдної хімії.
Додаткова література:
Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1964.
Короткі методичні вказівки до роботи на практичному занятті
Кожний студент повинен виконати тестовий контроль (20-30 тестів). Після того, як студент віддає тестову роботу викладачеві, він отримує 3 завдання, які охоплюють матеріал теми. Завдання передбачають вміння інтерпретувати матеріал за темою та проводити розрахунки параметрів утворення колоїдів, їх оптичних та електричних властивостей, тощо. Студенти працюють самостійно. Відповіді оформлюються на бланках. Потім викладач перевіряє роботи, аналізує помилки, підводить підсумки заняття.
Заняття 15
Підсумковий модульний контроль № 1
Актуальність теми
Фізична хімія знаходиться в тісному зв'язку з біохімією, технологією ліків, фармакологією, фармацевтичною та токсикологічною хімією та іншими предметами циклу підготовки майбутніх провізорів. Глибоке розуміння явищ колоїдної хімії необхідно для повноцінної професійної підготовки фармацевтів-провізорів.
Цілі навчання
Загальна мета: вміти продемонструвати знання-уміння за темою.
Конректні цілі:
ВМІТИ:
- Інтерпретувати теоретичний матеріал за темою.
- Розрахувати параметри досліджуваних явищ з теми.
Теоретичні питання для самопідготовки:
- Предмет і основні поняття термодинаміки: система, процес, термодинамічні змінні.
- Перший закон термодинаміки. Внутрішня енергія як функція стану системи. Математичне вираження першого закону термодинаміки. Застосування першого закону термодинаміки.
- Ентальпія. Зв'язок між теплотою ізохорний процес.
- Закон Гесса як висновок першого закону термодинаміки. Практичне значення закону Гесса.
- Стандартні ентальпії утворення та згоряння, застосування для визначення теплових ефектів реакцій.
- Калориметрія. Значення термохимический вимірювань для складання теплових балансів хімічних і фармацевтичних виробництв.
- Залежність теплового ефекту від температури. Рівняння Кірхгофа га його практичне значення.
- Другий закон термодинаміки. Ентропія, фізичний зміст і розмірність.
- Розрахунок зміни ентропії в різних процесах.
- Статистичний характер другого закону термодинаміки. Зв'язок між ентропією та термодинамічною ймовірністю стану системи.
- Характеристичні функції. Термодинамічні потенціали їх застосування для визначення можливості, напрямки і межі проходження спонтанних фізико-хімічних і біологічних процесів.
- Рівнянням Гібса-Гельмгольца, його аналіз і практичне застосування.
- Хімічна рівновага, його ознаки. Закон дії мас. Константа хімічної рівноваги і способи її вираження.
- Рівняння ізотерми хімічної реакції Вант-Гоффа, його аналіз і застосування.
- Вплив температури на зміщення рівноваг. Рівняння ізохори та ізобари хімічної реакції Вант-Гоффа, їх практичне визначення.
- Розрахунок константи хімічної рівноваги за допомогою таблиць термодинамічних величин. Значення цього методу для фармацевтичної практики.
- Поняття про фазу, число компонентів і число незалежних компонентів, число ступенів свободи (варіантність) системи.
- Правило фаз Гібса, його аналіз і практичне застосування.
- Діаграма стану однокомпонентної системи (на прикладі води), аналіз її за допомогою правила фаз Гібса.
- Рівняння Клаузіуса-Клапейрона, його аналіз. Розрахунок теплових ефектів фазового переходу за експериментальними даними.
- Фазові діаграми двокомпонентних систем, їх аналіз із застосуванням правила фаз.
- Поняття про фізико-хімічний аналіз. Термічний аналіз (теорія і практика), застосування для дослідження фармацевтичних об'єктів.
- Трикомпонентні системи. Розподіл речовини між двома рідкими фазами. Коефіцієнт розподілу. Різні форми рівнянь закону розподілу. Екстрагування. Рівняння екстракції (виведення).
- Типи розчинів: рідкі, ідеальні, розбавлені, реальні, неелектролітів, електролітів.
- Ізотонічний коефіцієнт Вант-Гоффа для розчинів електролітів.
- Склад розчинів. Способи виразу концентрацій компонентів розчинів. Масова частка. Молярна частка. Моляльність. Молярність.
- Закон Рауля і його слідства.
- Рівняння для двокомпонентних розчинів.
- Рівняння для багатокомпонентних розчинів.
- Колігативні властивості розбавлених розчинів.
- Методи експериментального визначення колігативних властивостей. Розрахунок колігативних властивостей розбавлених розчинів.
- Осмотичний тиск. Осмометрія.
- Застосування методів ебуліометрії, кріометрії і осмометрії у фармації.
- Поняття сили електроліту. Здатність молекул електролітів дисоціювати, оборотність дисоціації.
- Ступінь дисоціації. Константа дисоціації.
- Колигативні властивості розчинів електролітів.
- Питома, молярна, іонна електропровідність електролітів.
- Розрахунок електричної провідності розчинів електролітів.
- Застосування даних електропроводності розчинів електролітів у фармації.
- Класифікація електродів.
- Електродні потенціали.
- Гальванічний елемент.
- Електро рушійна сила (ЕРС).
- Водневий показник рН. Іонний добуток води. Гідроксильний показник рОН.
- Метод потенціометричного визначення рН. Електродна система. Калібрування шкали потенціометра. Виконання вимірювань величини ЕРС або рН.
- Чим визначається швидкість хімічних реакцій?
- Фактори що впливають на швидкість хімічної реакції.
- Швидкість гомогенних хімічних реакцій і методи її вимірів.
- Молекулярність і порядок реакції.
- Кінетичні рівняння реакцій 1-го і 2-го порядків. Константа швидкості реакцій 1-го і 2-го порядків.
- Температурний коефіцієнт реакції і його особливість для біохімічних процесів.
- Енергія активації. Рівняння Арреніуса.
- Класифікація хімічних реакцій за механізмом.
- Кінетична класифікація хімічних реакцій.
- Методи визначення швидкості хімічних реакцій.
- Залежність швидкості хімічних реакцій від температури.
- Залежність швидкості хімічної реакції від концентрації реагентів.
- Поняття молекулярності реакції.
- Порядок реакції. Методи визначення порядку реакції.
- Поняття каталізатора і інгібітору.
- Типи каталізу.
Джерела інформації
Основна література:
- Физическая и коллоидная химия / В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др.; Под ред. В.И. Кабачного. – Харьков: изд-во НФАУ, 2001.
- Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во УукФА „Прапор”, 1999.
- Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во НФАУ „Золоті сторінки”, 2001.
- Лекції з фізичної та колоїдної хімії.
Додаткова література:
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1964.
Короткі методичні вказівки до роботи на практичному занятті
Кожний студент повинен виконати тестовий контроль (30-50 тестів). Після того, як студент віддає тестову роботу викладачеві, він отримує 5 завдань, які охоплюють матеріал всього модуля. Завдання передбачають вміння інтерпретувати матеріал за темою та проводити розрахунки параметрів явищ колоїдної хімії. Студенти працюють самостійно з наборами завдань за темою. Відповіді оформлюються на бланках та віддаються викладачеві для перевірки.
