Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика Донецьк 2011
| Вид материала | Документы |
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 222.17kb.
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 215.57kb.
- Лекція хімічна кінетика, 315.26kb.
- Тема: Химический комплекс Украины в современных условиях, 176.49kb.
- 1. Хімічна термодинаміка в тнр основні поняття хіміко-технологічного процесу. Стехіометричні, 147.66kb.
- Програма вступних іспитів з дисципліни "Технічна електрохімія" для бакалаврів за напрямком, 324.77kb.
- Конспект лекцій для студентів спеціальностей 091605 «Хімічна технологія високомолекулярних, 1882.89kb.
- О. М. Науменко. Хімічна освіта в школі: екскурс в історію // К.: Шкільний світ, 131.41kb.
- І. Фізико-математичне відділення Секція, 96.5kb.
- Загальна програма з математики для підготовки до тестування на 2-ий курс радіофізичного, 24kb.
Заняття 7
Колоквіум за темою: «Хімічна термодинаміка. Термодинаміка фазових рівноваг»
Актуальність теми
Хімічна термодинаміка, базуючись на двох законах термодинаміки дозволяє вирішувати такі завдання, як визначення енергетичних ефектів хімічних та фізико-хімічних процесів, можливості та умови самодовільного перебігу хімічної реакції з максимальним виходом продукту, що використовується в фармацевтичній промисловості.
Цілі навчання
Загальна мета: вміти продемонструвати знання-уміння за темою.
Конректні цілі:
ВМІТИ:
- Інтерпретувати теоретичний матеріал за темою.
- Розрахувати параметри досліджуваних явищ з теми.
Теоретичні питання для самопідготовки:
- Предмет і основні поняття термодинаміки: система, процес, термодинамічні змінні.
- Перший закон термодинаміки. Внутрішня енергія як функція стану системи. Математичне вираження першого закону термодинаміки. Застосування першого закону термодинаміки.
- Ентальпія. Зв'язок між теплотою ізохорний процес.
- Закон Гесса як висновок першого закону термодинаміки. Практичне значення закону Гесса.
- Стандартні ентальпії утворення та згоряння, застосування для визначення теплових ефектів реакцій.
- Калориметрія. Значення термохимический вимірювань для складання теплових балансів хімічних і фармацевтичних виробництв.
- Залежність теплового ефекту від температури. Рівняння Кірхгофа га його практичне значення.
- Другий закон термодинаміки. Ентропія, фізичний зміст і розмірність.
- Розрахунок зміни ентропії в різних процесах.
- Статистичний характер другого закону термодинаміки. Зв'язок між ентропією та термодинамічною ймовірністю стану системи.
- Характеристичні функції. Термодинамічні потенціали їх застосування для визначення можливості, напрямки і межі проходження спонтанних фізико-хімічних і біологічних процесів.
- Рівнянням Гібса-Гельмгольца, його аналіз і практичне застосування.
- Хімічна рівновага, його ознаки. Закон дії мас. Константа хімічної рівноваги і способи її вираження.
- Рівняння ізотерми хімічної реакції Вант-Гоффа, його аналіз і застосування.
- Вплив температури на зміщення рівноваг. Рівняння ізохори та ізобари хімічної реакції Вант-Гоффа, їх практичне визначення.
- Розрахунок константи хімічної рівноваги за допомогою таблиць термодинамічних величин. Значення цього методу для фармацевтичної практики.
- Поняття про фазу, число компонентів і число незалежних компонентів, число ступенів свободи (варіантність) системи.
- Правило фаз Гібса, його аналіз і практичне застосування.
- Діаграма стану однокомпонентної системи (на прикладі води), аналіз її за допомогою правила фаз Гібса.
- Рівняння Клаузіуса-Клапейрона, його аналіз. Розрахунок теплових ефектів фазового переходу за експериментальними даними.
- Фазові діаграми двокомпонентних систем, їх аналіз із застосуванням правила фаз.
- Поняття про фізико-хімічний аналіз. Термічний аналіз (теорія і практика), застосування для дослідження фармацевтичних об'єктів.
- Трикомпонентні системи. Розподіл речовини між двома рідкими фазами. Коефіцієнт розподілу. Різні форми рівнянь закону розподілу. Екстрагування. Рівняння екстракції (виведення).
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во УукФА „Прапор”, 1999. - с. 11-87.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во НФАУ „Золоті сторінки”, 2001. с. 1-41.
3. Лекції з фізичної та колоїдної хімії.
Додаткова література:
4. Физическая и коллоидная химия/ В.И. Кабачный, л.к. Осипенко, Л.Д. Грицан; Под ред. В.И. Кабачного.- Харьков: изд-во НФаУ, 2005. - с. 11-85.
Короткі методичні вказівки до роботи на практичному занятті
Кожний студент повинен виконати тестовий контроль (20-30 тестів). Після того, як студент віддає тестову роботу викладачеві, він отримує 3 завдання, які охоплюють матеріал теми. Завдання передбачають вміння інтерпретувати матеріал за темою та проводити розрахунки параметрів утворення колоїдів, їх оптичних та електричних властивостей, тощо. Студенти працюють самостійно. Відповіді оформлюються на бланках. Потім викладач перевіряє роботи, аналізує помилки, підводить підсумки заняття.
Заняття 8
Колігативні властивості розбавлених розчинів. Ідеальні розчини
Актуальність теми
Розчини — це однофазні системи змінного складу, утворені не менше чим двома компонентами. Склад розчинів характеризується концентраціями компонентів. Властивості розчинів, які не залежать від природи (складу і хімічної будови) розчиненої речовини, а залежать тільки від його молярної концентрації, називають колігативними. Майже всі лікарські засоби мають лікувальну дію на організм в розчиненому стані. Синтез і виробництво основної маси препаратів здійснюється в розчинах. Розчини використовують майже в кожному технологічному процесі. Більшість продуктів харчування людини — розчини.
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть фазових рівноваг в рідких розчинах для подальшого використання таких знань - умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Інтерпретувати типи розчинів.
2. Інтерпретувати суть закону Рауля.
3. Інтерпретувати колігативні властивості розчинів і методи їх експериментального визначення.
4. Розраховувати колигативні властивості розчинів і оцінювати отримані результати.
Зміст навчання
Перелік теоретичних питань:
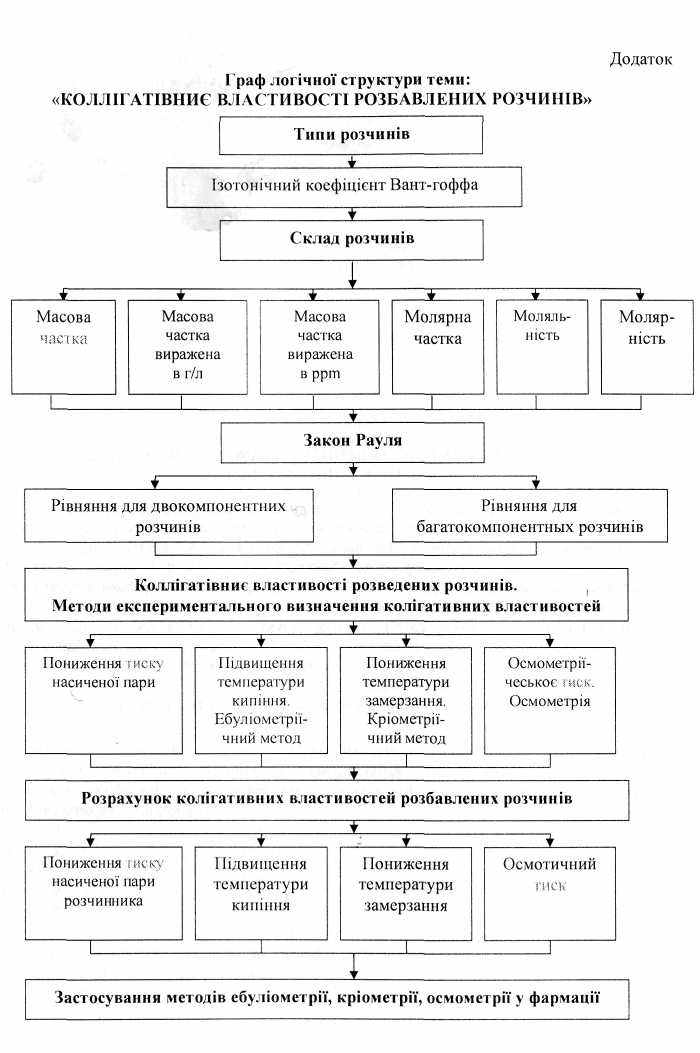
- Типи розчинів: рідкі, ідеальні, розбавлені, реальні, неелектролітів, електролітів.
- Ізотонічний коефіцієнт Вант-Гоффа для розчинів електролітів.
- Склад розчинів. Способи виразу концентрацій компонентів розчинів. Масова частка. Молярна частка. Моляльність. Молярність.
- Закон Рауля і його слідства.
- Рівняння для двокомпонентних розчинів.
- Рівняння для багатокомпонентних розчинів.
- Колігативні властивості розбавлених розчинів.
- Методи експериментального визначення колігативних властивостей. Пониження тиску насиченої пари розчинника. Підвищення температури кипіння. Ебулеометрічний метод. Пониження температури замерзання. Кріометричний метод.
- Осмотичний тиск. Осмометрія.
- Розрахунок колігативних властивостей розбавлених розчинів. Пониження тиску насиченої пари розчинника. Підвищення температури кипіння. Пониження температури замерзання.
- Застосування методів ебуліометрії, кріометрії і осмометрії у фармації.
Граф логічної структури теми “Колігативні властивості розбавлених розчинів”
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін.; Зазаг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. - С. 88-109.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. — Харьків: Вид-во НФАУ „Золоті сторінки", 2001. — С. 68-80.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ВИ. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.- Харьков.: Издательство УкрФА «Прапор», 2005.- С.88-109.
Орієнтовна основа дії
Алгоритм рішення задач, див. Заняття 1.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Який з розчинів однакової молярної концентрації характеризується найбільшим осмотичним тиском?
А. Етанол
В. Фенол
С. Хлорид кальцію
О. Хлорид калія
Е. Хлорид літію
Тест 2
У технології фармацевтичних препаратів іноді потрібно проводити процеси при низьких температурах. Який з розчинів почне кристалізуватися раніше за умов їх однаковою моляльности?
А. КВг
В. А12(ЗО4)з
С. СаС12
D. NаСІ
Е. С6Н12О6
Тест 3
Який з розчинів однакової молярної концентрації характеризується найбільшим осмотичним тиском?
A. Хлорид кальция
B. Фенол
C. Хлорид лития
D. Хлорид калия
E. Етанол
Тест 4
Були приготовані водні розчини сахарози, СаСl2, NaCl, Al2(SO4)3, и K3[Fe(CN)6] однаковою моляльність. Який з перерахованих розчинів кипить при більш високій температурі?
A. Al2(SO4)3
B. K3[Fe(CN)6]
C. Сахарози
D. СаС12
E. NaCl
Тест 5
Розрахувати рН розчину, в якому [H+] = 1,0· 10–8 моль /л.
A. 8
B. 6
C. 14
D. 1
E. 4
Еталони відповідей до рішення цільових навчальних завдань: тест 1-А.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
