Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика Донецьк 2011
| Вид материала | Документы |
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 222.17kb.
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 215.57kb.
- Лекція хімічна кінетика, 315.26kb.
- Тема: Химический комплекс Украины в современных условиях, 176.49kb.
- 1. Хімічна термодинаміка в тнр основні поняття хіміко-технологічного процесу. Стехіометричні, 147.66kb.
- Програма вступних іспитів з дисципліни "Технічна електрохімія" для бакалаврів за напрямком, 324.77kb.
- Конспект лекцій для студентів спеціальностей 091605 «Хімічна технологія високомолекулярних, 1882.89kb.
- О. М. Науменко. Хімічна освіта в школі: екскурс в історію // К.: Шкільний світ, 131.41kb.
- І. Фізико-математичне відділення Секція, 96.5kb.
- Загальна програма з математики для підготовки до тестування на 2-ий курс радіофізичного, 24kb.
Заняття 4
Фазові рівноваги. Правило фаз Гібсса. Фазові перетворення в однокомпонентних системах. Рівняння Клапейрона-Клаузіуса
Актуальність теми
Відповідно до закону фазової рівноваги (правило фаз Гібса), термодинамічні системи поділяють: а) за характером фазової будови на гетерогенні, гомогенні і такі, що конденсують; б) за числом ступенів свободи на безваріантні, одно-, двух-, трьох- і багатоваріантні; в) за числом незалежних компонентів на одно-, двух-, трьох-, багато компонентні. Графічне зображення експериментальних співвідношень між параметрами стану термодинамічних систем і величинами їх вимірюваних фізичних властивостей називають діаграмами стану. За цими діаграмами встановлюють характер взаємодії компонентів, склад і межі існування фаз постійного і змінного складу, що утворюються, без ізолювання цих фаз та їх хімічного аналізу. Це пояснює широке застосування діаграм стану в фармацевтичній хімії.
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть фазової рівноваги для подальшого використання таких знань — умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Інтерпретувати фазовий стан термодинамічних систем, фазовий перехід, фазову рівновагу, суть закону фазової рівноваги.
2. Розраховувати число компонентів і варіантність гетерогенних систем, оцінювати отримані результати.
3. Інтерпретувати діаграми стану термодинамічних систем, аналізувати фазові діаграми одно- і двокомпонентних систем.
Зміст навчання
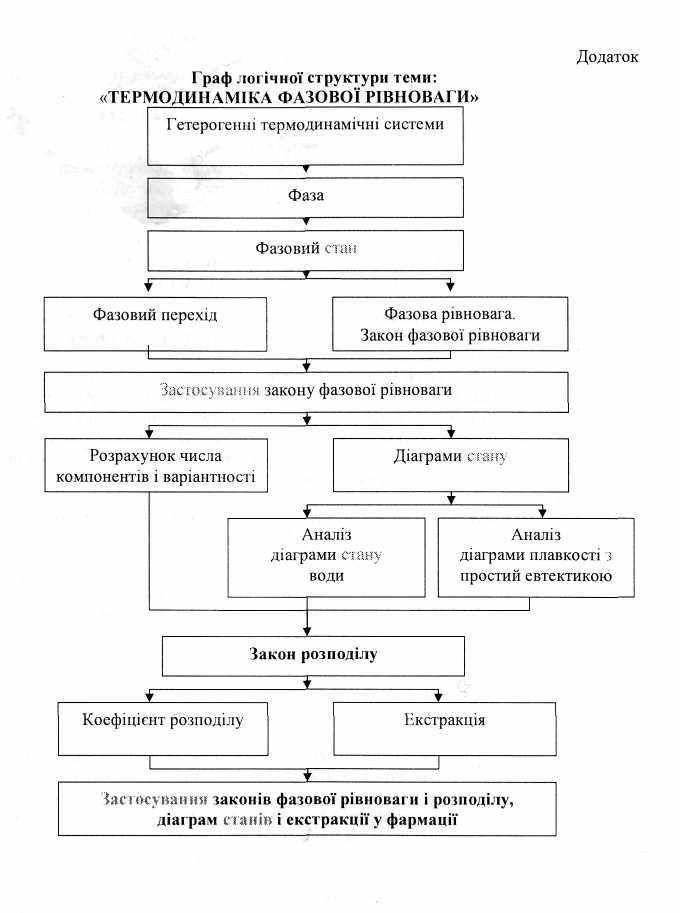
Перелік теоретичних питань:
- Гетерогенні термодинамічні системи.
- Фаза. Фазовий стан.
- Фазовий перехід. Рівняння Клапейрона-Клаузіуса.
- Фазова рівновага. Закон фазової рівноваги.
- Застосування закону фазової рівноваги.
- Розрахунок числа компонентів і варіантності.
- Діаграми стану. Аналіз діаграми стану води.
- Аналіз діаграми плавкості з простий евтектикою.
- Закон розподілу. Рівняння Нернста.
- Визначення коефіцієнта розподілу.
- Екстракція. Прийоми екстракції.
- Застосування законів фазової рівноваги і розподілу, діаграм станів і екстракції у фармації.
Граф логічної структури: “Термодинаміка фазової рівноваги”
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. -С. 50-78.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. -Харьків: Вид-во НФАУ „Золоті сторінки", 2001. -С. 39-41.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачньш, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.-Харьков.: Издательство УкрФА «Прапор», 2005.- С.50-78.
Орієнтовна основа дії
Алгоритм рішення задач, див. Заняття 1.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Чому дорівнює число компонентів в точці перетину лінії ліквідуса з віссю ординат на діаграмі плавкості?
А. 1
В. З
С. 2
D. 0
Е. 4
Тест 2
Екстракція — це один з технологічних етапів виробництва лікарських препаратів. При дослідженні розподілу оцетової кислоти між хлороформом і водою було встановлено, що її молекули утворюють дімери в органічному розчиннику. Вкажіть рівняння, яке використовують для розрахунку розподіли в цьому випадку.
А. К=с2/с,
В. К=с2/с,2
С. К=с,/с2
D. к=с2/сГ
Е. К = 1§с2-т1§с,
Тест 3
У стоматологічній практиці використовують рідкі лікарські форми, що містять камфару і хлоралгідрат. Вкажіть, які фази знаходитимуться в рівновазі за умови відповідних евтектичній крапці на вивченій діаграмі:
А. Розплав евтектичного складу і кристалічний хлоралгідрат
В. Розплав евтектичного складу і кристалічна камфара
С. Кристали камфарьі і хлоралгідрати
О. Розплав евтектичного складу
Е. Розплав евтектичного складу, кристали хлоралгідрата, кристали камфарьі
Тест 4
Однією з важливих у вивченні физико-хімічних властивостей води є аналіз діаграми стану. Які фази в рівновазі за умов, позначених потрійною крапкою на діаграмі стану води?
А. Рідка вода, лід
В. Рідка вода, пари води
С. Рідка вода, лід, пари води
D. Лід, пари води
Е. Лід
Тест 5
При виготовленні суппозіторієв використовують діаграми плавкості. Правило фаз Гиббса для системи, що конденсує, записують так:
А. С = К-Ф-1
В. С = Ф-К+1
С. С = К-Ф+2
D. С=К-Ф+1
E. с = ф-к+2
Еталони відповідей до рішення цільових навчальних завдань: тест 1 — А, тест 5 — 0.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
