Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика Донецьк 2011
| Вид материала | Документы |
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 222.17kb.
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 215.57kb.
- Лекція хімічна кінетика, 315.26kb.
- Тема: Химический комплекс Украины в современных условиях, 176.49kb.
- 1. Хімічна термодинаміка в тнр основні поняття хіміко-технологічного процесу. Стехіометричні, 147.66kb.
- Програма вступних іспитів з дисципліни "Технічна електрохімія" для бакалаврів за напрямком, 324.77kb.
- Конспект лекцій для студентів спеціальностей 091605 «Хімічна технологія високомолекулярних, 1882.89kb.
- О. М. Науменко. Хімічна освіта в школі: екскурс в історію // К.: Шкільний світ, 131.41kb.
- І. Фізико-математичне відділення Секція, 96.5kb.
- Загальна програма з математики для підготовки до тестування на 2-ий курс радіофізичного, 24kb.
Заняття 5
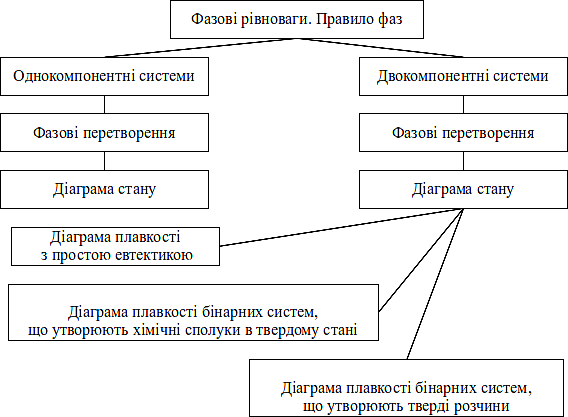
Фазові рівноваги. Двокомпонентні системи. Діаграми плавкості з простою евтектикою. Діаграми плавкості бінарних систем, компоненти котрих утворюють тверді розчини
Актуальність теми
За діаграмами плавкості встановлюють склад сумішей, межі існування утворюваних фаз. Термодинаміка фазових рівноваг широко застосовується у фармації. Побудова фазових діаграм використовується у фармацевтичному аналізі для ідентифікації і визначення ступеня чистоти лікарських речовин. Дані термічного аналізу застосовують для оптимізащї синтезу біологічно активних і лікарських речовин, для підбору основ суппозіторієв, при рішенні питання про сумісність лікарських препаратів в лікарських формах.
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть фазової рівноваги для подальшого використання таких знань — умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Будувати діаграми плавкості речовин за експериментальними даними.
2. Визначати склад суміші лікарських речовин за діаграмами плавкості.
Зміст навчання
Перелік теоретичних питань:
1. Фазові перетворення в двухкомпонентних системах.
2. Диаграма плавкості з простою евтектикою.
3. Застосування диаграм плавкості в фармації.
Граф логічної структури теми “Фазові рівноваги”
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. -С. 67-79.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. -Харьків: Вид-во НФАУ „Золоті сторінки", 2001. -С. 39-41.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.-Харьков.: Издательство УкрФА «Прапор», 2005.- С.67-78.
Орієнтовна основа дії
Алгоритм виконання досліду “Визначення складу лікарських сумішей за діаграмами плавкості”
1. Включити водяну баню. Помістити в баню 2-3 пробірки з сумішшю лікарських речовин в різних співвідношеннях.
2. Визначити температуру плавлення в пробірках. Результати занести в таблицю.
3. Витягнути пробірки з бані та фіксувати температуру суміші кожні 30с. Результати досліджень занести до таблиці.
3. Визначити температуру появи перших кристалів. Результати досліджень занести до таблиці.
4. За результатами вимірів побудувати криві охолодження та диаграмму плавкості.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Обчислення температури фазових перетворень при різних тисках має важливе практичне значення для сучасного фармацевтичного виробництва і здійснюється відповідно до:
A. Рівняння Клапейрона-Клаузіуса
B. Правила Трутона
C. Правила фаз Гіббса
D. Рівняння Менделєєва-Клапейрона
E. Законів Коновалова
Тест 2
Точка максимуму на діаграмі плавкості, коли речовини утворюють стійку сполуку, зветься:
A.Сінгулярною
B. Евтектичною
C. Рівноважною
D. Максимальною
E. Критичною
Тест 3
На діаграмі плавкості двохкомпонентної системи з простою евтектикою выще лінії ліквідуса:
A. Обидва компоненти знаходяться в рідкому стані
B. Обидва компоненти знаходяться в твердому стані
C. Обидва компоненти знаходяться в газуватому стані
D. Кожний компонент знаходиться частково в різних агрегатних станах
E. Один з компонентів знаходиться в рідкому стані, іншої - в твердому
Тест 4
Більшість технологічних процесів в фармації протікає в гетерогених системах. Яка кількість фаз знаходиться в суміші евтектичного складу при евтектичній температурі двуохкомпонентної системи?
A. 3
B. 2
C. 5
D. 4
E. 1
Тест 5
В евтектичній точці двохкомпонентної системи з простою евтектикою в рівновазі знаходяться фази:
А. 2 твердих и розплав евтектичного складу
B. 3 твердих
C. 2 рідких і 1 тверда
D. 1 тверда, 1 рідка и 1 газувата
E. 3 рідких
Еталони відповідей до рішення цільових навчальних завдань: тест 1 — A, тест 2 — A.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
Заняття 6
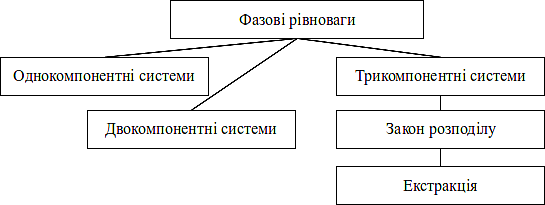
Фазові рівноваги. Трьохкомпонентні системи. Закон розподілу. Екстракція
Актуальність теми
Найпоширеніший випадок застосування закону розподілу у фармацевтичній і токсикологічній хімії, технології ЛС - це екстракція. Широкому розповсюдженню методу екстракції розділу сприяє можливість поєднання розділення з одночасним розділенням. Екстракцію використовують в лабораторній і заводській практиці для виділення і очищення ефірних масел, алкалоїдів, антибіотиків і інших лікарських речовин.
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть фазової рівноваги для подальшого використання таких знань — умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Провести екстракцію йода з водного розчину.
2. Розрахувати коефіцієнт розподілу.
3. Оцінити ефективність екстракції.
Зміст навчання
Перелік теоретичних питань:
1. Трьохкомпонентні системи.
2. Розподіл речовини між двома рідкими фазами.
3. Закон розподілу Нернста.
4. Екстракція та її застосування в фармации.
Граф логічної структури теми
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осіиенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. -С. 80-88.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. -Харьків: Вид-во НФАУ „Золоті сторінки", 2001. -С. 39-41.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.-Харьков.: Издательство УкрФА «Прапор», 2005.- С.79-85.
Орієнтовна основа дії
Алгоритм виконання досліду “Визначення коефіцієнта розподілу та ступеня вилучення йоду при однократній екстракції”
1. Визначити точну концентрацію розчину йода для екстракції.
2. Приготувати суміші розчин йоду — вода — хлороформ в колбах.
3. Струшувати суміші впродовж 10 хв.
4. Розділити фази за допомогою розділяючої воронки.
5. Визначити вміст йоду в водній та органічній фазі методом титрування натрію тиосульфатом.
6. Розрахувати ступінь вилучення йоду.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
В фармацевтичному виробництві для виділення ефірних олій з рослинної сировини можна використовувати метод.
A. Ректифікації
B. Кріоскопії
C. Екстракції
D. Конденсації
E. Поляриметрії
Тест 2
Дибазол характеризується спазмолітичною та гіпотензивною дією. Для розрахунка обсягу хлороформа для екстракції дибазолу з водного розчину необхідно знати:
A. Коефіцієнт розподілу
B. Температуру кипіння хлороформа
C. Коефіцієнт дифзії
D. Температуру плавлення дибазолу
E. Ебуліоскопічну сталу води
Тест 3
При дослідженні розподілу йода між хлороформом і водою було встановлено, що йод в кожній з рівноважних фаз знаходиться в однаковому молекулярному стані. Вкажіть, яким рівнянням слід скористатися для розрахунку коефіцієнту розподілу в цьому випадку.
A. К = С2/С12
B. К = С2/С1
C. К = С1/С2
D. К = С2/С1m
E. Lg К = Lg С2 – m Lg С1
Тест 4
При дослідженні розподілу оцтової кислоти між хлороформом і водою було встановлено, що її молекули утворюють димеры в органичному розчиннику. Вкажіть рівняння, яке використовують для розрахунку коефіцієнту розподілу в цьому випадку:
A. К = С2/С12
B. К = С2/С1
C. К = С1/С2
D. К = С2/С1m
E. Lg К = Lg С2 – m Lg С1
Тест 5
Екстракція – найпоширеніший метод виділення речовини з систем. Яким розчинником найкраще екстрагувати йод з водного розчину, якщо коефіцієнт розподілу змінюється в ряду: K(CS2) > K(C6H6) > K(циклогексан) > K(C6H14) > K(C6H13OH).
A. Циклогексан
B. C6H14
C. CS2
D. C6H14
E. C6H3OH
Еталони відповідей до рішення цільових навчальних завдань:
тест 1 — С, тест 2 — A, тест 3 — B, тест 4 — А, тест 5 — C.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
