Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика Донецьк 2011
| Вид материала | Документы |
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 222.17kb.
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 215.57kb.
- Лекція хімічна кінетика, 315.26kb.
- Тема: Химический комплекс Украины в современных условиях, 176.49kb.
- 1. Хімічна термодинаміка в тнр основні поняття хіміко-технологічного процесу. Стехіометричні, 147.66kb.
- Програма вступних іспитів з дисципліни "Технічна електрохімія" для бакалаврів за напрямком, 324.77kb.
- Конспект лекцій для студентів спеціальностей 091605 «Хімічна технологія високомолекулярних, 1882.89kb.
- О. М. Науменко. Хімічна освіта в школі: екскурс в історію // К.: Шкільний світ, 131.41kb.
- І. Фізико-математичне відділення Секція, 96.5kb.
- Загальна програма з математики для підготовки до тестування на 2-ий курс радіофізичного, 24kb.
Заняття 1
Застосування першого закону термодинаміки до хімічних процесів. Перший закон термодинаміки. Термохімія.
Актуальність теми
Хімічна термодинаміка - розділ термодинаміки, що вивчає залежності термодинамічних властивостей речовин від їх складу, будови, середовища а також явищ, які пов'язані з фізико-хімічними процесами (розчинення, випаровування, кристалізація, адсорбція, тощо). В основі хімічної термодинаміки лежать загальні положення і висновки термодинаміки. Перший закон термодинаміки служить основою термохімії, для термохімічних розрахунків використовують закон Гесса - важливе його слідство. У поєднанні з іншими термодинамічними характеристиками термохімічні дані дозволяють проводити вибір оптимальних технологічних режимів хімічних виробництв. З іншого боку, термохімічні дослідження встановлюють зв'язок між енергетичними характеристиками речовин і їх будовою, складом та реакційною здатністю. Термохімічний аналіз застосовується для дослідження стадій біологічного окислення, м'язового скорочення і деяких фізіологічних процесів у клітинах. Порівняння енергетики здорових і хворих клітин дозволяє вивчати різні патологічні явища, розробляти діагностику та методи лікування деяких захворювань на ранніх стадіях, розробляти нові та вдосконалювати відомі лікарські засоби.
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть першого закону термодинаміки і закону Гесса для подальшого використання таких знань - умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Інтерпретувати типи термодинамічних систем.
2. Інтерпретувати зміни внутрішньої енергії і ентальпії термодинамічних систем.
4. Розраховувати теплоти хімічних і фізико-хімічних процесів.
Зміст навчання
Перелік теоретичних питань:
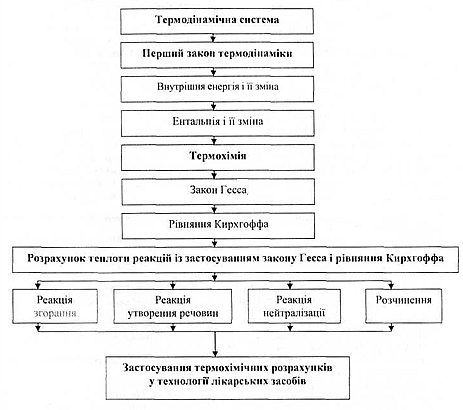
1. Термодинамічні системи: основні поняття і визначення термодинаміки.
2. Перший закон термодинаміки.
3. Внутрішня енергія і її зміна.
4. Ентальпія та її зміна.
5. Термохімія. Закон Гесса.
6. Термохімія. Рівняння Кирхгоффа.
7. Розрахунок теплоти реакцій із застосуванням закону Гесса і рівнянням Кирхгоффа.
8. Застосування термохімічних розрахунків в технології лікарських засобів.
Граф логічної структури теми: “Перший закон термодинаміки. Термохімія”
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. - С. 11-29.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. - Харьків: Вид-во НФАУ „Золоті сторінки", 2001. - С. 7-18.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др.: Под об.ред. В.И. Кабачного.-Харьков.: Издательство УкрФА «Прапор», 2005.- С.11-29
Орієнтовна основа дії
Алгоритм рішення задач з фізичної хімії:
- Вивчити уважно умови завдання: визначити, з якими величинами доведеться проводити обчислення, позначти їх буквами, встановити одиниці їх вимірювання, числові значення, визначити, яку величину потрібно знайти. Записати дані задачі у вигляді коротких умов.
- Якщо в умовах завдання йде мова про взаємодію речовин, записати рівняння реакції (реакцій) і зрівняти його (їх) коефіцієнтами.
- З'ясувати кількісні співвідношення між даними задачі і величиною, що знаходиться. Для цього розділити свої дії на етапи, почавши з питання задачі, з'ясування закономірності, за допомогою якої можна визначити невідому величину на останньому етапі обчислень.
- Якщо у вихідних даних не вистачає будь-яких величин, подумати, як їх можна обчислити, тобто визначити попередні етапи розрахунку. Цих етапів може бути декілька.
- Визначити послідовність всіх етапів вирішення задачі, записати необхідні формули розрахунків.
- Підставити відповідні числові значення величин, перевірити їх розмірності і провести обчислення.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
В процесі виробництва фармацевтичних препаратів важливу роль грають тиск, температура, концентрація. Який процес прискорюється при підвищенні температури?
А. Ендотермічний
В. Ізобарний
С. Адіабатичний
О. Екзотермічний
Е. Ізохорний
Тест 2
Біологічна система (живий організм) обмінюється з навколишнім середовищем речовиною і енергією. До яких систем вона повинна бути віднесена?
А. Відкритим, гомогенним
В. Ізольованим, гетерогенним
С. Відкритим, гетерогенним
О. Закритим, гомогенним
Е. Закритим, гетерогенним
Тест 3
Теплота нейтралізації кислот:
А Визначається їх основністю
В. Визначається окислювальними властивостями
С Постійна
D. Визначається природою кислотного залишку
Е. Визначається послідовністю зливання компонентів
Тест 4
Основний закон термохімії (закон Гесса) стверджує, що тепловий ефект реакції:
А. Залежить від природи продуктів реакції
В. Не залежить від шляху протікання реакції
С. Не залежить від природи початкових речовин
D. Не залежить від природи продуктів реакції
Е. Залежить від природи початкових речовин
Тест 5
Внутрішня енергія системи - це
А. Сума кінетичних енергій всіх частинок системи і потенційної енергії їх взаємодії, за
винятком кінетичної і потенційної енергії системи в цілому
В. Зміна енергії системи унаслідок протікання хімічної реакції
С. Сумарна величина розсіяної енергії системи
D. Повна енергія системи, за винятком кінетичної енергії частинок системи
Е. Енергія, яку може отримати система за певних умов
Тест 6
Розрахуйте стандартну ентальпію утворення вітаміну А-пальмітата (С36Н60О2), якщо його теплота згорання в калориметричній бомбі при 298 К складає -40,50 кДж/г.
A. -1484,591кДж/Моль
B. -1484,591 Дж/Моль
C. -1484,591кДж
D.-1000 кДж/Моль
E. 1484,591кДж/Моль
Еталони відповідей до рішення цільових навчальних завдань:
тест 1-А, тест 5 — В, тест 6 — А
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
