Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика Донецьк 2011
| Вид материала | Документы |
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 222.17kb.
- Реферат „Термодинаміка, структура та фазові рівноваги в багатокомпонентних системах, 215.57kb.
- Лекція хімічна кінетика, 315.26kb.
- Тема: Химический комплекс Украины в современных условиях, 176.49kb.
- 1. Хімічна термодинаміка в тнр основні поняття хіміко-технологічного процесу. Стехіометричні, 147.66kb.
- Програма вступних іспитів з дисципліни "Технічна електрохімія" для бакалаврів за напрямком, 324.77kb.
- Конспект лекцій для студентів спеціальностей 091605 «Хімічна технологія високомолекулярних, 1882.89kb.
- О. М. Науменко. Хімічна освіта в школі: екскурс в історію // К.: Шкільний світ, 131.41kb.
- І. Фізико-математичне відділення Секція, 96.5kb.
- Загальна програма з математики для підготовки до тестування на 2-ий курс радіофізичного, 24kb.
Заняття 12
Хімічна кінетика. Основний постулат хімічної кінетики. Порядок і молекулярність реакції. Методи розрахунку енергії активації та перед експоненціального множника.
Актуальність теми
Хімічна кінетика— розділ хімії, що вивчає швидкість хімічних процесів. Він вивчає вплив різних експериментальних умов на швидкість хімічних реакцій та досліджує їх механізми, що включає в себе знаходження також і характеризацію перехідного стану. Фермантативна кінетика вичає закономірності дії ферментів, фармакокінетика є частиною фармакології. Знання про кінетичні закономірності перебігу технологічних процесів важливі при створенні ліків.
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати поняття хімічної кінетики для застосування їх в фармації.
Конкретні цілі:
УМІТИ:
- Визначати молекулярність і порядок реакції.
- Розраховувати кінетичні параметри.
Зміст навчання
Перелік теоретичних питань:
- Чим визначається швидкість хімічних реакцій.
- Фактори що впливають на швидкість хімічної реакції.
- Швидкість гомогенних хімічних реакцій і методи її вимірів.
- Молекулярність і порядок реакції.
- Період напівперетворення.
- Кінетичні рівняння реакцій 1-го і 2-го порядків.
- Константа швидкості реакцій 1-го і 2-го порядків.
- Температурний коефіцієнт реакції і його особливість для біохімічних процесів.
- Енергія активації.
- Рівняння Арреніуса.
- Класифікація хімічних реакцій за механізмом.
- Кінетична класифікація хімічних реакцій.
- Методи визначення швидкості хімічних реакцій.
- Залежність швидкості хімічних реакцій від температури.
- Залежність швидкості хімічної реакції від концентрації реагентів.
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.-Харків.: Вид-во УкрФА «Прапор», 1999.-С. 151-174.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. - Харьків: Вид-во НФАУ „Золоті сторінки", 2001. - С. 88-109.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.- Харьков.: Издательство УкрФА «Прапор», 2005.- С.151-174.
Граф логічної структури теми
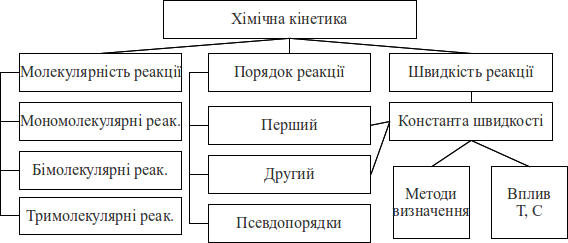
Орієнтовна основа дії
Алгоритм рішення задач. Див. Заняття 1.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Період напівперетворення деякої реакції А -> У обратно пропорційно залежить від початкової концентрації речовини А. Якого порядку дана реакція?
A. третього
B. першого
C. другого
D. нульового
E. дробового
Тест 2
Вкажіть порядок хімічної реакції, якщо експериментальні дослідження вказують на лінійну залежність величини зворотного концентрації реагентів від часу:
A.перший
B. другий
C. третій
D. нульовий
E. дробний
Тест 3
Для точного обчислення константи швидкості за величиною енергії активації застосовується стерічній | фактор, який враховує:
A. Хімічні властивості взаємодіючих сполук
B. Концентрацію реагуючих речовин
C. Температуру реакційної суміші
D. Взаємну орієнтацію реагують молекул
E. Будова молекул взаємодіючих сполук
Тест 4
Дослідження залежності швидкості реакцій від різних факторів дозволяє інтенсифікувати технологічні процеси фармацевтичних виробництв, визначати терміни придатності лікарських препаратів і т.п. Який з факторів не впливає на константу швидкості хімічної реакції?
A. Температура
B. Природа реагуючих речовин
C. природа розчинника
D. Концентрація реагуючих речовин
E. Ступінь дисперсності твердої речовини
Тест 5
Температурний коефіцієнт швидкості реакції дорівнює 3. У скільки разів зросте швидкість реакції при підвищенні температури на 30 ° С?
A. В 9 разів
B. У 18 разів
C. У 27 разів
D. В 36 раз
E. У 45 разів
Еталони відповідей до рішення цільових навчальних завдань:
тест 1-С, тест 2- B, тест 3-D, тест 4- D, тест 5-С.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
