«Федеральный центр сердца, крови и эндокринологии им. В. А. Алмазова Федерального агентства по оказанию высокотехнологичной медицинской помощи»
| Вид материала | Автореферат |
- Редукция полости левого предсердия при хирургической коррекции порока митрального клапана, 235.93kb.
- Особенности структурно-функциональных изменений миокарда и нарушения сердечного ритма, 287.4kb.
- Работа выполнена в Военно-медицинской академии им., 699.27kb.
- Ишемического инсульта, 630.79kb.
- «Уральский научно-исследовательский институт травматологии и ортопедии им. В. Д. Чаклина, 485.31kb.
- «Нижегородский научно-исследовательский институт травматологии и ортопедии Федерального, 434.13kb.
- Актуальные вопросы аритмологии, 88.42kb.
- Организация специализированной ортопедической помощи больным остеоартрозами тазобедренного, 840.56kb.
- «Военно-медицинская академия им. С. М. Кирова», 845.84kb.
- Гусаева ханум замрутдиновна современные аспекты патогенеза, диагностики и лечения сочетанных, 556.52kb.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ «ФЕДЕРАЛЬНЫЙ ЦЕНТР СЕРДЦА, КРОВИ И ЭНДОКРИНОЛОГИИ ИМ. В. А. АЛМАЗОВА РОСМЕДТЕХНОЛОГИЙ»
На правах рукописи
ЛОПАТИНА
ЕКАТЕРИНА ВАЛЕНТИНОВНА
ФАРМАКОЛОГИЧЕСКАЯ МОДУЛЯЦИЯ СИГНАЛЬНОЙ ФУНКЦИИ Na+,K+-АТФазы
14.03.06 – фармакология, клиническая фармакология
03.03.01 – физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Санкт-Петербург
2010
Работа выполнена в отделе экспериментальной физиологии и фармакологии ФГУ «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова Федерального агентства по оказанию высокотехнологичной медицинской помощи» и лаборатории физиологии возбудимых мембран Института физиологии им. И.П. Павлова РАН
Научные консультанты: Заслуженный деятель науки РФ, профессор, доктор медицинских наук Цырлин Виталий Александрович
профессор, доктор биологических наук Крылов Борис Владимирович
Официальные оппоненты: Заслуженный деятель науки РФ,
профессор, доктор медицинских наук
Лосев Николай Андреевич
Профессор, доктор медицинских наук
Звартау Эдвин Эдуардович
Лауреат Государственной премии СССР, профессор, доктор биологических наук
Кропотов Юрий Дмитриевич
Ведущая организация: Санкт-Петербургский Государственный
Университет (медицинский факультет)
Защита состоится « » апреля 2010 г. в часов на заседании диссертационного совета Д 001.022.03 по защите диссертаций на соискание ученой степени доктора и кандидата наук при Научно-исследовательском институте экспериментальной медицины СЗО РАМН» по адресу: 197376 Санкт-Петербург, Каменноостровский пр., 69/71 (конференц-зал).
С диссертацией можно ознакомиться в научной библиотеке НИИЭМ СЗО РАМН по адресу: 197376 Санкт-Петербург, ул. акад. И.П. Павлова, 12
Автореферат разослан “___” _____________ 2010 г.
Ученый секретарь диссертационного совета Д 001.022.03
доктор биологических наук, профессор Пучкова Л.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Проблема аналгезии привлекает особое внимание исследователей и клиницистов. Несмотря на наличие в арсенале современной медицины широкого круга лекарственных препаратов, обладающих аналгетическими свойствами, изучение фундаментальных механизмов, лежащих в основе кодирования и восприятия ноцицептивных сигналов с целью создания принципиально новых лекарственных средств, остается по-прежнему актуальным.
Большинство субстанций, претендующих на роль лекарственных препаратов, выявляют с помощью одного из трех подходов: 1) химическая модификация известных молекул; 2) скрининг биологической активности большого количества натуральных продуктов, ряда ранее открытых химических структур, больших «библиотек» пептидов или нуклеиновых кислот; 3) направленный синтез (рациональный дизайн лекарств), основанный на понимании биологических механизмов реализации их эффектов и химической структуры мишеней (Катцунг Б.Г, 1998).
Создание полусинтетических и синтетических агонистов и антагонистов опиатов является примером первого подхода. Второй подход можно проиллюстрировать созданием препаратов, представляющих собой пептидные биорегуляторы. Пример реализации третьего подхода – создание ингибиторов ангиотензинпревращающего фермента, которое стало возможным благодаря изучению связи между строением и действием блокаторов активного сайта фермента и компьютерному конструированию гипотетической химической структуры лекарства.
Для создания нового лекарственного препарата, относящегося к группе аналгетиков, наряду с общепринятыми способами может использоваться и принципиально иной подход. В его основе лежит исследование возможности фармакологической модуляции сигнальной функции Na+,K+-АТФазы при прохождении ноцицептивного сигнала в сенсорном нейроне спинального ганглия в системе: опиоидоподобный рецептор – Na+,K+-АТФаза – Nav1.8-канал (Крылов Б.В. и др., 1999). Первая стадия формирования болевого ощущения связана с активацией тканевых периферических рецепторов, так называемых ноцицепторов, кодирующих информацию не только о болевом воздействии, но и сигналы других модальностей. Ноцицептивные сигналы передаются по афферентным волокнам группы С и Аδ через сенсорные нейроны спинальных ганглиев. Эти темные ноцицептивные нейроны (их размер не превышает 30 мкм) представляют собой клетки, характеризующиеся наличием опиоидных, опиоидоподобных и неопиоидных рецепторов и высокой плотностью медленных натриевых каналов (Gold M.S., et al., 1996). Медленные тетродотоксиннечувствительные натриевые каналы (Nav1.8) определяют процесс кодирования ноцицептивных сигналов в афферентах и сенсорных нейронах (Borovikova L.V., et al., 1997; Cardenas C.G., et al., 1997).
Модуляторы активности медленных натриевых каналов являются субстанциями, применение которых представляется перспективным с точки зрения разработки новых аналгетических лекарственных препаратов, поскольку анальгезирующие агенты, независимо от первичной мишени воздействия, избирательно снижают их функциональную активность (Brau M.E., et al., 2001; Ogata N., Ohishi Y., 2002).
Механизм болеутоляющего действия наркотических аналгетиков (наиболее эффективных соединений) обусловлен влиянием препаратов на разных уровнях прохождения ноцицептивного сигнала. Аналгезия на спинальном уровне осуществляется за счет взаимодействия опиоидного соединения с µ-, δ- или ķ- рецепторами. Опиоидные рецепторы вовлечены в однотипный механизм сигнализации, включающий в себя опиоидный рецептор – G белок – кальциевый или калиевый канал (Катцунг Б.Г., 1998). G белок в этом механизме выполняет функцию трансдуктора, усиливая величину сигнала при передаче ноцицептивной информации от рецептора к ионному каналу, а также передавая его на геном. При этом изменяются системы вторичных посредников, связанных с током кальция, ингибированием аденилатциклазы и стимуляцией синтеза G белков (Катцунг Б.Г., 1998). Повышение уровня экспрессии G белков стимулирует синтез опиоидных рецепторов и увеличение числа ионных каналов.
Модуляция ноцицептивного сигнала может оцениваться по снижению потенциалочувствительности активационного воротного устройства медленных натриевых каналов сенсорных нейронов спинального ганглия, которое возникает вследствие уменьшения величины эффективного заряда. Исследование механизма кодирования ноцицептивного сигнала в системе опиоидоподобный рецептор – Na+,K+-АТФаза – Nav1,8-канал (Крылов Б.В. и др., 1999) с помощью метода локальной фиксации потенциала (patch-clamp метод) показало, что не только наркотические аналгетики оказывают влияние на этот процесс. Эффективность гидрохлорида морфина (Крылов Б.В. и др., 1999) была сопоставима с эффективностью производных гамма-пирона (Derbenev A.V., et al., 2000; Рогачевский И.В. и др., 2006, Плахова В.Б. и др., 2006). При этом оказалось, что на фоне блокаторов G белков эффекты исследуемых соединений сохранялись. Приложение налтрексона или оуабаина к наружной стороне мембраны сенсорного нейрона устраняло влияние изученных соединений на эффективный заряд воротного устройства медленного натриевого канала (Крылов Б.В. и др., 1999; Derbenev A.V. et al., 2000). Были получены экспериментальные доказательства участия Na+,K+-АТФазы в модуляции ноцицептивного сигнала (Крылов Б.В. и др., 1999; Derbenev A. V. et al., 2000).
Фармакологическая модуляция сигнальной (трансдукторной) функции Na+,K+-АТФазы при помощи производных гамма-пирона может позволить направленно регулировать ноцицептивные сигналы и зарегистрировать обезболивающий эффект соединения в in vivo. Последнее открывает перспективы для создания аналгетического препарата нового класса.
Как трансдуктор сигнала Na+,K+-АТФаза участвует не только в регуляции ноцицепции, но и в модуляции роста и пролиферации клеток разных тканей (Пеннияйнен В.А. и др., 2003; Xie Z., Askari A., 2002; Schiener-Bobis G., 2002; Schoner W., 2002a; Schoner W., 20002b; Schoner W., Schiener-Bobis G., 2005). Ее активность в организме человека и животных регулируют эндогенные дигиталисоподобные факторы, выделяющиеся в кровь в наномолярных концентрациях. Возможно, эндогенные стероиды могут модулировать сигнальную функцию Na+,K+-АТФазы в системе опиоидоподобный рецептор – Na+,K+-АТФаза – Nav1.8-канал и изменение функциональной активности Na+,K+-АТФазы будет оказывать как аналгетический, так и иные эффекты.
Цель исследования. Исследовать болеутоляющий эффект и изменение пролиферативной активности клеток разных тканей при фармакологической модуляции сигнальной функции Na+,K+-АТФазы и разработать оригинальный лекарственный препарат с аналгетической активностью, механизм действия которого связан с модуляцией этой функции фермента.
Задачи:
- Исследовать участие Na+,K+-АТФазы в модуляции ноцицептивных сигналов в системе опиоидоподобный рецептор – Na+,K+-АТФаза – Nav1.8-канал.
- Исследовать действие эндогенного блокатора Na+,K+-АТФазы оуабаина на процессы роста и пролиферации нейритов сенсорных нейронов, ткани сердца и сетчатки глаза 10-12-дневных куриных эмбрионов.
- Выявить физиологическую роль рамнозильного остатка в молекуле оуабаина.
- Исследовать действие препаратов группы сердечных гликозидов как экзогенных блокаторов Na+,K+-АТФазы на процессы роста и пролиферации нейритов сенсорных нейронов, ткани сердца и сетчатки глаза 10-12-дневных куриных эмбрионов.
- Исследовать действие производной гамма-пирона коменовой кислоты как экзогенного модулятора Na+,K+-АТФазы на процессы роста и пролиферации нейритов сенсорных нейронов, ткани сердца и сетчатки глаза 10-12-дневных куриных эмбрионов.
- Исследовать аналгетическую активность коменовой кислоты в экспериментах in vivo.
- На основе структуры коменовой кислоты разработать лекарственную форму препарата, обладающего аналгетическим эффектом и реализующего свои свойства за счет модуляции сигнальной функции Na+,K+-АТФазы.
- Оценить фармакологическую активность препарата «Аноцептин» в экспериментах in vitro и in vivo.
- Изучить возможность формирования лекарственной зависимости при длительном введении препарата «Аноцептин».
10. Исследовать безопасность действия и фармакокинетику препарата «Аноцептин» в исследованиях на животных и человеке.
Основные положения, выносимые на защиту:
- Разработана методологическая система поиска и изучения обезболивающих препаратов, механизм действия которых основан на модуляции сигнальной функции Na+,K+-АТФазы.
- Сигнальная функция Na+,K+-АТФазы проявляется в модуляции ноцицептивных сигналов ансамблем: опиоидоподобный рецептор – Na+,K+-АТФаза – Nav1.8-канал (либо Na+,K+-АТФаза – Nav1.8-канал) и регуляции процесса тканевого моделирования на различных этапах онтогенеза.
- Оуабаин в концентрациях, сопоставимых с эндогенными, модулирует сигнальную функцию Na+,K+-АТФазы. Наличие в молекуле оуабаина рамнозильного остатка повышает аффинность Na+,K+-АТФазы к этому сердечному гликозиду и определяет тканеспецифичность действия гликозида.
- При регуляции процессов роста и пролиферации в эмбриональный период развития оуабаин по эффективности превосходит строфантин К, дигоксин, оуабагенин и сопоставим с коменовой кислотой. Трофотропные эффекты оуабаина и коменовой кислоты наиболее выражены в отношении ткани сетчатки.
- На основе производной гамма-пирона коменовой кислоты создан препарат «Аноцептин», обладающий аналгетической и противовоспалительной активностью и не вызывающей лекарственной зависимости и выраженных побочных эффектов при его длительном (90 суток) парентеральном введении.
Научная новизна. Доказано, что Na+,K+-АТФаза как трансдуктор участвует в модуляции ноцицептивных сигналов в системе опиоидоподобный рецептор – Na+,K+-АТФаза – Nav1.8-канал и направленной регуляции процесса тканевого моделирования. Показано, что физиологическое значение эндогенных дигиталисоподобных факторов заключается в регуляции этих процессов на разных этапах онтогенеза. Обнаружено, что оуабаин в концентрациях, сопоставимых с эндогенными, участвует в регуляции ноцицептивных сигналов в ансамбле Na+,K+-АТФаза – Nav1.8-канал мембраны сенсорных нейронов спинальных ганглиев млекопитающих.
Наличие в молекуле оуабаина рамнозильного остатка повышает аффинность Na+,K+-АТФазы к этому гликозиду на пять порядков. При регуляции процессов роста и пролиферации в эмбриональный период развития оуабаин по эффективности превосходит строфантин К, дигоксин, оуабагенин и сопоставим с коменовой кислотой.
Установлено, что трофотропные эффекты оуабаина и коменовой кислоты наиболее выражены в отношении ткани сетчатки.
Действие препарата «Аноцептин», разработанного на основе коменовой кислоты, основано на рецептор-опосредованной регуляции сигнальной функции Na+,K+-АТФазы сенсорных нейронов спинальных ганглиев. Доказана его эффективность как аналгетического средства. Обнаружен противовоспалительный эффект препарата. Применение препарата «Аноцептин» не вызывает активации системы положительного подкрепления латерального гипоталамуса. Лекарственная зависимость при длительном парентеральном введении препарата не формируется. Побочные эффекты при использовании аноцептина в аналгетических дозах не проявляются.
Теоретически и экспериментально обосновано новое перспективное направление создания аналгетических средств, механизм действия которых основан на фармакологической модуляции сигнальной функции Na+,K+-АТФазы.
Научно-практическое значение работы. Разработана методологическая система поиска и изучения обезболивающих препаратов, механизм действия которых основан на модуляции сигнальной функции Na+,K+-АТФазы.
Создана лекарственная форма принципиально нового отечественного препарата «Аноцептин», относящегося к классу аналгетиков. Отчет о доклиническом исследовании безопасности, фармакокинетики и фармакологической активности препарата «Аноцептин» (лекарственная форма в виде 1 и 2% раствора для внутривенных инъекций) представлен в Фармакологический комитет Федеральной службы по надзору в сфере здравоохранения и социального развития Российской Федерации. На основании разрешения Федеральной службы по надзору в сфере здравоохранения и социального развития N 185 от 03 05.2007 г. в Институте мозга человека РАН проведено исследование безопасности и фармакокинетики препарата «Аноцептин» в клинических условиях. Безопасность препарата для организма человека клинически доказана. Отчет о клиническом исследовании безопасности и фармакокинетики представлен в ФГУ Научный центр экспертизы средств медицинского применения Росздравнадзора РФ и утвержден (протокол N12 от 5 июня 2009 г.). Выпуск препарата планируется в виде 1 и 2% раствора для инъекций в ампулах объемом 1, 2 и 5 мл. Получены патенты Российской Федерации: патент РФ № 2322977 «Синтетическое анальгетическое средство и способ лечения на основе этого средства», приоритет от 01.08.2006, авторы: Крылов Б.В., Лопатина Е.В; патент РФ № 2367432 «Анальгетическое средство и способ лечения болевого синдрома различной этиологии с помощью этого средства», приоритет от 27.09.2007, авторы Крылов Б.В., Лопатина Е.В.; патент РФ № 2362554 «Регенерирующее противовоспалительное средство и способы лечения с помощью этого средства», приоритет от 27.09.2007, авторы: Лопатина Е.В., Карецкий А.В., Крылов Б.В.
Основные положения диссертации используются в научно-исследовательской работе научно-исследовательского отдела экспериментальной физиологии и фармакологии ФГУ «ФЦСКИЭ им. В. А. Алмазова», Института физиологии им И.П. Павлова РАН, экспериментальных исследованиях отделения туберкулеза глаз ФГУ «СПбНИИФ», научно-клинической работе Института Мозга человека РАН, педагогической работе кафедры общей физиологии биолого-почвенного факультета СПбГУ.
Под руководством д.х.н. И.Н. Домнина налажен промышленный синтез коменовой кислоты на базе ФГУП «СКТБ» «Технолог». Лабораторный регламент изготовления готовой лекарственной формы препарата адаптирован к промышленным условиям. Экспериментальные партии препарата «Аноцептин» произведены на базе НИИ ОЧБ и ООО «НТФФ» «Полисан».
Апробация работы. Результаты работы доложены на: конгрессе ассоциации кардиологов стран СНГ «Фундаментальные исследования и прогресс в кардиологии», СПб, 18-20 сентября 2003 г.; Научно-практической конференции «Фундаментальные науки – медицине», Москва, 10-11 декабря 2003 и 3-4 декабря 2007 г.; III Всероссийской с международным участием Школе-конференции по физиологии кровообращения, Москва. 27-30 января 2004 г.; Международной конференции «Проблемы интеграции функций в физиологии и медицине (к 100-летнему юбилею присуждения Нобелевской премии академику И.П.Павлову)», Минск, 15-16 июня 2004 г.; XIX съезде физиологического общества им. И.П. Павлова, Екатеринбург. 20-24 сентября 2004 г.; Конференции “Современные возможности диагностики и лечения витрео-ретинальной патологии”, Москва, 27 мая 2004 г.; Международной конференции «Клеточные технологии в офтальмологии», Москва, 16-17 марта 2005 г.; Humboldt-Kolleg Conference «Technologies of the 21st Century: Biological, Physical, Informational and Social Aspects», SPb, September 27–29 2005 г.; I съезде физиологов СНГ, Сочи, 19-23 сентября 2005 г.; Международной научно-практической конференции «Исследование, разработка и применение высоких технологий в промышленности» [Высокие технологии, фундаментальные и прикладные исследования, образование], СПб, 7-9 февраля 2006 г.; V Международной конференции по функциональной нейроморфологии (Колосовские чтения – 2006), СПб. 2006 г.; на XX Съезде Физиологического общества им И.П. Павлова, Москва, 4-8 июня, 2007 г.; Всероссийском симпозиуме с международным участием «Гормональные механизмы адаптации» (Посвящается памяти проф. А.А. Филаретова), СПб, 3-5 октября, 2007 г.; Конференции «Нейрохимические механизмы формирования адаптивных и патологических состояний мозга», СПб. 10-12 сентября, 2008 г.; Всероссийском симпозиуме по фармакологии «Результаты фундаментальных и прикладных исследований для создания новых лекарственных средств. Фундаментальные науки новым лекарствам», Москва, 9-11 июня 2008 г.; The 2nd St.-Petersburg Humboldt-Kolleg Conference «Technologies of the 21st Century: Biological, Physical, Informational and Social Aspects», SPb. October 7–9, 2008; II съезде физиологов СНГ, Кишинев, 29-31 октября, 2008 г.; международной конференции «Висцеральные системы», СПб, 29 сентября-2 октября 2009 г.
Публикации. По теме диссертации опубликовано 39 научных работ в отечественной и зарубежной печати и три патента РФ.
Объем и структура диссертации. Диссертация изложена на 215 страницах машинописного текста, иллюстрирована 45 рисунками, содержит 45 таблиц. Работа построена по стандартному плану и состоит из следующих разделов: введение, обзор литературы, методы, результаты исследований, обсуждение результатов, выводы и список литературы, включающий 47 отечественных и 91 зарубежных источников.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
1.1. Метод локальной фиксации потенциала (patch-clamp)
Patch-clamp эксперименты осуществляли на культивируемых изолированных нейронах спинальных ганглиев новорожденных крыс линии Wistar. Дорзальные ганглии выделяли из областей L5 – S1 спинного мозга и помещали в раствор Хенкса. Для выделения ноцицептивных нейронов применяли модифицированный метод краткосрочного культивирования (Elliott A.A., Elliott J.R., 1993). Внеклеточный раствор (концентрации представлены в миллимолях): NaCl - 65, CaCl2 - 2, MgCl2 - 2, Choline Cl - 70, HEPES Na - 10, TTX - 0.0001, pH = 7.4; внутриклеточный раствор: CsF - 100, NaCl - 10, CsCl - 40, MgCl2 - 2, HEPES Na - 10, pH=7.2. Оуабаин вводили во внеклеточный раствор в диапазоне концентраций от 1 пмоль/л до 200 мкмоль/л, налтрексон в дозе 50 мкмоль/л. Применяли реактивы фирмы "Sigma" (США). Опыты проводили при комнатной температуре 22 - 240С. Использовали аппаратно-программный комплекс на основе усилителя «L/M EPC-7», ПЭВМ и специальной системы автоматизации. Эффективный заряд (Zeff) активационной воротной системы медленных натриевых каналов использовали как количественный показатель, отражающий воздействие оуабаина и налтрексона. Zeff – это физическая величина, отражающая состояние сенсора напряжения активационного воротного устройства медленного Nav1.8-канала, выраженная в зарядах электрона (Крылов Б.В. и др., 1999). Уменьшение величины Zeff после приложения исследуемого агента свидетельствует о способности последнего регулировать ноцицептивные сигналы на уровне мембраны нервной клетки (Крылов Б.В. и др., 1999). Для оценки величины Zeff использовали подход Ходжкина-Хаксли (Hodgkin A., Huxley A.F, 1952; Almers V., 1981). Достоверность различий величин Zeff активационной воротной системы до и после воздействия исследуемых агентов оценивали с помощью t-критерия Стьюдента.
1.2. Синтез коменовой кислоты
Синтез коменовой кислоты (C6H4O5; М.м. 156.10) осуществляли в три стадии по методу Гаркуши Ж.А. (Гаркуша Ж.А., 1961), модифицированному И.Н. Домниным. (Домнин И.Н. и др., 2008). Полученная субстанция представляла собой порошок от белого до белого с желтовато-сероватым оттенком цвета с легким специфическим запахом.
1.3. Метод органотипического культивирования ткани
В разных сериях экспериментов объектами исследования являлись культивируемые нейроны спинальных ганглиев, эксплантаты ткани сердца и сетчатки 10-12-дневных куриных эмбрионов. Исследования выполнены на 2000 эксплантатах, культивируемых в чашках Петри с коллагеновым покрытием дна в питательной среде в течение 3 суток в СО2-инкубаторе («Sanyo», Япония) при температуре 37° С и 5% содержании СО2. Контрольные эксплантаты культивировали в питательной среде стандартного состава (Пеннияйнен В.А. и др., 2003). В культуральную среду экспериментальных чашек добавляли оуабаин, оуабагенин, ЭГТА (Sigma, USA), строфантин К, дигоксин и коменовую кислоту (Россия) в широком диапазоне концентраций. Для оценки влияния исследуемых веществ использовали относительный критерий – индекс площади (ИП), который рассчитывали как отношение площади всего эксплантата, к площади центральной зоны. Контрольное значение ИП принимали за 100%. В каждой серии опытов "n" – количество культивируемых эксплантатов. Для визуализации использовали микротеленасадку для микроскопа (серия 10, МТН-13 «Альфа телеком», Россия).
1.3.1. «Цитологические» методы исследования
Окрашивание гематоксилином и эозином и метиленовым синим осуществляли по стандартной методике (Меркулов Г.А., 1969). Препараты фотографировали при помощи установки, включающей в себя микроскоп Carl Zeiss Axiostar Plus, цифровую фотокамеру Nicon 8M и компьютер с пакетом программ для обработки изображений и описывали.
1.4. Приготовление лекарственной формы препарата «Аноцептин» (раствор для инъекций)
Препарат «Аноцептин» содержит индивидуальное вещество — коменовую (5-гидрокси--пирон-2-карбоновую) кислоту. В качестве вспомогательного вещества в состав препарата включен натрия гидрокарбонат. Лекарственная форма представляет собой прозрачную жидкость желтого или желто-зеленого цвета без запаха. Испытания на определение посторонних примесей проводили методом высокоэффективной жидкостной хромотографии (ВЖХ). Стерилизацию препарата осуществляли методом мембранной фильтрации в асептических условиях. Фильтрат разливали в ампулы нейтрального стекла и запаивали.
1.5. Тест «горячая пластина»
Аналгетическое действие препарата «Аноцептин» определяли на 20 мышах по методу «горячей пластинки». Пластина, представляющая собой пол экспериментальной камеры, в которую помещали животных во время исследования, была нагрета до 52°С. Латентный период появления у животных подергивания лап, двигательного беспокойства, прыжковой активности оценивали в секундах. Опыты проводили спустя 30, 60 и 120 минут после внутривенного введения препарата «Аноцептин» в дозах 5, 10 и 50 мг/кг, препаратом сравнения был анальгин в дозе 50 мг/кг.
1.6. Формалиновый тест
Обезболивающие действие препарата «Аноцептин» исследовали в условиях формалинового теста на 19 самцах крыс линии Wistar с массой тела 200-250 г по стандартной методике (Руководящие и методические материалы по экспериментальному и клиническому изучению новых лекарственных средств. Ч.2. М., 1980, с. 126-133; Dubbisson D., Dennis S.G., 1977; Tjolsen A. et. al., 1992; Abbott F., Guy E., 1995; Clavelou P. et al., 1995; Dallel R., et al., 1995). В левую заднюю лапу животного подкожно вводили 50 мкл 5%-ного раствора формалина. Животным экспериментальной группы внутрибрюшинно вводили аноцептин 35 мг/кг или оуабаин 0,3 мг/кг. Животным контрольной группы внутрибрюшинно вводили физиологический раствор. Регистрацию количества сгибаний, встряхиваний и продолжительности вылизывания (измеряется в секундах) инъецированной формалином конечности осуществляли каждую минуту в течение 60-90 минут с помощью оригинального пакета программ для обработки данных (Буткевич И.П. и др., 2009). Интенсивность болевого ответа в первую и во вторую фазы теста оценивали по количеству паттернов сгибания+встряхивания и продолжительности паттернов вылизывания (в секундах). Продолжительность каждой фазы и межфазного интервала измеряли в минутах. Снижение количества паттернов сгибания+встряхивания, возникающее благодаря действию исследуемых веществ, характеризует изменение в восприятии ноцицептивных сигналов на спинальном уровне. Уменьшение продолжительности паттернов вылизывания доказывает наличие болеутоляющего действия у изучаемых агентов на супраспинальном уровне (Abbott F., Guy E., 1995; Dallel R., et al., 1995).
1.7. Метод самостимуляции латерального гипоталамуса
Возможность формирования физической зависимости от приема аноцептина исследовали с помощью метода самостимуляции латерального гипоталамуса. Опыты выполнены на 16 крысах самцах линии Wistar (из которых 6 – контрольные). В стерильных условиях под наркозом в область латерального гипоталамуса (А 1,5 мм, L 1,5 мм, H 8,5 мм), согласно координатам атласа мозга крысы (Pellegrino L.J. et al., 1979), вживляли биполярные концентрические электроды. Через 5-7 дней после операции крыс помещали в экспериментальную камеру (40х40х60 см) с рычагом, нажатие на который замыкало цепь тока и подачу на электрод пачки импульсов (длительность импульса – 0,5 мс, частота следования - 100 Гц, сила тока 90-300 мкА. Силу тока, вызывающую стабильную частоту нажатий на рычаг, условно принимали за пороговую. Регистрировали количество нажатий за 10 мин. Реакцию самостимуляции (СС) тестировали после внутрибрюшинного введения препарата «Аноцептин» в дозах 1, 10 и 30 мг/кг. Контрольным крысам вводили раствор Хенкса 1,5 мл рН=7,0-7,4. Частоту СС в течение всего опыта регистрировали на чернильном самописце H320-5. На компьютере в режиме реального времени строили гистограммы и таблицы количества нажатий на рычаг в течение 10 минут до инъекции аноцептина, сразу после и через 30 и 60 минут после инъекции, с одновременной обработкой средней величины. Наблюдали за изменением порога реакции СС. Определяли достоверность различий полученных данных по критерию Стъюдента-Фишера. Локализацию кончика стимулирующего электрода в области латерального гипоталамуса подтверждали гистологически.
1.8. Методика определения антимикробного действия препарата «Аноцептин» на M. tuberculosis
Использовали стандартный метод двукратных серийных разведений препарата в синтетической полужидкой среде Сотона с добавлением 25% нормальной лошадиной сыворотки и питательного агара (0,35 г на 100 мл среды). Диапазон исследуемых доз препарата «Аноцептин» составил 1,56 – 200 мкг/мл. Контролем питательной среды служила плотная среда Левенштейна-Йенсена. Суспензии тест-культур M. tuberculosis H37 Rv и ЛИХТ-98 в объеме 0,2 мл (10 миллионов микробных тел) засевали методом поверхностного наслоения в контрольные и опытные пробирки. Результаты учитывали через 7 суток инкубации посевов в условиях термостата при +370С по интенсивности роста микобактериальной пленки на поверхности питательной среды.
1.9. Методика моделирования туберкулезного очагового хориоретинита
Моделирование туберкулезного хориоретинита выполнили на 20 кроликах (40 глаз) по методу Э.Н. Белендира (1971). После формирования хориоретинальных очагов (в среднем на 7-10 день после заражения) 20 животным на протяжении всего периода исследования проводили стандартную противотуберкулезную терапию (ПТТ), включающую изониазид – 3% раствор парабульбарно (по 0,5 мл в оба глаза) и 10% раствор внутримышечно (10 мг/ кг); стрептомицин внутримышечно (40 000 ЕД/кг). На 45-й день после заражения кролики были распределены на серии: 1-я (n=10) – местно (парабульбарно) 2% раствор аноцептина по 0,5 мл в каждый глаз на фоне ПТТ; 2-я (n=10) – животные, получающие только ПТТ. Курс лечения аноцептином составил 10 дней. Эффективность лечения оценивали по динамике массы тела животных, общеповеденческим реакциям, офтальмоскопическим параметрам (размер очага, уровень проминенции и экссудации). Животные основной и контрольной серий по трем оцениваемым показателям достоверно не отличались. Офтальмоскопическое исследование выполняли один раз в 3 дня. Через 6 недель от начала лечения аноцептином экспериментальных животных выводили из опыта, глаза энуклеировали, гистологические препараты готовили по стандартной методике (окраска гематоксилином и эозином). Было изготовлено и исследовано более 160 срезов. Препараты фотографировали при помощи установки, описанной в п. 1.3.1. Эффективность лечения экспериментальных туберкулезных хориоретинитов в процентах для каждого из трех изучаемых параметров (размер очага, проминенция, экссудация) вычисляли по формуле:
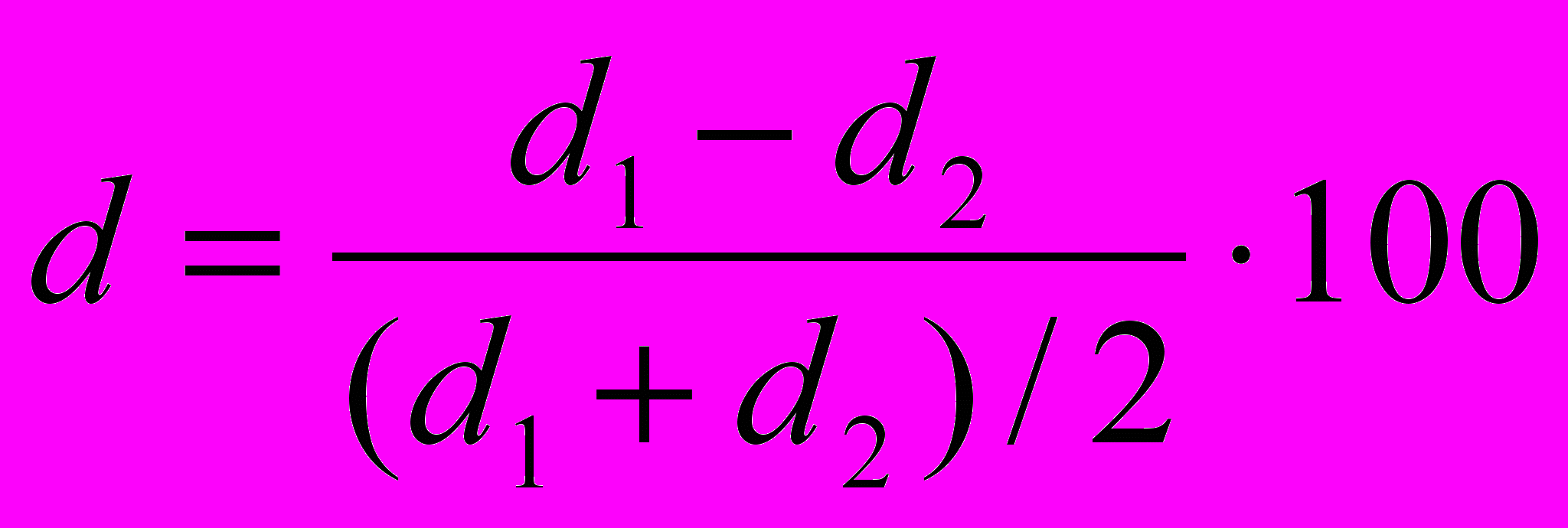 , где
, где 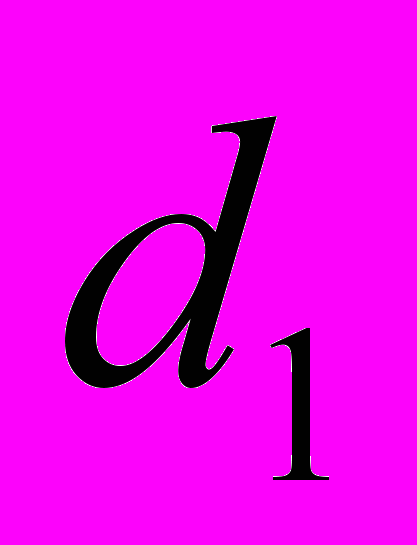 и
и 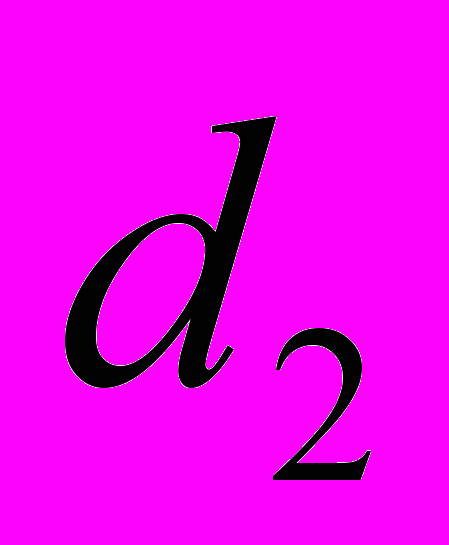 – величина показателя до и после лечения в реальных единицах измерения. Статистическую обработку данных выполняли на персональном компьютере с использованием прикладных программ для статистического анализа «Microsoft Excel» и «STATGRAPHICS Plus» для Windows.
– величина показателя до и после лечения в реальных единицах измерения. Статистическую обработку данных выполняли на персональном компьютере с использованием прикладных программ для статистического анализа «Microsoft Excel» и «STATGRAPHICS Plus» для Windows.1.10. Исследование острой токсичности препарата «Аноцептин»
Исследования проведены на 70 мышах и 72 крысах обоего пола. Для определения показателей острой токсичности препарат вводили белым мышам и крысам обоего пола внутривенно в хвостовую вену в возрастающих дозах. Расчеты средних летальных доз проводили по В.Б. Прозоровскому (1978). Контрольным животным вводили 1,1%-ный раствор бикарбоната натрия. Период наблюдения составил 14 дней. Регистрируемые показатели: летальность, время гибели, симптоматика отравления, ежедневное наблюдение общего состояния и поведения, взвешивание до введения, на 7 и 14 дни наблюдения, объемы потребления корма и воды (для этого животные помещались в обменные клетки итальянской фирмы «Texnoplast»), вскрытие и макроскопическое исследование всех погибавших и выживших животных в конце исследования (эвтаназия у грызунов осуществлялась передозировкой эфира), определение массовых коэффициентов внутренних органов.
1.11. Исследование безопасности препарата «Аноцептин» при хроническом 90-дневном внутривенном введении
В опытах на крысах обоего пола препарат вводили внутривенно ежедневно на протяжении 90 дней в 3-х дозах: 5 мг/кг, 100 мг/кг и 300 мг/кг. Общее количество животных – 160, из них 40 – контрольная группа.
Регистрируемые показатели: общее состояние животных (оценивали ежедневно у всех животных), взвешивание, потребление воды (1 раз в неделю), летальность, время гибели, симптоматика отравления, ежедневное наблюдение общего состояния и поведения, вскрытие и макроскопическое исследование всех погибавших и выживших животных в конце исследования (эвтаназия у грызунов осуществлялась передозировкой эфира), определение массовых коэффициентов внутренних органов. При офтальмологическом исследовании у животных оценивали величину зрачка и ширину глазной щели.
1.11.1. Изучение эмбриотоксического действия препарата «Аноцептин»
Исследование эмбриотоксического действия препарата «Аноцептин» проведено в 2 этапа на нелинейных белых крысах-самках весом 180-200 г. Первая группа самок получала внутривенно препарат в дозе 5 мг/кг, вторая – 50 мг/кг. Препарат вводили с 1 по 19 день беременности. Животным контрольной группы в те же сроки вводили внутривенно 1,1%-ный раствор соды. В каждой экспериментальной группе было по 20 животных. Вскрытие самок осуществляли на 20 день беременности, при этом определяли количество желтых тел в яичниках, подсчитывали количество мест имплантации, резорбции и живых плодов.
Статистическую обработку экспериментальных данных проводили с использованием t-критерия Стъюдента и U-критерия Уилкоксона-Манна-Уитни.
На втором этапе исследования препарат «Аноцептин» вводили внутривенно с 1 по 21 день беременности в тех же дозах 5 и 50 мг/кг. Контрольным животным вводили 1,1%-ный раствор соды. В каждой группе было получено потомство от 15 самок. После родов в каждом помете оставляли не более 8 крысят для дальнейшего изучения физического развития потомства, скорости созревания сенсорно-двигательных рефлексов в период вскармливания, исследования эмоционально-двигательного поведения крысят после окончания периода вскармливания. Регистрировали размер помета, число живых и мертвых новорожденных, число особей разного пола, массу тела крысят на 4-й, 7-й, 14-й и 21-й дни после рождения, а также сроки отлипания ушной раковины, появление первичного волосяного покрова, прорезывание резцов, открытие глаз, опускания семенников и открытия влагалища. Скорость созревания сенсорно-двигательных рефлексов в период вскармливания оценивали с помощью тестов: переворачивание на плоскости (2-4 дни), отрицательный геотаксис (5-6 дни), избегание обрыва (4-6 дни). Опыты проводили 1 раз в день в одно и то же время до полного формирования рефлексов по указанным тестам. При исследовании физического развития и скорости созревания сенсорно-двигательных рефлексов в период вскармливания для статистической обработки использовали t-критерий Стъюдента и U-критерий Уилкоксона-Манна-Уитни. За единицу наблюдения при статистической обработке принимали помет. В возрасте 30 дней у потомства изучали эмоционально-двигательное поведение в тесте «открытое поле». Статистическую обработку по тесту «открытое поле» проводили по U-критерию Уилкоксона-Манна-Уитни, при этом за единицу наблюдения принимали одного крысенка.
1.11.2. Изучение влияния препарата «Аноцептин» на репродуктивную функцию
Исследование действия препарата «Аноцептин» на репродуктивную функцию было проведено на 120 нелинейных белых крысах массой 180-200 г. Наблюдение и оценку состояния животных проводили ежедневно. Аноцептин (50 мг/кг) вводили внутривенно. Контрольные животные получали внутривенно 1,1%-ный раствор соды. В течение 60 дней до спаривания с интактными самками самцам вводили аноцептин или 1,1%-ный раствор соды. Самкам введение препарата или 1,1%-ного раствора соды производили в течение 15 дней до спаривания с интактными самцами. После окончания введения препарата либо 1,1%-ного раствора соды самок подсаживали к соответствующей группе самцов в соотношении 2:1 сроком на 2 эстральных цикла (10 дней). Половину самок вскрывали на 18-21 дни беременности, подсчитывали количество желтых тел, мест имплантации, количество живых и погибших плодов. Вторую половину самок оставляли до родов, наблюдали за течением родов и физическим развитием потомства в период вскармливания. Индекс беременности рассчитывали как отношение числа беременных самок к числу самок, подсаженных к самцам, умноженное на 100%. За единицу наблюдения при статистической обработке принимали одну самку или один помет. Статистическую обработку результатов производили с использованием t-критерия Стъюдента и U-критерия Уилкоксона-Манна-Уитни.
1.12. Методы исследования, используемые для оценки влияния препарата «Аноцептин» на рост трансплантируемых опухолей
Рак Эрлиха привили 20 мышам под кожу правого бока в количестве 107 клеток в 0,1 мл физраствора. Спустя 48 часов после перевивки опухоли животных рандомизировали. Препарат «Аноцептин» (50 мг/кг) экспериментальным животным (n=10) вводили внутрибрюшинно. В контрольной группе (n=10) внутрибрюшинно вводили физиологический раствор (0,125 мл/мышь). Общее количество инъекций – 10. Лимфосаркому Плисса привили 20 крысам под кожу правого бока в количестве 10% суспензии опухоли в 0,5 мл физиологического раствора. Спустя 48 часов после перевивки опухоли животных рандомизировали. Аноцептин (50 мг/кг) экспериментальным животным (n=10) вводили внутрибрюшинно. Животным контрольной группы (n=10) внутрибрюшинно вводили физиологический раствор (0,125 мл/крыса). Общее количество инъекций – 10. Длину и ширину опухолевых узлов измеряли регулярно. Объем опухоли рассчитывали по формуле: V=(a*b2)/2, где а – больший, а b – меньший линейный размер узла.
