Редукция полости левого предсердия при хирургической коррекции порока митрального клапана 14. 01. 26 сердечно-сосудистая хирургия
| Вид материала | Автореферат |
- Сравнительная оценка способов хирургической коррекции аномалии эбштейн а 14. 01., 429.73kb.
- Артериальная гипертония и атеросклероз сонных артерий: особенности диагностики, течения,, 282.52kb.
- Механическая и медикаментозная поддержка кровообращения в хирургии аневризм левого, 451.94kb.
- При каком пороке сердца на верхушке выслушивается систолический шум: а митральный стеноз;, 443.13kb.
- Верховного Совета Российской Федерации, 1993, N 33, ст. 1318; Собрание закон, 330.78kb.
- Лечебная тактика при окклюзионных и аневризматических поражениях аорто-подвздошного, 322.23kb.
- Тактика хирургического лечения аномалии эбштейна у детей до 3-х лет /14. 00. 44. сердечно-сосудистая, 459.29kb.
- Отдаленные результаты хирургического лечения и качество жизни больных, оперированных, 305.19kb.
- Применение ксеноперикардиальных протезов с трехстворчатым клапаном для реконструкции, 446.39kb.
- Виды высокотехнологичной медицинской помощи по профилю «Сердечно-сосудистая хирургия», 71.43kb.
На правах рукописи
Гурщенков Александр Викторович
РЕДУКЦИЯ ПОЛОСТИ ЛЕВОГО ПРЕДСЕРДИЯ ПРИ ХИРУРГИЧЕСКОЙ КОРРЕКЦИИ ПОРОКА МИТРАЛЬНОГО КЛАПАНА
14.01.26 – сердечно-сосудистая хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2010
Работа выполнена в Федеральном Государственном учреждении «Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова Росмедтехнологий»
Научный руководитель:
доктор медицинских наук
Михаил Леонидович Гордеев
Официальные оппоненты:
доктор медицинских наук, профессор,
член-корреспондент РАМН
Иван Петрович Дуданов
доктор медицинских наук, профессор
Владимир Викторович Гриценко
Ведущее учреждение:
Государственное образовательное учреждение дополнительного профессионального образования «Санкт-Петербургская медицинская академия последипломного образования федерального агентства по здравоохранению и социальному развитию»
Защита состоится "__" _______________2010 года в ____ часов на заседании диссертационного совета Д.208.090.05 при Государственном образовательном учреждении высшего профессионального образования «Санкт-Петербургский Государственный медицинский Университет им. акад. И.П. Павлова» по адресу: 197022, Санкт-Петербург, ул. Л.Толстого 6/8, зал заседаний Учёного Совета.
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Санкт-Петербургский Государственный медицинский Университет им. акад. И.П. Павлова» по адресу: 197022, Санкт-Петербург, ул. Льва Толстого, 6/8
Автореферат разослан "__" _________________2010 года
Ученый секретарь
диссертационного совета,
доктор медицинских наук, доцент М.О. Мясникова
Введение
Актуальность проблемы.
Крайние степени дилатации левого предсердия обозначаются терминами “атриомегалия”, “гигантское левое предсердие”. Частота атриомегалии по сводным данным составляет от 7,8 до 19 % всех больных, оперированных по поводу митрального порока (Apostolakis E. et al., 2008). С учётом приведённых выше цифр, за 2008 год в Российской Федерации было прооперировано от 462 до 1126 таких пациентов (Бокерия Л.А., 2009). Согласно литературным данным, увеличенное левое предсердие может сдавливать окружающие органы, что приводит к развитию сердечной и дыхательной недостаточности, дисфагии и развитию синдрома Ортнера (Иванов В.А., 2005). Растяжение стенки левого предсердия сопровождается развитием фибрилляции предсердий, что ведёт к снижению производительности сердца. Застой крови в увеличенном и фибриллирующем предсердии обусловливает повышенный риск тромбообразования и тромбоэмболий, являясь значимым фактором риска внезапной смерти (Ates M., 2006). Разработан ряд хирургических процедур, позволяющих уменьшить объём полости левого предсердия, однако отсутствует единая точка зрения относительно их эффективности и необходимости. Нет обоснованных указаний относительно необходимой степени редукции левого предсердия (Armstrong R., 1972; Apostolakis E. et al., 2008). Были предложены многочисленные способы пластики левого предсердия, но универсальной методики нет.
Цель исследования – оценить влияние редукции левого предсердия на результаты хирургического лечения пороков митрального клапана и оптимизировать её выполнение.
Задачи исследования:
- Провести анализ структурно-функциональных показателей сердца после коррекции пороков митрального клапана с и без пластики левого предсердия.
- Проанализировать влияние пластики левого предсердия на частоту и структуру тромбоэмболических осложнений после коррекции пороков митрального клапана.
- Оценить влияние пластики левого предсердия на частоту нарушений сердечного ритма и проводимости.
- Разработать алгоритм использования различных вариантов хирургического доступа и пластики левого предсердия при коррекции пороков митрального клапана.
- Предложить метод расчета степени редукции левого предсердия при выполнении атриопластики.
Научная новизна.
Получены новые данные, свидетельствующие о том, что пластика левого предсердия не влияет на показатели внутрисердечной гемодинамики и, прежде всего на степень легочной гипертензии, при увеличении исходных размеров левого предсердия до 75 мм.
Показано, что атриопластика не влияет на частоту восстановления синусового ритма в ранние и отдалённые сроки после операции.
Выявлено, что использование доступа по Жирадону, а также пластика правого предсердия, выполняемая наряду с пластикой левого предсердия, ассоциированы с высокой вероятностью фибрилляции предсердий в послеоперационном периоде.
Установлено, что атриопластика снижает риск развития артериальных тромбоэмболий.
Развитие нарушений проводимости у больных с пластикой левого предсердия может быть связано с интраоперационным повреждением проводящих путей.
Практическая ценность исследования.
Доказано положительное влияние пластики левого предсердия на частоту развития тромбоэмболий. Выявлены факторы, определяющие перспективы восстановления синусового ритма после коррекции митрального порока (срок существования и форма фибрилляции предсердий, возраст пациентов, размер левого предсердия), учёт которых обеспечивает дифференцированный подход к выбору схемы пластики левого предсердия.
Выявлены элементы операции (доступ по Жирадону, шов на крышу левого предсердия, швы и разрезы межпредсердной перегородки), обусловливающие повреждение проводящих путей предсердий при выполнении процедуры атриопластики.
Разработан метод интраоперационного контроля результатов редукции полости левого предсердия на остановленном и разгруженном сердце.
Основные положения, выносимые на защиту:
- Выполнение пластики левого предсердия не приводит к изменениям структурных и гемодинамических показателей сердца после коррекции митральных пороков сердца при исходных размерах левого предсердия до 75 мм. При этом атриопластика не оказывает влияния на динамику сердечного ритма. К повреждению структур проводящей системы, определяющему вероятность имплантации кардиостимуляторов, приводят такие элементы операции, как атриопластика вообще и аутотрансплантация сердца в частности.
- Выполнение пластики левого предсердия обосновано с точки зрения предупреждения развития артериальных тромбоэмболических осложнений, наиболее частых у больных с тромбозом левого предсердия. Однако редукция полости левого предсердия не обеспечивает свободы от тромбоэмболий после операции.
Апробация работы.
Основные положения работы доложены и обсуждены на XI Ежегодной сессии научного центра сердечно – сосудистой хирургии им. А.Н. Бакулева РАМН с Всероссийской конференцией молодых учёных (2007), на XIII и XIV Всероссийских съездах сердечно – сосудистых хирургов (2007 и 2008), на Всероссийской научно – практической конференции с международным участием «Высокотехнологичные методы диагностики и лечения заболеваний сердца, крови и эндокринных органов» (2007 и 2008), на секции Сердечно – сосудистой хирургии Научного Общества им Н.И. Пирогова (2008), на Ежегодной научной конференции совета молодых ученых и специалистов ФГУ «ФЦСКЭ имени В.А. Алмазова» (2009).
Личный вклад автора в выполненное исследование.
Автор лично осуществлял отбор всех пациентов, включённых в исследование. Принимал непосредственное участие в обследовании, предоперационной подготовке больных, ассистировал на операциях коррекции пороков митрального клапана осложнённых дилатацией левого предсердия, проводил наблюдение и обследование всех пациентов как в раннем послеоперационном периоде, так и в отдаленные сроки после оперативного вмешательства. Самостоятельно провёл статистическую обработку данных.
Внедрение результатов работы в практику.
Разработанный алгоритм выполнения атриопластики, наряду со способом контроля степени редукции полости левого предсердия, внедрены и применяются в Отделе хирургии сердца и сосудов ФГУ “Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова Росмедтехнологий” (197341 Санкт – Петербург, ул. Аккуратова д. 2).
Структура и объем работы.
Диссертация изложена на 164 листах машинописного текста, иллюстрирована 41 рисунком, 38 таблицами, и состоит из введения, обзора литературы, описания материалов и методов исследования, собственных результатов, обсуждения, выводов, практических рекомендаций и библиографического списка, включающего 180 работ, 23 отечественных и 157 зарубежных.
Содержание работы
Материалы и методы.
Для реализации поставленных задач исследования произведен анализ результатов 237 операций коррекции порока митрального клапана (МК). В исследование включались пациенты с передне - задним размером левого предсердия (ЛП) более 50 мм, что расценивалось нами как атриомегалия. Все пациенты были разделены на 2 группы. 107 пациентов, которым была выполнена атриопластика, составили исследуемую группу. Группу сравнения составили 130 больных после изолированной коррекции митрального порока. В отдаленные сроки (от 6 до 30 месяцев) после оперативного лечения обследовано 126 пациентов. Исследование носило по большей части проспективный характер. Рассматривались данные, полученные в 3 – х временных точках – накануне операции, на 7 – е сутки после операции и в отдалённом периоде, в сроки от 6 до 30 месяцев. Средний возраст больных к моменту операции составил 54 года. Женщины среди них преобладали. По этиологии большинство больных имели длительный ревматический анамнез. Статистическая обработка результатов произведена на персональном компьютере IBM PC с применением пакета прикладных программ StatSoft STATISTICA v. 7.0., Microsoft Excel. Достоверность различий средних двух выборок оценивалась с использованием критерия Манна – Уитни. Достоверность динамики показателей во времени под влиянием внешнего воздействия (оперативного вмешательства) определялась с применением метода дисперсионного анализа (ANOVA – repeated). Различия показателей считались статистически достоверными при значениях p<0,05. Для проверки независимости категориальных признаков использовался критерий Пирсона – χ2. Для проверки независимости категориальных и количественных признаков использовался параметрический метод Фишера - однофакторный дисперсионный анализ и непараметрический критерий Краскела – Уоллиса. Для исследования зависимости между количественными признаками использовался коэффициент корреляции Пирсона. Для выявления наиболее значимых признаков использовался метод факторного анализа. Канонический анализ применялся для выявления связи между признаками и структуры указанной связи. Для разработки способа контроля редукции объёма ЛП был использован метод математического моделирования.
Результаты.
Анализ динамики 11 основных эхокардиографических параметров в первых двух временных точках выявил значимое (р<10-5) различие только в динамике передне – заднего размера ЛП между группами с пластикой левого предсердия (ПлЛП) и без таковой. Уменьшение размера ЛП после операции происходило как у больных без ПлЛП, так и с ПлЛП, однако у тех, кому выполнялась ПлЛП, степень уменьшения ЛП была значимо больше (рис. 1). Для всех остальных параметров значимых различий динамики не наблюдается.

Рисунок 1. Динамика размера ЛП в группах пациентов с ПлЛП (красный цвет) и без таковой (синий цвет). На вертикальной оси отложены размеры ЛП, на горизонтальной оси - временные точки (0 – до операции, 1 – после операции).
При анализе данных во всех трёх временных точках были выявлены различия динамики давления в лёгочной артерии (р(ЛА)). После операции у больных обеих групп наблюдается уменьшение р(ЛА). Однако в отдаленном периоде в группе больных без ПлЛП снижение давления продолжается, а в группе с ПлЛП наблюдается небольшое увеличение давления (рис. 2). Различия динамики остальных параметров между изучаемыми группами пациентов не значимы.

Рисунок 2. Динамика р(ЛА) в группах с ПлЛП (красный цвет) и без таковой (синий цвет). На вертикальной оси отложено р(ЛА), на горизонтальной оси - временные точки (0 – до операции, 1 – после операции, 2 – отдалённый период).
Данные дисперсионного анализа указывают на более высокое р(ЛА) в группе с ПлЛП после операции, что послужило поводом для дополнительного исследования с целью выявления причин различной динамики р(ЛА). В ходе анализа была установлена зависимость динамики давления в лёгочной артерии от сроков существования фибрилляции предсердий (ФП), а соответственно и порока МК (таблица 1). В группе с атриопластикой сроки существования ФП исходныебыли значимо выше (р = 0,000005).
Таблица №1
Степень уменьшения р(ЛА) в зависимости от срока существования ФП
| | ФП до 10 лет | ФП 10 лет и более | р - level |
| Степень уменьшения р(Ла) | 29,75±15,82% (n=101) | 20,4±17,41% (n=30) | 0,004 |
Независимость структурных и гемодинамических параметров сердца от размера ЛП подтверждается также данными факторного анализа. В обеих группах было выявлено по 4 фактора идентичного состава. На диаграмме видно смешение индивидуальных значений факторов, что говорит об отсутствии различий факторной структуры между группами.
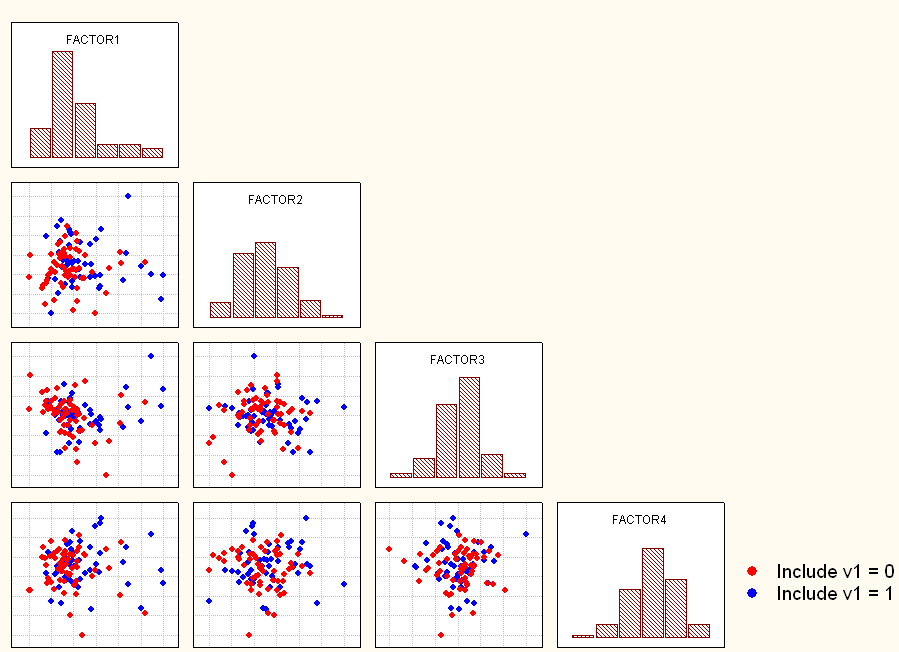
Рисунок 3. Двумерные диаграммы, отражающие факторную структуру изучаемой совокупности признаков во второй временной точке (после операции, госпитальный период). Красным цветом выделены признаки пациентов, которым не выполнялась ПлЛП, синим цветом выделены признаки пациентов, которым она была выполнена.
В результате проведения канонического анализа эхокардиографических данных до операции, выявлены две значимые положительные канонические корреляции R (U1,V1) = 0,647 и R (U2,V2) = 0,448; р < 10-5 и р < 0,0006 соответственно. В соответствии с вкладом каждого признака в группе, канонические случайные величины можно интерпретировать следующим образом:
1) Относительно соотношения U1 – V1, отражающего характер порока МК: при митральной недостаточности более выражена дилатация левого желудочка (ЛЖ), а при наличии чистого стеноза МК наблюдается приближение структурных параметров к норме (рис. 4).

Рисунок 4. Двумерная диаграмма канонических случайных величин, соответствующая первой канонической корреляции для данных до операции.
2) Относительно соотношения U2 – V2: чем больше р(ЛА), тем больше размеры ЛП и правого желудочка (ПЖ) (рис. 5).
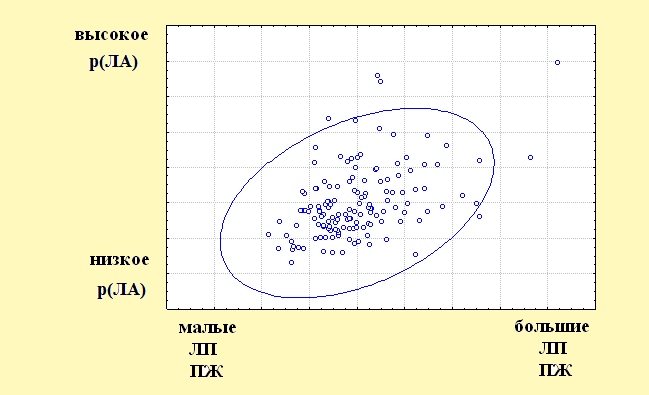
Рисунок 5. Двумерная диаграмма канонических случайных величин, соответствующая второй канонической корреляции для данных до операции.
Для данных после проведения операции канонический анализ не выявил ни одной значимой канонической корреляции, что позволяет сделать вывод о нарушении структурных связей между сопоставляемыми параметрами сразу после операции. Канонический анализ данных в отдаленном послеоперационном периоде выделяет одну значимую каноническую корреляцию R (U1,V1) = 0,95; р = 0,0008, которую можно интерпретировать следующим образом: чем больше степень выраженности стеноза МК, тем больше размеры ЛП, ударного объёма (УО) и фракции выброса (ФВ) левого желудочка (ЛЖ) (рис. 6).
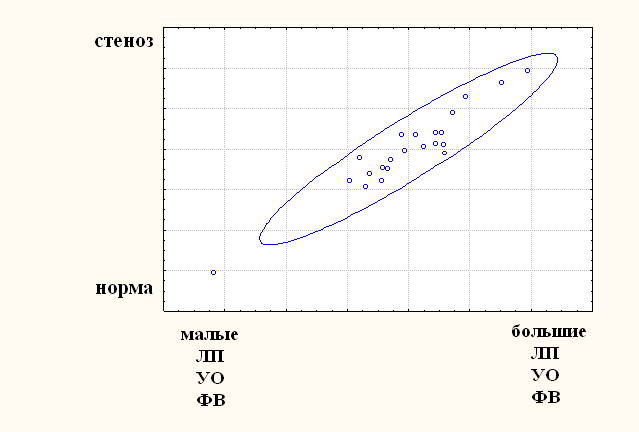
Рисунок 6. Двумерная диаграмма канонических случайных величин, соответствующая первой канонической корреляции для данных в отдаленном послеоперационном периоде.
Таким образом, как в дооперационном, так и в отдалённом послеоперационном периодах имеет место связь между структурными и гемодинамическими параметрами. Обращает на себя внимание отсутствие зависимости ФВ и УО ЛЖ от размера ЛП. Это может служить основанием для заключения о том, что хирургическая процедура редукции дилатированного ЛП не приводит к достоверному изменению производительности сердца, а соответственно и к улучшению системной гемодинамики (при данных средних размерах ЛП).
Наиболее частыми тромбоэмболическими осложнениями в изучаемой совокупности больных были ишемические инсульты (ОНМК). Остальные виды тромбоэмболий носили единичный характер, их анализ не проводился.
До операции в группе без ПлЛП встречались следующие виды тромбоэмболий: ОНМК - 14 (10,77%), тромбоэмболия лёгочной артерии (ТЭЛА) - 13 (10%), другие артериальные эмболии - 2 (1,54%). В группе с ПлЛП имели место: ОНМК - 17 (15,89%), ТЭЛА - 6 (5,61%), другие артериальные эмболии - 2 (1,87%).
В раннем послеоперационном периоде в группе без ПлЛП зарегистрированы: ОНМК - 3 (2,7%), ТЭЛА - 2 (1,54%), другие артериальные эмболии - 2 (1,54%); в группе с ПлЛП - ОНМК - 7 (9,33%), ТЭЛА - 2(1,87%), другие клинически выраженные артериальные эмболии отсутствовали.
В отдалённом послеоперационном периоде в группе без ПлЛП встречались: ОНМК - 11 (16,92%), ТЭЛА - 2 (3,08%), другие артериальные эмболии - 1 (1,54%); в группе с ПлЛП - ОНМК - 9 (14,75%), ТЭЛА - 1 (1,64%), другие артериальные эмболии - 2 (3,28%).
Исходно группа с атриопластикой включала более тяжёлых больных, имевших значимо большие размеры левых камер, больше случаев ФП и тромбоза ЛП. Закономерно, в данной группе до операции и в раннем послеоперационном периоде инсульты встречались несколько чаше. В отдалённом периоде, среди пациентов с атриопластикой, отмечается тенденция к относительному снижению частоты нарушений мозгового кровообращения. С учётом большего количества факторов риска это может свидетельствовать о пользе атриопластики с точки зрения предупреждения ОНМК.
Частота развития инсультов до операции коррелирует с индексом массы тела (ИМТ), размером ЛП и длительностью существования ФП.
Таблица №2
Факторы, влияющие на количество ОНМК.
| Период времени | Признаки | Характер зависимости | p -level с ПлЛП | p – level без ПлЛП |
| До операции | ИМТ | прямая | 0,02 | 0,11 |
| Размер ЛП | прямая | 0,02 | 0,50 | |
| Длительность ФП | прямая | 0,03 | <0,01 | |
| После операции | Удаление тромба ЛП | прямая | 0,15 | <0,01 |
| Отдалённый период | Летальный исход | прямая | 0,04 | 0,03 |
| ИМТ | обратная | 0,38 | 0,04 | |
| Срок после операции | прямая | 0,57 | <0,01 |
Атриопластика позволяет ликвидировать площадку прикрепления тромба к стенке предсердия, что приводит к уменьшению вероятности тромбоэмболий. Это подтверждается отсутствием зависимости частоты инсультов от фактов удаления тромбов ЛП в группе больных с атриопластикой и наличием такой зависимости в группе без неё.
Уменьшение объёма предсердия сопровождается снижением количества тромбоэмболий в отдалённом периоде. Это подтверждается отсутствием зависимости частоты инсультов от ИМТ и срока после операции у пациентов перенёсших атриопластику в отличие от тех, кому она не выполнялась. На частоту фатальных инсультов атриопластика не влияет – значимые корреляции частоты смертельных исходов и инсультов имеются в обеих группах.
Исследование динамики сердечного ритма показало отсутствие достоверных различий между группами с атриопластикой и без неё как после операции так и в отдалённом периоде.
Таблица 3.
Различия динамики сердечного ритма между группами пациентов с атриопластикой и без неё
| Варианты динамики сердечного ритма | Ранний послеоперационный период р – level | Отдалённый послеоперационный период р – level |
| ФП → СР | 0,90 | 0,86 |
| СР → ФП | 0,70 | 0,31 |
| СР → ПР | 0,28 | 0,17 |
| ФП → АСИСТОЛИЯ | 0,54 | 0,10 |
| СР→СР | 0,25 | 0,61 |
| ФП → ФП | 0,74 | 0,50 |
| Отсутствие динамики ритма | 0,78 | 0,87 |
Наиболее частым видом нарушений сердечного ритма в изучаемой совокупности больных была ФП. Были выявлены значимые прямые зависимости сохранения ФП после операции со следующими факторами: срок существования аритмии (p < 10-6), её форма (p < 10-5), возраст пациентов (p < 10-2) и размер левого предсердия (p < 10-5). С учётом выявленных закономерностей, для оценки зависимостей динамики сердечного ритма и особенностей операции была сформирована группа пациентов из 120 человек, перспективных в плане конверсии ФП в синусовый ритм (СР). Перспективными считались пациенты, имевшие срок существования постоянной формы ФП менее 10 лет или пароксизмальную её форму; средний возраст их составил 54 года, средние размеры ЛП до операции – 59, после операции 49 мм. Было установлено, что использование внутрисердечного доступа (ВСД) по Жирадону сопровождается сохранением ФП после операции. Это подтверждается данными корреляционного анализа (р = 0,05), а также было показано нами в эксперименте. Увеличение полости предсердий приводит к развитию и поддержанию ФП, об этом свидетельствует наличие обратной зависимости между дилатацией правого предсердия (ПП), требующей его редукции, и сохранением аритмии после операции (р = 0,026). Указанное влияние на динамику ритма элементов операции свидетельствует о необходимости оценки перспектив перехода ФП в СР для принятия решения о возможности применения указанных элементов.
Длительное существование пороков сердца сопровождается развитием брадиаритмий. Это подтверждается прямой зависимостью между сроками существования ФП и частотой имплантации кардиостимуляторов (ПЭКС) после операции (р = 0,04). Повреждение элементов проводящей системы сердца при хирургических манипуляциях также обусловливает необходимость имплантации ПЭКС. Данное утверждение обосновывается наличием прямой зависимости частоты их имплантации от фактов выполнения атиопластики вообще (р = 0,02) и аутотрансплантации сердца в частности (р < 0,01).
Учитывая выявленные факторы риска, была предпринята попытка разработать оптимальный алгоритм использования различных вариантов ВСД и ПлЛП. Предпосылками к выполнению данного фрагмента исследования явились следующие факты:
- Зависимость между частотой тромбоэмболий по большому кругу кровообращения от размеров и объёма ЛП.
- Отсутствие зависимости между количеством зон пликации и частотой тромбоэмболий.
- Зависимость между частотой ОНМК и ПлЛП у больных с тромбозом ЛП.
- Влияние на динамику ритма элементов операции, обусловливающее необходимость оценки перспектив перехода ФП в СР для принятия решения об их использовании.
- Возможность повреждения элементов проводящей системы сердца при осуществлении ВСД и выполнении ПлЛП, что было подтверждено в эксперименте .
С учётом приведённых выше оснований разработан алгоритм принятия решений об использовании вариантов атриопластики и ВСД. Согласно ему, у пациентов с СР необходимо выполнять атриопластику в наиболее малотравматичном варианте, а также использовать наименее травматичные ВСД. При наличии у пациентов тромба ЛП, первоочередной задачей является ликвидация зоны его прикрепления. Если при этом предполагается повреждение проводящих путей, то зоны атриопластики и доступы значения не имеют. У больных с ФП, помимо наличия и локализации тромба ЛП необходимо оценивать перспективы восстановления СР после операции. При наличии таковых необходимо использовать доступы и варианты атриопластики как у больных с СР. В противном случае зоны атриопластики и доступы значения не имеют.
В ходе выполнения настоящего исследования была поставлена задача осуществления контроля результатов ПлЛП непосредственно после её выполнения, без восстановления сердечной деятельности. При этом мы исходили из следующих фактов:
1. В норме индекс объёма ЛП составляет 41 мл/м2 .
2. После коррекции порока МК происходит уменьшение объёма ЛП за счёт снижения гемодинамической нагрузки на его стенку, за счёт захвата её в шов. Согласно многочисленным наблюдениям, указанное уменьшение объёма ЛП составляет в среднем 20%.
3. ЛП представляет собой образование сложной формы, которая индивидуальна в каждом конкретном случае. На фоне существующего порока МК, по мере увеличения объёма ЛП, его форма приближается к сферической.
4. ПлЛП, независимо от метода (пликация, резекция), по сути своей является уменьшением площади поверхности стенки ЛП.
5. При выполнении ПлЛП методом пликации по К. Kawazoe зона пликации представляет собой прямоугольник. При резекционных методах ПлЛП, резецируемые участки имеют форму эллипса (краевая резекция), треугольника (пластика по R. Sinatra), прямоугольника и иную (аутотрансплантация сердца).
6. Математические формулы, описывающие площади всех вышеперечисленных геометрическх фигур, обеспечивают возможность расчета параметров хирургической процедуры уменьшения ЛП.
7. Общеизвестны хирургические принципы выполнения пликационной ПлЛП, согласно которым, рекомендуется отступать от устьев лёгочных вен и фиброзного кольца МК не менее 10 мм, во избежание деформации указанных структур, повреждения коронарных артерий и проводящих путей.

Рисунок 7. Схема расчёта степени редукции левого предсердия и основные рабочие формулы.
Порядок действий при реализации способа: 1) Измеряются размеры зоны редукции и вычисляется площадь её поверхности. 2) Из известного объёма предсердия вычисляется площадь его поверхности. 3) Из площади поверхности предсердия вычитают площадь зоны редукции, получают значение площади поверхности предсердия, которая получится в результате пластики в указанной зоне. 4) Из получившейся площади поверхности предсердия, вычисляется получившийся его объём. Данный алгоритм повторяется до тех пор, пока не будет достигнут требуемый объём предсердия.
Наш метод был применён у 10 пациентов. Погрешность расчетов по сравнению с данными эхокардиографии составила в среднем 20%.
Выводы:
- Редукция левого предсердия не влияет на структурные (за исключением размера левого предсердия) и гемодинамические параметры сердца при размерах предсердия до 75 мм.
- Редукция объёма левого предсердия может приводить к снижению риска развития ишемических инсультов.
- Выполнение атриопластики не влияет на частоту восстановления синусового ритма, но ассоциируется с большим риском развития нарушений проводимости и необходимостью имплантации ПЭКС.
- У больных с длительностью фибрилляции предсердий менее 10 лет, шансы восстановления синусового ритма значимо уменьшаются при выполнении редукции двух предсердий и использовании внутрисердечного доступа по Жирадону.
- При выполнении пластики левого предсердия её тактика должна определяться наличием тромба в полости левого предсердия, его локализацией и перспективами восстановления синусового ритма.
Практические рекомендации:
- Для принятия решения об использовании различных вариантов атриопластики и внутрисердечного доступа необходим учёт характера сердечного ритма, наличия тромбов левого предсердия, перспектив восстановления синусового ритма у больных с исходной фибрилляцией предсердий, что реализовано в разработанном алгоритме.
- Выполнение атриопластики в наименее “травматичном” варианте показано больным с синусовым ритмом, а также пациентам с фибрилляцией предсердий имеющим перспективы восстановления синусового ритма. У остальных допустимо применение “травматичных”, но удобных и эффективных вариантов атриопластики и внутрисердечного доступа.
- При наличии тромба левого предсердия главной задачей атриопластики является удаление площадки его прикрепления, независимо от риска повреждения проводящих путей. При расположении тромба вне зоны прохождения проводящих путей, целесообразно использовать “малотравматичные” доступы и варианты атриопластики.
- Во избежание нежелательных эффектов как недостаточного (сохранение негативных последствий атриомегалии), так и чрезмерного (повышение сопротивления кровотоку) уменьшения полости левого предсердия в процессе выполнения атриопластики, необходимо контролировать степень его уменьшения по предложенному способу.
Список работ, опубликованных по теме диссертации:
- Гурщенков А.В., Татарский Р.Б., Сухова И.В., Гневашев А.С., Наймушин А.В., Лебедев Д.С., Гордеев М.Л. Множественные эктопические предсердные тахикардии после пликационной пластики левого предсердия // Вестник аритмологии. – 2008. - №53. – С. 78 - 80 (издание из списка рекомендованных ВАК РФ).
- Гурщенков А.В., Гордеев М.Л. Хирургическое лечение гигантского левого предсердия // Артериальная гипертензия. – 2009. – Т. 15. - №5. – С. 555 — 558 (издание из списка рекомендованных ВАК РФ).
- Гурщенков А.В., Антонова И.В., Митрофанова Л.Б., Сухова И.В., Гордеев М.Л. Случай хирургического лечения рецидива рабдомиосаркомы левого предсердия // Артериальная гипертензия. – 2009. – Т. 15. - №6. – С. 716 - 720 (издание из списка рекомендованных ВАК РФ).
- Гурщенков А.В., Сухова И.В., Новиков В.К., Немченко Е.В., Наймушин А.В., Баканов А.Ю., Худоногова С.В., Гордеев М.Л. Опыт коррекции атриомегалии у больных с митральным пороком сердца // Бюллетень НЦССХ им. А.Н. Бакулева. Приложение. Тезисы докладов и сообщений XI Ежегодной сессии научного центра сердечно – сосудистой хирургии им. А.Н. Бакулева РАМН с Всероссийской конференцией молодых учёных. – Москва. – 2007. – С. 22.
- Гурщенков А.В., Сухова И.В., Новиков В.К., Немченко Е.В., Наймушин А.В., Баканов А.Ю., Худоногова С.В., Гордеев М.Л. Результаты хирургической коррекции атриомегалии у больных с митральным пороком сердца // Бюллетень НЦССХ им. А.Н. Бакулева. Приложение. Тезисы докладов и сообщений XIII Всероссийского съезда сердечно – сосудистых хирургов – Москва. – 2007. - С. 39.
- Лаврешин А.В., Гурщенков А.В., Новиков В.К. Пластика левого предсердия при хирургической коррекции пороков митрального клапана // Сборник студенческих научных работ СПбГУ. – СПб. – 2007. - С. 67 - 68.
- Гурщенков А.В., Сухова И.В., Новиков В.К., Немченко Е.В., Наймушин А.В., Баканов А.Ю., Худоногова С.В., Гордеев М.Л. Результаты хирургической коррекции атриомегалии у больных с митральным пороком сердца // Сборник научных трудов посвященных 10-летию кафедры сердечно-сосудистой хирургии Санкт-Петербургской медицинской академии последипломного образования. – СПб. – 2007. - С. – 34.
- Митрофанова Л.Б., Антонова И.В., Гурщенков А.В. Результаты гистологического исследования операционного материала правого предсердия у больных с фибрилляцией предсердий // Артериальная Гипертензия. – 2008. - Т. 14. - №1. - Приложение №1: Материалы Всероссийской научно – практической конференции с международным участием “Высокотехнологичные методы диагностики и лечения заболеваний сердца, крови и эндокринных органов”. – С. 65.
- Гурщенков А.В., Сухова И.В., Новиков В.К., Немченко Е.В., Наймушин А.В., Баканов А.Ю., Худоногова С.В., Гордеев М.Л. Результаты хирургической коррекции атриомегалии у больных с митральным пороком сердца // Артериальная Гипертензия. – 2008. - Т. 14. - №1. - Приложение №1: Материалы Всероссийской научно – практической конференции с международным участием “Высокотехнологичные методы диагностики и лечения заболеваний сердца, крови и эндокринных органов”. – С. 78.
- Гурщенков А.В., Сухова И.В., Наймушин А.В., Баканов А.Ю., Гордеев М.Л. Осложнения пликационной пластики левого предсердия // Артериальная Гипертензия. – 2008. - Т. 14. - №2. - Приложение №1: Материалы Всероссийской научно – практической конференции с международным участием “Высокотехнологичные методы диагностики и лечения заболеваний сердца, крови и эндокринных органов”. – С. 75.
- Гурщенков А.В., Митрофанова Л.Б., Сухова И.В., Гордеев М.Л. К вопросу об анатомичности пликационной пластики левого предсердия // Артериальная Гипертензия. – 2008. - Т. 14. - №2. - Приложение №1: Материалы Всероссийской научно – практической конференции с международным участием “Высокотехнологичные методы диагностики и лечения заболеваний сердца, крови и эндокринных органов”. – С. 63.
- Гурщенков А.В., Митрофанова Л.Б., Сухова И.В., Гордеев М.Л. Исследование взаимоотношения пликационных швов и проводящих путей левого предсердия после редукции его объёма // Бюллетень НИИПК им. академика Е.Н. Мешалкина. Приложение. Тезисы докладов и сообщений Шестых научных чтений, посвящённых памяти академика РАМН Е.Н. Мешалкина, “Новые технологии в сердечно – сосудистой хирургии и интервенционной кардиологии” c международным участием. – Новосибирск. – 2008. – С. 53.
- Гурщенков А.В., Митрофанова Л.Б., Сухова И.В., Гордеев М.Л. К вопросу об анатомичности пликационной пластики левого предсердия // Бюллетень НЦССХ им. А.Н. Бакулева. Приложение. Тезисы докладов и сообщений XIV Всероссийского съезда сердечно – сосудистых хирургов. – Москва. – 2008. – С. 29.
- Гурщенков А.В., Сухова И.В., Наймушин А.В., Баканов А.Ю., Гордеев М.Л. Осложнения пликационной пластики левого предсердия // Бюллетень НЦССХ им. А.Н. Бакулева. Приложение. Тезисы докладов и сообщений XIV Всероссийского съезда сердечно – сосудистых хирургов. – Москва. – 2008. – С. 46.
- Гурщенков А.В., Гордеев М.Л. Протоколы заседаний Научного общества им Н.И. Пирогова № 2312 – 2317 (Доклад: “Редукция полости левого предсердия при коррекции пороков митрального клапана”. Демонстрация больного перенёсшего аутотрансплантацию сердца) // Вестник хирургии им И.И. Грекова. – 2008. – Т. 167. - №5. – С. 125 – 134.
- Гурщенков А.В. Исследование изменений эхокардиографических параметров после редукции полости левого предсердия с использованием метода корреляционного анализа // Сборник научных трудов I ежгодной научно – практической конференции Совета молодых учёных и специалистов ФГУ “ФЦСКЭ им. В.А. Алмазова Росмедтехнологий”. – 2009. – С. 5 - 6.
- Гурщенков А.В. Исследование изменений эхокардиографических параметров после редукции полости левого предсердия с использованием факторного анализа // Сборник научных трудов I ежгодной научно – практической конференции Совета молодых учёных и специалистов ФГУ “ФЦСКиЭ им. В.А. Алмазова Росмедтехнологий”. – 2009. – С. 6.
