Сравнительная оценка способов хирургической коррекции аномалии эбштейн а 14. 01. 26 Сердечно-сосудистая хирургия
| Вид материала | Автореферат диссертации |
- Тактика хирургического лечения аномалии эбштейна у детей до 3-х лет /14. 00. 44. сердечно-сосудистая, 459.29kb.
- Редукция полости левого предсердия при хирургической коррекции порока митрального клапана, 235.93kb.
- Артериальная гипертония и атеросклероз сонных артерий: особенности диагностики, течения,, 282.52kb.
- Обоснование способов хирургической коррекции нарушений углеводного обмена (клинико-экспериментальное, 502.51kb.
- Оценка динамики соматичнского состояния у детей при хирургической коррекции сколиоза, 278.3kb.
- Применение ксеноперикардиальных протезов с трехстворчатым клапаном для реконструкции, 446.39kb.
- «оптимизация местного лечения трофических язв венозной этиологии» 14. 01. 17 хирургия, 287.67kb.
- Программа вступительного экзамена в клиническую ординатуру по специальности «сердечно-сосудистая, 99.88kb.
- Выбор метода реваскуляризации у больных с дистальными формами облитерирующего атеросклероза, 327kb.
- Динамические физические нагрузки в комплексной терапии облитерирующего атеросклероза, 296.36kb.
1 2
На правах рукописи
АРХИПОВ Алексей Николаевич
СРАВНИТЕЛЬНАЯ ОЦЕНКА СПОСОБОВ
ХИРУРГИЧЕСКОЙ КОРРЕКЦИИ АНОМАЛИИ ЭБШТЕЙНА
14.01.26 Сердечно-сосудистая хирургия
Автореферат диссертации на соискание ученой степени
кандидата медицинских наук
Новосибирск – 2010
Работа выполнена в кардиохирургическом отделении детей школьного возраста
и взрослых Центра детской кардиохирургии и хирургии новорожденных детей ФГУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина
Министерства здравоохранения и социального развития Российской Федерации»
Научный руководитель:
Доктор мед. наук, профессор Горбатых Юрий Николаевич
Официальные оппоненты:
Доктор мед. наук профессор Шипулин Владимир Митрофанович
(отделение сердечно-сосудистой хирургии НИИ кардиологии Томского Научного Центра Сибирского Отделения Российской Академии Медицинских Наук)
Доктор мед. наук, профессор Железнев Сергей Иванович
(Центр приобретенных пороков сердца и биотехнологий ФГУ«Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина Министерства здравоохранения и социального развития Российской Федерации»)
Ведущая организация:
НИИ комплексных проблем сердечно-сосудистых заболеваний СО РАМН, г. Кемерово
Защита состоится 22 декабря 2010 года в 10 часов на заседании диссертационного совета Д 208.063.01 при ФГУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина».
Адрес: 630055, Новосибирск, ул. Речкуновская, 15;
e-mail: ds-meshalkin@yandex.ru
lkin.ru/dis_council
С диссертацией можно ознакомиться в библиотеке ФГУ ННИИПК
Автореферат разослан 22.11.2010 года
Ученый секретарь совета по защите
докторских и кандидатских диссертаций
доктор мед. наук, профессор Ленько Е.В.
СПИСОК СОКРАЩЕНИЙ
АВ блокада – атрио-вентрикулярная блокада
АЭ – аномалия Эбштейна
в/з – венозное зондирование
ВПС – врожденный порок сердца
ДМЖП – дефект межжелудочковой перегородки
ДМПП-II – дефект межпредсердной перегородки вторичного типа
ИВЛ – искусственная вентиляция легких
ИК – искусственное кровообращение
КДО – конечный диастолический объем
КДР – конечный диастолический размер
КСО – конечный систолический объем
КСР – конечный систолический размер
ЛЖ – левый желудочек
ЛЛА – левая легочная артерия
ЛП – левое предсердие
МНО – Международное нормализованное отношение
ООО – открытое овальное окно
ПЖ – правый желудочек
ПЛА – правая легочная артерия
ПП – правое предсердие
п/о – после операции
ТрК – трикуспидальный клапан
УО – ударный объем
ФВ – фракция выброса
ХСН – хроническая сердечная недостаточность
ЧСС – частота сердечных сокращений
ЭКС – электрокардиостимулятор
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы исследования
Анализ мировой литературы показал, что, несмотря на пятидесятилетнюю историю хирургической коррекции аномалии Эбштейна, до сих пор не существует общепринятого протокола выбора хирургической тактики. Первые неудачные попытки восстановления функции клапана за счет нативного створчатого аппарата (S.Hunter, C.Lillehei 1957, G.Schiebler 1959, Е.Н.Мешалкин 1969, K.Hardy 1965) во многих центрах надолго определили гегемонию клапанозамещающих операций. При этом выбор типа протеза для имплантации в трикуспидальную позицию до настоящего времени является наиболее дискутабельным.
Подавляющее большинство исследований, сравнивающих механические и биологические протезы, охватывают весь спектр патологии трикуспидального клапана, требующей его замещения. Пациенты с аномалией Эбштейна упоминаются в ряде трудов (Y.Kawachi 1992, K.Nakano 1994, 2001, G.Van Nooten 1995, D.Glower 1995, M.Kaplan 2002, B.Chang, 2006), однако не анализируются отдельно. Для единичных обзоров пациентов с аномалией Эбштейна характерны небольшой клинический материал и преимущественное использование той или иной группой исследователей выбранного ими типа протеза.
В общем спектре работ, касающихся протезирования трикуспидального клапана, часть исследователей склоняются в пользу биотканевых протезов, выбирая их для трикуспидальной позиции на основании отсутствия необходимости в антикоагулянтной терапии (низкой тромбогенности), низкого сопротивления кровотоку, отсутствия турбулентности (центрального кровотока), бесшумности в работе и менее выраженных (по сравнению с митральной и аортальной позицией) дегенеративных изменений (F.Guerra, 1990, J.Eng, 1990, D.Glower 1995, Y.Kawauchi 1999, H.Kawano 2000, K.Nakano 2001). Другая группа исследователей утверждает, что современные низкопрофильные двустворчатые протезы в меньшей степени подвержены тромбообразованию, обладают увеличеным пропускным отверстием и низким транспротезным градиентом давления, менее выраженным турбулентным потоком и, при соблюдении адекватной антикоагулянтной терапии, могут быть рекомендованы даже молодым пациентам, что выгодно отличает их от биопротезов со склонностью последних к кальцинозу, паннусообразованию, структурной дегенерации и непродолжительным срокам функционирования (D.Williams, 1990, Van Nooten, 1995, Y.Kobayashi, 1996, M.Dalrymple-Hay, 1999, B.Chang 2006, K.Sughimoto 2008). В третьей группе сравнительных анализов биологических и механических протезов в трикуспидальной позиции авторы не находят существенных различий в течении раннего и отдаленного послеоперационного периода у пациентов с механическими и биологическими протезами (H.Scully, 1995, C.Ratnatunga, 1998, G.Rizolli, 2004).
Что касается пластической реконструкции клапана, то в результате в литературе опубликованы небольшие серии пациентов с весьма ограниченными сроками наблюдения и отсутствием отдаленных данных. Лишь несколько крупных центров (A.Carpentier, J.Quaegebeur), практикующие пластическую реконструкцию трикуспидального клапана на протяжении десятилетий, публикуют обширные серии пациентов, лишенные, однако сравнительной характеристики с имплантированными протезами по причине небольшой доли последних в общем количестве наблюдений.
Цель исследования: Улучшение результатов хирургического лечения аномалии Эбштейна на основе оптимизации выбора способа коррекции и усовершенствования способа имплантации протеза в трикуспидальную позицию.
Задачи исследования:
- Оценить непосредственные и отдаленные (3-10 лет) результаты клапансохраняющих и клапанзамещающих оперативных вмешательств.
- Выявить специфические осложнения, оценить причины дисфункции для каждой из групп: клапансохраняющих операций, биологических и механических протезов.
- Обосновать операцию выбора в хирургической коррекции аномалии Эбштейна.
4. Разработать способ имплантации протеза в трикуспидальную позицию, позволяющий свести к минимуму риск повреждения проводящей системы сердца и уменьшить время ишемии миокарда.
5. Оценить эффективность разработанного способа имплантации в отношении профилактики развития нарушений атриовентрикулярной проводимости и продолжительности ишемии миокарда.
Научная новизна
- Дана комплексная оценка клинических и гемодинамических показателей на диагностическом этапе с целью определения показаний и противопоказаний к предстоящему оперативному лечению и выбора наиболее оптимального способа хирургической коррекции аномалии Эбштейна.
- На базе клинического материала (n=100) дана сравнительная оценка результатов пластической реконструкции и протезирования трикуспидального клапана механическими и биологическими протезами у пациентов с аномалией Эбштейна.
- Произведен сравнительный анализ отдаленных результатов через 1, 3, 5, 7 и 10 лет после операции в каждой группе, при этом выявлены основные специфичные осложнения отдаленного периода для каждого вида оперативного вмешательства, что позволило оптимизировать хирургическую тактику при аномалии Эбштейна.
- Разработан способ имплантации протеза в трикуспидальную позицию с применением разметочно-армирующего шва, исключающий вероятность блокирования запирательного элемента механического протеза тканями крыши коронарного синуса или промежуточной перегородки, а также деформации коронарного синуса, снижающий риск повреждения проводящих путей сердца и формирования парапротезных фистул, не увеличивающий при этом времени выполнения операции (патент № 2371116 от 27.10.2009).
Отличие полученных новых научных результатов от результатов,
полученных другими авторами
О преимуществе пластической реконструкции трикуспидального клапана писали многие авторы (F.Vargas 1998, R.Hetzer 1998, F.Sebening 1997, J.Quaegebeur 2004), однако их результаты ограничены небольшими сериями пациентов, оперированных по авторской методике, без отдаленных результатов и сравнительного анализа с группами протезирования клапана. G.Danielson и J.Dearani в 2006 г представили, пожалуй, крупнейшую серию из 539 пациентов, оперированных за 34 года, у 182 была выполнена пластика клапана по авторской методике, у остальных 357 – протезирование преимущественно биопротезами, количество механических протезов в серии было настолько мало, что не было включено в анализ. В диссертации же проведен сравнительный анализ как пластической реконструкции клапана на обширном клиническом материале, так и групп с имплантацией и биологических, и механических протезов в трикуспидальную позицию.
Ряд авторов продемонстрировали очень убедительные отдаленные результаты имплантации глютаральдигидобработанных биопротезов (89-92% через 8-10 лет) (D.Glower 1995, H.Kiziltan, 1998, F.Guerra 1990). Оценив отдаленные гемодинамические результаты диэпоксиобработанных биопротезов в трикуспидальной позиции, мы не получили таких обнадеживающих результатов, убедившись в недолговечности данных протезов в педиатрической группе.
Крупные ретроспективные анализы клиник США и Великобритании (H.Scully 1995, C.Ratnatunga 1998, G.Rizolli 2004) не выявили разницы между механическими и биологическими протезами в трикуспидальной позиции, причем эти исследования охватывают весь спектр патологии трикуспидального клапана, как врожденной, так и приобретенной. В диссертации анализируются пациенты детского и подросткового возраста с конкретным врожденным пороком сердца, подразумевающим как весьма широкий анатомо-функциональный спектр пациентов, так и выявленные различия в использовании биологических и механических протезов.
Практическая значимость полученных новых научных знаний
- Полученные в ходе исследования результаты позиционируют пластическую реконструкцию трикуспидального клапана как операцию выбора в хирургическом лечении аномалии Эбштейна, что позволило усовершенствовать существующий протокол ведения данной категории пациентов.
- Оценка гемодинамических параметров и специфичных для каждого типа протеза осложнений позволило сформулировать критерии выбора типа протеза и создать протокол ведения пациентов с протезами трикуспидального клапана.
- Анализ непосредственных и отдаленных результатов позволяет обосновать перспективные возможности и технические аспекты клапаносохраняющих и клапанозамещающих операций в хирургии аномалии Эбштейна, снизить количество осложнений, сократить длительность пребывания больного в стационаре, улучшить течение ближайшего и отдаленного послеоперационного периода.
Достоверность выводов и рекомендаций
Достаточный клинический материал (100 обследованных и оперированных пациентов с аномалией Эбштейна), высокий методический уровень выполненных исследований, а также обощенный опыт одного из ведущих кардиохирургических центров страны являются свидетельством высокой достоверности выводов и рекомендаций, сформулированных в диссертационной работе. У каждого пациента при выполнении статистического анализа обработано более двадцати параметров клинических и инструментальных исследований. В отдаленном периоде обследовано 90% пациентов.
Краткая характеристика клинического материала и научных
методов исследования
В основу диссертационной работы положен пятнадцатилетний опыт хирургического лечения 100 пациентов, которым за период с 1994 по 2009 годы в Новосибирском НИИ патологии кровообращения им. Е.Н.Мешалкина выполнена первичная радикальная бивентрикулярная хирургическая коррекция аномалии Эбштейна.
Возраст пациентов варьировал от 1 месяца до 49 лет, составив в среднем 13,11±8,8 лет, при этом 87% пациентов были детского и подросткового возраста. В зависимости от выбранного варианта оперативного вмешательства, больные разделены на две сопоставимые по возрасту, полу и антропометрическим показателям группы: в первую группу (n=72) вошли пациенты, которым было выполнено протезирование трикуспидального клапана, эта группа была разделена на две подгруппы: IA – пациенты, которым был имплантирован биологический протез (n=52) и IБ, которым в трикуспидальную позицию был имплантирован механический протез (n=20). Вторую группу (n=28) составили пациенты, перенесшие пластическую реконструкцию трикуспидального клапана.
Всем пациентам до операции проведено стандартное обследование, включающее основные инструментальные методы обследования: рентгенографию органов грудной клетки, электрокардиографию, трансторакальную и/или трансэзофагеальную эхокардиографию, полученные данные проанализированы и изложены в работе.
Для оценки операционного этапа использовались следующие показатели: время искусственного кровообращения, время окклюзии аорты, ректальная температура тела во время перфузии, соответствие диаметров имплантированных протезов расчетным.
При оценке непосредственных результатов учитывались: время ИВЛ, нахождения в палате реанимации, время инфузии и кумулятивные дозы симпатомиметиков, динамика эхокардиографических параметров и гемодинамические параметры трикуспидального клапана/протеза в раннем послеоперационном периоде.
В отдаленном периоде в качестве объектов анализа выбраны параметры ремоделирования камер сердца, транспротезные градиенты давления, площадь эффективного отверстия протеза по данным эхокардиографии, динамика параметров с течением времени.
Среднее арифметическое значение величин, стандартное отклонение от генеральной совокупности и средняя ошибка при статистической обработке результатов определялись с использоввнием лицензионного программного обеспечения Statistica 6.0 (StatSoft, США) и Microsoft Excel (Microsoft, США). Разница между показателями считалась статистически достоверной при p 0,05.
Использованное оснащение, оборудование и аппаратура
При обследовании пациентов использовалась следующая аппаратура: электрокардиографы «Cardiovit АТ-2» (Schiller AG, Швейцария), «PageWriter 200» (Philips Electronics N.V., Нидерланды), «MingoGraph 42В» (Siemens AG, Германия); рентгенодиагностические установки: рентгенодиагностический комплекс «Baccara» (Apelem DMS Group, Франция), аппарат рентгенографический цифровой «Новорент» (НПФ «Дигирент», Россия), аппарат рентгеновский РДС/4 – «Абрис» (ЗАО «МГП «Абрис», Россия); эхокардиографические аппараты «VIVID 4», «VIVID 7» (General Electric MS, США) и «Sonos 5500» (Philips Electronics N.V., Нидерланды).
Личный вклад автора в получении новых научных результатов
данного исследования
При выполнении работы автор лично: принимал участие в обследовании, определении показаний к кардиохирургическому лечению пациентов с аномалией Эбштейна; принимал участие в хирургическом лечении больных с аномалией Эбштейна; проводил дальнейшее наблюдение пациентов на госпитальном этапе и в отдаленные сроки; провел анализ исследуемых параметров по 100 историям болезни (клинического статуса пациентов, показателей операционного периода, динамического контроля в послеоперационном периоде) и создал базу данных, провел научную интерпретацию полученных результатов.
Апробация работы и публикации по теме диссертации
Основные положения, выводы и практические рекомендации доложены на Первом съезде хирургов Сибири и Дальнего Востока (Улан-Уде, 2005), Пятых научных чтениях, посвященных памяти академика РАМН Е.Н. Мешалкина, с международным участием, Юбилейной конференции и Первом съезде кардиохирургов Сибирского федерального округа (Новосибирск, 2006); Двенадцатом всероссийском съезде сердечно-сосудистых хирургов (Москва, 2006); Ученом совете ФГУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина Росмедтехнологий», Новосибирск, 2010.
Опубликовано 29 печатных работ, из них 8 по теме диссертации и 1 патент на изобретение.
Структура и объем диссертации
Диссертационная работа оформлена в виде специально подготовленной рукописи, изложена на 169 страницах. Текст оформлен в соответствии с требованиями к работам, направляемым в печать. Диссертация состоит из введения, пяти глав, обсуждения результатов исследования, выводов, практических рекомендаций. Список литературы включает 204 источника, из них 16 отечественных и 188 зарубежных. Работа содержит 36 таблиц, 24 диаграммы и 27 рисунков.
Основные положения, выносимые на защиту
- Операцией выбора в хирургической коррекции аномалии Эбштейна является пластическая реконструкция трикуспидального клапана.
- Механические и диэпоксиобработанные биологические протезы могут быть рекомендованы в качестве замены трикуспидального клапана в случае невозможности клапансохраняющей операции.
- Механические протезы в трикуспидальной позиции, по сравнению с биологическими, демонстрируют лучшие гемодинамические параметры и свободу от повторных оперативных вмешательств, но являются фактором высокого риска фатального тромбоза протеза, что не допускает погрешностей в антитромботической терапии.
- Имплантация протеза в трикуспидальную позицию является фактором риска развития нарушений атриовентрикулярной проводимости, применение разработанного способа позволяет предотвратить это осложнение.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Во избежание гемодинамической разнородности групп из исследования были исключены пациенты с полуторажелудочковой коррекцией, сложными комбинированными врожденными пороками сердца (сочетание аномалии Эбштейна с тотальным аномальным дренажем легочных вен, тетрадой Фалло и т.д.), а также пациенты с атрио-вентрикулярной и вентрикуло-артериальной дискордантностью (корригированной транспозицией магистральных артерий).
Демографическая и антропометрическая характеристика пациентов изложена в таблице 1. Для лаконичной характеристики анатомической формы нозологии и оптимизации выбора хирургической тактики была использована общепринятая классификация аномалии Эбштейна A.Carpentier и S.Chauvaud. В исследуемых группах мы столкнулись со следующим количественным соотношением морфо-функциональных вариантов порока: тип А – 8%, тип В – 47%, тип С – 35%, тип D – 10%.
Таблица 1
Демографическая и антропометрическая характеристика
групп пациентов.
| Группы | Пол, м/ж | Возраст, годы | Рост, см | Масса тела, кг | S тела, м2 |
| IА группа (n=52) | 22/30 | 14,97±9,1 (2,5 - 49) | 150,7±20,76 (90 - 182) | 44,84±16,66 (12 - 74) | 1,37±0,35 (0,55 - 1,95) |
| IБ группа (n=20) | 9/11 | 11,95±9 (1 - 42) | 133,3±26,13 (72 - 180) | 30,61±16,13 (10 - 67) | 1,06±0,37 (0,42 - 1,84) |
| II группа (n=28) | 13/15 | 10,47±7,6 (1 мес - 34) | 133±28,35 (58 - 176) | 34,09±20,09 (4,1 - 81) | 1,10±0,43 (0,26 - 1,83) |
| Всего | 44/56 | 13,11±8,8 (1 мес - 49) | 142,3±25,5 (58 - 182 ) | 39,0±18,5 (4,1 - 81) | 1,34±0,94 (0,26 – 1,95) |
Показаниями для оперативного вмешательства считали наличие выраженной недостаточности трикуспидального клапана, либо умеренной недостаточности в сочетании с выраженной одышкой, цианозом и признаками правожелудочковой сердечной недостаточности (ФК II-IV NYHA), прогрессирующим снижением толерантности к физической нагрузке, прогрессирующей кардиомегалией (увеличением СЛК более 60%, снижением сократительной способности левого желудочка), сопутствующими органическими пороками сердца, тахиаритмиями, не поддающимися консервативной терапии.
Все операции выполнены в условиях нормо- и гипотермического искусственного кровообращения (средняя минимальная температура тела во время перфузии в исследуемой группе составила 31,6 ± 3,6С per rectum), фармакохолодовой кардиоплегии кристаллоидным раствором и Custodiol.
Показанием к протезированию трикуспидального клапана считали невозможность клапансохраняющей операции при следующих условиях: а) невозможность использования по меньшей мере одной из створок (преимущественно передней) для восстановления замыкательной функции клапана (недостаточная площадь свободного паруса створок, чрезмерно ограниченная подвижность паруса за счет сращений с эндокардом и дисплазии хордально-папиллярного аппарата (гипоплазия, сращения, склероз хорд и папиллярных мышц); б) избыточная длина папиллярного аппарата, исключающая возможность реконструкции клапана в связи с выраженным пролапсом единственной функционально пригодной створки в полость правого предсердия; в) предполагаемые недостаточные диастолический объем функционирующей полости правого желудочка после аннулопластики с пликацией атриализованной части правого желудочка и формирования пространственно максимально приближенной к плоскости истинного фиброзного кольца точки коаптации.
При выборе типа протеза учитывались: возраст пациента, сопутствующие хронические заболевания (в т.ч. инфекционный эндокардит), детородный возраст у женщин, наличие противопоказаний к антикоагулянтной терапии, место жительства и социальный статус пациента, размеры полости правого желудочка.
Из вошедших в IА группу 52 пациентов подавляющему большинству (40 пациентов) были имплантированы биопротезы «КемКор» (Россия), 8 пациентам – «ПериКор» (Россия), 1 пациенту – «БиоЛаб» (Россия), 2 – «Carpentier-Edwards Perimount» (США), 1 – «Sorin Pericarbon» (Италия).
В IБ группе спектр имплантированных протезов оказался более широким. Применение механических протезов для имплантации в трикуспидальную позицию в НИИПК хронологически можно разделить на два этапа. Первый этап длился до 1999 года (до появления первых биопротезов КемКор) и связан с использованием дисковых механических отечественного производства: «ЭМИКС» (Россия) (12 пациентов) и «ЛИКС» (Россия) (1 пациент). Второй этап начался в 2007 году после неудовлетворительных отдаленных результатов применения биопротезов у детей и появления в клинике современных двустворчатых низкопрофильных механических протезов зарубежного производства. 2 пациентам был имплантирован протез «Carbomedics» (США), 1 пациенту – «ATS» (США), 1 – «On X» (США), 1 – «Sorin Bicarbon» (Италия) и 2 пациентам – отечественный двустворчатый протез МедИнж (Россия).
Выбор позиции и способа фиксации трикуспидального протеза обусловлен прежде всего стремлением хирурга избежать одного из наиболее грозных осложнений раннего послеоперационого периода - дисфункции проводящей системы сердца. Из 72 пациентов у подавляющего большинства (57 пациентов) была выбрана позиция истинного фиброзного кольца с применением комбинированной техники имплантации (выворачивающими П-образными швами (5 – 14 швов) прошивался сегмент периметра фиброзного кольца, соответствующий проекции септальной и частично задней створок (в области задне-септальной комиссуры), затем протез опускался в позицию, швы завязывались, и по оставшейся окружности оплетка фиксировалась непрерывным обвивным швом), однако эта техника требует от хирурга максимума внимания и осторожности при проведении швов в проекции верхушки треугольника Коха. Шестерым пациентам протез был имплантирован в предсердную (атриальную) позицию (выше коронарного синуса), причем следует отметить, что это были только механические протезы с низкопрофильной оплеткой (один из существенных недостатков способа - вероятность блокирования оплеткой протеза оттока из коронарного синуса у детей ранего возраста).
М
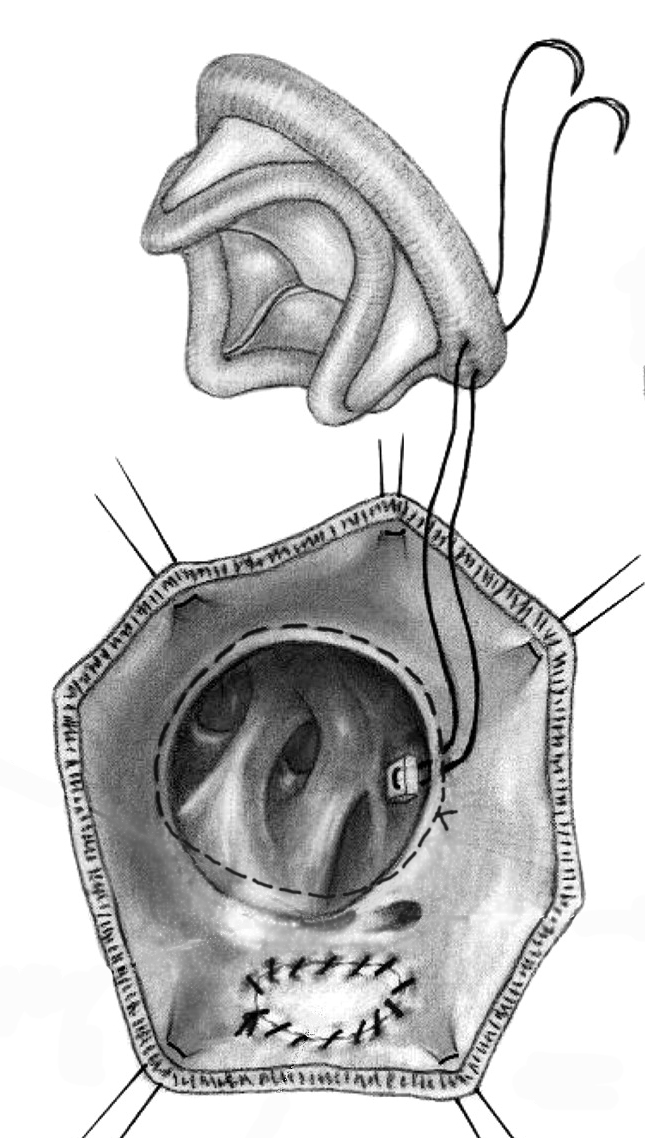 ы поставили перед собой задачу разработать и внедрить в практику способ фиксации протеза в трикуспидальную позицию, который бы позволил свести к минимуму риск повреждения проводящей системы сердца и в то же время сократить время окклюзии аорты. Предложеный способ подразумевает имплантацию протеза в желудочковую (вентрикулярную) позицию с использованием разметочно-армирующего шва. При этом первым этапом производится наложение разметочно-армирующего шва (в проекции перегородочного сегмента – на 5 мм апикальнее анатомического фиброзного кольца), а вторым - фиксация оплетки протеза непрерывным обвивным швом, проводимым вокруг нити разметочно-армирующего шва (Рисунок 1.)
ы поставили перед собой задачу разработать и внедрить в практику способ фиксации протеза в трикуспидальную позицию, который бы позволил свести к минимуму риск повреждения проводящей системы сердца и в то же время сократить время окклюзии аорты. Предложеный способ подразумевает имплантацию протеза в желудочковую (вентрикулярную) позицию с использованием разметочно-армирующего шва. При этом первым этапом производится наложение разметочно-армирующего шва (в проекции перегородочного сегмента – на 5 мм апикальнее анатомического фиброзного кольца), а вторым - фиксация оплетки протеза непрерывным обвивным швом, проводимым вокруг нити разметочно-армирующего шва (Рисунок 1.)Рисунок 1. Имплантация биопротеза в трикуспидальную позицию с помощью разметочно-армирующего шва.
По описанной технологии оперировано 9 пациентов. Отмечена достоверно меньшая продолжительность окклюзии аорты: в группе с использованием разметочно-армирующего шва среднее время ишемии миокарда 28,9 4,7 мин против 44,7 20,6 мин у остальных пациентов, перенесших протезирование трикуспидального клапана (p 0,05).
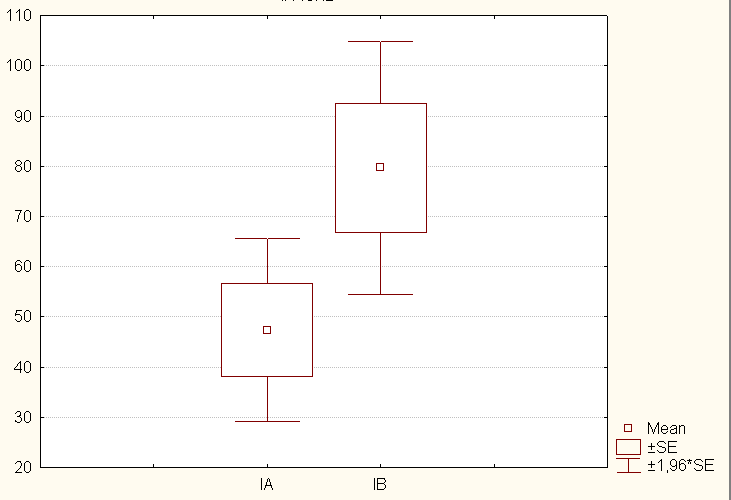
Расчет площади поверхности тела (BSA) производился c учетом массы тела (Wt) и роста (Ht) пациента по формуле: BSA = 0,024265 х Wt0,5378 х Ht0,3964 (Haycock GB et all (1978)). Расчет долженствующего диаметра фиброзного кольца клапана производился с учетом площади поверхности тела (BSA) по формуле: 8,2531 * LN(BSA) + 24,835 (Rowlatt IE et all (1963)). На диаграммах 1 и 2 продемонстировано соотношение расчетных и фактических диаметров имплантированных протезов в обеих группах.

Диаграмма 1. Отношение фактических и расчетных диаметров имплантированных биопротезов.
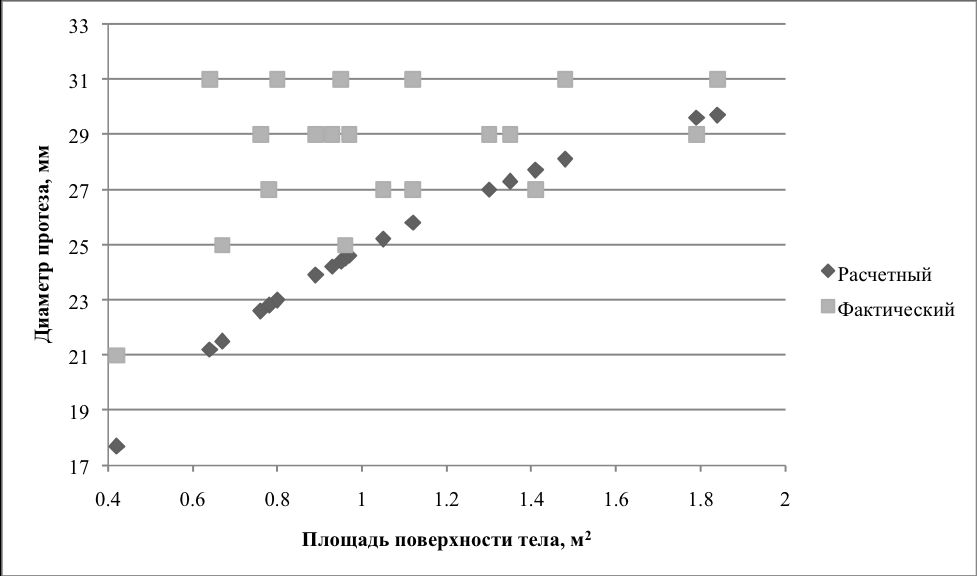
Диаграмма 2. Отношение фактических и расчетных диаметров имплантированных механических протезов.
У подавляющего числа пациентов размер имплантированного протеза превышал расчетный, за исключением нескольких случаев, когда был имплантирован протез меньшего диаметра в силу анатомических особенностей фиброзного кольца трикуспидального клапана. Стремление имплантировать протез большего диаметра было обусловлено, с одной стороны, громадным потенциалом дилатированных правых отделов сердца, куда можно было вшить протез практически любого диаметра, а с другой стороны – желанием обеспечить максимальное пропускное отверстие протеза с минимальным транспротезным градиентом давления и нормальную скорость ламинарного кровотока, что уменьшает вероятность развития дисфункции протеза.
Пластическая реконструкция у большего числа пациентов заключалась в основном в формировании монокуспидального клапана по методике Danielson либо Hetzer с различными вариантами дополнительных вариантов аннуло- либо комиссуропластики при необходимости. Пликацию атриализованной части правого желудочка и суживание правого атриовентрикулярного отверстия выполняли под контролем расчетных бужей и с оценкой объемных показателей полости оставшейся функционирующей части правого желудочка.
Не было выявлено достоверных отличий во времени окклюзии аорты между двумя основными группами, что вполне предсказуемо, поскольку аномалия Эбштейна – чрезвычайно морфологически вариабельный порок сердца. Это обусловливает тот факт, что большая часть протезирований выполнена после попыток пластической реконструкции клапана, а удачные пластики не всегда ограничивались одной техникой в стремлении достичь убедительной коаптации створок, что занимает примерно одинаковое количество времени (таблица 2).
Таблица 2
Продолжительность искусственного кровообращения и окклюзии аорты в исследуемых группах, минуты.
| Параметры ИК | IA группа | IБ группа | II группа | Всего |
| Время ИК | 85,1 ± 24,2 | 89,4 ± 21,7 | 80,6 ± 20,8 | 84,7 ± 22,8 |
| Время окклюзии аорты | 45,5 ± 20,8 | 37,1 ± 30,3 | 44,1 ± 18,4 | 43,4 ± 22,4 |
В исследование вошли 13 пациентов с исходным синдромом Wolf-Parkinson-White и пароксизмами ортодромной тахикардии. Наиболее часто встречающаяся локализация – задне-септальный (5 пациентов) и задний (5 пациентов) пучки Кента. Стоит отметить, что у 4 пациентов из 13 выявлены множественные дополнительные пути проведения (2-3 локализаций). У 3 пациентов радиочастотная аблация дополнительных путей проведения выполнена на «открытом» сердце во время хирургической коррекции порока (до 2000 г), у 8 пациентов – транскатетерным способом в рентгеноперационной за несколько дней до хирургической коррекции порока с хорошим эффектом. Еще у двоих пациентов транскатетерная радиочастотная аблация по разным причинам оказалась неэффективной, и им выполнена процедура Sealy во время оперативного лечения на «открытом» сердце. Локализация дополнительных путей проведения в серии представлена на рисунке 2.
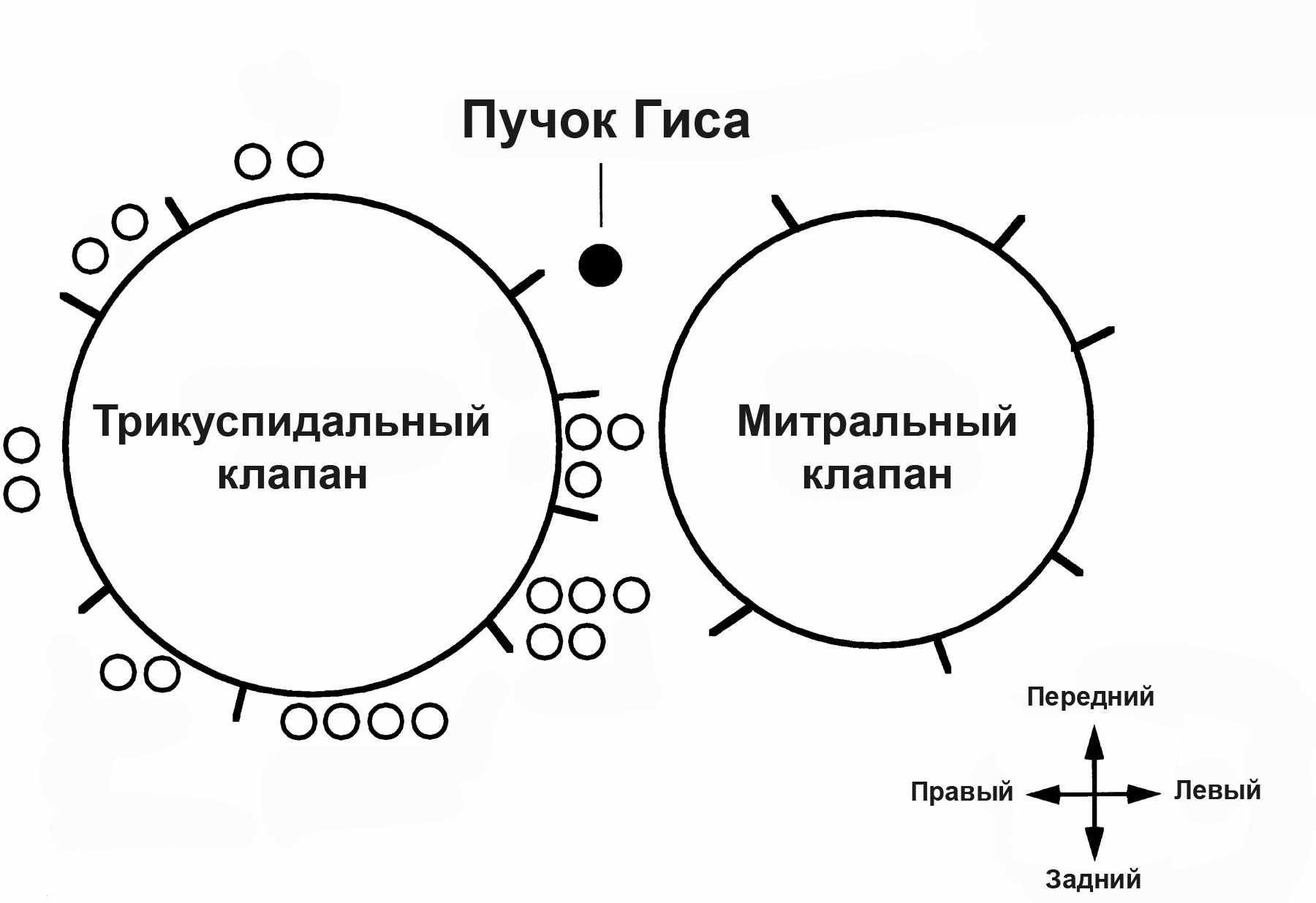
Рисунок 3.14. Локализация дополнительных путей проведения у пациентов с синдромом Wolf-Parkinson-White.
Таким образом, выполнение электрофизиологического исследования и радиочастотной аблации дополнительных путей проведения целесообразно выполнять первым этапом до хирургической коррекции порока, что дает возможность повторной радиочастотной аблации либо хирургической резекции пучков Кента при технических затруднениях транскатетерной методике либо манифестации ранее скрытых множественных дополнительных путей проведения.
Для определения зависимости тяжести течения послеоперационного периода от выбранного способа хирургической коррекции была произведена оценка длительности пребывания пациента в палате интенсивной терапии, продолжительности искусственной вентиляции легких и длительности применения инотропных препаратов. Длительность искусственной вентиляции легких определялась как временной промежуток с момента поступления из операционной до перевода на спонтанное дыхание, длительность пребывания пациента в палате интенсивной терапии определялась как временной промежуток с момента поступления из операционной до перевода в профильное отделение. Распределение по группам представлено в таблице 3.
Таблица 3
Средняя продолжительность искусственной вентиляции легких и пребывания в ПИТ, часы
| Параметры | IА группа | IБ группа | II группа | Всего |
| Время появления признаков сознания | 2,3 ± 1,3 | 2,2 ± 0,9 | 1,7 ± 0,8 | 2,1 ± 1,1 |
| Продолжительность искусственной вентиляции легких | 10,6 ± 7,9 | 21,0 ± 17,0 | 9,7 ± 8,7 | 12,3 ± 11,1 |
| Продолжительность пребывания в ПИТ | 59,5 ± 47,1 | 84,5 ± 56,4 | 43,7 ± 33,6 | 64,2 ± 54,0 |
В
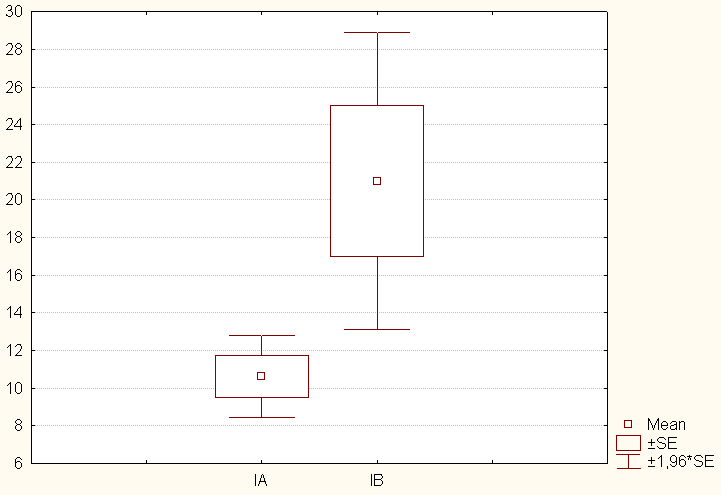 группе протезов менее осложненное течение раннего послеоперационного периода продемонстрировали биологические протезы. Достоверно меньшее по сравнению с механическими протезами время искусственной вентиляции легких (10,6 ± 7,9 часов против 21,0 ± 17,0 часов) (диаграмма 3), длительность инфузии кардиотонических препаратов (47,4 ± 45,3 часов против 79,7 ± 44,5 часов) (диаграмма 4) связано, вероятно, с более физиологичным центральным кровотоком через биологический протез.
группе протезов менее осложненное течение раннего послеоперационного периода продемонстрировали биологические протезы. Достоверно меньшее по сравнению с механическими протезами время искусственной вентиляции легких (10,6 ± 7,9 часов против 21,0 ± 17,0 часов) (диаграмма 3), длительность инфузии кардиотонических препаратов (47,4 ± 45,3 часов против 79,7 ± 44,5 часов) (диаграмма 4) связано, вероятно, с более физиологичным центральным кровотоком через биологический протез. Д
 иаграмма 3. Продолжительность искусственной вентиляции легких в группах с биологическими (IА) и механическими (IБ) протезами.
иаграмма 3. Продолжительность искусственной вентиляции легких в группах с биологическими (IА) и механическими (IБ) протезами.Диаграмма 4. Длительность применения кардиотоников в группах протезирования IA и IБ.
Кроме того, в группе биопротезов отмечено достоверное ремоделирование камер сердца после коррекции порока (уменьшение размеров правого предсердия, правого желудочка, а также улучшение диастолического наполнения левого желудочка (увеличение КДР, КДО и УО) (Таблица 4).
Таблица 4
| ЭхоКГ-показатели | До операции | После операции | p-уровень | |
| ПП, см | 5,4 ± 1,3 | 4,1 ± 0,7 | < 0,001 | |
| Индекс ПП / S тела, см / м2 | 4,12 ± 1,23 | 3,14 ± 0,71 | < 0,001 | |
| КДР ПЖ, см | 3,1 ± 1,0 | 2,6 ± 0,7 | 0,002 | |
| Индекс КДР ПЖ / S тела, см / м2 | 2,33 ± 0,71 | 1,97 ± 0,64 | 0,008 | |
| ЛЖ | КДР, см | 3,6 ± 0,6 | 3,8 ± 0,5 | 0,04 |
| Индекс КДР / S тела, см / м2 | 2,77 ± 0,84 | 2,94 ± 0,8 | 0,29 | |
| КДО, мл | 56,3 ± 20,4 | 64,9 ± 17,4 | 0,02 | |
| Индекс КДО / S тела, мл / м2 | 41,94 ± 14,10 | 49,27 ± 14,81 | 0,01 | |
| УО, мл | 38,6 ± 14,1 | 44,6 ± 12,8 | 0,02 | |
| Индекс УО / S тела, мл / м2 | 29,08 ± 10,87 | 33,88 ± 10,84 | 0,03 | |
В группе же механических протезов отмечено лишь статистически достоверное уменьшение размеров правого предсердия (с 4,8 ± 0,9 см до 4,0 ± 0,9 см). Тем не менее, механические протезы показали себя достойной альтернативой трикуспидальному клапану, продемонстрировав практически идентичные биопротезам показатели транспротезного градиента давления, площади эффективного отверстия протеза и скорости транспротезного кровотока (таблицы 5 и 6).
Таблица 5
Гемодинамические параметры биопротезов (группа IA)
| Диаметр протеза | 18 | 26 | 28 | 30 | 32 |
| Количество пациентов | 1 | 4 | 13 | 29 | 5 |
| Пиковый ∆Р, мм рт.ст. | 4,5 | 5,0±0,47 | 6,82±3,0 | 6,07±2,58 | 5,91±2,32 |
| Средний ∆Р, мм рт.ст. | 1,9 | 2,75±0,48 | 3,32±1,02 | 2,63±0,79 | 3,06±1,72 |
| Эффективная площадь, см² | - | 3,33±0,22 | 3,10±0,42 | 3,36±0,5 | 3,95±0,49 |
| Скорость, м/с | - | 1,45±0,05 | 1,32±0,1 | 1,22±0,25 | 1,06±0,14 |
Таблица 6
Гемодинамические параметры механических протезов (группа IБ)
| Диаметр протеза | 21 | 25 | 27 | 29 | 31 |
| Количество пациентов | 1 | 2 | 5 | 6 | 6 |
| Пиковый ∆Р, мм рт.ст. | 4,2 | 4,75±0,35 | 7,64±6,61 | 7,45±3,3 | 5,82±1,83 |
| Средний ∆Р, мм рт.ст. | 2,1 | 2,75±0,21 | 3,58±2,6 | 3,45±1,13 | 2,78±1,03 |
| Эффективная площадь, см² | 2,07 | 3,0±0,14 | 2,92±0,69 | 3,32±0,46 | 3,43±0,58 |
| Скорость, м/с | н/у | 1,41±0,06 | 1,24±0,26 | 1,17±0,25 | 1,19±0,2 |
Группа пластической реконструкции продемонстрировала наиболее благоприятное течение послеоперационного периода, обусловленное сохранением физиологичного клапана без жесткого каркаса. При сравнении групп протезирования и пластической реконструкции клапана (I и II) выявлена достоверно меньшие кумулятивные дозы допмина (288136,8 ± 156411,8 против 604113,9 ± 488425,8 мкг) (таблица 7) и меньшее время пребывания в ПИТ (43,7 ± 33,6 против 66,5 ± 50,7 часов) (диаграмма 5) для II группы.
Таблица 7
Распределение по группам средних кумулятивных доз
кардиотонических препаратов, мкг
| Кардиотоники | IА группа | IБ группа | II группа | Всего |
| Допмин | 533272,2 ± 469653,5 | 735394,0 ± 519845,2 | 288136,8 ± 156411,8 | 533896,8 ± 454966,6 |
| Адреналин | 5169,7 ± 4085,5 | 7344,1 ± 3401,9 | 2717,0 ± 1207,7 | 5790,7 ± 3773,8 |
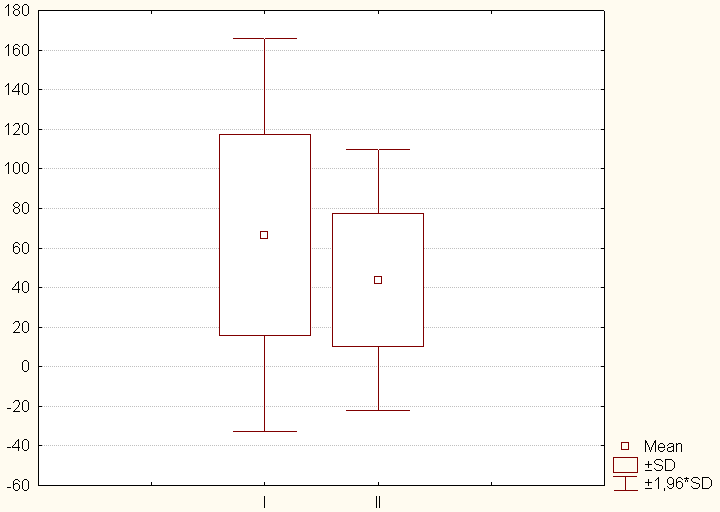
Диаграмма 5. Продолжительность пребывания в палате интенсивной терапии в группах I и II.
Также для второй группы характерно достоверное ремоделирование камер сердца (уменьшение размеров правого предсердия, правого желудочка, а также улучшение диастолического наполнения левого желудочка (увеличение КДО и УО) (таблица 8). Пиковый транспротезный градиент давления в группе составил 4,66 ± 1,83 мм рт.ст., средний 2,02 ± 0,91 мм рт.ст. Средняя площадь эффективного отверстия клапана во II группе составила 3,79 ± 0,74 см2 при скорости кровотока 1,0 ± 0,27 м/с. По распространению струи регургитации недостаточность клапана после пластики не превышала II степени (I степени – у 16 пациентов, II степени – у 12 пациентов), по объему от площади предсердия у 22 пациентов констатирована незначительная, у 6 – умеренная струя регургитации.
Таблица 8.
Результаты эхокардиографического исследования исследования (II группа)
| ЭхоКГ-показатели | До операции | После операции | p-уровень | |
| ПП, см | 4,5 ± 1,23 | 3,3 ± 0,6 | < 0,001 | |
| Индекс ПП / S тела, см / м2 | 4,66 ± 2,12 | 3,48 ± 1,60 | 0,02 | |
| КДР ПЖ, см | 2,8 ± 0,8 | 2,3 ± 0,7 | 0,03 | |
| Индекс КДР ПЖ / S тела, см / м2 | 2,93 ± 1,62 | 2,46 ± 1,30 | 0,24 | |
| | Индекс КДО / S тела, мл / м2 | 42,64 ± 12,47 | 50,40 ± 15,90 | 0,05 |
| КСО, мл | 13,8 ± 7,7 | 15,1 ± 5,9 | 0,48 | |
| Индекс КСО / S тела, мл / м2 | 12,51 ± 5,15 | 14,79 ± 5,53 | 0,12 | |
| УО, мл | 32,9 ± 16,2 | 36,2 ± 11,8 | 0,87 | |
| Индекс УО / S тела, мл / м2 | 29,87 ± 8,9 | 35,47 ± 11,37 | 0,04 | |
Кардиотоническую поддержку в серии получали 47% пациентов, причем у 29% проводилась монотерапия допмином, и у 16% - комбинированная терапия допмином и адреналином. В группе протезирования необходимости в инфузии симпатомиметиков не было у 51,4% пациентов, в группе пластической реконструкции – у 64,3%, причем у большинства пациентов, потребовавших кардиотонической терапии во II группе, терапия инфузия была ограничена монотерапией допмином. В I же группе у 40% пациентов отмечена необходимость в инфузии двух кардиотоников.
В отдаленные сроки обследовано 90% пациентов, средний срок наблюдения составил 82,1 ± 46,1 месяца (таблица 9). Высокая частота активации инфекционного эндокардита в послеоперационном периоде требует ежегодной диспансеризации пациентов и своевременной санации очагов хронической инфекции.
Таблица 9
Сроки наблюдения пациентов в исследуемых группах, месяцы.
| Группы | IА группа | IIБ группа | II группа | Всего |
| Сроки наблюдения | 77,9 ± 26,9 (14 – 123) | 107,6 ± 60,7 (12 - 181) | 71,9 ± 56,3 (8 - 175) | 82,1 ± 46,0 (8 - 181) |
Анализ клинического состояния пациентов после хирургической коррекции аномалии Эбштейна выявил отчетливую положительную динамику функционального класса по NYHA (таблица 10).
Таблица 10
Распределение пациентов по функциональным классам (NYHA).
| До операции | ||||
| Группы | IА группа (n=52) | IБ группа (n=20) | II группа (n=28) | Всего |
| I ФК | 6 (11,5%) | - | - | 6 (6%) |
| II ФК | 37 (71,2%) | 15 (75%) | 24 (85,7%) | 76 (76%) |
| III ФК | 9 (17,3%) | 5 (25%) | 4 (14,3%) | 18 (18%) |
| Отдаленный период | ||||
| Группы | IА группа (n=43) | IБ группа (n=20) | II группа (n=27) | Всего |
| I ФК | 26 (60,5%) | 12 (60%) | 22 (81,5%) | 60 (66,7%) |
| II ФК | 17 (39,5%) | 8 (40%) | 5 (18,5%) | 30 (33,3%) |
| III ФК | - | - | - | - |
Оценка протеза в трикуспидальной позиции и пластированного клапана осуществлялась с помощью трансторакального и трансэзофагеального эхокардиографического исследования. В качестве временных контрольных точек выбраны стандартные этапы: 1, 3, 5, 7 и 10 лет.
В группе биопротезов за наблюдаемый период отмечено быстропрогрессирующее нарастание транспротезного градиента давления. 17 пациентов из 44 (37,8%) были повторно оперированы в среднем через 60,1 ± 2,0 месяца (5 лет). Во всех случаях репротезирования трикуспидального клапана выход протеза из строя являлся результатом значительного ограничения подвижности либо запирательного элемента механического протеза, либо створок биопротеза с резким уменьшением площади эффективного отверстия. При исследовании биопсийного материала очевидно, что причиной раннего выхода из строя протеза клапана сердца является блокирование тромбом или паннусом, развившимся поверх тромба и распространившимся на створку или запирательный элемент (12 пациентов (70,6%)), и только у 5 пациентов (29,4%) нарушение функции протеза было связано со структурной дегенерацией всех створок, что приводило к выраженному кальцинозу, уменьшению в размерах и абсолютной неподвижности. Результаты оценки гемодинамических протезов в послеоперационном периоде представлены в таблице 11.
Таблица 11
Послеоперационные величины транспротезного
градиента и эффективной площади биопротезов (группа IA)
| Диаметр протеза | После операции | 1 год | 3 года | 5 лет | 7 лет | 10 лет |
| Количество пациентов | 52 | 44 | 38 | 25 | 11 | 2 |
| Пиковый ∆Р, мм рт.ст. | 6,1±2,5 | 9,0±3,0 | 11,7±2,6 | 12,6±3,8 | 15,0±3,6 | 18,2±6,6 |
| Средний ∆Р, мм рт.ст. | 2,8±1,0 | 4,6±2,0 | 6,3±2,0 | 7,3±3,2 | 9,2±2,6 | 11,8±6,2 |
| Эффективная площадь, см² | 3,35±0,51 | 2,88±0,49 | 2,44±0,76 | 2,19±0,70 | 2,02±0,67 | 1,50±0,70 |
В группе механических протезов репротезирование выполнено у 9 пациентов (45%), при этом у 2-х пациентов был диагностирован острый тромбоз протеза – наиболее грозное осложнение этого типа протезов в раннем послеоперационном периоде, один случай закончился летальным исходом. Репротезирование в IБ группе выполнено в среднем через 89,0 месяцев (7,5 лет), что превышает аналогичный показатель для биологических протезов. ЭхоКГ-параметры представлены в таблице 12.
Таблица 12
Послеоперационные величины транспротезного градиента и эффективной площади механических протезов (группа IБ).
| Диаметр протеза | После операции | 1 год | 3 года | 5 лет | 7 лет | 10 лет |
| Количество пациентов | 20 | 19 | 15 | 13 | 13 | 11 |
| Пиковый ∆Р, мм рт.ст. | 5,7±2,1 | 6,3±1,9 | 7,6±2,5 | 8,7±2,2 | 10,1±2,1 | 13,0±6,4 |
| Средний ∆Р, мм рт.ст. | 2,8±0,9 | 2,9±0,8 | 3,8±1,8 | 4,6±1,7 | 5,3±1,8 | 7,1±4,2 |
| Эффективная площадь, см² | 3,21±0,56 | 3,00±0,66 | 2,69±0,75 | 2,78±0,55 | 2,41±0,40 | 2,17±0,83 |
Во II группе повторные вмешательства выполнены у 4 пациентов (14,8%) в среднем через 53,3 месяца. Результаты контрольной эхокардиографии у пациентов после пластической реконструкции представлены в таблице 13.
Таблица 13
Послеоперационные величины транспротезного градиента и эффективной площади трикуспидального клапана после пластики (группа II).
| Диаметр протеза | После операции | 1 год | 3 года | 5 лет | 7 лет | 10 лет |
| Количество пациентов | 28 | 27 | 10 | 9 | 6 | 6 |
| Пиковый ∆Р, мм рт.ст. | 4,7±1,8 | 4,5±2,0 | 3,4±0,9 | 3,6±0,9 | 3,5±1,1 | 3,5±1,3 |
| Средний ∆Р, мм рт.ст. | 2,0±0,9 | 2,1±0,9 | 1,9±0,5 | 1,9±0,6 | 1,9±0,7 | 2,0±0,7 |
| Эффективная площадь, см² | 3,61±0,72 | 3,79±0,74 | 3,99±0,54 | 4,03±0,49 | 4,00±0,51 | 4,1±0,16 |
| Степень клапанной регургитации | I - 16 II - 12 | I - 10 II - 16 III - 1 | I - 4 II - 5 III - 1 | I - 3 II - 4 III - 2 | I - 1 II - 5 | I - 1 II - 5 |
Повторные кардиохирургические вмешательства выполнены у 30 пациентов, что составляет 33,3% от 90 наблюдаемых пациентов. Свобода от повторных операций в группах IА (биопротезы), IБ (механические протезы) и II (пластика трикуспидального клапана) представлена на диаграмме 6 и в сроки 3, 5 и 10 лет составляет в группе биопротезов 93%, 72% и 32%, в группе механических протезов 90%, 77%, 71%, а в группе пластической реконструкции 93%, 92% и 81 % соответственно.
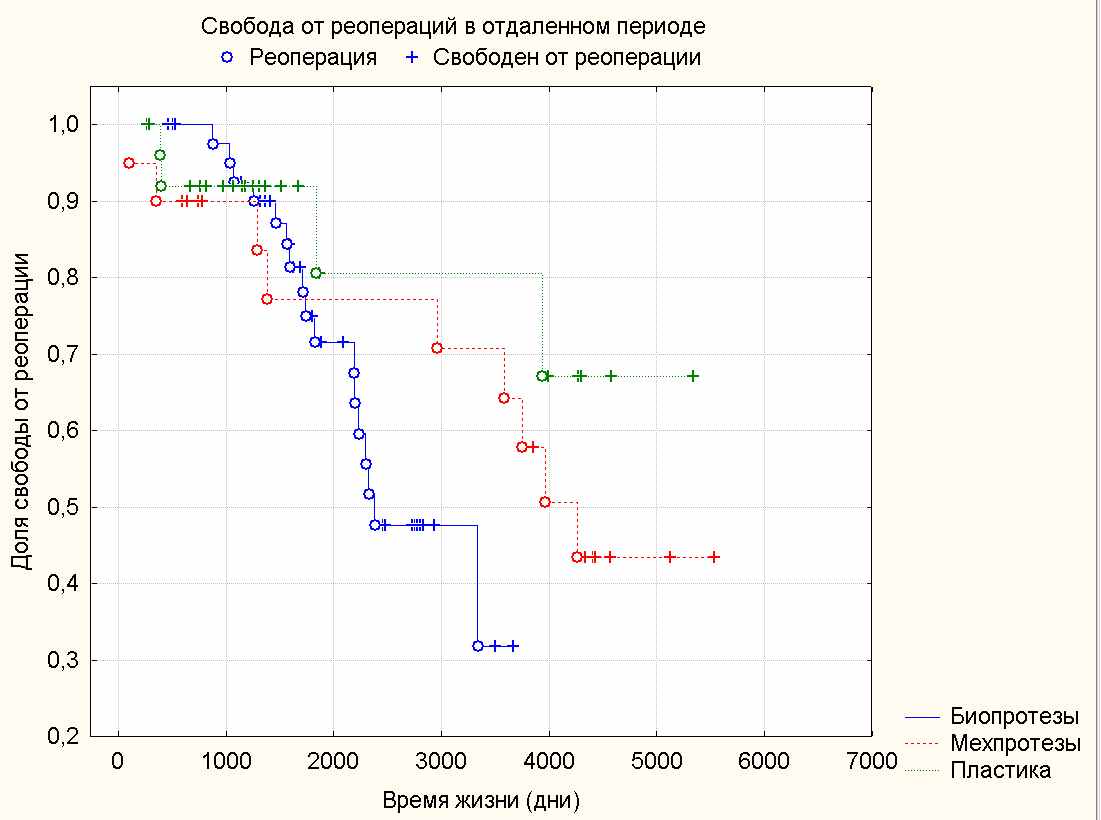
Диаграмма 6. Свобода от повторных оперативных вмешательств в отдаленном периоде в исследуемых группах.
Выбор типа протеза должен быть сделан пациентом на основе полной информации, которую пациенту обязан предоставить хирург. Ключевое значение при выборе имеет возможность обеспечения постоянной пожизненной адекватной антикоагулянтной терапии.
Механический протез может быть рекомендован пациенту в следующих случаях:
- Есть возможность обеспечения постоянной пожизненной адекватной антикоагулянтной терапии;
- Пациент уже принимает антикоагулянты, когда имеются факторы риска тромботических осложнений или механический клапан уже имплантирован в другую позицию;
- Высокий риск ускоренной структурной дегенерации створок: возраст моложе 40 лет (интенсивность кальциевого обмена, особенно актуально у детей раннего возраста), гиперпаратиреоз, почечная недостаточность;
- Повторное хирургическое вмешательство по поводу быстропрогрессирующей структурной дегенерации створок ранее имплантированного биопротеза, а также при повторной замене биопротеза.
Биопротез должен быть рекомендован при:
- Невозможности обеспечения постоянной пожизненной адекватной антикоагулянтной терапии (медицинские противопоказания, социальный статус пациента, проживание в отдаленных районах);
- Невозможность подбора адекватной дозы антикоагулянтов;
- Прогноз ситуаций риска кровотечения в будущем (сопутствующая патология, потребующая хирургического лечения; планируемая беременность);
- При повторных операциях по замене тромбированного механического протеза у пациентов с трудностями обеспечения эффективной антикоагулянтной терапии;
- Сниженный риск кальциевой дегенерации створок (возраст старше 40 лет).
