Я україни міністерство освіти І науки, молоді та спорту україни сумський державний університет медичний інститут «актуальні питання теоретичної медицини»
| Вид материала | Документы |
- Я україни міністерство освіти І науки, молоді та спорту україни сумський державний, 3595.69kb.
- Міністерство освіти та науки україни міністерство охорони здоров’я україни сумський, 964.46kb.
- Міністерство освіти І науки україни сумський державний університет медичний інститут, 738.24kb.
- Міністерство освіти та науки україни міністерство охорони здоров’я україни сумський, 1028.21kb.
- Ерство освіти І науки україни міністерство охорони здоров’я україни сумський державний, 950.39kb.
- Міністерство освіти та науки україни міністерство охорони здоров`я україни сумський, 1131kb.
- Конспект лекцій Суми Сумський державний університет 2011 Міністерство освіти І науки,, 1592.04kb.
- Міністерство освіти І науки україни міністерство охорони здоров’я україни сумський, 784.64kb.
- Міністерство освіти І науки україни міністерство охорони здоров’я україни сумський, 1042.47kb.
- Міністерство освіти І науки, молоді та спорту України Міністерство охорони здоров’я, 5570.5kb.
Новий матеріал для остеопластики: доклінічні випробування
Погорєлов М.В., Дейнека В.М., студ. 2-го курсу, Бончев С.Д., лікар-інтерн
СумДУ, кафедра анатомії людини
Вибір та оцінювання якості будь-якого матеріалу або виробу, який призначений для використовування у людей вимагає структурованої програми аналізу. У процесі планування треба прийняти і задокументувати рішення, в якому реально порівнюють і оцінюють переваги або недоліки вибору різних матеріалів і методів випробування. Для того, щоб гарантувати відповідність кінцевого продукту призначенню і під час використовування буде безпечним для людей, програма повинна охоплювати біологічне оцінювання.
Біологічне оцінювання повинен планувати, виконувати і задокументовувати знавець і досвідчений спеціаліст, здатний прийняти рішення, що ґрунтується на перевагах і недоліках різноманітних матеріалів і доступних методиках проведення дослідження. Під час вибирання матеріалів, що їх будуть використовувати в процесі виробництва виробу, увагу, перш за все, треба приділяти відповідності матеріалу меті з якою його планують використовувати, з урахуванням його характеристик і властивостей, що охоплюють хімічні, токсикологічні, фізичні, електричні, морфологічні та механічні властивості.
Для вирішення питання про надання дозволу для використання медичного виробу в клінічній практиці неодхідно пройти його сертифікацію, яка включає в себе характеризацію виробу (фізико-хімічні властивості), дослідження in-vivo та клінічні випробування.
В результаті сумісних досліджень нашого університету та ІПФ НАН України був синтезований новий нанокомпозтний матеріал для заміщення кісткових дефектів на основі апатиту кальцію та хітозану (хітозан-апатит). Зважаючи на необхідність сертифікації матеріалу були вивчені його фізико-хімічні характеристики за допомогою рентгенівської дифракції, інфрачервоної спектроскопії, растрової електронної мікроскопії, масспектрометрії. Результати досліджень були опубліковані як в Україні так і за кордоном.
Зважаючи на необхідність проведення досліджень in-vivo, метою даної роботи стало вивчення реакції організму на підшкірну імплантацію матеріалу згідно з ДСТУ ISO 10993-1:2004 "Біологічне оцінювання медичних виробів ".
В результаті дослідження були отримані данні про нетоксичність хітозан-апатиту, задовільні біосумісні та остеокондуктивні властивості, що стане підгрунтям для подальшого його дослідження з метою отримання дозволу для клінічного застосування.
ВИЗНАЧЕННЯ ЗАЛЕЖНОСТІ СТРУКТУРНИХ ЗМІН ЕРИТРОЦИТІВ ВІД ВІКУ ТВАРИН ТА ТЕРМІНУ ВЖИВАННЯ СОЛЕЙ ВАЖКИХ МЕТАЛІВ
Приходько О.О.
Науковий керівник – проф. В.З. Сікора
СумДУ, кафедра анатомії людини
Метою даної роботи є встановлення залежності структурних змін еритроцитів від віку тварин та терміну вживання солей важких металів у щурів молодого, зрілого та старечого віку в умовах техногенного мікроелементозу організму з використанням критеріїв
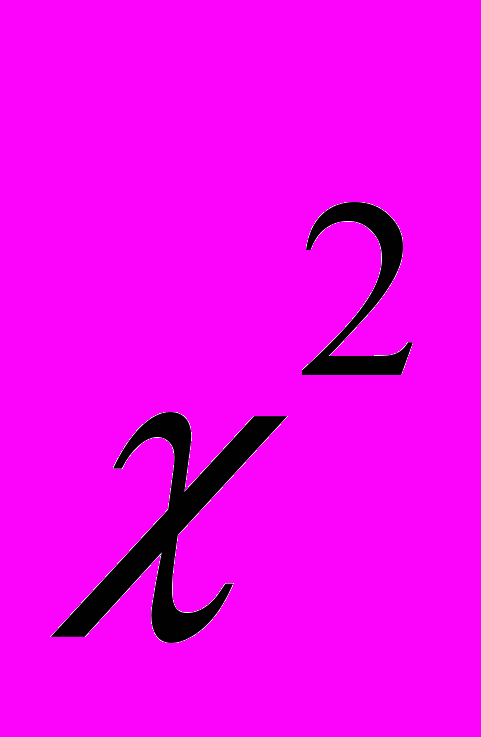 -Пірсона та
-Пірсона та 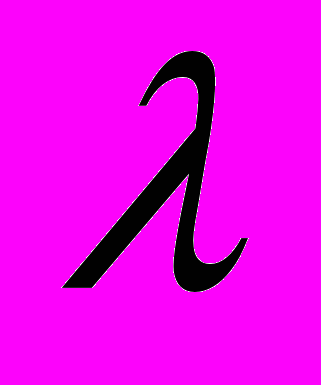 -Колмогорова – Смірнова.
-Колмогорова – Смірнова.Аналіз морфологічних форм еритроцитів був проведений на 120-ти безпорідниих щурах-самцях 3-х, 6-ти та 20-и місячного віку, які були поділені на контрольну та експериментальну серії по 60 тварин у кожній. Щурам експериментальної серії в питну воду додавали комбінацію солей Zn, Cu, Fe, Mn, РЬ протягом одного та двох місяців.
Для комп’ютерного морфометричного аналізу еритроцитів використовували електронограми, отримані на збільшенні у 2000 разів при дослідженні за допомогою растрового електронного мікроскопу. Морфометрію здійснювали за допомогою системи комп'ютерного аналізу зображення “ Видео Тест 5,0” та “ Видео Размер 5,0”. До складу вимірюваних параметрів входили: периметр, середній діаметр еритроцитів. Підрахунок морфологічних форм усіх еритроцитів проводили по мікросвітлинах, зроблених на растровому електронному мікроскопі з камерою низького вакууму « РЭМ 106 - И». На отриманих при збільшенні в 2000 разів електронограмах оцінювали загальну структуру морфологічних форм еритроцитів та виділяли їх типи за Козинец Г.І. та співавт., 2004. Співвідношення різних морфологічних типів еритроцитів вивчали із 1000 клітин кожного щура. Порівняльний аналіз експериментальних значень показників для різних вікових груп і в різні періоди часу базуються на критеріях
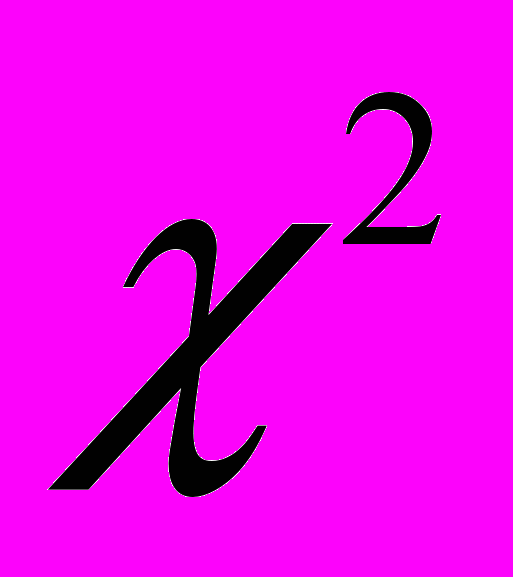 -Пірсона та
-Пірсона та 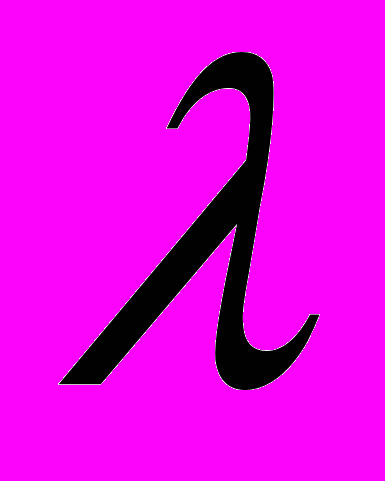 -Колмогорова–Смірнова. Розрахунки проводились із використанням програми “Differences”, реалізованої на мові С. Відмітимо, що при статистичному аналізі даних за критерієм
-Колмогорова–Смірнова. Розрахунки проводились із використанням програми “Differences”, реалізованої на мові С. Відмітимо, що при статистичному аналізі даних за критерієм 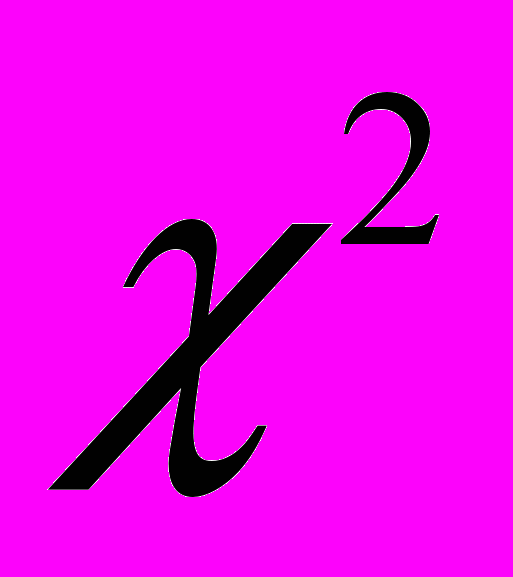 -Пірсона порівнюються не абсолютні значення отриманих результатів, а їх зміни відносно контролю, значення якого відрізняється у різних вікових групах.
-Пірсона порівнюються не абсолютні значення отриманих результатів, а їх зміни відносно контролю, значення якого відрізняється у різних вікових групах. Аналіз показників крові і експериментальних щурів за критеріями
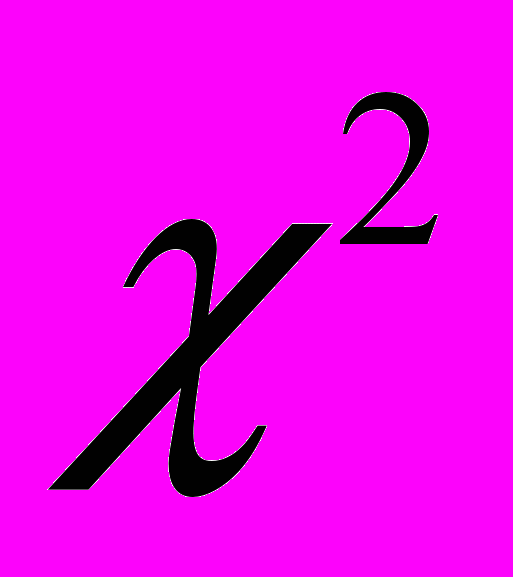 -Пірсона і
-Пірсона і 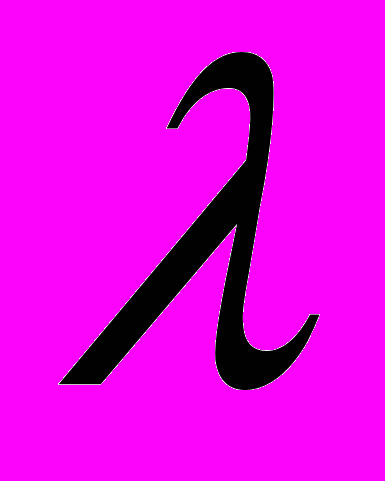 -Колмогорова–Смірнова доводить, що кількість і розміри дискоцитів не залежать від віку тварин та терміну вживання ними мультикомпонентної суміші солей важких металів. Зворотньодеформовані змінюються більше при двохмісячному вживанні солей, незалежно від віку тварин. Показник відсотку незворотньодеформованих еритроцитів та індекс трансформації еритроцитів визначається в залежністі від віку щурів.
-Колмогорова–Смірнова доводить, що кількість і розміри дискоцитів не залежать від віку тварин та терміну вживання ними мультикомпонентної суміші солей важких металів. Зворотньодеформовані змінюються більше при двохмісячному вживанні солей, незалежно від віку тварин. Показник відсотку незворотньодеформованих еритроцитів та індекс трансформації еритроцитів визначається в залежністі від віку щурів.Використання критеріїв
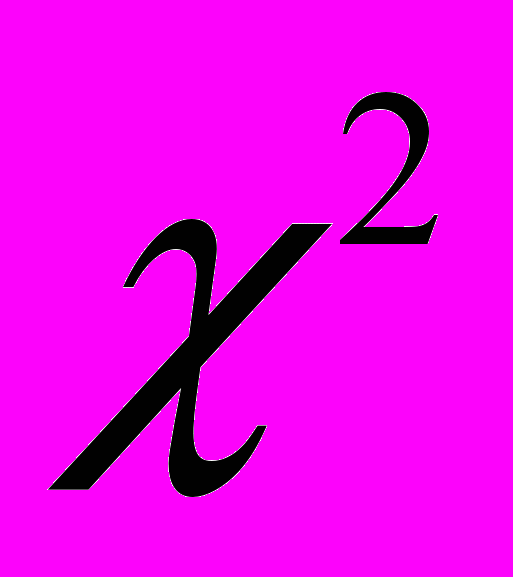 - Пірсона і
- Пірсона і 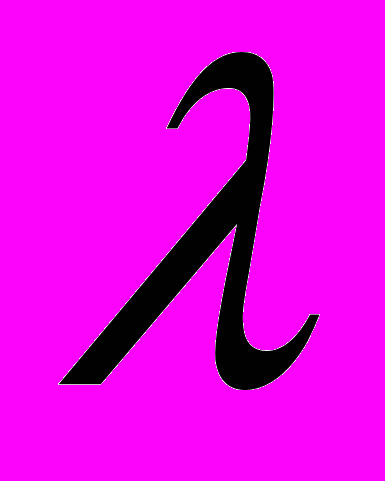 -Колмогорова – Смірнова дозволяє точно визначити залежність показників з урахуванням віку тварин та терміну вживання солей важких металів.
-Колмогорова – Смірнова дозволяє точно визначити залежність показників з урахуванням віку тварин та терміну вживання солей важких металів.Чи є альтернатива тваринних моделей в медико-біологічних дослідженнях?
Сікора В.З., Погорєлов М.В.
СумДУ, кафедра анатомії людини
Лабораторні тварини використовувались в біології та медицині протягом всієї історії наукових досліджень. Проте з середини ХХ сторіччя почали з’являтись заклики до зменшення використання експериментальних тварин. Так у 1959 р. R.L. Burch та W.M.S. Russell сформулювали «правило трьох R» - “Refinement, Reduction, and Replacement”, що лягло в основу всіх міжнародних та національних законів та правил роботи з лабораторними тваринами, які спрямовані на зменшення їх кількості в експерименті, полегшення страждань та, за можливості, використовувати альтернативні методи. Проте, чи можна зовсім відмовитись від використання лабораторних тварин в умовах сьогодення? Деякі науковці, а особливо захисники тварин, дають ствердну відповідь на дане питання, в якості аргумента приводячи можливість використання клітинних культур (in vitro) та комп’ютерних моделей (in silico) в якості замінника «лабораторного щура».
В 1885 р. Вільгельм Ру встановив принцип культивування клітин, але широке використання дана методика отримала тільки в середині ХХ століття для вирощування чистих культур вірусів. На теперішній час культури клітин використовують для вирішення загальнобіологічних проблем, таких як вивчення процесів диференціювання та проліферації, взаємодії клітин з середовищем, адаптації, старіння, карценогенезу тощо. Також їх використання дозволяє діагностувати та лікувати спадкові хвороби. Однією з основних галузей застосування культур клітин – це використання їх в якості тест-об’єктів при досліджені нових фармакологічних субстанцій. Таким чином, метод культивування клітин є невід’ємною складовою генної інженерії, молекулярної біології, клонування та багатьох інших направлень експериментальної біології та медицини. Простота використання (за наявності обладнаної лабораторії та кваліфікованого персоналу) та висока відтворюваність методу дозволяють стверджувати про повну відповідність досліджень в культурі клітин загальноприйнятим методам експерименту з тваринами. Але, нажаль, культури клітин не можуть повністю відтворити біологічні процеси через ряд обмежень.
По-перше, в культурі клітин не можливо змоделювати безліч фізіологічних та патологічних станів, таких як запалення, тканинна регенерація тощо, в яких беруть участь кілька гетерогенних за походженням та функцією клітин. По-друге, в даних умовах неможливо вивчати систему органів, де в якості об’єкта виступають різні тканини. Це основні з обмежень, які обумовлені тим, що клітина, як частина тканини чи органа, знаходиться під впливом міжклітинних, гуморальних та нервових чинників, що не можуть бути змодельовані «в пробірці». В даному випадку культура клітин може слугувати в якості «скринінг-об’єкта» для отримання попередніх висновків з подальшим проведенням експерименту на тваринній моделі. В літературі описані випадки виявлення побічної дії ліків в наступному поколінні через відсутність дослідження тератогенного ефекту на тваринах. Не зважаючи на це, культура клітин дозволяє істотно зменшити об’єм досліджень на тваринах та скоротити час експерименту. При вивченні лікарських препаратів даний метод дозволяє виявити побічні ефекти або неефективність засобу на ранніх етапах дослідження, що окрім часу, значно зменшує витрати на дослідження. Культура клітин є незамінною в медико-генетичних дослідженнях, мікробіології, вірусології тощо.
Але використання тільки культури клітин на даному етапі неможливо через вищезазначені обмеження, які в наш час неможливо побороти. Навіть міжнародні протоколи по вивченню лікарських засобів та матеріалів медичного призначення вказують даний метод тільки для дослідження деяких показників, таких як цитотоксичність та біосумісність (ISO 10993-1:2004) з обов’язковим проведенням експерименту з тваринами. Аналіз деяких закордонних часописів з високим імпакт-фактором (Bone, Jornal of biomaterial research, Biomaterials тощо) показав зменшення кількості публікацій з використанням культури клітин як єдиного методу вивчення реакції біологічного середовища. Але дане зменшення супроводжується значним зростанням публікацій в яких поєднуються методи дослідження в культурі клітин та з використанням тваринних моделей, що дозволило збільшити ефективність проведення експерименту та отримати більш комплексні висновки.
Таким чином, методики дослідження в культурі клітин та з використанням тваринних моделей не є конкурентами. На даному етапі розвитку науки ці методи доповнюють один одного та дозволяють отримати більш достовірні дані з урахуванням міжнародних етичних принципів роботи з тваринами.
ОСТЕОМЕТРИЧНІ ПОКАЗНИКИ ТРАВМОВАНОЇ КІСТКИ В УМОВАХ
ПОРУШЕНЬ ВОДНО-СОЛЬОВОГО ОБМІНУ
Слісаренко О.В.
Науковий керівник – доц. В.І. Бумейстер
СумДУ, кафедра анатомії людини
Переломи кісток гомілки належать до самих поширених пошкоджень опорно-рухової системи і складають від 8,5% до 36,6% всіх переломів. Експертна оцінка діафізарних переломів довгих кісток свідчить, що в загальній структурі інвалідизації по наслідкам травм, пошкодження діафізів довгих кісток складають від 18% до 28%, займаючи провідне місце серед осіб молодого та середнього віку з високою трудовою активністю. У зв’язку з цим, дана проблема набуває важливого і соціально-економічного значення
З метою вивчення вікових особливостей морфологічної перебудови репаративного остеогенезу під впливом клітинного зневоднення організму проведено експериментальне дослідження остеометричних показників травмованої великогомілкової кістки білих лабораторних щурів-самців молодого віку. Відповідно до експериментальної моделі тварини були розподілені на дві групи: контрольна та група, в якій моделювалося клітинне зневоднення.
Клітинне зневоднення організму тварин було досягнуте шляхом пиття 1,5% розчину NaCl протягом 10 днів (легкий ступінь), 20 днів (середній ступінь) та 30 днів (важкий ступінь). По досягненню відповідного ступеня зневоднення тваринам обох груп був нанесений дірчастий дефект обох великогомілкових кісток стоматологічним бором діаметром 2 мм на межі проксимальної та центральної третин медіальної поверхні діафіза. Дослідження остеометричних показників проводилося на 24 добу від моменту нанесення травми.
Остеометричне дослідження великогомілкових кісток щурів проводилося за певними показниками, щоб виявити загальні зміни росту та формоутворення травмованих кісток. При легкому ступені зневоднення остеометричні показники експериментальної групи на відміну від контрольної групи характеризуються зменшенням довжини кістки на 8,74% і збільшенням передньо-заднього розміру діафізу на 3,02%, а ширини діафізу – на 5,53%. Ширина проксимального та дистального епіфізів нижча за контрольні показники на 4,27% і 4,04%, відповідно.
Таким чином, при клітинній дегідратації оранізму відбувається зменшення остеометричних показників травмованої великогомілкової кістки.
Життєві кредо Миколи Сергійовича Скрипнікова
(до 75-річчя з дня народження)
Устянський О.О.
СумДУ, кафедра анатомії людини
Навесні цього року медична громадськість, стоматологи та морфологи України відзначатимуть ювілей доктора медичних наук, заслуженого діяча науки і техніки України професора Миколи Сергійовича Скрипнікова. Він народився 19 травня 1936 року в м. Макіївка Донецької області в сім`ї металурга. В 1963 році з відзнакою закінчив Харківський медичний стоматологічний інститут. В 1966 році – аспірантуру при кафедрі топографічної анатомії та оперативної хірургії у професора Золотарьової Т.В. В цьому ж році захистив кандидатську дисертацію. В 1967 році вуз переїздить до м. Полтави, і вся трудова, наукова та громадська діяльність Миколи Сергійовича пов`язана з Полтавським медичним стоматологічним інститутом (з 1994 року – Українська медична стоматологічна академія) та з м. Полтавою.
З 1978 по 2003 рік завідує кафедрою топографічної анатомії та оперативної хірургії. З 1987 по 2003 рік – ректор ВНЗ.
Він володів надзвичайною здатністю згуртовувати навколо себе людей, створюючи атмосферу творчості, доброзичливості і взаєморозуміння. Завдяки винятковій працелюбності, унікальним здібностям та творчій ініціативі він зробив значний внесок у медичну науку та удосконалення вищої медичної освіти в Україні. Під його керівництвом виконано та захищено 20 докторський та більше 50 кандидатських дисертацій.
Він був членом Президії вченої медичної ради МОЗ України, головою проблемної комісії МОЗ України та Президії АМН України "Морфологія людини", експертом ВАК України, віце-президентом і членом координаційної Ради асоціації стоматологів України, членом Президії морфологів України, академіком шести Міжнародних академій. Його внесок у підготовку майбутніх лікарів, розробку нових методів дослідження, підготовку наукових кадрів та активну громадську роботу високо оцінений. Ще в радянські часи він нагороджений медалями "За доблестный труд" та "За трудовую доблесть". В часи незалежності України – орденами "За заслуги" І та ІІІ ступеня. У 2003 році Миколі Сергійовичу присуджена нагорода "Свята Софія" національної іміджевої програми "Лідери ХХІ століття", Українська православна церква відзначила Миколу Сергійовича орденом Святого князя Володимира та орденом Святого Миколи Чудотворця "За примноження добра на землі". Земляки-полтавці удостоїли звання "Почесний громадянин м. Полтави".
Доля подарувала автору цих рядків 17 років тісного спілкування та сумісної праці з Миколою Сергійовичем. Своїм друзям та колегам по роботі він завжди рекомендував:
1. Не розпорошуй свою увагу та енергію на поточні дрібниці. З усіх справ зумій обрати ключову. Концентруйся на ній, чітко визначай пріоритетні напрямки.
2. До будь-якої справи підходь творчо, відшукай перш за все позитивні сторони.
3. Уміло підбери собі помічників, визнач їм конкретні завдання.
4. Контролюй роботу підлеглих, але не будь над ними наглядачем.
5. Після завершення справи зумій подякувати кожного, хто з тобою співпрацював.
Цих принципів він дотримувався на протязі всього життя. На жаль, в квітні минулого 2010 року Микола Сергійович пішов у вічність.
Випадок відсутності третього відділу пахвової артерії та плечової артерії
Устянський О.О., Дейнека В.М., студ. 2-го курсу; Білокур Д.О., Харін В.В., студ. 1-го курсу
СумДУ, кафедра анатомії людини
На лівій верхній кінцівці фізичного тіла чоловічої статі нами виявлено рідкісний варіант артеріальних судин. Пахвова артерія довжиною 6 см (вимірювання провели від рівня нижнього краю підключичного м`яза) діаметром 8 мм, являючись безпосереднім продовженням підключичної артерії, на рівні нижнього краю малого грудного м`язу розгалужувалась на дві прикінцеві гілки: променеву артерію та ліктьову артерію. В першому відділі (ключично-грудний трикутник) пахвова артерія гілок не віддавала. У другому відділі (грудний трикутник) від стовбура пахвової артерії дещо вище її біфуркації відходили три достатньо крупні гілки: 1) надлопаткова артерія; 2) грудонадплечова артерія;3) підлопаткова артерія. Їх діаметр досягав 5 мм. Третій відділ пахвової артерії відсутній, тому що остання на рівні нижнього краю малого грудного м’язу під кутом 300 розгалужувалася під кутом. Бічна гілка, променева артерія, діаметром 3 мм, по присередній поверхні дзьобоплечового м`язу, а потім по присередній поверхні двоголового м`яза плеча прямувала донизу. На передпліччя виходила під апоневрозом двоголового м`яза плеча, залягаючи поверхнево безпосередньо під шкірою. На відстані 1,8 см від свого початку віддавала бічну грудну артерію діаметром 2,5 мм. Від її стовбура до двоголового м`яза плеча відходили 6 дрібних гілочок.
Ліктьова артерія, діаметром 5 мм на своєму початковому відділі по присередній поверхні дзьобоплечового м`яза прямувала в присередню борозну плеча, де залягала на передній поверхні присередньої головки триголового м`яза. На відстані 2 мм від її стовбура відходила передня огинальна артерія плеча діаметром 2,5 мм.
Подальший хід та гілки цієї артерії відповідали плечовій артерії. На передпліччі хід та розгалуження артерій відбувались за класичним принципом.
УЛЬТРАСТРУКТУРНА ОРГАНІЗАЦІЯ ЕНДОТЕЛІАЛЬНИХ КЛІТИН СИНУСОЇДНИХ КАПІЛЯРІВ ТА ЗІРЧАТИХ МАКРОФАГОЦИТІВ ПЕЧІНКИ ЩУРІВ ЗРІЛОГО ВІКУ НА ТЛІ СУБЛЕТАЛЬНОЇ ГІПЕРГІДРІЇ
Шутка Н.А., студ. 1-го курсу, Болотна М.А., лікар-інтерн
Науковий керівник – ст. викл. І.В. Болотна
СумДУ, кафедра анатомії людини
В останні роки різко зросла кількість хворих з патологією серцево-судинної, сечової та ендокриної систем, які супроводжуються затримкою води в організмі і викликають гіпергідрію. В таких умовах дуже важливим є дослідження структурних змін печінки як центрального органа знешкодження токсичних сполук, регуляції та інтеграції міжорганного обміну речовин. Наявність у печінці різних метаболічних зв'язків, характерних для синтезу та розпаду багатьох біологічно активних речовин, участь у компенсаторно-пристосувальних процесах обумовлює необхідність вивчення її в умовах гіпергідратаційних порушень водно-сольового обміну організму. У сучасній літературі майже відсутні відомості про реакцію печінки на гіпергідратаційні порушення водно-сольового обміну організму, які можуть бути спричинені дією різноманітних чинників навколишнього середовища в несприятливих екологічних умовах сьогодення. Важливим є дослідження ультраструктури не тільки гепатоцитів, а й ендотеліоцитів та зірчатих макрофагоцитів печінки. Нами проведено дослідження морфофункціональних змін в цих клітинах не тільки залежно від ступеня гіпергідрії, а ще й у віковому аспекті. Так, групу експериментальних тварин склали 8-місячні щурі масою 150-180 г.
При ультраструктурному дослідженні ендотеліальні клітини синусоїдних капілярів мають просвітлену цитоплазму з невеликою кількістю органел. Спостерігається набряк цитоплазми ендотеліоцитів. Зменшена кількість вільно розташованих в цитоплазмі рибосом і полісом. З'являються вторинні лізосоми. У цитоплазмі відростків ендотеліоцитів зменшена кількість мікропіноцитозних пухирців. Ядра ендотеліоцитів мають неправильну форму, матрикс їх низької електронної щільності та містять переважно конденсований хроматин, гранули якого розташовані в центральній ділянці ядра. Ядерна мембрана значно розпушена, а перинуклеарні простори нерівномірно розширені. Мітохондрій мало, вони мають заокруглену форму і грубоволокнистий матрикс. Зустрічаються набухлі мітохондрії з поодинокими кристами. Зовнішні мембрани і кристи в деяких мітохондріях підлягають лізису. Гранулярна ендоплазматична сітка розвинута слабо і представлена окремо розташованими в цитоплазмі вакуолями. Кількість зв'язаних з його мембранами рибосом знижена порівняно зі зрілими інтактними щурами. Спостерігається редукція пластинчастого цитоплазматичного комплексу Гольджі. У цитоплазмі деяких ендотеліоцитів виявлені вторинні лізосоми. Цитоплазматична мембрана з боку просвіту капіляра вогнищево лізована, втрачає чітко контуровану структуру. У просвіті капіляра досить часто спостерігається детрит осмієфільного матеріалу і дегенеративно змінені фрагменти мембран і органел.
При дослідженні ультраструктури зірчастих макрофагоцитів помічений їх поліморфізм. Деякі клітини містять добре розвинений гранулярний ендоплазматичний ретикулум, велику кількість рибосом, мітохондрій з контурованими кристами, а також дещо гіпертрофований комплекс Гольджі. Цитоплазма таких клітин має і велику кількість полісом, скупчення аутофагосом і ліпідних включень. Але поряд розташовані клітини Купфера, що мають дистрофічно і деструктивно змінені органели. Їх мітохондрії набухлі, мають грубоволокнистий матрикс, помічений лізис крист і зовнішніх мембран. Спостерігаються розпушені і місцями зруйновані мембрани гранулярного ендоплазматичного ретикулуму. У цитоплазмі виявлені вторинні лізосоми і фагоцитований матеріал. Ультраструктурна організація ядра і цитоплазматичної мембрани відповідає таким в інтактних щурів.
Таким чином, надмірне надходження води в організм зрілих щурів, що відповідає гіпергідрії важкого ступеня, спричиняє зрив внутрішньоклітинних компенсаторних механізмів і призводить до розвитку деструктивних процесів у клітинах, що підлягали дослідженню. Але поряд з тим спостерігається посилення захисно-компенсаторних реакцій організму тварин у відповідь на подразнення паренхіми печінки гіпергідрією організму.
