Хімія є однією з основних природознавчих наук, що розвивається останнім часом дуже швидко
| Вид материала | Документы |
- Програми для профільного навчання в загальноосвітніх навчальних закладах Рекомендовано, 103.17kb.
- Останнім часом у літературознавстві з’явилося багато нових підходів до аналізу літературного, 126.23kb.
- 12 штучний інтелект. Експертні системи, 633.04kb.
- Енергозбереження в нашій країні останнім часом набуває все більшої актуальності, 66.58kb.
- Голоду не нова в історії світового письменства, оскільки йдеться, 136.43kb.
- «Про особисте селянське гос подарство», 924.69kb.
- Розпорядження, 26.48kb.
- Матеріал для виступу на педагогічній раді, 57.83kb.
- Єчимало класифікацій природних ресурсів, 682.02kb.
- Робоча програма навчальної дисципліни екоаналітична хімія напряму підготовки 040101, 154.06kb.
ПРАКТИЧНА РОБОТА № ОХ-5
ВЛАСТИВОСТІ СПИРТІВ
ДОСЛІД 1. Властивості одноатомних спиртів
Реактиви: металічний натрій, етанол, ізопентанол, ізопропанол, трет-бутанол, фенолфталеїн, ортоборатна кислота, оцтова кислота, концентрована сульфатна кислота, калій перманганат і калій дихромат кристалічні, 1% розчин калій перманганату, реактив Лукаса (розчин 10 г цинк хлориду безводного в 10 мл концентрованої хлоридної кислоти).
Обладнання: штатив з лапкою, пробірки, пінцет, штатив для пробірок, вигнута газовідвідна трубка з пробкою, кип'ятильні камінці, піпетки, нагрівний прилад, тримач для пробірок, водяна баня.
а) Утворення натрій алкоголяту та його гідроліз
1. У пробірку з етанолом занурте шматочок металічного натрію розміром з головку сірника.
● Що спостерігаєте? Чому? Який газ виділяється? Як його можна зібрати і довести, що це саме він? Чому?
2. Після повного розчинення натрію додайте у пробірку 1–2 мл води і випробуйте фенолфталеїном реакцію отриманого розчину.
● Що спостерігаєте? Чому?
■ Напишіть рівняння реакцій, що відбувалися.
б) Міжмолекулярна дегідратація спиртів
1. До 3 мл етанолу долийте 1 мл концентрованої сульфатної кислоти. Пробірку закрийте пробкою з газовідвідною трубкою. Суміш нагрійте на водяній бані до кипіння.
● Що спостерігаєте? Чому? Який запах має продукт реакції?
2. Підпаліть пару речовини, що виділяється.
● Що можна сказати про характер полум'я?
■ Напишіть рівняння реакцій, що відбувалися.
в) Взаємодія спиртів з кислотами
1. Помістіть в пробірку 2 мл концентрованої оцтової кислоти і 2 мл ізо-пентанолу. Додайте 1 мл концентрованої сульфатної кислоти і нагрійте на водяній бані протягом 1–2 хвилин. Охолодіть вміст пробірки і перелийте його в стакан з холодною водою.
● Що спостерігаєте? Чому? Який запах має продукт реакції?
2. Розплавте в пробірці 1,5–2,0 г ортоборатної кислоти. Остудіть пробірку на повітрі до затвердіння плаву, додайте 3–4 мл етанолу, 2 мл концентрованої сульфатної кислоти і внесіть кип'ятильний камінчик. Закрийте пробірку пробкою з газовідвідною трубкою і нагрійте суміш. Біля виходу газовідвідної трубки підпаліть естер боратної кислоти, що виділяється.
● Що спостерігаєте? Чому?
■ Напишіть рівняння реакцій, що відбувалися.
г) Окиснення спиртів
1. Змішайте в пробірці 0,5 мл етанолу з 0,5 мл розчину калій перманганату і нагрійте суміш.
● Що спостерігаєте? Чому?
2. У пробірку помістіть 0,5 мл концентрованої сульфатної кислоти і близько 1 г подрібненого калій дихромату. Суміш перемішайте, додайте 2 мл води і 0,5 мл 3-метилбутан-1-олу (ізопентанолу), обережно нагрійте.
● Що спостерігаєте? Чому?
3. Піпеткою акуратно, не змочуючи стінок, внесіть у суху пробірку, закріплену в штативі, 2 мл етилового спирту. Потім по стінці іншою піпеткою обережно долийте 2 мл концентрованої сульфатної кислоти так, щоб вийшло два шари. Після цього насипте 0,1–0,2 г кристалічного калій перманганату.
● Що спостерігаєте? Чому?
■ Напишіть рівняння реакцій, що відбувалися.
д) Взаємодія спиртів з реактивом Лукаса
У три пробірки налийте по 0,5 мл реактиву Лукаса і додайте по 3–4 краплі спиртів: етилового, ізопропілового, трет-бутилового. Енергійно струсніть і залиште у склянці з водою при 30оС на 1–2 хвилини. Що спостерігаєте? Чому?
■ Напишіть рівняння проведених реакцій.
► Зробіть висновок щодо реакційної здатності одноатомних спиртів відповідно до їх будови.
ДОСЛІД 2. Властивості поліатомних спиртів
Реактиви: гліцерол, розчин купрум(ІІ) сульфату (2 %), розчин натрій гідроксиду (10 %), калій гідросульфіт кристалічний.
Обладнання: штатив пластмасовий, пробірки, тримач для пробірок, нагрівний прилад.
а) Взаємодія з купрум(ІІ) гідроксидом
Налийте у пробірку 0,5 мл розчину купрум(ІІ) сульфату і 1 мл розчину натрій гідроксиду. До осаду, що утвориться, додайте декілька крапель гліцеролу і суміш енергійно збовтайте.
● Що спостерігаєте? Чому?
■ Напишіть рівняння реакцій, що відбувалися.
б) Утворення акролеїну з гліцеролу
У суху пробірку помістіть кілька кристалів калій гідросульфіту безводного і 2–3 краплі гліцеролу. Вміст пробірки нагрійте в полум'ї пальника.
● Що спостерігаєте? Чому?
■ Напишіть рівняння реакцій, що відбувалися.
► Зробіть висновок щодо реакційної здатності поліатомних спиртів відповідно до їх будови в порівнянні з одноатомними.
СЕМІНАРСЬКЕ ЗАНЯТТЯ № ОХ–5
ВЛАСТИВОСТІ СПИРТІВ
Контрольні питання
- Що таке функціональна група? Як наявність спиртової функціональної групи відображається в назві речовини?
- Які типи номенклатури хімічних сполук застосовні до спиртів? Поясніть їх основні принципи, назвіть за їх допомогою наступні речовини:
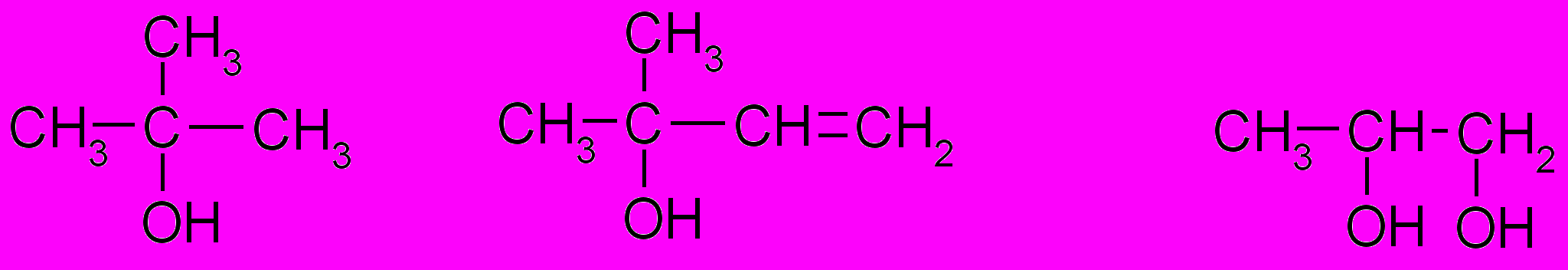
- Опишіть електронну будову гідроксильної групи, поясніть її вплив на фізичні властивості спиртів.
- Які види ізомерії характерні для спиртів? Напишіть можливі ізомери речовини С5Н12О, назвіть їх за міжнародною номенклатурою.
- Дайте поняття кислоти й основи за Бренстедом і за Льюїсом. Наведіть приклади. Що відрізняє ці два підходи до кислотно-основних взаємодій?
- Наведіть реакції, що підтверджують кислотний характер спиртів. Порівняйте кислотність наступних спиртів, розташуйте їх у ряд за збільшенням кислотності: а) метанол; б) етанол; в) н-бутанол; г) трет-бутанол; д) ізопропанол; е) 2,2,2-трифторетанол. Порівняйте основність за Льюїсом наведених спиртів.
- Напишіть рівняння реакцій наступних спиртів з хлороводнем: а) етанол; б) ізопропанол; в) трет-бутанол. У якому випадку реакція буде йти найшвидше, а в якому ― повільніше, чому? Від яких факторів залежить швидкість реакції заміщення? Що таке проба Лукаса, для чого вона використовується?
- Які властивості ― кислотні або основні ― виявляють спирти при взаємодії з галогеноводневими кислотами? Відповідь поясніть. Відповідно яким граничним механізмам може перебігати ця реакція залежно від будови спирту та інших умов реакції?
- *На оптично чистий (S)-(+)-бутан-2-ол послідовно подіяли розчином цинк хлориду і потім водним розчином лугу. Передбачте, чи буде утворений продукт проявляти оптичну активність? Чи буде він оптично чистим?
- *Експериментально доведено, що (R)-(-)-бутан-2-ол під час стояння в водному розчині кислоти втрачає оптичну активність. Поясніть цей факт.
- Як ставляться первинні, вторинні і третинні спирти до дії окисників (наприклад, KMnО4 у кислому середовищі)? Які продукти при цьому утворюються?
- Що таке реакція дегідратації, в яких умовах вона проходить? Які види дегідратації спиртів Вам відомі, від яких факторів залежить будова продукту?
- Які вуглеводні утворяться при внутрішньомолекулярній дегідратації наступних спиртів: а) 2-метил-бутан-1-ол; б) 2-метил-бутан-2-ол; в) 2,3-диметилбутан-2,3-діол; г) пентан-2-ол? Напишіть рівняння відповідних реакцій, назвіть продукти.
- Що таке реакція естерифікації? Напишіть рівняння реакції естери-фікації оцтової кислоти з метанолом, етанолом, бутан-2-олом.
- Наведіть приклади багатоатомних спиртів. Які їхні відмінності від одноатомних? За допомогою яких реакцій можна розрізнити одно- і багатоатомні спирти?
- Чому одноатомні спирти на відміну від багатоатомних не взаємодіють з купрум(II) гідроксидом?
- Запропонуйте, за допомогою яких хімічних проб можна відрізнити наступні сполуки: а) циклогексанол і циклогексан; б) пропан-1-ол і пропен-2-ол-1 (аліловий спирт); в) пропан-1,2-діол і пропан-1,3-діол; г) трет-бутанол і ізобутанол; д) етанол і гліцерол; е)* пентан 2-ол і пентан-3-ол? Напишіть рівняння реакцій.
- *При дегідратації оптично активної сполуки С6Н14О утворилася речовина, озоноліз якої дає ацетон і пропаналь. Яку будову може мати С6Н14О?
- *Визначте будову сполуки А складу С8Н18О2, яка реагує з натрієм, виділяючи 1 моль водню на кожний моль сполуки А, а при окисненні утворює тільки метилетилкетон. Чи буде речовина А взаємодіяти з купрум(ІІ) гідроксидом? Напишіть рівняння згаданих реакцій.
- *Сполука А (С3Н6О) реагує з оцтовою кислотою з утворенням Б (С5Н8О2) та обезбарвлює бромну воду, утворюючи В (С3Н6ОBr2). Яку будову мають А, Б, В? Чи буде А взаємодіяти з HCl? За яким механізмом?
- Сигнали коливань яких груп Ви очікуєте в ІЧ спектрі етанолу? Інтенсивність якого сигналу буде істотно залежати від концентрації речовини? Чому?
- Який з спектральних фізико-хімічних методів (ІЧ, УФ, ЯМР чи мас-) можна використати для ідентифікації гексан-1-олу та діізопропілового етеру?
- Яким фізико-хімічним методом (ІЧ, УФ чи ЯМР) Ви скористуєтесь для того, щоб ідентифікувати пропан-1-ол і аліловий спирт?
- *Яку будову має речовина С4Н10О, в ЯМР 1Н спектрі якої є два синглети =1,1 м.д. та =4,2 м.д.? Яка їх відносна інтенсивність?
- *Сполука складу С4Н10О не взаємодіє з натрієм, в ЯМР 1Н спектрі має три сигнали з відношенням інтенсивностей 6:3:1. Яку будову вона має?
- *Визначте будову сполуки С3Н8О за такими даними: в ІЧ спектрі є широка смуга поглинання в інтервалі 3200–3500 см-1, в спектрі ЯМР 1Н ― три сигнали =1,2 м.д.(дублет), =1,6 м.д. (синглет) та =4,0 м.д. (мультиплет).
- Охарактеризуйте основні галузі застосування одноатомних та багатоатомних спиртів.
ПРАКТИЧНА РОБОТА № ОХ–6
