Хімія є однією з основних природознавчих наук, що розвивається останнім часом дуже швидко
| Вид материала | Документы |
- Програми для профільного навчання в загальноосвітніх навчальних закладах Рекомендовано, 103.17kb.
- Останнім часом у літературознавстві з’явилося багато нових підходів до аналізу літературного, 126.23kb.
- 12 штучний інтелект. Експертні системи, 633.04kb.
- Енергозбереження в нашій країні останнім часом набуває все більшої актуальності, 66.58kb.
- Голоду не нова в історії світового письменства, оскільки йдеться, 136.43kb.
- «Про особисте селянське гос подарство», 924.69kb.
- Розпорядження, 26.48kb.
- Матеріал для виступу на педагогічній раді, 57.83kb.
- Єчимало класифікацій природних ресурсів, 682.02kb.
- Робоча програма навчальної дисципліни екоаналітична хімія напряму підготовки 040101, 154.06kb.
СЕМІНАРСЬКЕ ЗАНЯТТЯ № ОХ–10
АРОМАТИЧНІ ВУГЛЕВОДНІ
Контрольні питання
- Що означає поняття «ароматичність» в сучасній органічній хімії?
- Порівняйте умови реакцій гідрування циклогексену і бензену. Який їхній тепловий ефект? Що таке енергія спряження?
- Сформулюйте правило Хюккеля. Які умови є необхідними для прояву ароматичності?
- Наведіть приклади небензоїдних ароматичних систем (5- та 7-членних, моно-, ди- та трицикличних). Дайте пояснення.
- Назвіть види ізомерії, характерні для ароматичних сполук. Скільки ізомерних ароматичних речовин відповідають молекулярній формулі С9Н12?
- Які типи номенклатури застосовні до ароматичних речовин? Напишіть формули аніліну, фенолу, стирену, пара-ксилену, кумену, толуену, бензойної кислоти.
- Перелічіть основні типи реакцій, характерні для ароматичних сполук.
- В яких умовах перебігає реакція нітрування бензену, опишіть її механізм. Поясніть каталітичну дію сульфатної кислоти.
- Порівняйте умови нітрування бензену, толуену та нітробензену. Чим вони обумовлені ?
- В яких умовах перебігає реакція галогенування бензену, який її механізм? Поясніть роль каталізатора при галогенуванні ароматичних вуглеводнів. Які речовини можна використовувати як каталізатор?
- На які групи можна умовно розділити замісники в ароматичному ядрі бензену за спрямованістю та швидкістю введення наступних замісників? Дайте пояснення.
- Чому хлорбензен нітрується значно повільніше, ніж толуен і навіть бензен, але в продуктах нітрування хлорбензену переважно знаходяться о- і п-нітрохлорбензени?
- Поясніть причину різного відношення бензену і толуену до калій перманганату. Які особливості реакцій окиснення гомологів бензену калій перманганатом?
- Які продукти утворюються при бромуванні етилбензену еквімолярною кількістю брома: а) на світлі без каталізатора; б) у присутності заліза?
- Які реакції можна віднести до якісних реакцій на толуен? Чому?
- Яким чином можна одержати з бензену: а) о- і п-нітротолуен; б) м-нітротолуен?
- Як розрізнити між собою наступні речовини: а) бензен і толуен; б) толуен і стирен?
- *Вуглеводні складу С8Н6 та С9Н8 є гомологами. Вони обезбарвлюють бромну воду, з реактивом Толленса дають осади, а при окисненні калій перманганатом утворюють бензойну кислоту. Напишіть структурні формули цих вуглеводнів, назвіть їх та наведіть рівняння описаних реакцій.
- *Визначте будову вуглеводню С9Н8, якщо він не реагує з амоніачним розчином аргентум оксиду, але знебарвлює бромну воду і при окисненні утворює бензойну кислоту. Напишіть рівняння відповідних реакцій.
- *Ароматичний вуглеводень С8Н10 при озонолізі утворює суміш гліоксалю (НОС–СОН), метилгліоксалю (СН3СО–СОН) та діацетилу (СН3СО–СОСН3). Встановіть будову С8Н10.
- *Встановіть будову речовини C7H7NO2, хлорування якої надлишком хлору при освітленні дає продукт C7H4NO2Cl3, гідроліз якого приводить до п-нітробензойної кислоти.
- **Сполуки А і В (С14Н12) швидко обезбарвлюють розчин Br2 в CCl4 та холодний розведений розчин KMnO4; легко поглинають 1 моль водню, перетворюючись на Г (С14Н14). При окисненні в жорстких умовах сполуки А і В утворюють бензойну кислоту. Сполуку В можна отримати з А в результаті наступних перетворень:
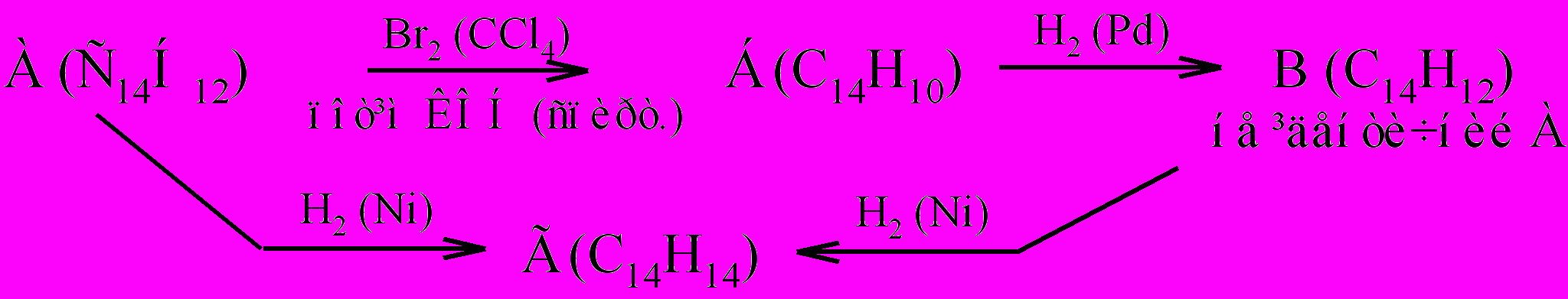
Яка будова сполук А, Б, В, Г?
- **При окисненні вуглеводню складу С12Н18 (в ЯМР 1Н спектрі тільки один синглет з =2,5 м.д.) концентрованим розчином калій перман-ганату утворюється кислота складу С12Н6О12 (в ЯМР 1Н спектрі один синглет при =13,5 м.д). Визначте будову цих сполук.
- *Органічна сполука складу С8Н10 не взаємодіє з бромною водою, а при її взаємодії з бромом як на світлі при нагріванні, так і в присутностї заліза виділяється їдкий газ. При взаємодії С8Н10 з калій перманганатом в лужному середовищі випадає бурий осад, а з відфільтрованого розчину після обробки хлоридною кислотою виділяється біла кристалічна речовина. Визначте структуру сполуки С8Н10, якщо в її ЯМР 1Н спектрі наявні три сигнали (1,25 м.д., 2,68 м.д., 7,23 м.д.).
- *При приєднанні бромоводню до стирену отримали продукт, в ЯМР 1Н спектрі якого є три сигнали: =2,0 м.д.(дублет), =5,2 м.д. (квадру-плет), =7,3 м.д. (синглет), відношення інтесивностей відповідно 3:1:5. Визначте, як здійснювалось перетворення ― за правилом Марковніко-ва, чи всупереч йому?
ПРАКТИЧНА РОБОТА № ОХ-11
ХІМІЧНІ ВЛАСТИВОСТІ ОКСИГЕНО-
І НІТРОГЕНОВМІСНИХ ПОХІДНИХ БЕНЗЕНУ
ДОСЛІД 1. Добування і вивчення властивостей
аніліну і його похідних
Реактиви: концентрована хлоридна кислота, розчини: сульфатної кислоти (10%), хлоридної кислоти (10%), калій перманганату (1%), натрій гідроксиду (10%), натрій нітриту (5%), калій хлорату (5%), формальдегіду (40%), хлорне вапно, нітробензен, хромова суміш, оцтовий ангідрид, бромна вода, цинковий пил, лакмусовий папір.
Обладнання: льод, вигнуті газовідвідні трубки, хімічні склянки (50–100 мл), конічні колби, штатив пластмасовий, пробірки, нагрівний прилад, штатив з лапкою.
а) Добування аніліну (реакція Зініна)
1. У пробірку налийте 0,5 мл нітробензену, 1 мл концентрованої хлоридної кислоти й до суміші додайте на кінчику шпателя цинковий пил. При постійному струшуванні реакційну масу слабко нагрійте до зникнення шару і запаху нітробензену. (Якщо цинковий пил розчиниться раніш, ніж зникне запах нітробензену, то додайте нову порцію цинкового пилу). Для розчинення залишків цинкового пилу додайте концентровану хлоридну кислоту.
● Які зміни спостерігаєте?
2. До реакційної суміші додайте по краплях розчин натрій гідроксиду до лужної реакції, кип'ятильний камінець і 2 мл води. Пробірку щільно закрийте пробкою з газовідвідною трубкою і закріпіть похило в лапці штатива. Кінець відвідної трубки опустіть у пробірку-приймач, охолоджену в склянці з холодною водою. Пробірку з реакційною сумішшю обережно нагрійте полум'ям пальника до кипіння і початку перегонки (по краплях).
● Який вигляд має продукт реакції? З якою метою додають розчин лугу?
■ Напишіть рівняння реакцій, що відбувалися.
б) Взаємодія аніліну з мінеральними кислотами
У дві пробірки налийте по 0,3 мл аніліну. В одну додайте розчин хлоридної кислоти, в другу ― розчин сульфатної кислоти.
● Що спостерігаєте?
■ Напишіть рівняння реакцій, що відбувалися.
в) Реакція конденсації аніліну з формальдегідом
До 2–3 мл водного розчину аніліну додайте такий же об'єм розчину формальдегіду. Протягом деякого часу збовтуйте суміш.
● Що спостерігаєте? Чому?
■ Напишіть рівняння реакції, що відбувалася.
г) Реакція діазотування
У невеликій конічній колбі приготуйте розчин солянокислого аніліну (1 мл аніліну і 10 мл розчину хлоридної кислоти до повного розчинення аніліну). Розчин охолодіть сумішшю подрібненого льоду з сіллю до 5°С. Не виймаючи колби з охолоджувальної суміші, долийте по краплях при помішуванні 1,5–2 мл розчину натрій нітриту. (Про кінець реакції дізнаються по посинінню йодкрахмального папірця ― у надлишку нітритної кислоти виділяється вільний йод, внаслідок чого крохмаль забарвлюється в синій колір)
■ Напишіть рівняння реакцій, що відбувалися.
► Зробіть висновок щодо властивостей аміногрупи в аніліні в порів-нянні з аліфатичними амінами.
д) Взаємодія аніліну із бромною водою
До 2–3 мл водного розчину аніліну додайте по краплях бромну воду.
● Які ознаки реакціі? Чому?
■ Напишіть рівняння проведеної реакції.
► Зробіть висновок щодо властивостей бензенового кільця в аніліні в порівнянні з бензеном.
е) Окиснення аніліну
В три пробірки налийте декілька мілілітрів водного розчину аніліну.
В першу пробірку додайте декілька крапель профільтрованого водного розчину хлорного вапна, в другу ― стільки ж розчину калій хлорату, в третю ― стільки ж хромової суміші.
● Які зміни відбуваються у пробірках? Відмітьте зміну кольорів у пробірках. (В умовах проведених реакцій утворюються по-різному забарвлені сполуки, що містять у своїй структурі хіноїдне угрупування).
■ Складіть рівняння реакції аніліну з хромовою сумішшю, враховуючи утворення барвника – анілінового чорного.
► Зробіть висновок щодо особливостей окиснення ароматичних амінів.
ДОСЛІД 2. Добування і вивчення властивостей
фенолу і його похідних
Реактиви: концентровані нітратна, сульфатна кислоти, розчини: хлоридної кислоти (10%), калій перманганату (1%), натрій гідроксиду (10%), ферум(ІІІ) хлориду (3%), натрій карбонату (10%), фенол, бромна вода, універсальний індикаторний папір.
Обладнання: скляні палички, вигнуті газовідвідні трубки, хімічні склянки (50–100 мл), конічні колби, штатив пластмасовий, штатив з лапкою, пробірки, піпетки, нагрівний прилад, водяна баня, кип'ятильні камінці, вовна (шовк).
а) Добування фенолу із солі фенілдіазонію
Декілька мілілітрів розчину солі фенілдіазонію, отриманого у досліді 1 г) обережно нагрійте у пробірці до початку виділення азоту, що продовжується і без подальшого нагрівання. Обережно понюхайте речовину, що виділяється.
● За характерним запахом зробіть висновок про утворення нового продукту.
■ Напишіть рівняння проведеної реакції.
б) Розчинність фенолу у воді і його кислий характер
1. У пробірку помістіть 0,5 г кристалічного фенолу і 3 мл води. При струшуванні фенол частково розчиняється.
● Що утворюється при цьому?
2. Обережно нагрійте розчин до повного розчинення фенолу. Водний розчин фенолу випробуйте індикаторним папером.
● Чи відбувається зміна кольору індикатору? Чому?
в) Добування натрій феноляту і його гідроліз
1. Вміст пробірки з попереднього досліду збовтайте до утворення емульсії і додайте по краплях розчин натрій гідроксиду.
● Що спостерігаєте?
2. До розчину натрій феноляту додайте розчин хлоридної кислоти.
● Що спостерігаєте? Чому?
■ Напишіть рівняння реакцій, що відбувалися.
г) Взаємодія фенолу з ферум(ІІІ) хлоридом
У пробірку налийте 2–3 мл водного розчину фенолу і додайте 2–3 краплі розчину ферум(ІІІ) хлориду.
● Що спостерігаєте? Чому?
■ Напишіть рівняння проведеної реакції, враховуючи утворення комплексної солі феруму(ІІІ).
► Зробіть висновок щодо кислотних властивостей фенолу в порівнянні з спиртами.
д) Взаємодія фенолу з бромною водою
У пробірку налийте 2–3 мл розчину фенолу і при струшуванні поступово додайте бромну воду.
● Що спостерігаєте? Чому?
■ Напишіть рівняння проведеної реакції.
е) Нітрування фенолу (Працювати під тягою!)
1. У пробірку з 1–1,5 г фенолу додайте декілька крапель води до розчинення фенолу й утворення однорідної рідини. В іншій пробірці змішайте 2 мл концентрованої нітратної кислоти з 2,5 мл води. Отриману розведену нітратну кислоту повільно долийте краплями (при струшуванні й охолодженні) до суміші фенолу і води, підтримуючи температуру 20–25°С.
● Що утворюється?
2. Через 15 хвилин темну рідину, що утворилася, вилийте у 15 мл води. Після відстоювання суміші воду злийте, а напіврідку масу, що виділилася, ще раз промийте такою ж кількістю води, перелийте у велику пробірку, додаючи 5–7 мл води, опустіть шматочки пористої цегли в якості кип'ятильних камінців і закрийте її пробкою з вставленою відвідною трубкою. Пробірку закріпіть похило в лапці штатива. Кінець відвідної трубки занурте в охолоджену пробірку–приймач. Обережно прогріваючи вміст пробірки, відгонить у приймач продукт реакції.
● Який вигляд має речовина, що відганяється? Яка це речовина?
■ Напишіть рівняння проведеної реакції.
є) Добування і властивості пікринової кислоти (Тяга!)
1. У пробірці обережно змішайте 0,5 г фенолу з 1,5 мл концентрованої сульфатної кислоти, потім суміш нагрійте до добування однорідної рідини. Охолодіть рідину і поступово додайте 2 мл концентрованої нітратної кислоти.
● В який колір забарвлюється розчин?
2. Отриману суміш нагрівайте протягом 15 хвилин на водяній бані, і після охолодження розбавте рівним об'ємом води.
● Який вигляд має речовина, що утворилася? Яку систематичну назву вона має?
3. У насичений водний розчин пікринової кислоти занурте вовну або шовк і нагрійте на киплячій водяній бані протягом 15–20 хвилин. Злийте рідину, матеріал промийте кілька разів у воді, відіжміть і висушить.
● В який колір забарвлюється тканина? (Пікринова кислота взаємодіє з аміногрупами білків, утворюючи нерозчинні продукти характерного кольору).
■ Напишіть рівняння проведеної реакції.
► Зробіть висновок щодо реакцій електрофільного заміщення в моле-кулі фенолу в порівнянні з іншими ароматичними сполуками.
ж) Окиснення фенолу
У пробірці розчиніть 0,1 г фенолу в розчині натрій карбонату. Потім при збовтуванні по краплях додайте розчин калій перманганату.
● Що відбувається при цьому? Чому?
■ Напишіть рівняння проведеної реакції. Назвіть реагенти і продукти реакції.
► Зробіть висновок щодо особливостей окиснення фенолів.
