Хімія є однією з основних природознавчих наук, що розвивається останнім часом дуже швидко
| Вид материала | Документы |
СодержаниеСемінарське заняття № ох–7 добування і властивості карбонових кислот |
- Програми для профільного навчання в загальноосвітніх навчальних закладах Рекомендовано, 103.17kb.
- Останнім часом у літературознавстві з’явилося багато нових підходів до аналізу літературного, 126.23kb.
- 12 штучний інтелект. Експертні системи, 633.04kb.
- Енергозбереження в нашій країні останнім часом набуває все більшої актуальності, 66.58kb.
- Голоду не нова в історії світового письменства, оскільки йдеться, 136.43kb.
- «Про особисте селянське гос подарство», 924.69kb.
- Розпорядження, 26.48kb.
- Матеріал для виступу на педагогічній раді, 57.83kb.
- Єчимало класифікацій природних ресурсів, 682.02kb.
- Робоча програма навчальної дисципліни екоаналітична хімія напряму підготовки 040101, 154.06kb.
СЕМІНАРСЬКЕ ЗАНЯТТЯ № ОХ–7
ДОБУВАННЯ І ВЛАСТИВОСТІ КАРБОНОВИХ КИСЛОТ
Контрольні питання
- Які принципи класифікації карбонових кислот Вам відомі?
- Дайте визначення гомологічного ряду насичених одноосновних карбонових кислот.
- Які типи ізомерії характерні для насичених і ненасичених монокарбонових кислот?
- Які типи номенклатури органічних сполук застосовні до карбонових кислот?
- Опишіть електронну будову карбоксильної групи. Які фізичні властивості кислот вона обумовлює? Чому вищі насичені карбонові кислоти розчиняють в діетиловому етері, а не у воді?
- Як залежить кислотність карбонових кислот від будови вуглеводневого радикала, від положення і природи замісників у ньому?
- Розташуйте наступні сполуки в ряд за збільшенням кислотних властивостей: а) вода; б) етанол; в) оцтова кислота; г) трихлороцтова кислота; д) малонова кислота; е) карбонатна кислота; ж) мурашина кислота; з) акрилова кислота (СН2=СН–СООН); и) щавлева кислота. Дайте відповідні пояснення.
- Перелічіть лабораторні і промислові способи добування карбонових кислот. Напишіть рівняння реакції (або послідовності реакцій) добування пропанової кислоти виходячи з: а) пропаналю; б) пропан-1-олу; в) пропену; г) бромистого етилу; д) пентан-3-ону; е) диетилмалонового естеру.
- Назвіть речовини, що утворюються при гідролізі наступних сполук: а) NCCH(CH3)CN; б) (CH3)3CCN; в) (CH3)2CHCOOCH(CH3)2; г) CH3CH2COOCH2CH2CH3; д) CH3COOCH2CH2CH(CH3)2; е) СН3ССl3.
- Перелічіть основні реакційні центри в молекулі оцтової кислоти. Які типи реакцій будуть характерні для кожного них?
- Чи буде реагувати оцтова кислота з натрій гідросульфітом? З натрій хлоридом? Чому?
- Що таке реакція Гелля-Фольгарда-Зелинського? Чи всі кислоти можуть вступати в цю реакцію?
- Опишіть механізм реакції естерифікації на прикладі оцтової кислоти й етанолу. Які експериментальні факти підтверджують цей механізм?
- Яка роль сульфатної кислоти в реакції естерифікації? Чому не можна застосовувати надлишок сульфатної кислоти?
- Як змінюється реакційна здатність в реакції естерифікації при збільшенні довжини вуглеводневого радикалу кислоти? При переході від первинного спирту до вторинного і третинного?
- Чим відрізняється мурашина кислота від її гомологів? Чому при естерифікації мурашиної кислоти (а також щавлевої) не потрібно додавати мінеральні кислоти?
- Які хімічні властивості характерні для ненасичених карбонових кислот? Наведіть приклади. Напишіть реакції акрилової кислоти з: а) Na2CO3, б) Br2, в) HBr, г) NH3, д) розведеним водним розчином KMnO4 за кімнатної температури.
- За допомогою яких реакцій можна розпізнати наступні речовини: а) мурашину і оцтову кислоти; б) етилацетат і бутанову кислоту; в) акрилову та пропанову кислоти; г) етилформіат та метилацетат; д) ізомасляну та 2,2-диметилпропанову кислоти; е) щавлеву та мало-нову кислоти?
- *Чим відрізняються механізми гідролізу метилетаноату і трет-бутилетаноату в кислому середовищі?
- Чому гідроліз естерів у лужному середовищі ― реакція необоротна?
- У чому полягають особливості хімічної поведінки двоосновних карбонових кислот? Порівняйте відношення до нагрівання щавлевої, малонової, бурштинової, глутарової та адипінової кислот. Назвіть отримані сполуки.
- Які хімічні властивості щавлевої кислоти обумовлюють її застосування в аналітичній хімії?
- Які розходження в будові малеїнової і фумарової кислот? Як вони позначаються на фізичних і хімічних властивостях цих речовин?
- *Визначте будову сполуки складу С4Н8О2, що має такі властивості: а) реагує з розчином соди з виділенням газу; б) при сплавленні з лугом утворює пропан; в) при дії Са(ОН)2 утворює сполуку, термічний піроліз якої приводить до утворення діізопропілкетону.
- *Визначте будову речовини С4Н4О4. Речовина має кислий характер, утворює бурштинову кислоту при гідруванні, а при нагріванні виділяє воду з утворенням сполуки С4Н2О3, що знебарвлює бромну воду і водний розчин KMnО4.
- Визначте структуру органічної речовини С3Н6О2, у ЯМР 1Н спектрі якої є два синглети однакової інтенсивності при =2,1 м.д. та =3,8 м.д.
- *Визначте структури сполук, які відповідають таким параметрам спектрів ЯМР 1Н: а) С2Н4О2 ― 2,08 м.д. (синглет, 3Н), 11,5 м.д. (синглет, 1Н); б) С4Н8О2 ― 1,21 м.д. (триплет, 3Н), 1,93 м.д. (синглет, 3Н), 4,0 м.д. (квадруплет, 2Н).
- *Речовина С5Н10О2 у ЯМР 1Н спектрі має три сигнали: 1,05 м.д. (дублет, 6Н), 1,95 м.д. (синглет, 3Н), 4,85 м.д. (мультиплет, 1Н). Яку будову має С5Н10О2, якщо одним з продуктів ії гідролізу є оцтова кислота?
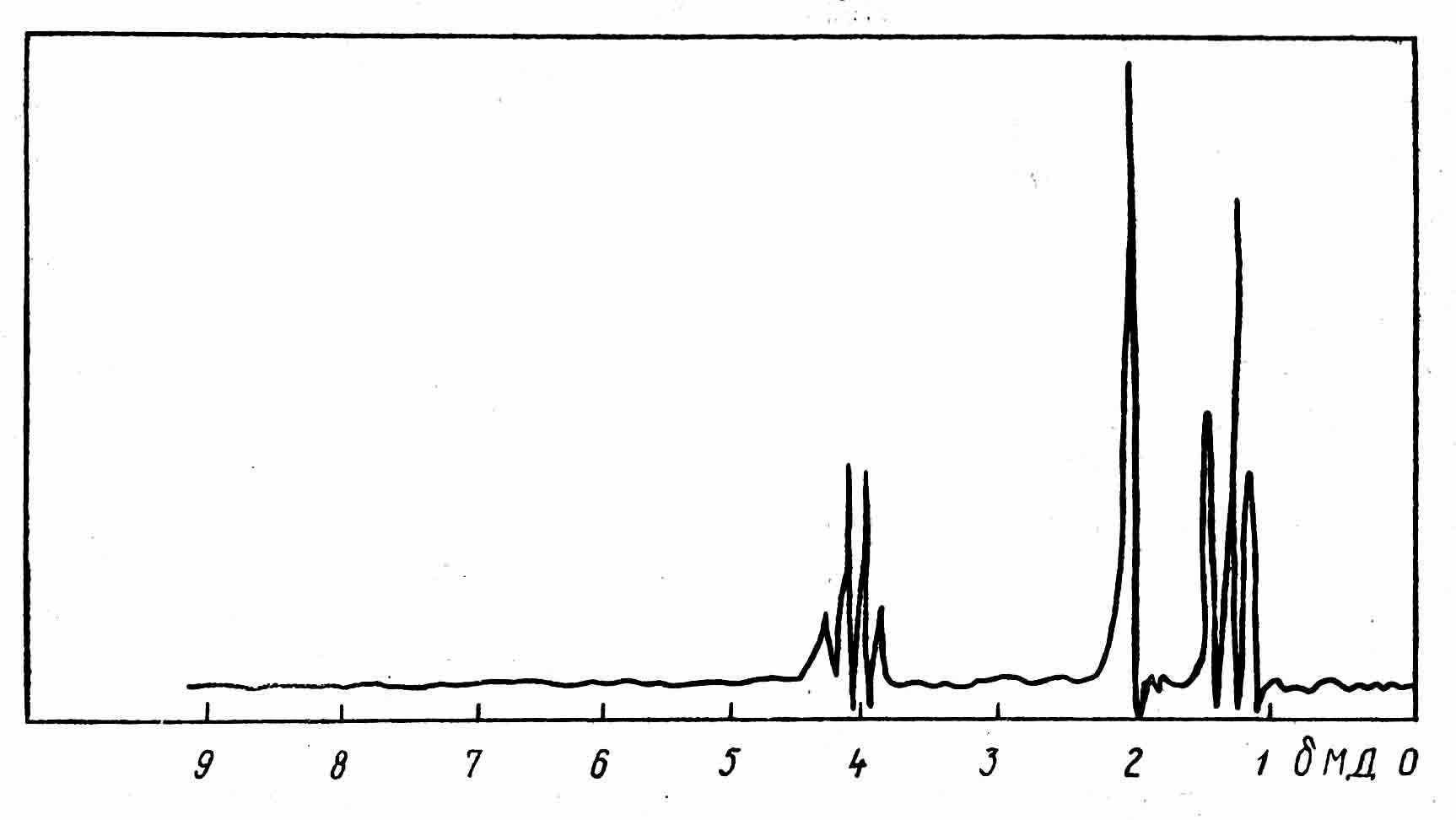
- На малюнку наведений ЯМР 1Н спектр етилацетату. Дайте віднесення сигналів і поясніть їхню мультиплетність.
- Яка смуга поглинання буде з'являтися в ІЧ-спектрі при утворенні ізоамілацетату з відповідного спирту? Яка буде зникати?
