Хімія є однією з основних природознавчих наук, що розвивається останнім часом дуже швидко
| Вид материала | Документы |
СодержаниеПрактична робота № ох-3 ДОСЛІД 2. Відкриття Нітрогену і Сульфуру в органічній речовині Реактиви: хлороцтова кислота або хлороформ, вода (чи спирт та ін.), хлоридна кислота. |
- Програми для профільного навчання в загальноосвітніх навчальних закладах Рекомендовано, 103.17kb.
- Останнім часом у літературознавстві з’явилося багато нових підходів до аналізу літературного, 126.23kb.
- 12 штучний інтелект. Експертні системи, 633.04kb.
- Енергозбереження в нашій країні останнім часом набуває все більшої актуальності, 66.58kb.
- Голоду не нова в історії світового письменства, оскільки йдеться, 136.43kb.
- «Про особисте селянське гос подарство», 924.69kb.
- Розпорядження, 26.48kb.
- Матеріал для виступу на педагогічній раді, 57.83kb.
- Єчимало класифікацій природних ресурсів, 682.02kb.
- Робоча програма навчальної дисципліни екоаналітична хімія напряму підготовки 040101, 154.06kb.
ПРАКТИЧНА РОБОТА № ОХ-3
ЯКІСНИЙ АНАЛІЗ НА ОРГАНОГЕНИ
ДОСЛІД 1. Виявлення Карбону і Гідрогену
в органічній речовині
Реактиви: сахароза (цукор), купрум(II) оксид, вапняна (чи баритова) вода (насичений розчин кальцій чи барій гідроксиду), безводний купрум(II) сульфат (свіжопрожарений).
О
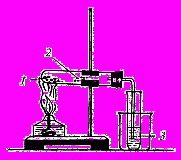
Мал. 3.1. Прилад
для добування газів
бладнання: штатив з лапкою, вигнута газовідвідна трубка з пробкою, вата, пробірки, штатив пластмасовий для пробірок, нагрівний прилад.
1. Зберіть прилад для добування газів як показано на мал.3.1. У суху пробірку помістіть 0,2–0,3 г сахарози і 1–2 г порошку купрум(II) оксиду. Вміст пробірки ретельно перемішайте. У верхню частину пробірки (під пробку) помістіть маленьку грудочку вати, на яку попередньо насипте невеличку кількість безводного купрум(II) сульфату. Закрийте пробірку пробкою з газовідвідною трубкою і закріпіть її в лапці штатива з нахилом убік пробки. Вільний кінець газовідвідної трубки опустіть в пробірку з вапняною (чи баритовою) водою так, щоб отвір трубки був занурений під поверхню рідини. Обережно прогрійте спочатку всю пробірку, потім сильно прогрійте ту частину, де знаходиться реакційна суміш.
● Відмітьте, що відбувається з вапняною водою і купрум(II) сульфатом. Чому?
■ Напишіть рівняння реакцій окиснення сахарози (С12Н22О11) купрум(II) оксидом, взятим у надлишку, та взаємодії продуктів, що утворюються при окисненні сахарози, з вапняною водою і з безводним купрум(II) сульфатом.
► Зробіть висновок щодо наявності зазначених елементів в органіч-ній речовині.
ДОСЛІД 2. Відкриття Нітрогену і Сульфуру
в органічній речовині
Реактиви: сульфанілова кислота (C6H7NO3S), металічний натрій, ферум(II) сульфат, розчини: натрій гідроксиду (10%), плюмбум(II) ацетату (10%).
Обладнання: штатив пластмасовий, пробірки, тримач для пробірок, скляна лійка, фільтрувальний папір, стакан, нагрівний прилад.
1. Сульфанілову кислоту (0,05–0,1 г) помістіть на дно пробірки. Тримаючи пробірку майже горизонтально, покладіть туди ж (трохи вище) шматочок металічного натрію діаметром 3–4 мм, попередньо очищений від оксидної плівки. Тримаючи пробірку горизонтально, спочатку нагрійте натрій до його розплавлення, а потім поверніть пробірку вертикально, щоб крапля розплавленого натрію впала на речовину (обережно, спалах!). Після цього пробірку прогрійте до червоного розжарювання; гарячу пробірку швидко опустіть в ступку з 5–10 мл дистильованої води так, щоб пробірка розтріснулася (цю операцію необхідно проводити за скляними дверцятами витяжної шафи, а також працювати в захисних окулярах!). Чорні шматочки плаву зі склом добре подрібніть товкачиком, після цього відфільтруйте отриману рідину через невеликий складчастий фільтр. Вважається, що внаслідок реакції утворюється суміш продуктів, в якій містяться натрій ціанід і натрій сульфід. Визначте за допомогою індикаторного паперу середовище реакційного розчину.
● Яке середовище у розчині? Чому?
■ Підтвердіть свої міркування рівняннями гідролізу.
2. Фільтрат розділіть на дві частини і використовуйте для проб на Сульфур і Нітроген.
а) Проба на Сульфур
До 1 мл розчину плюмбум(II) ацетату долийте розчин їдкого натру до розчинення осаду плюмбум(II) гідроксиду, що спочатку утвориться. Потім додайте декілька крапель досліджуваної рідини.
● Відмітьте, що відбувається з розчином плюмбум(II) ацетату. Про що свідчить поява ознаки реакції?
■ Напишіть рівняння вказаних реакцій, враховуючи утворення тетра-гідроксоплюмбат-йону з йону Pb2+.
б) Проба на Нітроген
1. До досліджуваної лужної рідини додайте кристалик залізного купоросу, прокип'ятіть суміш протягом 1–2 хвилин.
● Що відбувається з розчином?
2. Реакційну суміш охолодіть і підкисліть розведеною хлоридною кислотою.
● Що при цьому відбувається? Про що свідчить поява ознаки реакції?
■ Напишіть рівняння вказаних реакцій, враховуючи утворення осаду берлінської лазурі внаслідок реакції.
► Зробіть висновок щодо наявності зазначених елементів в органіч-ній речовині.
ДОСЛІД 3. Проба Бейльштейна на галогени
Реактиви: хлороцтова кислота або хлороформ, вода (чи спирт та ін.), хлоридна кислота.
Обладнання: мідний дріт з петлею на кінці, вставлений іншим кінцем у коркову пробку, спиртівка чи газовий пальник.
Візьміть мідний дріт за пробку і прожарте в полум'ї пальника або спиртівки до утворення на поверхні дроту чорного шару купрум(II) оксиду. Дайте петлі охолонути і змочіть її у хлороформі (або підчепіть нею кристалик хлороцтової кислоти), після чого знову внесіть у полум'я. Спочатку полум'я стає таким, що світиться, потім з'являється інтенсивне забарвлення. Для контролю повторіть дослід, використовуючи речовину, що не містить галогену (наприклад, вода, спирт). Для очищення змочіть дріт хлоридною кислотою і прожарте.
● У який колір забарвлюється полум’я? Поясніть, чому?
■ Напишіть рівняння згаданих реакцій, враховуючи, що утворюється купрум(II) хлорид і купрум(I) хлорид (димер).
► Зробіть висновок щодо сутності проби Бейльштейна.
