Землянский Яков Яковлевич к Х. н., профессор учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
Содержание7. Тематика контрольных работ и методические рекомендации по их выполнению 7.1 Тематика работ II Контрольная работа III Контрольная работа IV Контрольная работа |
- Учебно-методический комплекс Специальности: 080301 Коммерция (торговое дело) Москва, 848.48kb.
- Алексунин Владимир Алексеевич, профессор, к э. н., профессор кафедры маркетинга и рекламы, 1296.15kb.
- Слонов Людин Хачимович Доктор биологических наук, профессор, профессор кафедры ботаники, 823.83kb.
- Литвинюк Александр Александрович д э. н., профессор должность профессор учебно-методический, 654.29kb.
- Панкратов Леонид Васильевич Д. т н., профессор учебно-методический комплекс, 948.73kb.
- Парамонова Татьяна Николаевна д э. н., профессор Красюк Ирина Николаевна к э. н., доцент,, 1704.02kb.
- Мудревский Александр Юзефович учебно-методический комплекс, 1001.41kb.
- Левашов Олег Александрович учебно-методический комплекс, 967.18kb.
- Буров Александр Сергеевич учебно-методический комплекс, 165.1kb.
- Смирнов Валентин Петрович, д т. н., доцент, профессор (Ф. И. О., ученая степень, ученое, 281.15kb.
7. Тематика контрольных работ и методические
рекомендации по их выполнению
Планом учебных занятий для студентов очной формы обучения предусмотрено выполнение 4-х контрольных работ.
7.1 Тематика работ
I Контрольная работа
Основные химические понятия. Классы Химических соединений. Газовые законы. Вывод формул химических веществ. Концентрационные расчеты. Закон эквивалентов.
Вариант № 1
- Напишите формулы карбоната, гидрокарбоната и основного карбоната магния. Какая из всех перечисленных солей имеет наибольшую молярную массу?
- При сгорании 20,0 г фосфора образуется 45,8 г его оксида. Определите эквивалент фосфора. Чему равна валентность фосфора в полученном оксиде?
- Вычислите объем газа при н.у., если при 15,0˚ С и 720 мм рт. ст. этот газ занимает объем 912 см3.
- Определите атомную массу, степень окисления металла и формулу его хлорида, если удельная теплоемкость равна 0,057 Дж/г.К, а хлорид содержит 61,3% металла и 38,7% хлора.
- Смешали 300 см3 1,20 М и 200 см3 2,00 М растворов серной кислоты. Вычислите нормальную концентрацию полученного раствора.
Вариант № 2
- Соль какой кислоты образуется при взаимодействии одного моль оксида натрия с одним моль оксида фосфора (V)? Чему равна молярная масса этой кислоты?
- Один и тот же металл может реагировать с 4,8 г кислорода или с 48 г одного из галогенов. Укажите галоген, участвующий в реакции. Чему равна его атомная масса.
- При 17,0˚ С и давлении 780 мм рт. ст. масса 624 см3 газа равна 1,56. Вычислите молекулярную массу этого газа.
- 10,0 г смеси меди с алюминием обработали избытком раствора гидроксида калия. При этом выделилось 5,60 л водорода (н.у.). Каковы массовые доли компонентов сплава?
- Сколько г нитрата калия следует добавить к 200 см3 0,100 Н раствора, чтобы концентрация его раствора стала равной 0,150 моль/дм3? Изменение объема раствора не учитывайте.
II Контрольная работа
Химическая кинетика и химическое равновесие. Термохимические расчеты. Коллигативные свойства растворов. Электролитическая диссоциация. Степень диссоциации. Изотонический коэффициент. Расчет рН растворов кислот, оснований, гидролизующихся солей. Окислительно-восстановительные реакции.
Вариант № 1
- Как изменятся скорости прямой и обратной реакции 4НCl + O2 ↔ 2Н2О + 2Сl2 при увеличении давления в два раза?
- Определите теплоту образования сероуглерода, используя следующие данные:
S + O2 = SO2 + 297,5 кДж/моль
СS2 + 3O2 = CO2 + 2SO2 + 1109,9 кДж/моль
С + О2 = СО2 + 394 кДж/моль
- Вычислите каково будет давление пара раствора при 65ºС, содержащего 13,68 г сахара в 90 г воды, если давление водяного пара при той же температуре равно 187,5 мм рт.ст.
- Вычислите, каково должно быть процентное содержание муравьиной кислоты (
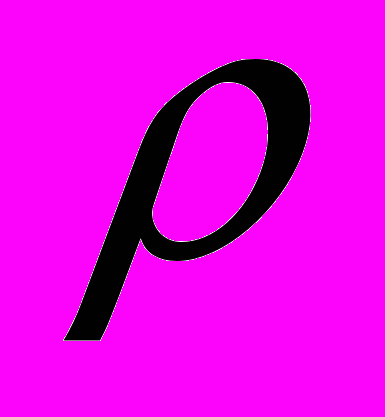 =1 г/см3) для того, чтобы концентрация водородных ионов в нем составляла 8,4.10-3 моль/л?
=1 г/см3) для того, чтобы концентрация водородных ионов в нем составляла 8,4.10-3 моль/л?
- Составьте молекулярные и ионные уравнения гидролиза солей: КСN; K2SO3.
- Составьте уравнения окислительно-восстановительных реакций:
Zn + H2SO4 → ZnSO4 + H2S + H2O
K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O
Вариант № 2
- Константа равновесия реакции N2 + 3Н2 ↔ 2NH3 равна 0,10 (при температуре 400ºС). Равновесные концентрации (моль/л) [Н2] = 0,20 и [NH3] = 0,080. Вычислите начальную и равновесную концентрации азота.
- Вычислите
 Н0 реакции восстановления оксида цинка углеродом с образованием СО, если
Н0 реакции восстановления оксида цинка углеродом с образованием СО, если  Н0Zn О = - 348 кДж/моль.
Н0Zn О = - 348 кДж/моль.
- Вычислите температуру кипения раствора, содержащего 100 г сахара в 750 г воды.
- Степень диссоциации КСl в растворе, содержащем 0,020 моль КСl в 10 л воды, равна 0,970. Вычислите осмотическое давление (в мм рт.ст.) раствора при 18ºС.
- Составьте в молекулярном и ионном виде уравнения гидролиза солей: Na3PO4; (NH4)2SO3.
- Составьте уравнения окислительно-восстановительных реакций:
HNO3 + Bi → Bi(NO3)3 + NO2 + …
KMnO4 + Na2SO3 + H2O → MnO2 ↓+ Na2SO4 + …
III Контрольная работа
Расчеты в гравиметрии и титриметрии. Расчеты погрешностей титрования. Построение интегральных кривых титрования в методах нейтрализации. Расчет скачка титрования. Выбор индикатора. Расчет массы навески. Расчет массы определяемого вещества методом прямого титрования и титрования остатка. Расчеты с использованием титра раствора.
Вариант №1
- Рассчитайте процентное содержание Ag в сплаве, если при анализе масса навески сплава составила 0,5000 г, а масса гравиметрической формы ( AgBr) – 0,4235 г. Чему равен аналитический множитель (гравиметрический фактор) в проведенных расчетах?
- Сколько г руды, содержащей приблизительно 20,0 процентов Fe, следует взять для определения точного содержания металла в анализируемом образце, если гравиметрическая форма определяемого элемента - Fe2O3 ? Чему равен аналитический множитель?
- Рассчитайте с погрешностью 0,100 % скачок титрования 100,0 мл 0,1000 Н раствора FeSO4 0,1000 Н раствором перманганата калия в сернокислой среде, если продуктом окисления аналита является Fe2(SO4)3 , а восстановленная форма титранта – сульфат марганца.
- Какую навеску Na2CO3 (г) следует взять для определения точной нормальной концентрации ~ 0,1 Н раствора HCl методом пипетирования, если объем мерной колбы равен 100 мл, пипетки – 10,0 мл, бюретки – 25,0 мл?
- Сколько г пентагидрата тиосульфата натрия необходимо растворить в 100,0 мл воды, чтобы его титр по H2O2 был равен 0,005000 г/мл?
Вариант № 2
- Рассчитайте процентное содержание Al в сплаве, если при анализе масса навески сплава составила 0,5000 г, а масса гравиметрической формы ( Al2O3) – 0,4235 г. Чему равен аналитический множитель (гравиметрический фактор) в проведенных расчетах?
- Сколько г руды, содержащей приблизительно 10,0 процентов Ni , следует взять для определения точного содержания металла в анализируемом образце, если гравиметрическая форма определяемого элемента - NiO ? Чему равен аналитический множитель?
- Рассчитайте с погрешностью 0,100 % скачок титрования 100,0 мл 0,1000 Н раствора H2O2 0,1000 Н раствором перманганата калия в сернокислой среде, если продуктом окисления аналита является H2O + O2 , а восстановленная форма титранта – сульфат марганца.
- Какую навеску K2CO3 (г) следует взять для определения точной нормальной концентрации ~ 0,1 Н раствора H2SO4 методом пипетирования, если объем мерной колбы равен 100 мл, пипетки – 10,0 мл, бюретки – 25,0 мл?
- Сколько г пентагидрата тиосульфата натрия необходимо растворить в 200,0 мл воды, чтобы его титр по KMnO4 был равен 0,005000 г/мл?
IV Контрольная работа
Классы органических соединений. Алканы. Алкены. Алкадиены. Алкины. Реакции полимеризации. Арены. Бензол. Фенол. Галогенопроизводные углеводородов. Альдегиды. Аминокислоты. Реакции поликонденсации. Белки. углеводы. Крахмал. Целлюлоза.
Вариант № 1
- Какие вещества получаются при полном гидрировании ароматических углеводородов:
а) бензола;
б) толуола;
в) стирола;
г) 1-метил-4-изопропилбензола?
Назовите образующиеся углеводороды.
- Напишите и объясните реакции получения спиртов путём гидратации этиленовых углеводородов:
а) этилена;
б) пропилена;
в) бутилена;
г) изобутилена.
Назовите образующиеся спирты.
3. Реакция серебряного зеркала является характерной для альдегидов. Почему муравьиная кислота даёт эту реакцию?
- 5 т свекольной стружки, содержащей 12% сахара, поместили в диффузоры и пропустили через них 1000 л горячей воды. Определите концентрацию сахара в растворе, вытекающем из последнего диффузора, если степень экстракции сахара и свеклы 90%.
- Сколько звеньев С6Н10О5 в хлопковом волокне, если его молекулярная масса 1620000?
Опишите химические свойства целлюлозы.
Вариант № 2
- Напишите уравнения реакций взаимодействия брома и водорода с бензолом, толуолом и стиролом. Покажите различие этих реакций.
- Один из способов получения спиртов заключается в том, что галогенопроизводные предельных углеводородов нагревают с растворами едких щелочей. Составьте уравнение реакции образования спирта:
а) из иодистого метила;
б) из иодистого пропила.
- Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
O
а) С2 Н4
 C2H5 Br
C2H5 Br  C2 H5 OH
C2 H5 OH  CH3 COOH
CH3 COOH  CH3 – C – O – C2 H5;
CH3 – C – O – C2 H5; О
//
CH3– С
\
О О О
\
б) С2 Н4
 CH3 – С
CH3 – С  CH3 – C
CH3 – C  Са
Са\ \ /
Н ОН О
/
CH3 – С
\\
О
- Сколько анилина можно получить из 61,5 г нитробензола при 90 %-ном выходе?
- Продукт полного гидролиза крахмала восстанавливает серебро из аммиачного раствора оксида серебра, а с уксусной кислотой образует сложный эфир. Какое вещество образовалось в результате полного гидролиза крахмала? Составьте соответствующие уравнения.
