Землянский Яков Яковлевич к Х. н., профессор учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
СодержаниеПример оформления лабораторных работ Таблица 1. Результаты измерений Таблица 2. Справочные данные |
- Учебно-методический комплекс Специальности: 080301 Коммерция (торговое дело) Москва, 848.48kb.
- Алексунин Владимир Алексеевич, профессор, к э. н., профессор кафедры маркетинга и рекламы, 1296.15kb.
- Слонов Людин Хачимович Доктор биологических наук, профессор, профессор кафедры ботаники, 823.83kb.
- Литвинюк Александр Александрович д э. н., профессор должность профессор учебно-методический, 654.29kb.
- Панкратов Леонид Васильевич Д. т н., профессор учебно-методический комплекс, 948.73kb.
- Парамонова Татьяна Николаевна д э. н., профессор Красюк Ирина Николаевна к э. н., доцент,, 1704.02kb.
- Мудревский Александр Юзефович учебно-методический комплекс, 1001.41kb.
- Левашов Олег Александрович учебно-методический комплекс, 967.18kb.
- Буров Александр Сергеевич учебно-методический комплекс, 165.1kb.
- Смирнов Валентин Петрович, д т. н., доцент, профессор (Ф. И. О., ученая степень, ученое, 281.15kb.
Пример оформления лабораторных работ
Лабораторная работа № Определение молярной массы углекислого газа
Масса одного моль вещества называется молярной массой (М) и представляет собой отношение массы (m) этого вещества к его количеству
(): М =
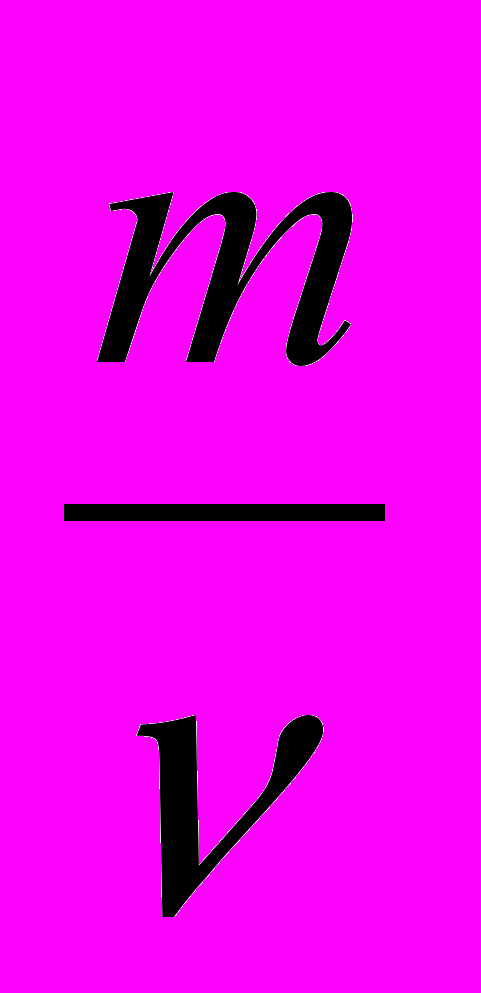 кг/моль (или г/моль). Численное значение М (г/моль) совпадает со значениями относительной молекулярной (М г), атомной (А г) или формульной (Ф г) массами данного вещества.
кг/моль (или г/моль). Численное значение М (г/моль) совпадает со значениями относительной молекулярной (М г), атомной (А г) или формульной (Ф г) массами данного вещества.Цель работы - определение молярной массы газообразного вещества.
Литература: Н.Л. Глинка, Общая химия, 1985, с.26-29.
А.А. Таперова, Лабораторный практикум, М., ВШ, 1976.
- Уравнение реакции:
- Схема прибора:
3. Последовательность выполнения работы
3.1. Взвесьте на технохимических весах сухую колбу с воздухом и пробкой (m1).
3.2. Заполните колбу оксидом углерода (IV) из аппарата Киппа (7-8 минут).
Закройте колбу пробкой и взвесьте (m2).
3.3. Проверьте полноту заполнения колбы, пропуская в нее повторно CO2 в
течение 2-х минут. Проведите повторное взвешивание колбы (m2).
3.4. Измерьте объем колбы водой с помощью мерного цилиндра (V).
3.5. Результаты измерений массы и объема, а также показания барометра и
термометра занесите в таблицу I.
Таблица 1. Результаты измерений
| № опыта | Масса колбы с воздухом m1 , г | Масса колбы с оксидом углерода (IV) m2 , г | Объем Колбы V, см3 | Температура | Атмосферное давление P, мм рт. ст. | ||
| t , С | T, К | ||||||
| 1 | | | | | | | |
| 2 | - | | | | | | |
4. Справочные величины приведены в таблице 2.
5. Предварительные расчеты .
5.1. Приведение объема газа (дм3) к нормальным условиям по уравнению:
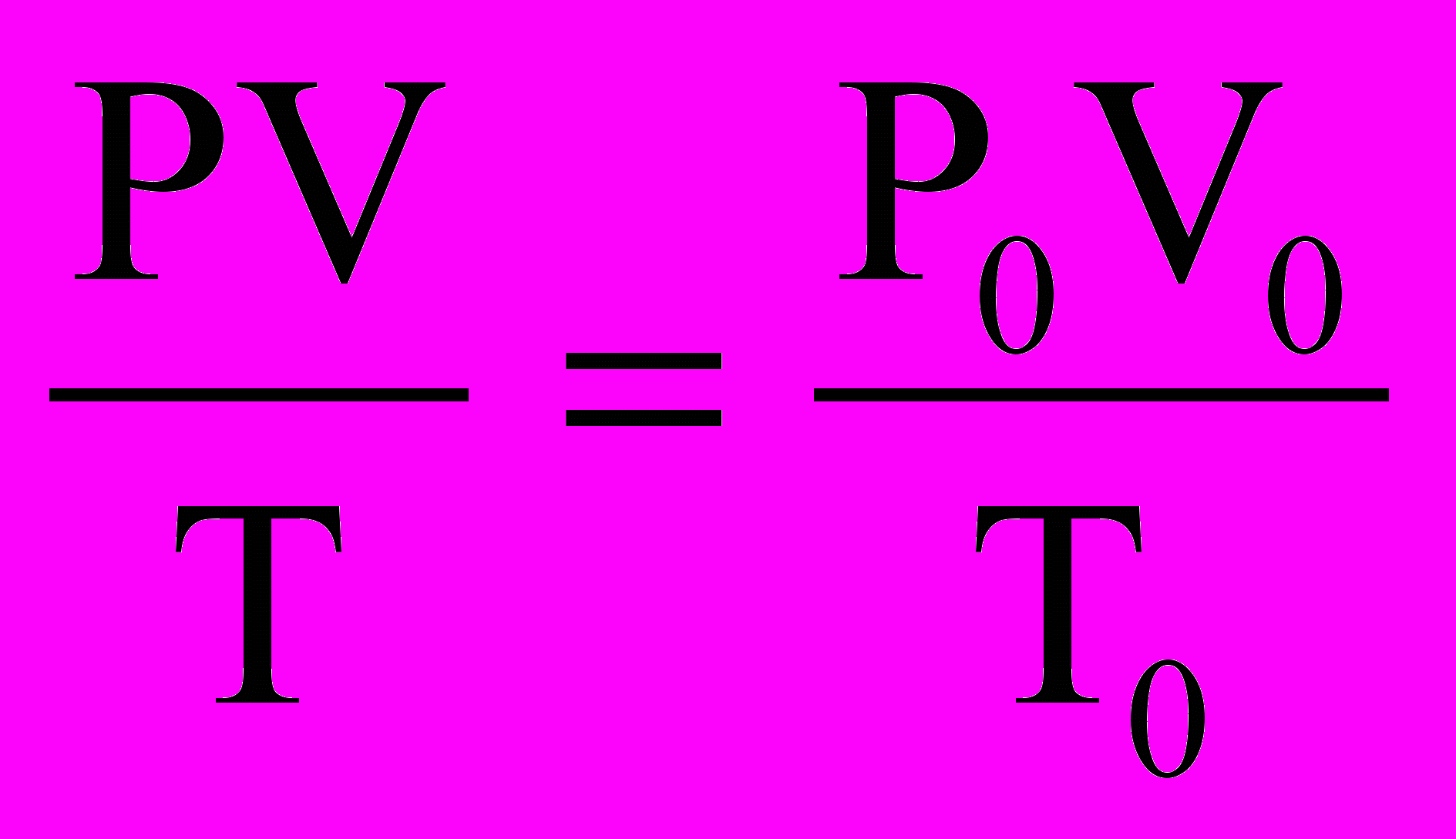 . V0 =
. V0 =5.2. Расчет массы воздуха в объеме колбы (н.у.): mв =
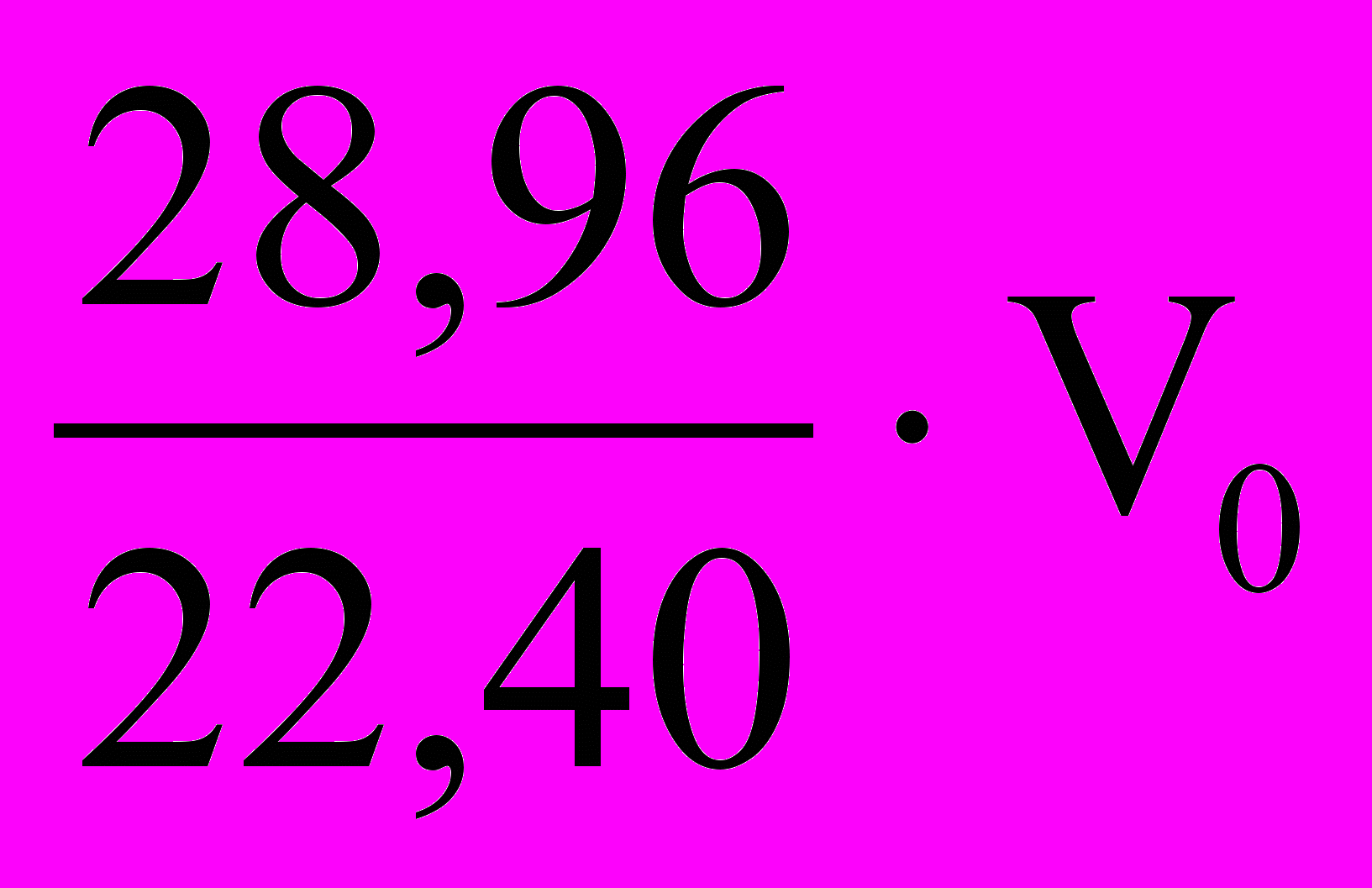
или mв = 1,293 V0
5.3. Расчет массы колбы с пробкой: mк = m1 – mв =
5.4. Расчет массы оксида углерода (IV) в объеме колбы:
m(CO2) = m2 – mк =
Таблица 2. Справочные данные
| R =  | To , К | Vo | Po |
| 0,082 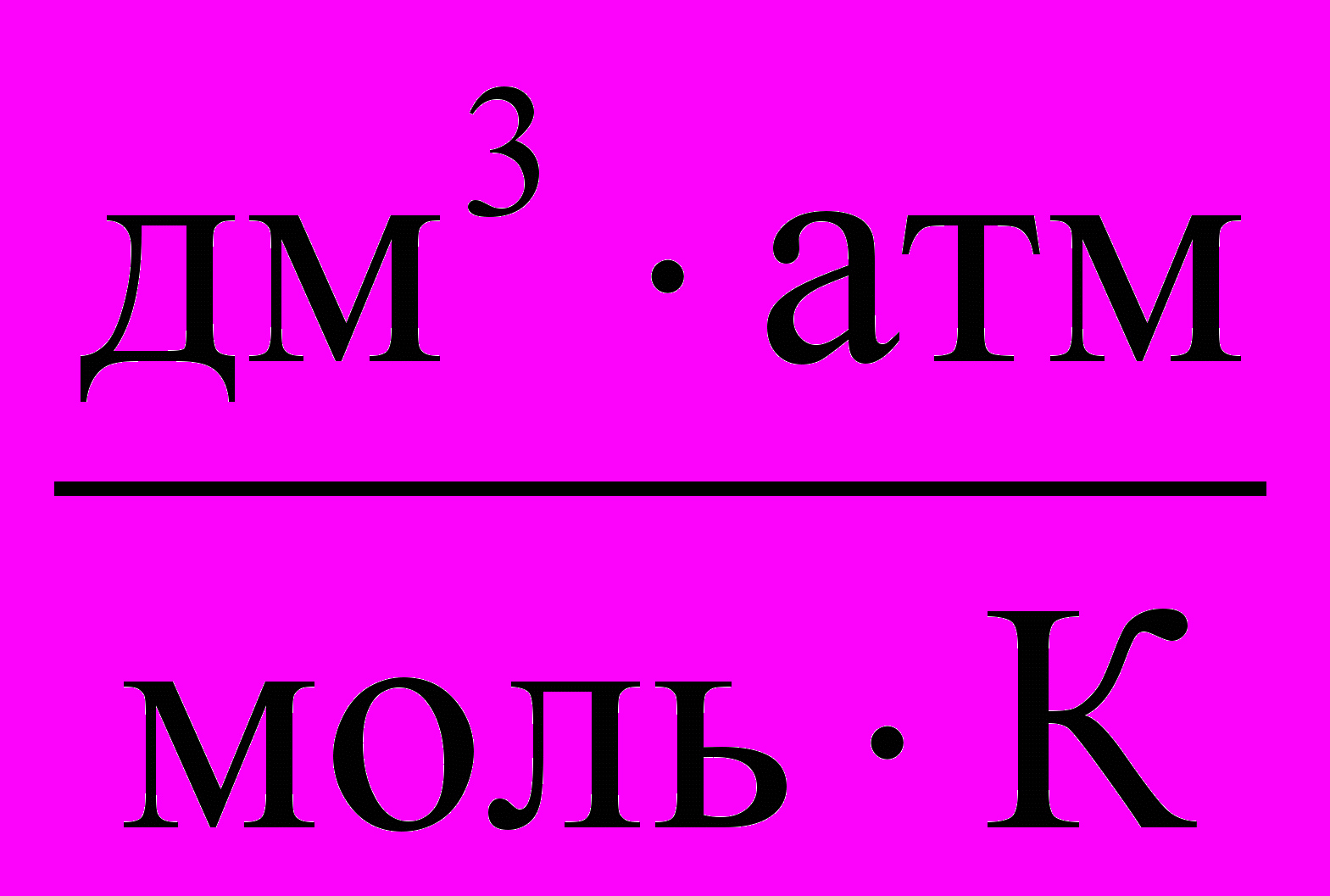 62,36 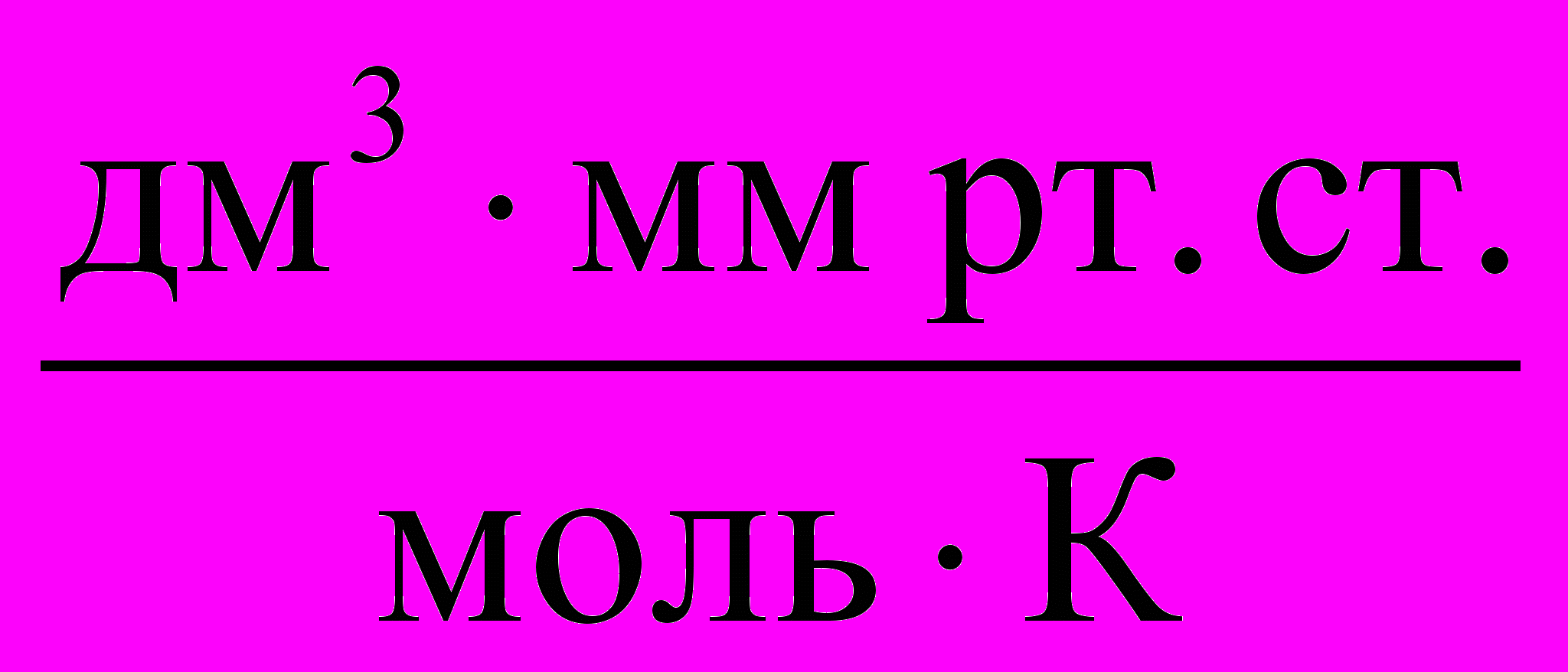 62360  8,314  8,314  | 273 273 273 273 273 | 22,4 дм3 22,4 дм3 22400 см3 22,4 10-3 м3 22,4 дм3 | 1 атм. 760 мм рт. ст. 760 мм рт. ст. 101325 Па 101,325 кПа |
