Землянский Яков Яковлевич к Х. н., профессор учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
СодержаниеЛабораторная работа № Таблица I. Результаты измерений Атмосферное давление Таблица 2. Давление насыщенного водяного пара в равновесии с водой |
- Учебно-методический комплекс Специальности: 080301 Коммерция (торговое дело) Москва, 848.48kb.
- Алексунин Владимир Алексеевич, профессор, к э. н., профессор кафедры маркетинга и рекламы, 1296.15kb.
- Слонов Людин Хачимович Доктор биологических наук, профессор, профессор кафедры ботаники, 823.83kb.
- Литвинюк Александр Александрович д э. н., профессор должность профессор учебно-методический, 654.29kb.
- Панкратов Леонид Васильевич Д. т н., профессор учебно-методический комплекс, 948.73kb.
- Парамонова Татьяна Николаевна д э. н., профессор Красюк Ирина Николаевна к э. н., доцент,, 1704.02kb.
- Мудревский Александр Юзефович учебно-методический комплекс, 1001.41kb.
- Левашов Олег Александрович учебно-методический комплекс, 967.18kb.
- Буров Александр Сергеевич учебно-методический комплекс, 165.1kb.
- Смирнов Валентин Петрович, д т. н., доцент, профессор (Ф. И. О., ученая степень, ученое, 281.15kb.
1,000 кал = 4,187 Дж; 1,00 атм = 101325 Па = 760 мм рт. ст.;
1,00 л = 1,00 дм3 = 10-3 м3 1,00 мл = 1,00 см3
5.5. Расчет массы водорода в объеме колбы: m (H2) =
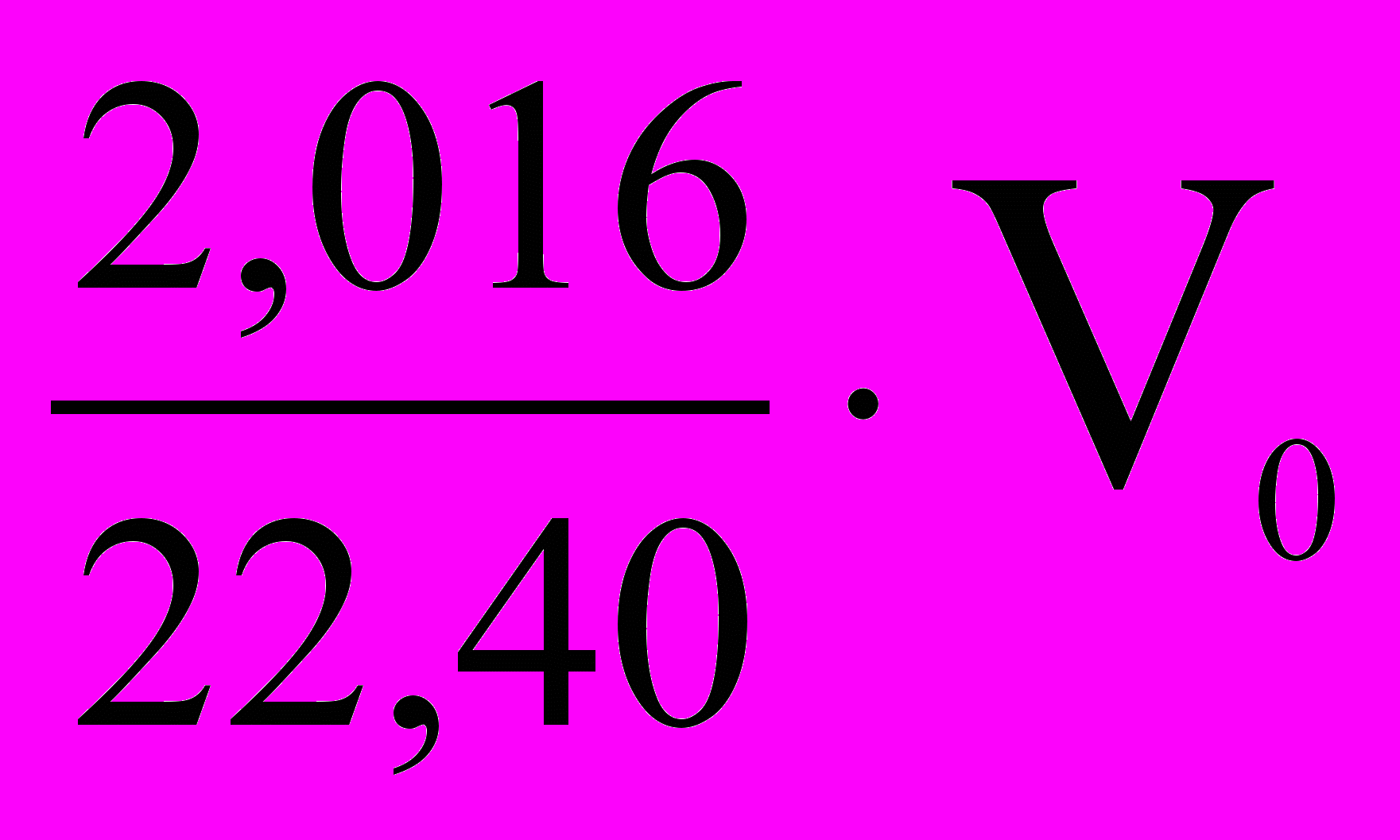 =
=5.6. Расчет относительной плотности диоксида углерода по воздуху и водороду:
Д (CO2/ воздух) =
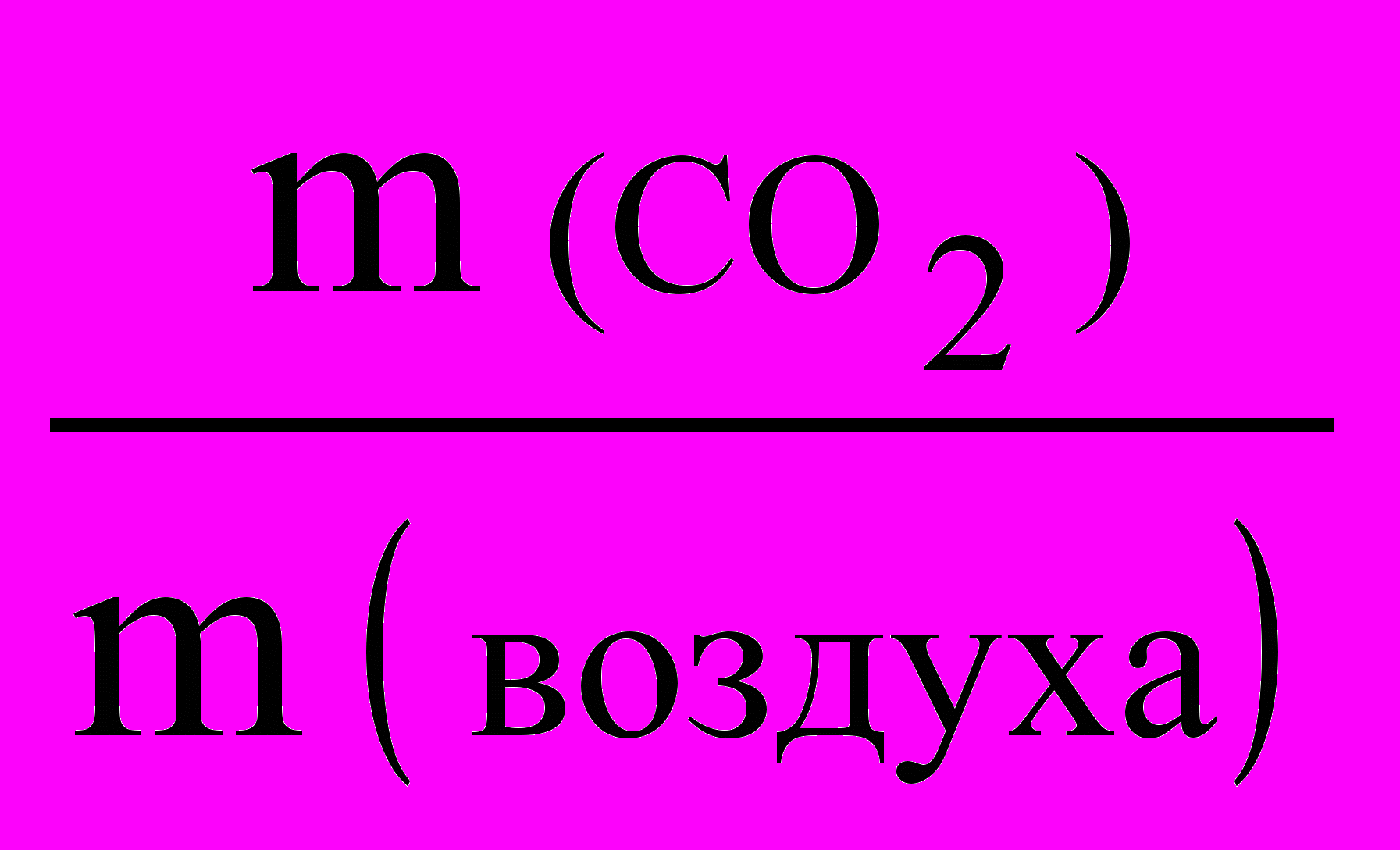 = Д (CO2 / H2) =
= Д (CO2 / H2) =  =
=6. Расчет молярной массы оксида углерода (IV)
6.1. По следствию из закона Авогадро:
 =
= 6.2. По уравнению Клапейрона-Менделеева:

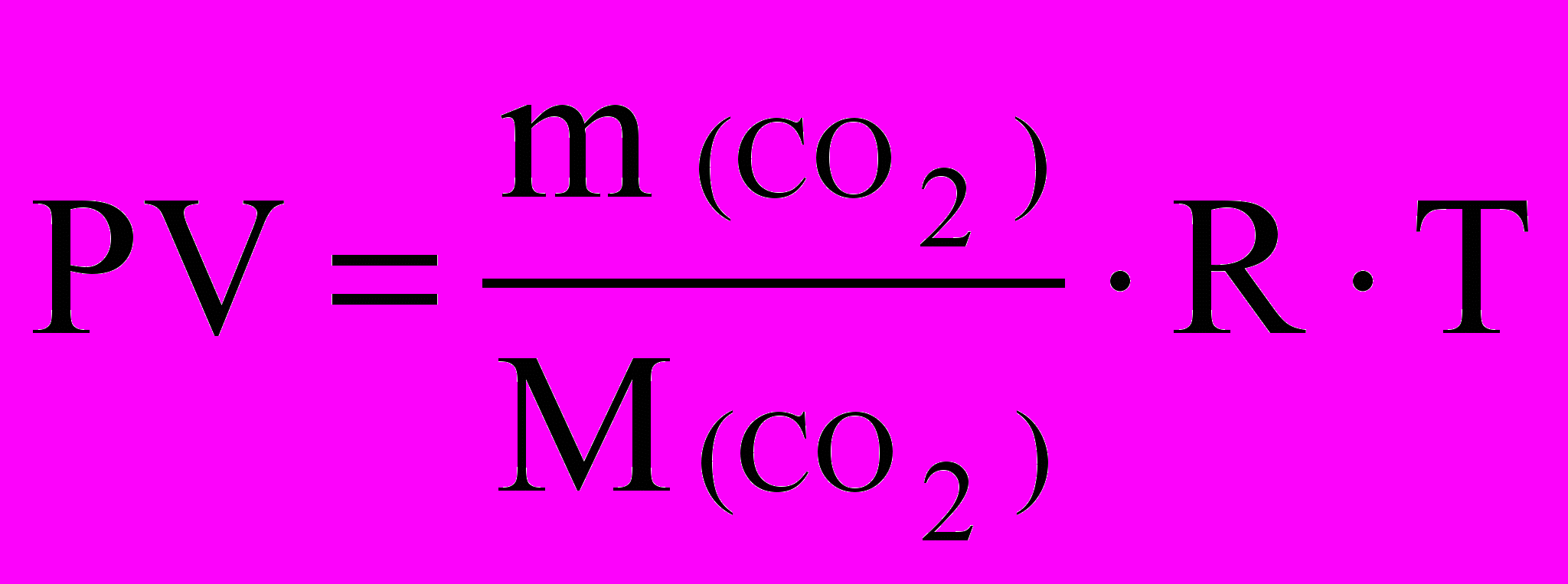 ,
, 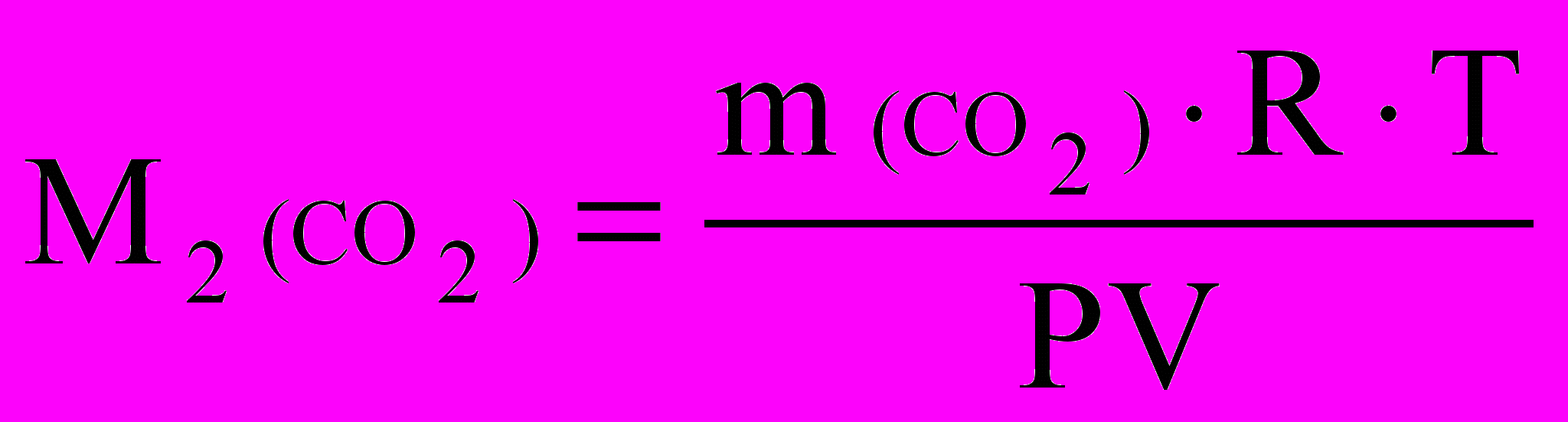
6.3. По относительной плотности оксида углерода (IY):
M
3(CO2) = 28,96 Д(CO2/воздух) = M4(CO2) = 2,016 Д(со2/Н2 )=
7. Расчет погрешности эксперимента.
Абсолютная погрешность
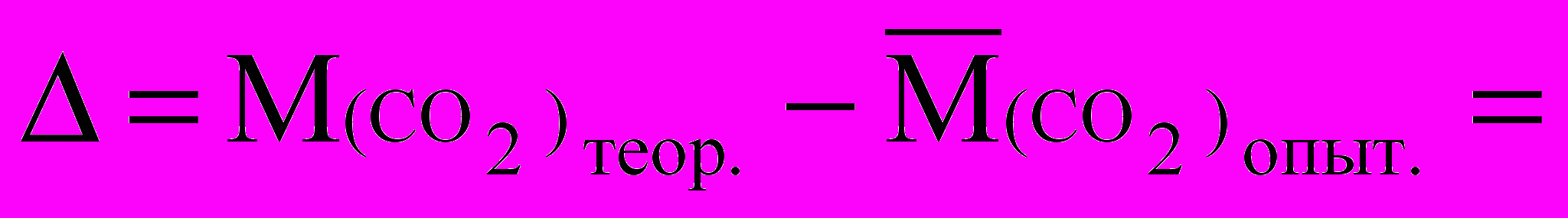
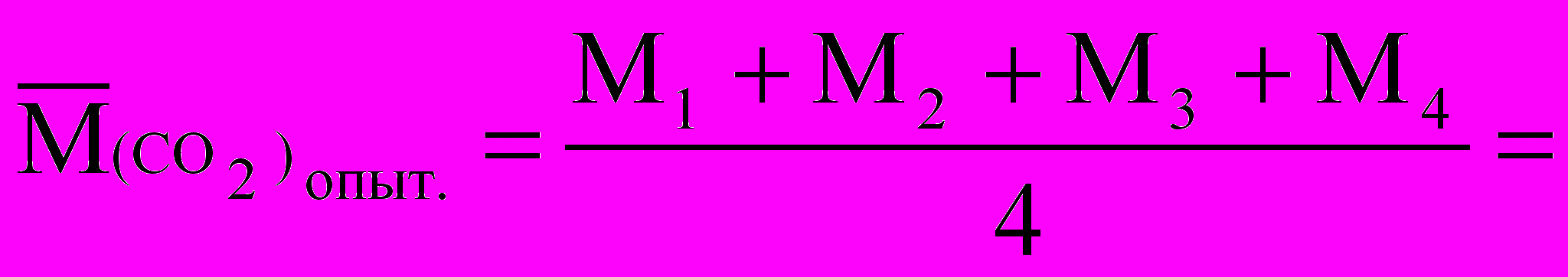
Относительная погрешность:
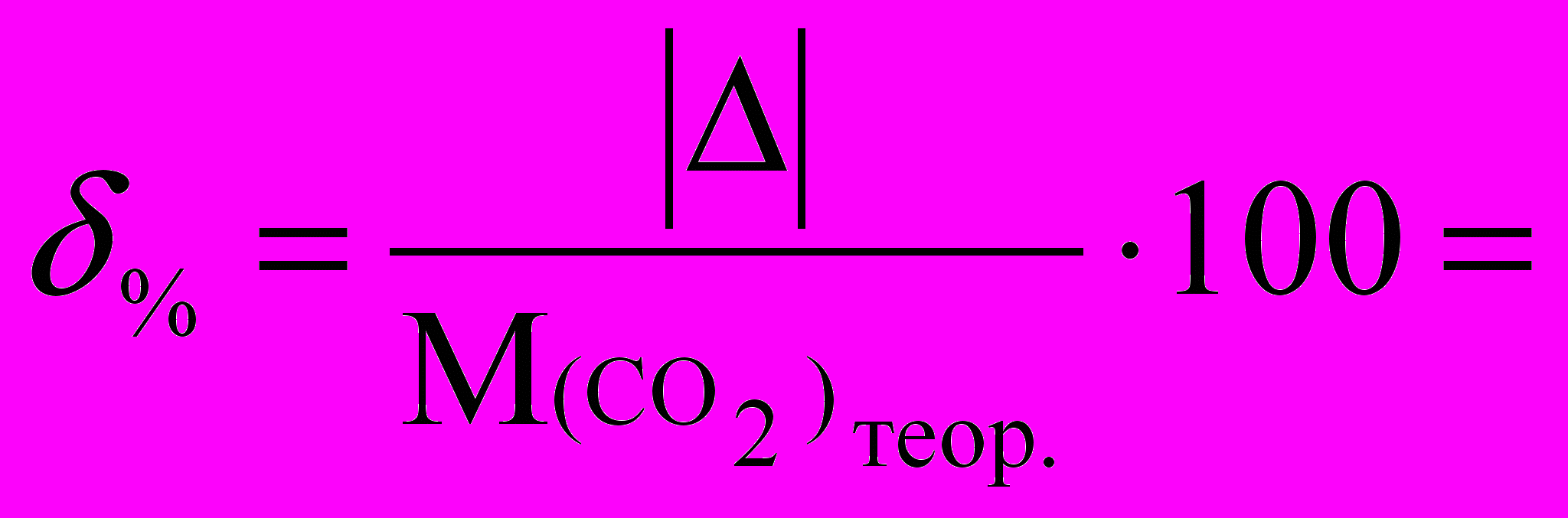
Лабораторная работа №
Определение молярной массы эквивалента цинка
Закон эквивалентов. К. Венцеля и И. Рихтера (1793 г.) : вещества реагируют и образуются в эквивалентных количествах:
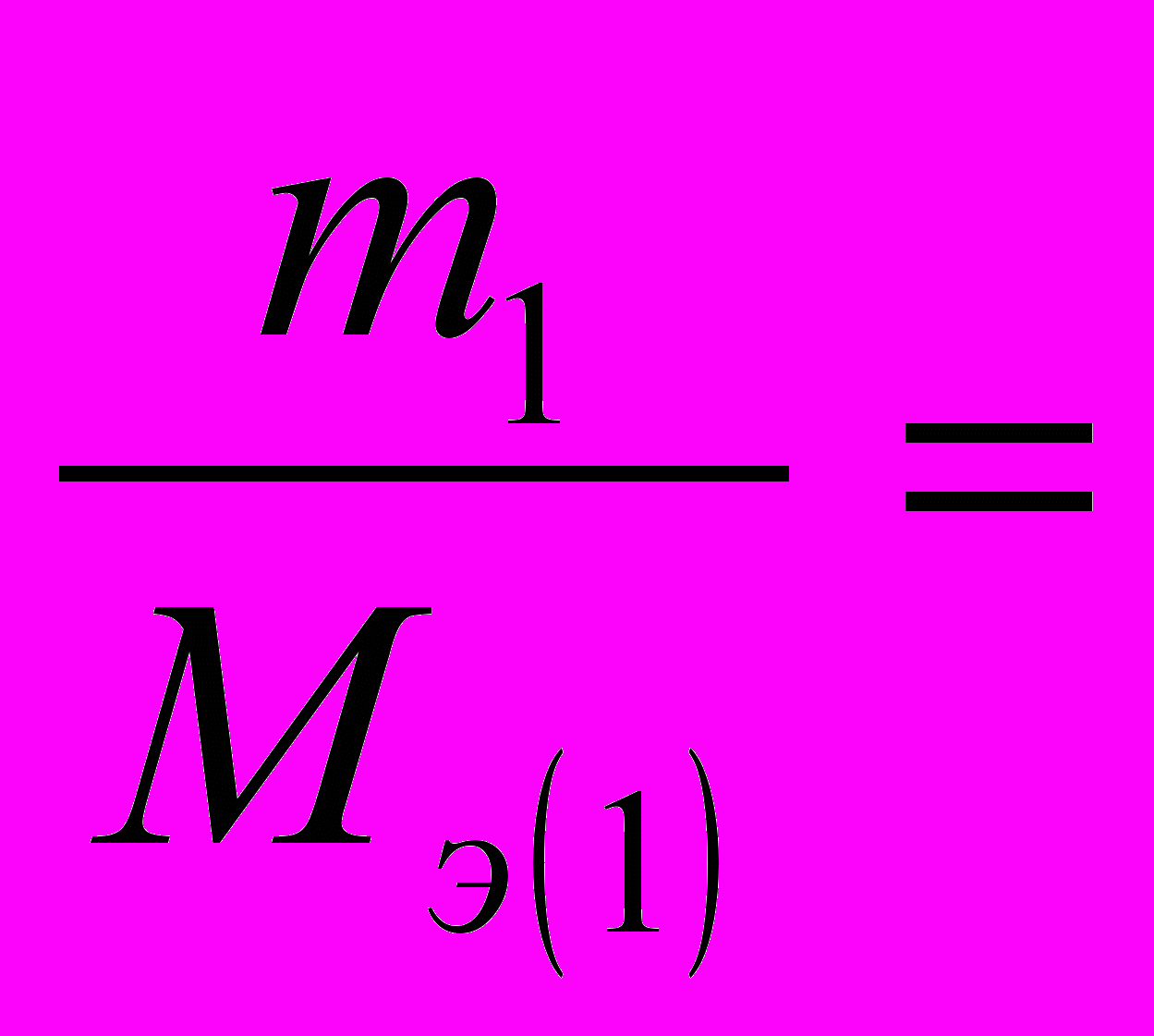
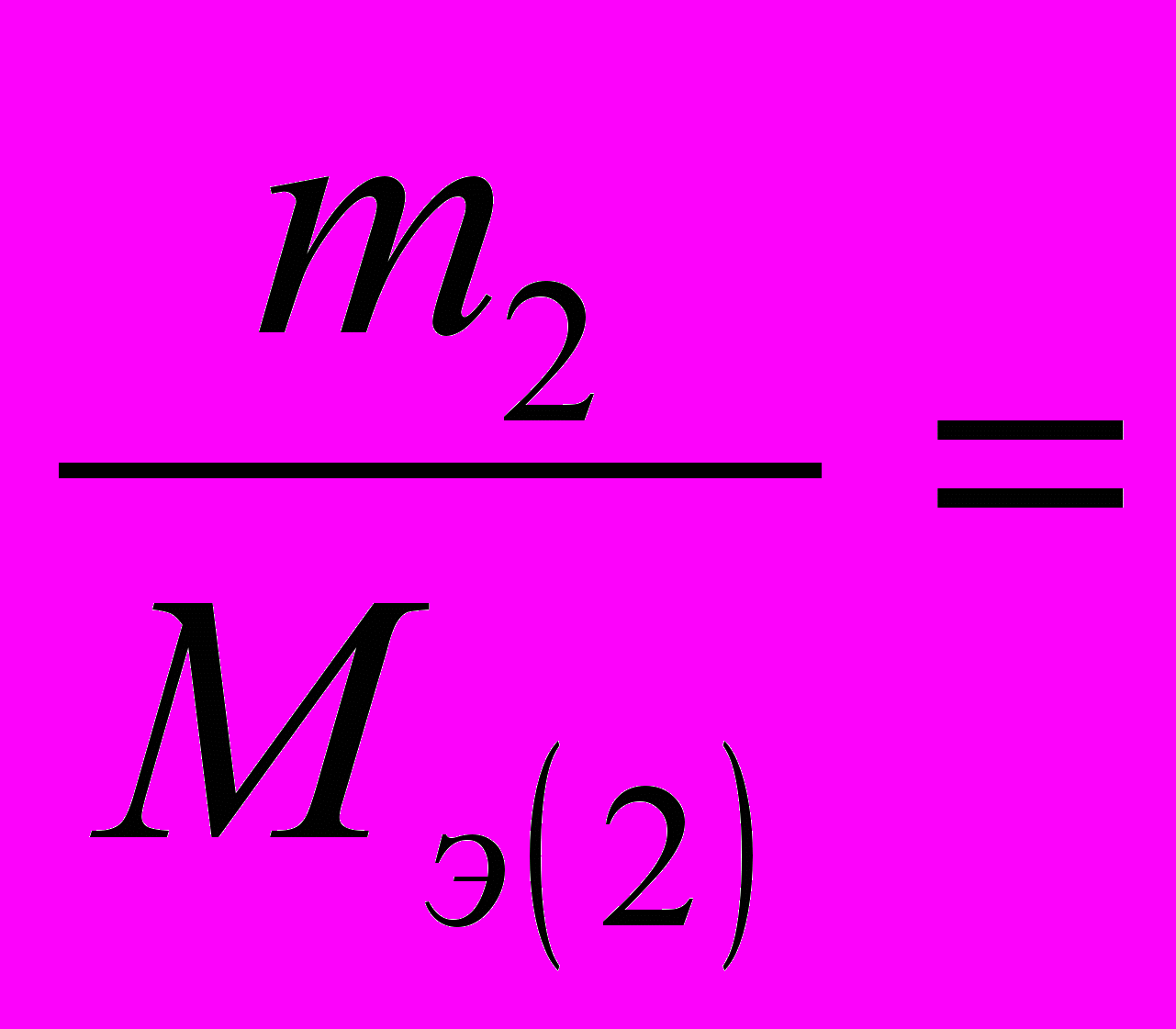

Литература: Н.Л. Глинка, Общая химия, Л. , Химия, 1985, с.28-34.
Лабораторный практикум под ред. А.А. Таперовой, М., ВШ., 1976, с. 31-34.
Цель работы - определение молярной массы эквивалента (Мэ) с использованием реакции замещения.
- Уравнение реакции:
- Схема прибора:
3. Последовательность выполнения работы
3.1. Проверьте герметичность прибора.
3.2. Взвесьте цинковую пластинку (mZn) с погрешностью 0,01 г.
3.3. Налейте в колбу Вюрца 15%-ный раствор HCl (не более 1/3 объема колбы).
3.4. Поместите в колбу Вюрца цинковую пластинку, быстро закройте колбу
резиновой пробкой и немедленно откройте зажим.
3.5. После завершения реакции, охладите реакционную смесь, плотно закройте
зажим и измерьте с помощью мерного цилиндра объем воды в приемнике.
3.6. Экспериментальные величины, а также значения температуры и давления, найденные по соответствующим приборам, запишите в табл. I.
Таблица I. Результаты измерений
| М 2 асса цинка г mZn | Объем выде- лившегося водорода, см3 VH2 = VH2 O | Температура | Атмосферноедавлениемм рт. ст. (Pатм ) | Парциальное давление при tС, мм рт. ст. | ||
| t, С | T, К | |||||
| водяного пара PH2 O | водорода PH =Pатм-PH 2O | |||||
- Справочные величины приведены в таблице 2
Таблица 2. Давление насыщенного водяного пара в равновесии с водой
| Температура, С | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | |
Давле-ние пара | Па 103 | 1,81 | 1,93 | 2,06 | 2,19 | 2,33 | 2,48 | 2,64 | 2,81 | 2,98 |
| мм рт.ст. | 13,6 | 14,5 | 15,4 | 16,4 | 17,5 | 18,6 | 19,8 | 21,0 | 22,3 | |
1 атм. = 101325 Па = 760 мм рт. ст. = 1,013 106 дн /см 3
Теоретическое значение молярной массы эквивалента цинка (Мэ) в проводимой реакции составляет 32,69 г/ моль.
