Землянский Яков Яковлевич к Х. н., профессор учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
- Учебно-методический комплекс Специальности: 080301 Коммерция (торговое дело) Москва, 848.48kb.
- Алексунин Владимир Алексеевич, профессор, к э. н., профессор кафедры маркетинга и рекламы, 1296.15kb.
- Слонов Людин Хачимович Доктор биологических наук, профессор, профессор кафедры ботаники, 823.83kb.
- Литвинюк Александр Александрович д э. н., профессор должность профессор учебно-методический, 654.29kb.
- Панкратов Леонид Васильевич Д. т н., профессор учебно-методический комплекс, 948.73kb.
- Парамонова Татьяна Николаевна д э. н., профессор Красюк Ирина Николаевна к э. н., доцент,, 1704.02kb.
- Мудревский Александр Юзефович учебно-методический комплекс, 1001.41kb.
- Левашов Олег Александрович учебно-методический комплекс, 967.18kb.
- Буров Александр Сергеевич учебно-методический комплекс, 165.1kb.
- Смирнов Валентин Петрович, д т. н., доцент, профессор (Ф. И. О., ученая степень, ученое, 281.15kb.
Таблица 3. Значения Универсальной газовой постоянной
| Единицы измерения | 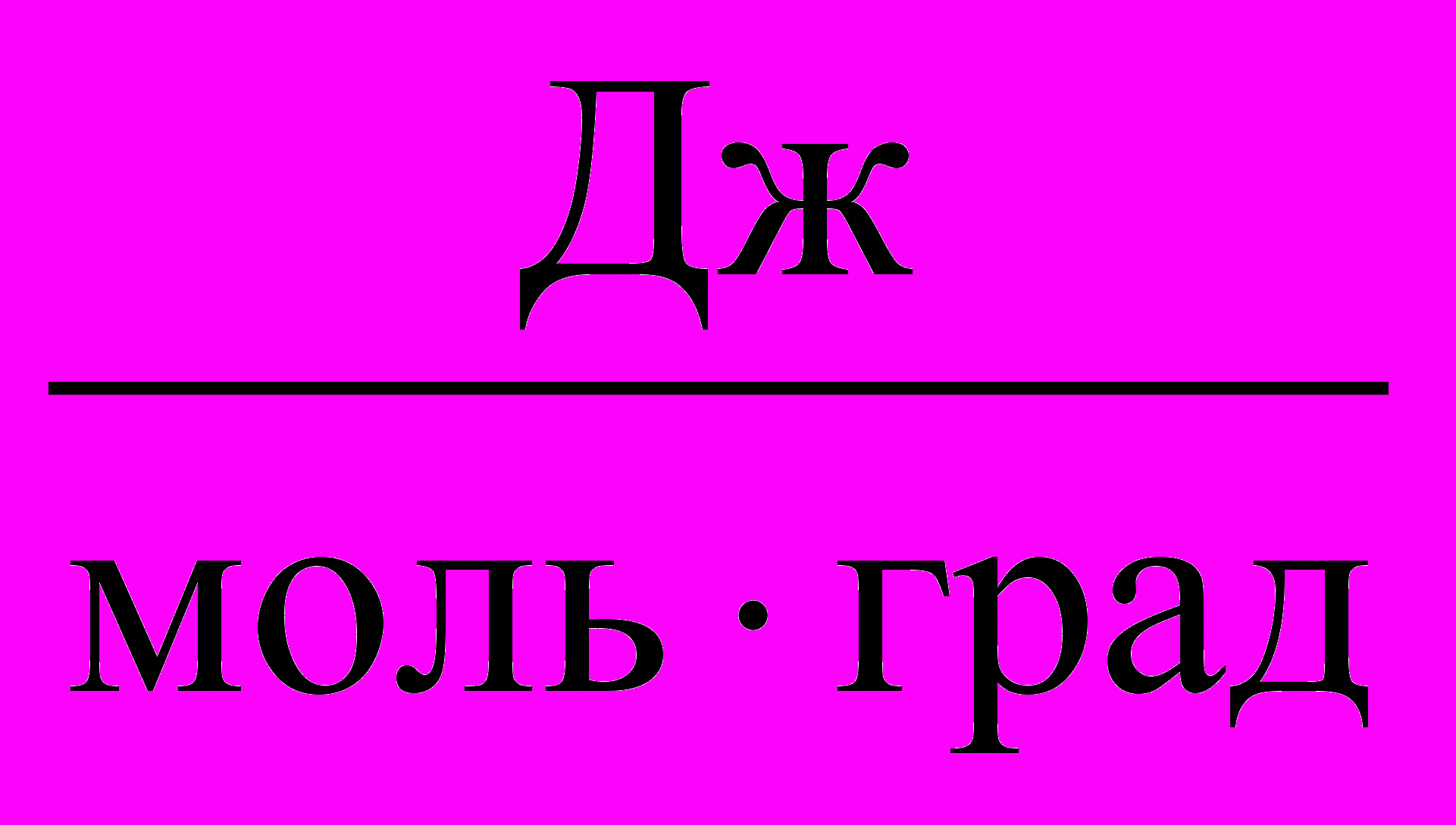 | 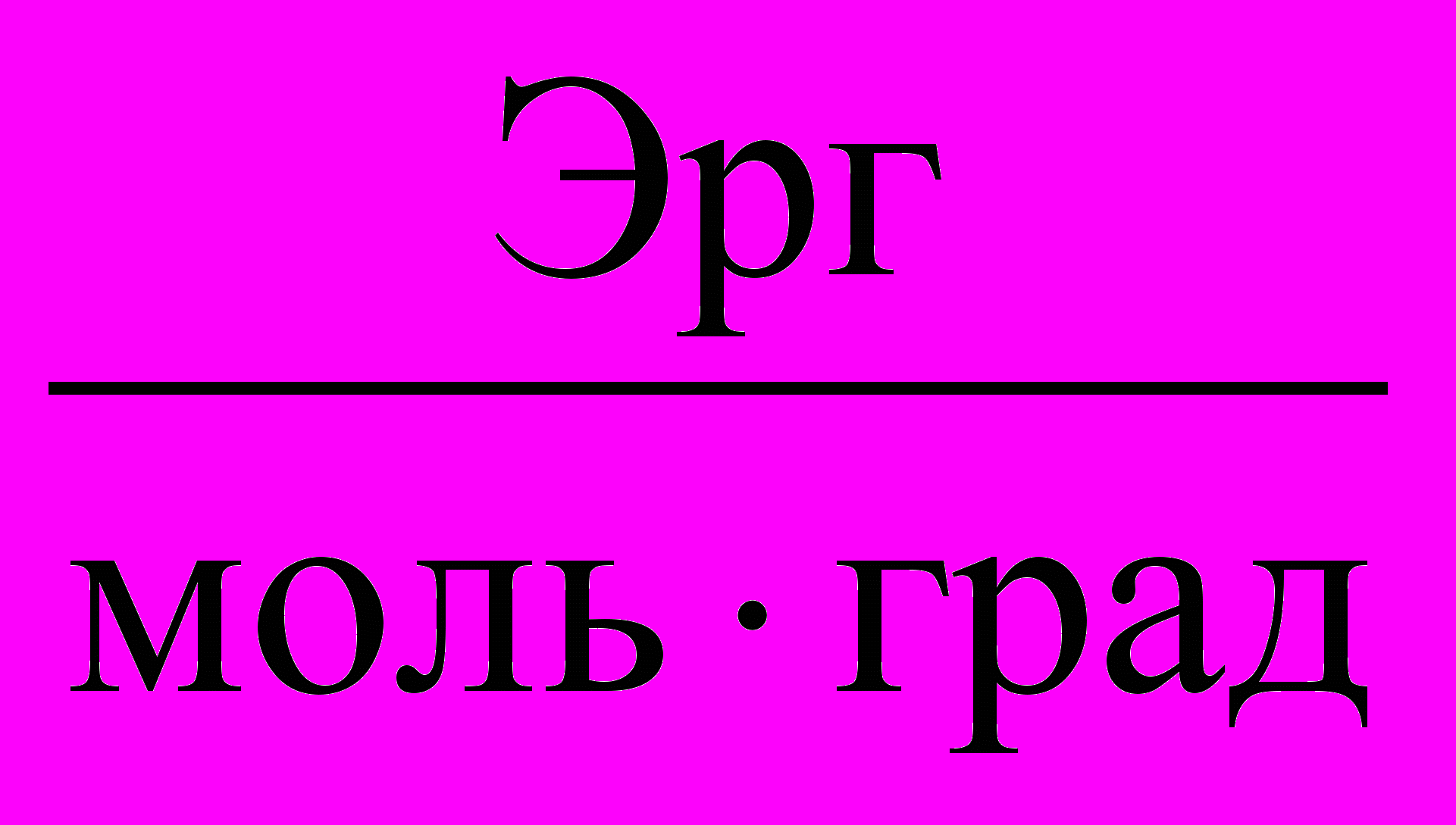 | 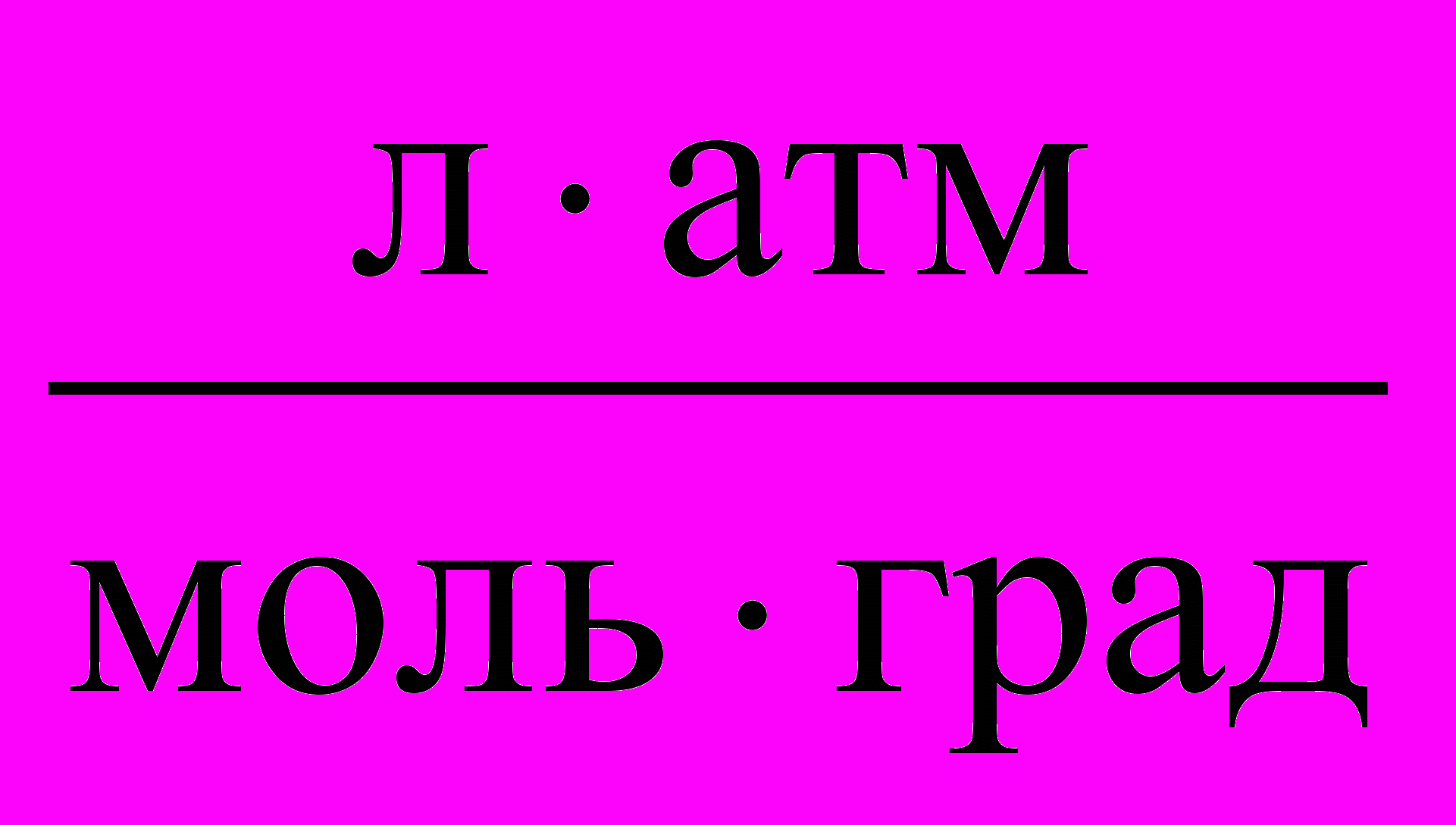 | 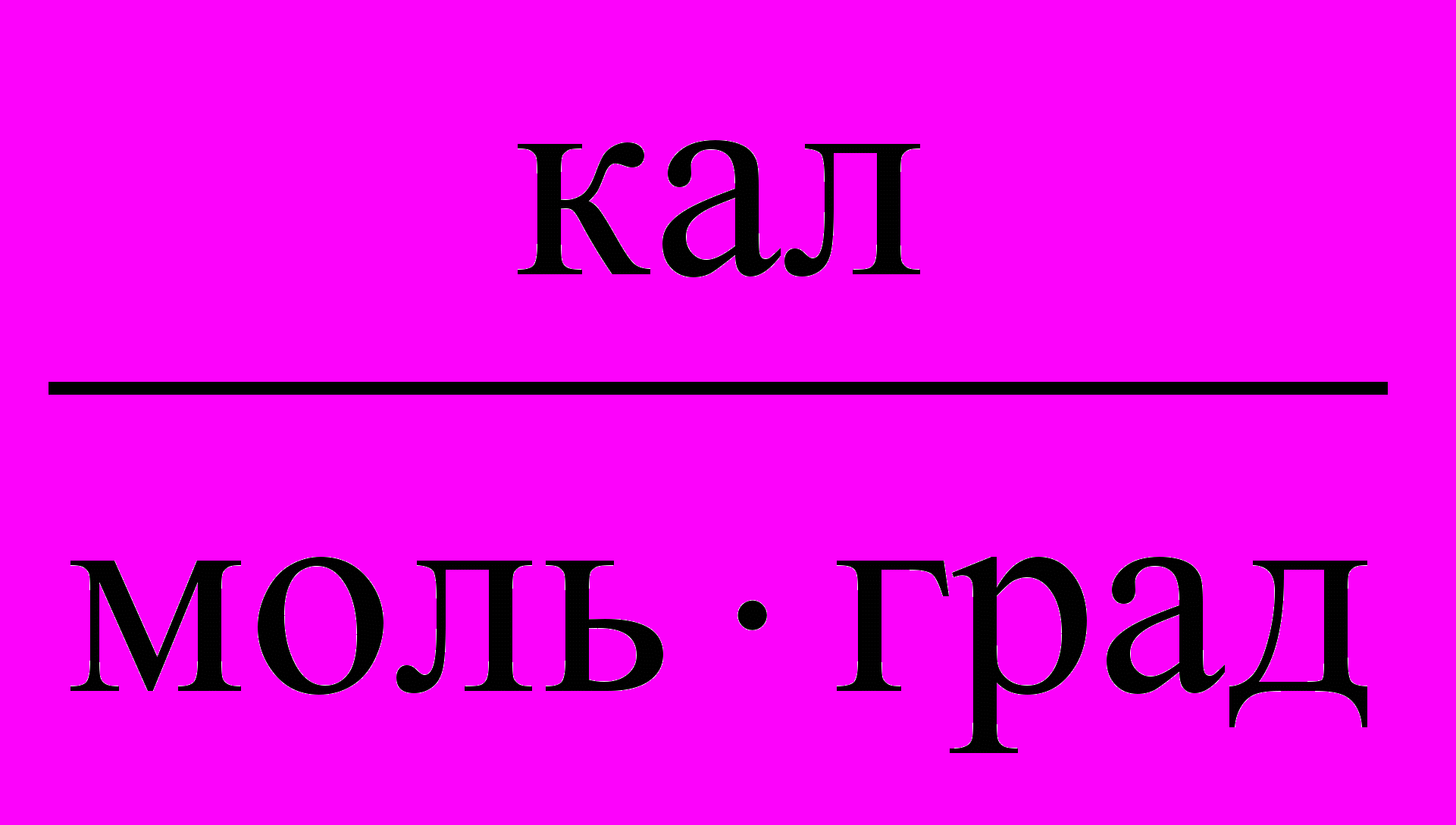 |  |
| значения | 8,3145 | 8,3145107 | 0,082057 | 1,9858 | 62360 |
5. На основании полученных результатов проведите следующие расчеты
5.1. Расчет молярной массы эквивалента цинка по массе выделившегося водорода в соответствии с законом эквивалентов.
Массу водорода рассчитайте по уравнению Клапейрона-Менделеева с
использованием данных из таблиц 1 и 3:
2
2
P( H ) V(H ) =
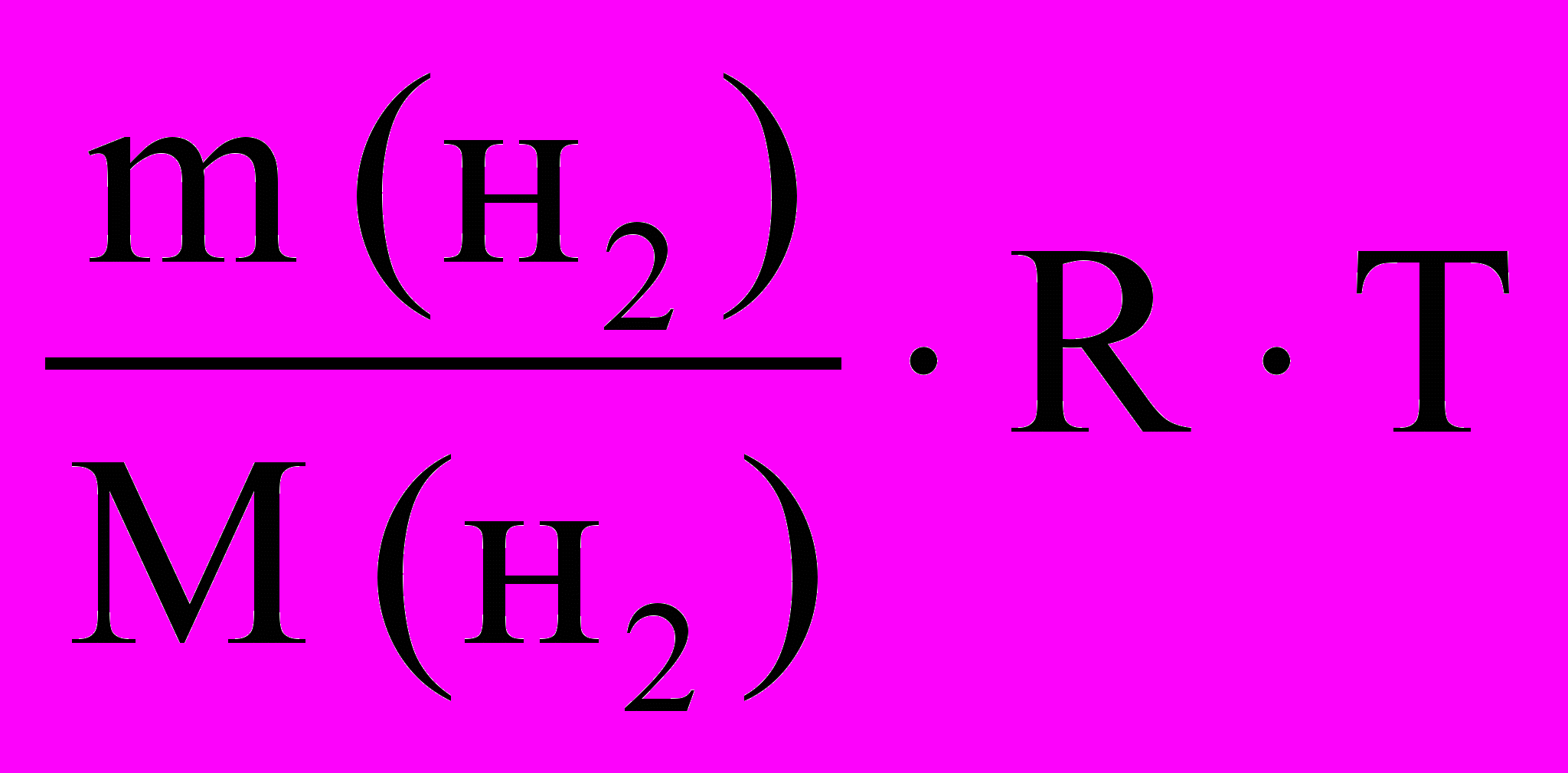
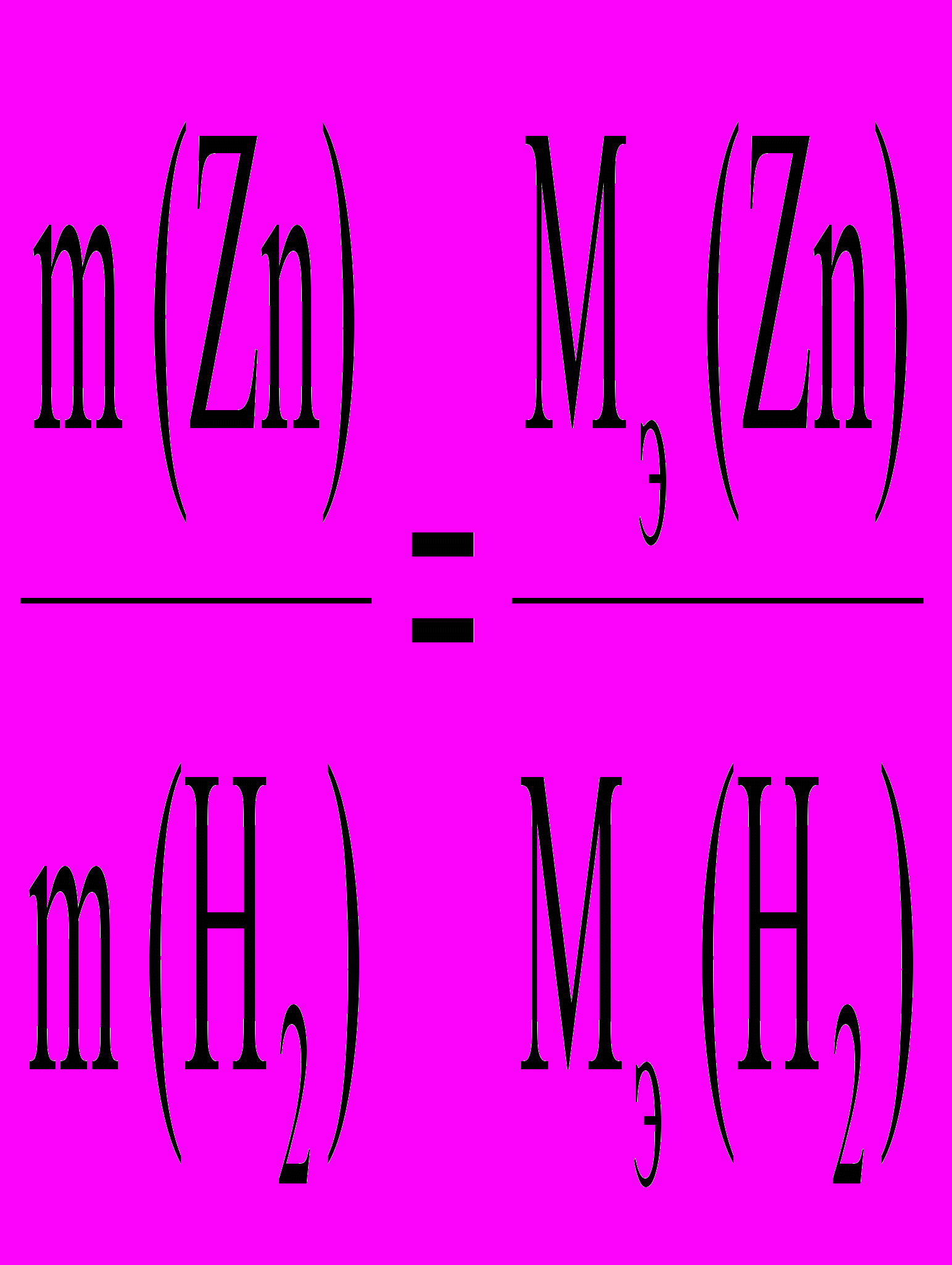 , Mэ (H2) = 1,008 г/ моль, Мэ (Zn)1 = …
, Mэ (H2) = 1,008 г/ моль, Мэ (Zn)1 = …5.2. Расчет молярной массы эквивалента цинка по объему выделившегося
водорода.
По закону эквивалентов :
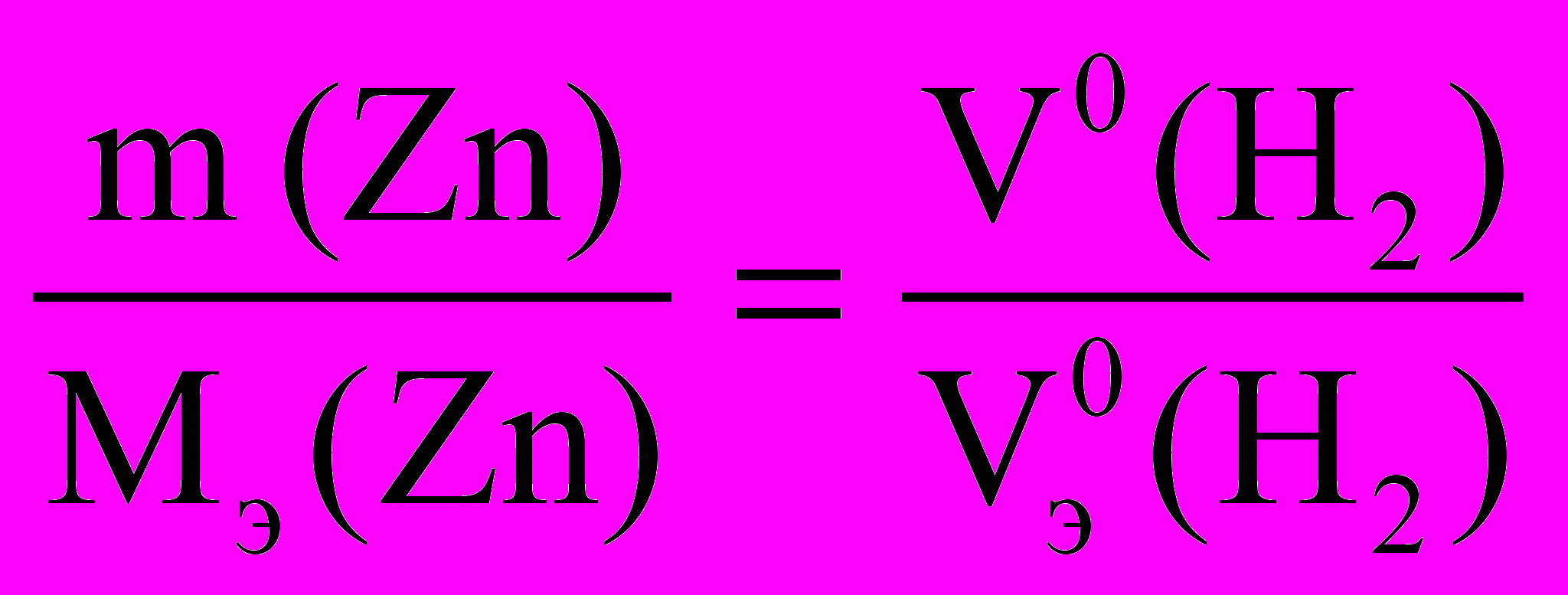
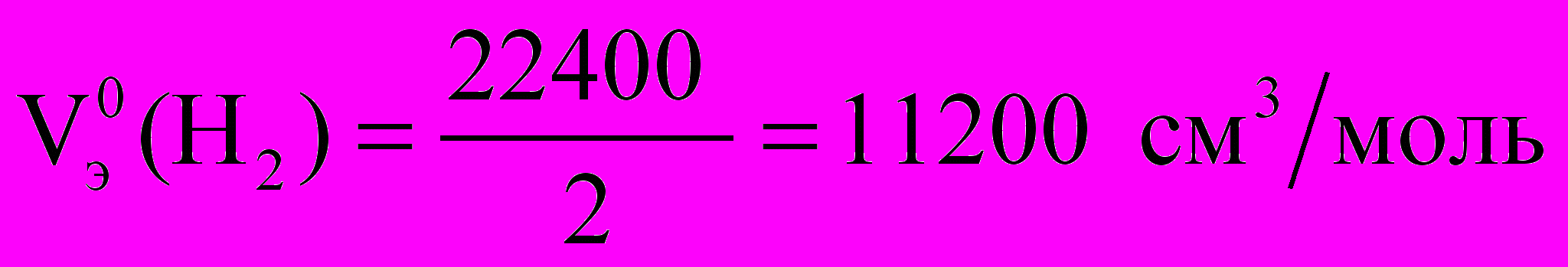 Мэ (Zn)2 =
Мэ (Zn)2 = Расчет объема водорода при нормальных условиях выполняют по уравнению Объединенного газового закона:
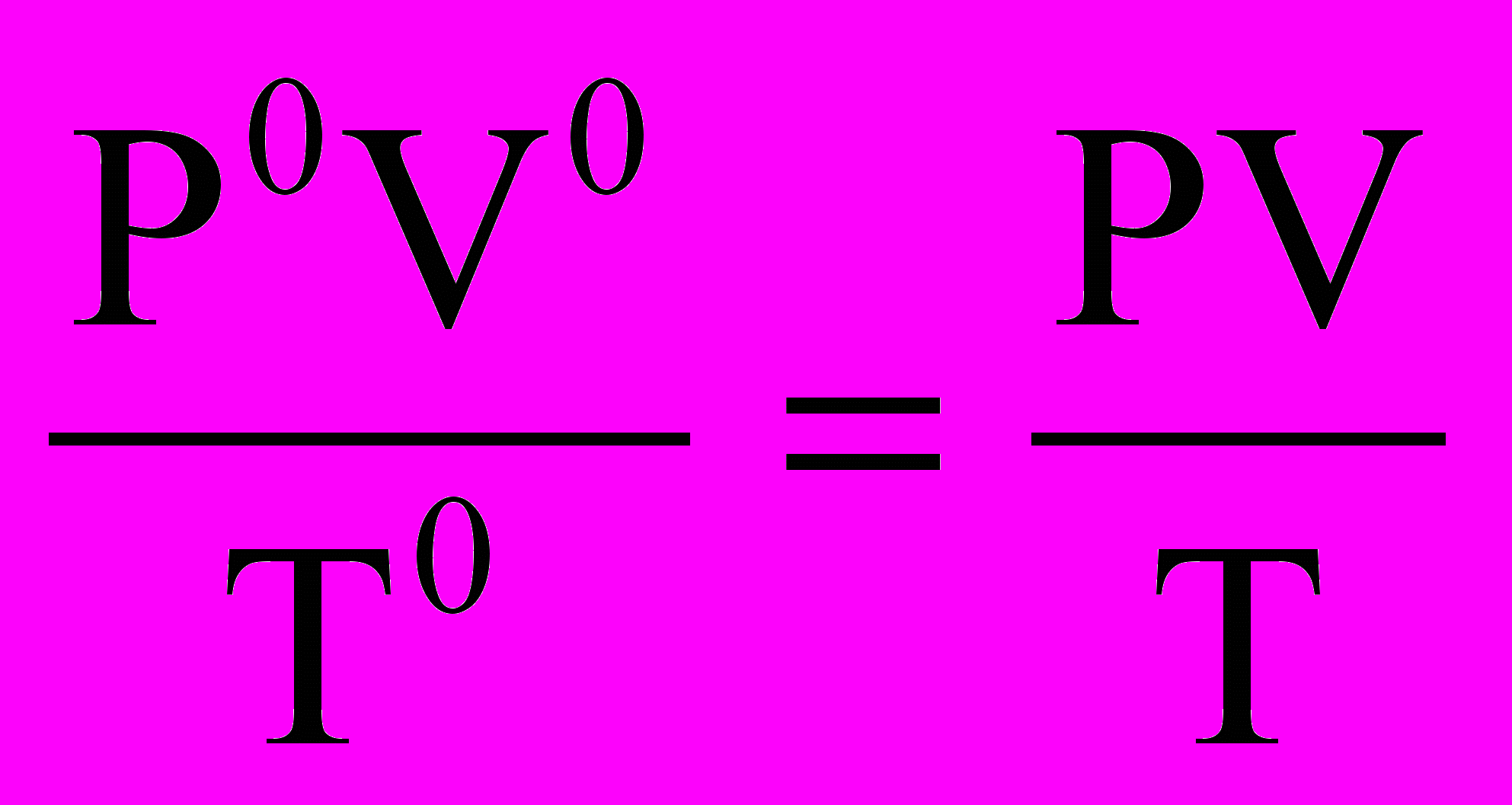 , V0 (H2) =
, V0 (H2) = 6. Проведят расчет погрешности эксперимента
6.1. Абсолютная погрешность
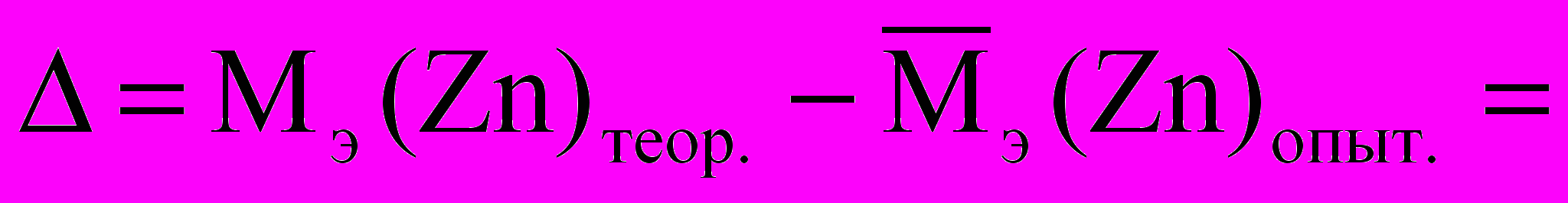
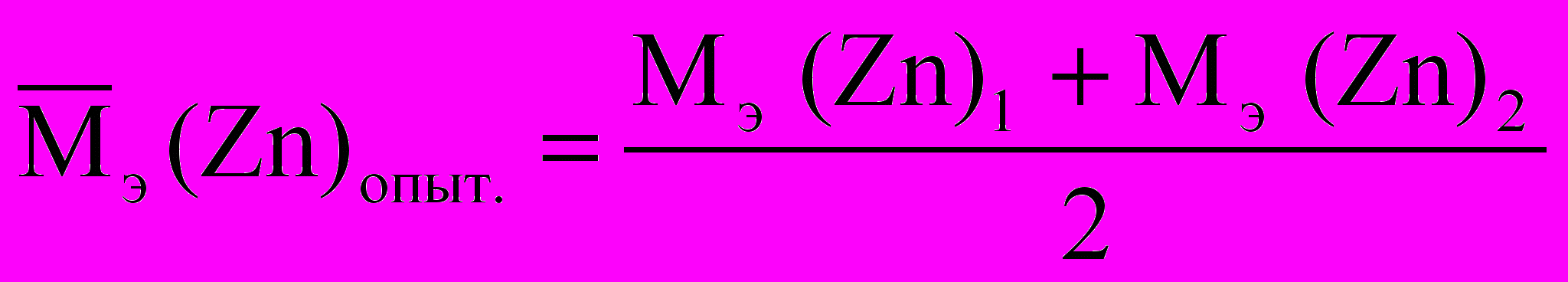
6.2. Относительная погрешность :
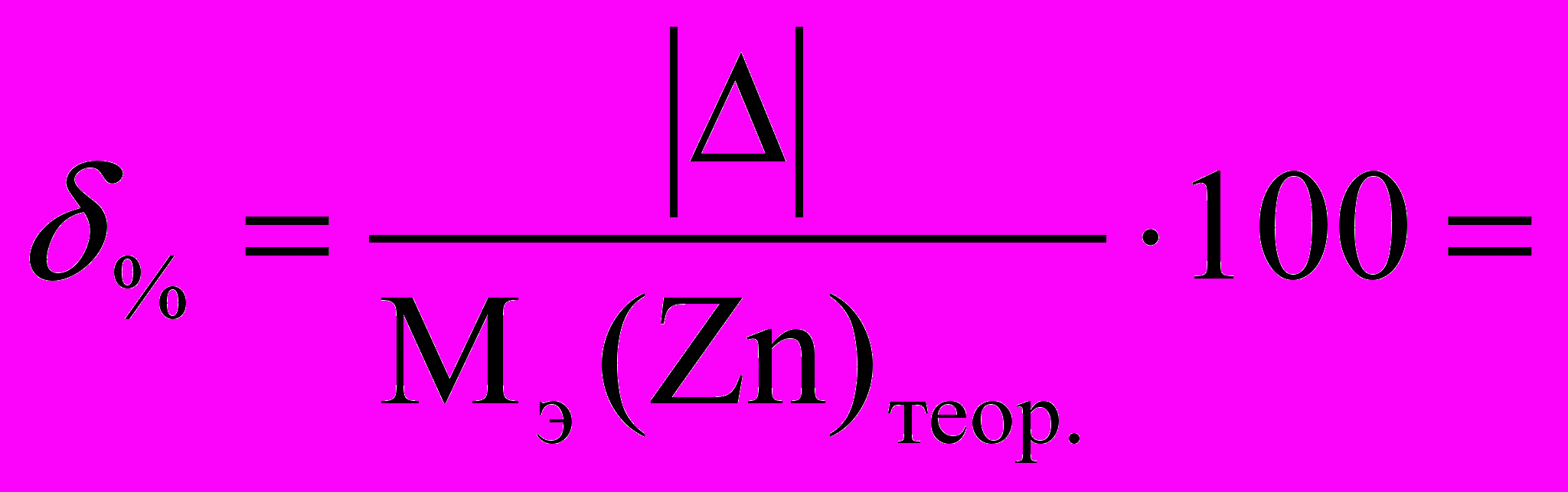
6. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ
Тема 1. Основные понятия химии [2]
Изучите основные понятия химии: атом, молекула, моль, эквивалент, классы соединений.
Эквивалент химический, условная частица, которая по своему действию в химических реакциях равнозначна одному протону в обменных процессах или одному электрону в процессах окисления-восстановления.
Эквивалент вещества А обозначается как Эк(А)
Молярная масса эквивалента - Мэк
Численно эквивалент атомарного водорода принят равным 1,00, а атомарного кислорода – 8,00. Таким образом, моль водорода (Н2) содержит 2 моль эквивалентов атомарного водорода (Н), а моль кислорода (О2) – 4 моль эквивалентов атомарного кислорода (О).
Эквивалент вещества является величиной переменной. Его численное значение зависит от реакции, в которой участвует это вещество:
-
n=1
NaH2PO4
MЭК(H3PO4) = 98,0 г/моль экв
n=2
H3PO4 + n NaOH
–––––
Na2HPO4
MЭК(H3PO4) = 49,0 г/моль экв
М(H3PO4) = 98 г/моль
n=3
Na3PO4
MЭК(H3PO4) = 32,7 г/моль экв
В окислительно-восстановительных реакциях МЭК окислителя (или восстановителя) соответствует молекулярной массе, деленной на то число электронов, которое приобретается (теряется) одним атомом окислителя (восстановителя) в рассматриваемой окислительно-восстановительной реакции.
-
H+, +5ē
Mn2+
MЭК(MnO4-) = 23,8 г/моль экв
H2O, +3ē
MnO4- + NO2-
–––––
MnO2
MЭК(MnO4-) = 39,6 г/моль экв
OH-, +ē
MnO42-
MЭК(MnO4-) = 118,9 г/моль экв
Закон эквивалентов Рихтера (1793).
Вещества реагируют и образуются в эквивалентных количествах.
nЭК(1) = nЭК(2) = nЭК(3) …
где nЭК(А) – число молярных эквивалентов вещества А, моль экв.
-
nЭК(А) =
m(А)
МЭК(А)
-
m(1)
=
m(2)
=
m(3)
Эк(1)
Эк(2)
Эк(3)
-
или:
m(1)
=
Эк(1)
;
m(1)
=
Эк(1)
;
m(2)
=
Эк(2)
m(2)
Эк(2)
m(3)
Эк(3)
m(3)
Эк(3)
Задача 1. При сгорании 5,00 г трехвалентного металла образовалось 9,45 г его оксида. Определите молярную массу эквивалента этого металла и назовите металл.
-
m(1)
=
m(2)
МЭК(1)
МЭК(2)
m(O) = 9,45 - 5,00 = 4,45 г
МЭК(О) = 8,00
-
5,00
=
4,45
x =
5,00 · 8,00
= 8,99 г/моль экв. Эк(Ме) = 8,99
x
8,00
4,45
-
B =
A
А = В · Эк = 3,00 · 8,99 = 27,0
Эк
Задача 2. 0,978 г щелочного металла реагирует с 0,200 г кислорода и с 3,17 г галогена. Определите эквивалент галогена и назовите его.
-
m(1)
=
m(2)
=
m(3)
Эк(1)
Эк(2)
Эк(3)
-
0,200
=
3,17
x =
3,17 · 8,00
= 127
8,00
х
0,200
2Me + xГ2 2MeГx
Г2 + 2ē = 2Г-
-
Эк(Г2)=
Мr(Г2)
2
Мr(Г2)= 2 · 126,8 = 253,6
-
Аr(Г)=
Мr(Г2)
Аr(Г)=126,8
2
Галоген – иод
-
0,200
=
0,978
8,00
y
-
y = Эк(Ме) =
0,978 · 8,00
= 39,1
0,200
Аr(Ме) = Эк(Ме) · В Аr(Ме) = 39,1 · 1,00 = 39,1
Одновалентный металл – калий.
Задача 3. Чему равен эквивалент щелочноземельного металла и его оксида, если известно, что 0,608 г металла вытесняют из раствора соляной кислоты 0,560 л водорода (н.у.)? Определите металл.
-
m(1)
=
V0(2)
Эк(1)
VЭК(2)
Эк(Н) = 1,00; Mr(H2) = 2
-
VM(H2) =22,4
2,00 – 22,4
V0ЭК(H2) =
22,4
= 11,2
дм3
1,00 – x
2,00
моль экв
-
0,608
=
0,560
; y = 12,2
y
11,2
Ar(Me) = 12,16 · 2 = 24,3
Металл – магний.
-
Эк(оксида) = Эк(элемента) + Эк(О) = 8,00 + Эк(элемента)
Эк(MgO) = 12,2 + 8,0 = 20,2
Эк(сульфата металла) = Эк(Ме) + Эк(SO42-)
Эк(хлорида металла) = Эк(Ме) + Эк(Cl-)
Задача 4. 0,200 г двухвалентного металла вытеснили 197 см3 водорода, который был собран под водой и измерен при 20ºС и 780 мм Hg. Давление насыщенных паров воды при этих условиях составляет 17,4 мм Hg. Определите какой это металл.
Робщ = Р(H2) + Р(H2O(г))
Р(H2)= 780,0 - 17,4 = 762,6 мм Hg
-
Р V
=
Р0V0
T
T0
-
V0(H2) =
Р·V·T0
=
762,6·197·273,15
=184 см3
T·Р0
293,15·760
-
m(Ме)
=
V0(Н2)
Эк(Ме)
V0ЭК(Н2)
-
Эк(Ме) =
0,200 · 11,2
= 12,2
0,1842
Ar(Me) = Э · В = 12,16 · 2,00 = 24,3
Металл – магний.
Задача 5. 3,16 г перманганата калия взаимодействуют с концентрированной соляной кислотой. Образующийся хлор пропустили в раствор иодида калия. Сколько граммов иода выделилось, если общий выход реакций составил 80 %?
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Cl2 + 2KI = 2KCl + I2
nЭК(KMnO4) = nЭК(Cl2) = nЭК(I2)
-
+4 +5ē +2
KMnO4 MnCl2
-
MЭК(KMnO4)=
M(KMnO4)
=
158
= 31,6 г/моль экв
5
5
nЭК(KMnO4) =
3,16
= 0,100 nЭК(I2) = 0,10 моль экв
31,6
-
2I- - 2ē = I2 MЭК(I2)=
254
= 127
2
mтеорет.(I2) = nЭК(I2) · MЭК(I2)= 0,100 ·127 = 12,7 г
mпрактич.(I2) = 12,7 · 0,80 = 10,16 г 10,2 г
Тема 2. Строение вещества [2]
Изучите строение атома. Выучите правила Гунда, Клечковского, принцип Паули. Изобразите электронную конфигурацию атомов с порядковыми номерами 9, 16, 45, 72.найдите положение этих элементов в периодической таблице.
Тема 3. Периодический закон – основа химии [2]
Изучите формулировку периодического закона по Менделееву. Приведите современную формулировку периодического закона. Выявите причину в периодичности свойств атомов различных элементов.
Тема 4. Химическая связь и строение молекул [2]
Изучите основные виды химической связи. Перечислите характеристики химической связи. Рассмотрите особенность образования химической связи.
Тема 5. Элементы химической термодинамики. Термохимия [2]
Ознакомьтесь с понятиями: энтальпия, энтропия. Изучите написание термохимических уравнений. Выучите формулировку закона Гесса.освойте простейшие термохимические расчеты (расчет теплового эффекта реакции, расчет стандартной энтальпии образования вещества).
Тема 6. Химическая кинетика и химическое равновесие. Гетерогенные равновесия [2]
Выучите общую формулу для расчета скорости простейших гомофазных и гетерофазных химических реакций. Изучите факторы, влияющие на скорость реакции. Рассмотрите роль катализаторов и ингибиторов в химических процессах.
Рассмотрите химическое равновесие. Изучите принцип Ле-Шателье. определите способы смещения равновесий.
Тема 7. Растворы и их свойства [2]
Изучите классификацию растворов. Приведите конкретные примеры твердых, жидких и газообразных растворов. Рассмотрите понятие осмотического давления. Сумейте ответить, почему растворы кипят при более высокой температуре и замерзают при более низкой, чем чистые растворители.
Тема 8. Способы выражения концентрации растворов [2,4]
Выучите формулы для расчета процентной, молярной и нормальной концентрации растворов.
Решите следующие задачи:
- Приготовьте 25,0 см3 раствора хлорида цинка молярной концентрации 0,10 моль/дм3. Чему равна нормальная концентрация этого раствора?
- Сколько граммов хлорида натрия потребуется взять для приготовления 4,50 дм3 10,0%-ного раствора плотностью 1,07 г/см3?
- 5,00 г металлического цинка прореагировало с 200 см3 раствора разбавленной серной кислоты с выделением водорода. Какова нормальная концентрация этой кислоты?
- Концентрированная серная кислота, имеющаяся в лаборатории, содержит 4,0% воды. Вычислите массу воды в 1,0 дм3 такой кислоты, если ее плотность 1840 кг/м3.
- Определите, какая масса хлорида натрия останется после выпаривания 0,1 дм3 раствора, концентрация которого 0,2 моль/дм3.
Тема 9. Водородный показатель, кислотность среды
Изучите шкалу рН. Научитесь рассчитывать рН и рОН для известных концентраций Н+ и ОН-. Решите ряд задач:
- Рассчитайте рН и рОН для 0,10М раствора НС1
- Рассчитайте рН 0,0050М раствора уксусной кислоты
- Рассчитайте рН ацетатного буферного раствора, если молярная концентрация уксусной кислоты 0,10М, а ацетата натрия – 0,01М.
Тема 10. Гидролиз солей
Выучите определение: обменная реакция взаимодействия соли с водой, сопровождающаяся изменением рН раствора и образованием слабодиссоциирующегося соединения называется гидролизом соли. Научитесь составлять уравнения гидролиза. Освойте применение расчетных формул для определения константы гидролиза, степени гидролиза и рН раствора гидролизующейся соли.
Решите задач Рассчитайте рН, Кг и αг раствора ацетата натрия, содержащего в 0,500л воды 2,05 г соли.
Составляют молекулярные и ионные уравнения гидролиза
CH3COO- + H2O CH3COOH + OH-
CH3COONa + H2O CH3COOH + NaOH, рН > 7
При необходимости проводят пересчет концентрации соли в моль/л:
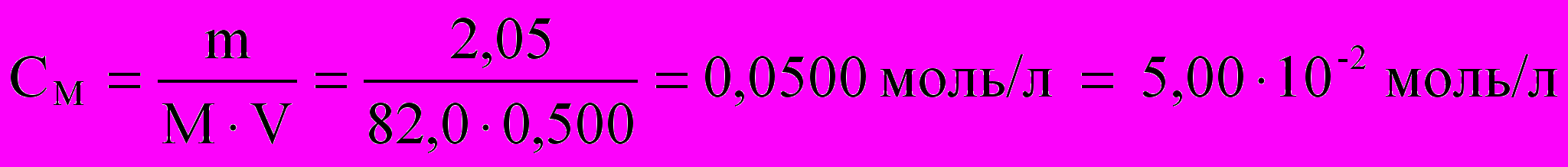
М(CH3COONa) = 82,0 г/моль
По справочнику находят константы диссоциации соответствующих слабых кислот и (или) оснований:
Кк = 1,7510-5
Рассчитывают Кг соли, разделив Кw на Кдис. слабой кислоты и (или) основания:
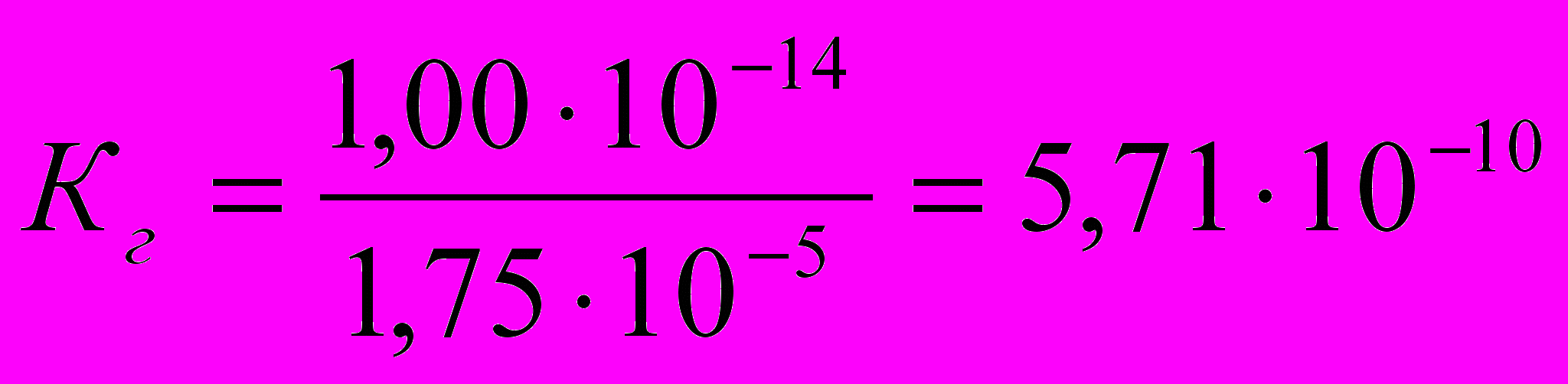
Исходя из найденного значения Кг, рассчитывают степень гидролиза соли:
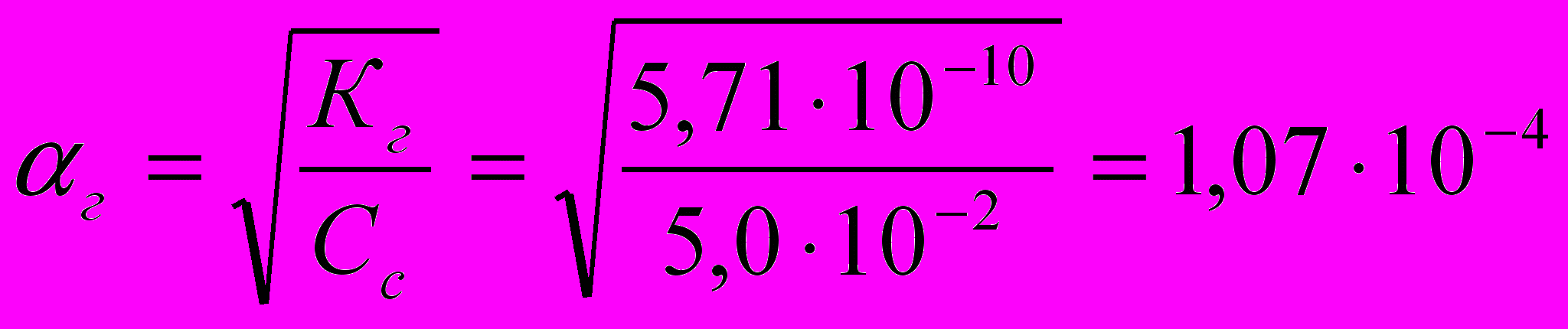
г 0,01%
По соответствующим формулам рассчитывают концентрацию [H+] или [OH-] в растворе гидролизующейся соли:
Рассчитывают [ОН-], т.к. реакция среды щелочная (п.1.)
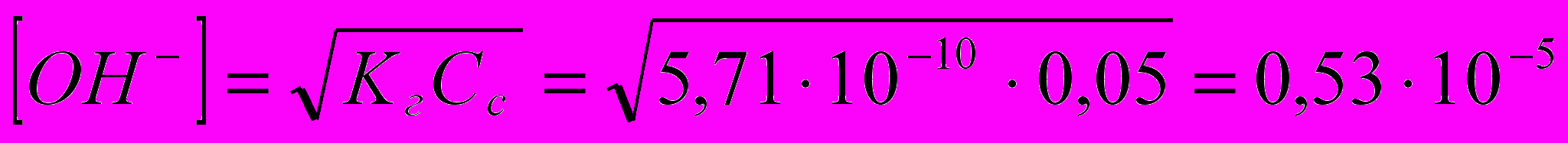 моль/л
моль/лВычисляют рН раствора
рОН = -lg 0,5310-5 = 5,00 – lg 0,53 =5,00 – (-0,28) = 5,28
pH = 14,00 – pOH = 14,00 – 5,28 = 8,72
Тема 11. Окислительно-восстановительные реакции [2]
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагентов, называются окислительно-восстановительными реакциями (ОВР).
Изучите способы классификации ОВР. Освойте подбор коэффициентов в уравнениях ОВР методом электронно-ионного баланса.
Тема 12. Электрохимические процессы. Электрохимическая коррозия и способы защиты металлов от коррозии [2].
Выучите расчетные формулы законов электрохимии М.Фарадея. Разберите электрохимическую коррозию в трех средах: кислой, нейтральной и щелочной. Ознакомьтесь с типами коррозии. Изучите электролиз расплавов и растворов солей.
Тема 13. Химические источники тока [2]
Изучите устройство и принцип действия свинцового аккумулятора. Обратите внимание на отличие химического источника электрической энергии от аккумулятора.
Тема 14. Комплексные соединения [2]
Изучите основные понятия химии комплексных соединений (КС): комплексообразователь, лиганд, внутренняя координационная сфера, внешняя сфера, устойчивость комплекса.
Освойте написание уравнений диссоциации КС по внешней и внутренней сфере.
Тема 15. Коллоидные системы [2]
Изучите особенности коллоидных растворов и их устойчивость во времени. Приведите конкретные примеры коллоидов: чай, кофе, молоко и т.д.
Тема 16. Периодическая система элементов Д.И.Менделеева. Химическая классификация элементов [2]
Классифицируйте элементы по электронному строению атомов (s-, p-, d-элементы). Охарактеризуйте периодическую таблицу: группы, периоды, подгруппы. Изучите характер изменения свойств элементов по группам и периодам.
Тема 17. Металлы и свойства их соединений[2]
Изучите общие свойства металлов. Ознакомьтесь с классификацией металлов и рассмотрите типичные способы их получения. Изучите их химические свойства.
Тема 18. Неметаллы и свойства их соединений[2]
Изучите расположение неметаллов в периодической таблице. Изучите химические свойства отдельных групп неметаллов (галогены, халькогены, подгруппа углерода и т.д.)
Тема 19. Основы аналитической химии[4]
Ознакомьтесь с требованиями, предъявляемыми к аналитическим реакциям. Изучите классификацию и возможности методов аналитической химии.
Тема 20. Методы качественного анализа[4]
Ознакомьтесь с разделением катионов и анионов на аналитические группы. Изучите качественные реакции на анионы и катионы.
Тема 21. Методы количественного химического анализа: гравиметрия и титриметрия[4].
Изучите требования к реакциям в гравиметрии и титриметрии.
Решите следующие задачи
1. Произойдет ли осаждение сульфида кадмия, если к 1,00л 0,10 Н раствора нитрата кадмия прибавить такой же объем 0,01 Н раствора сульфида натрия? ПР сульфида кадмия равно 7,1∙10-28 .
2. Произведение растворимости иодида свинца равно 8,7∙10-12.
Вычислите концентрацию ионов свинца в насыщенном растворе
иодида свинца.
3. Определите молярную растворимость карбоната серебра в воде, если
произведение растворимости этой соли равно 6.2∙10-12.
4. Насыщенный раствор сульфата свинца содержит в 1,00 дм3 0,044 г соли. Вычислите произведение растворимости этой соли.
5. 10,0 см3 раствора сульфата натрия плотностью 1,05 г/см3 добавили избыток раствора хлорида бария. Полученный осадок отделили, промыли, прокалили и взвесили. Масса полученной соли составила 0,080 г. Рассчитайте массовую долю сульфата натрия в растворе.
6. На титрование 10,00 см3 0,1050 Н раствора карбоната натрия было
затрачено 20,10 см3 раствора соляной кислоты. Рассчитайте нормальную концентрацию раствора кислоты.
7. На взаимодействие 10.00 см3 раствора гидроксида калия было израсходовано 20,00 см3 0,1000 Н раствора серной кислоты. Чему равна нормальная концентрация раствора КОН?
Ознакомьтесь с принципами построения кривых титрования[4]
Построение интегральной кривой титрования в методе нейтрализации
- Записывают уравнение реакции нейтрализации. Вычисляют факторы эквивалентности реагирующих веществ. Определяют возможное число точек эквивалентности (ТЭ) в ходе титрования.
- Определяют природу титранта и титруемого вещества (аналита): сильная кислота, щелочь, слабая кислота или основание, тип гидролизующейся соли и т.д.
- Рассчитывают молярные концентраций титруемого раствора и титранта.
- Выбирают формулы, необходимые для выполнения расчетов: до начала титрования, до ТЭ, в ТЭ, и после ТЭ.
- Если требуется по условию, то проводят корректировку формул с учетом коэффициента разбавления, ионной силы раствора и температуры.
- Составляют расчетную таблицу и вычисляют значения [Н+] и рН (10-15 точек) по мере увеличения объема добавляемого титранта.
-
Участки кривой титрования
Объем титранта. см3
Хар-ка системы
Расчетная формула
[Н+], моль *дм-3
рН
- Строят интегральную теоретическую кривую титрования в координатах рН (ось ординат) – Vтитранта (ось абсцисс) или рН – от 10% - ного избытка аналита до 10% - ного избытка титранта или рН – степень оттитрованности, f.
- Наносят на график линии нейтральности и эквивалентности. Определяют на кривой титрования ТЭ и интервал скачка титрования.
- По справочнику подбирают необходимый индикатор, наносят на график интервал перехода окраски индикатора и по значению рТинд определяют на кривой положение конечной точки титрования (КТТ).
- По значениям рН в ТЭ и в КТТ определяют пригодность выбранного индикатора и рассчитывают индикаторную ошибку титрования.
Практические рекомендации
Рассчитайте с относительной погрешностью 0,10% и постройте интегральную кривую титрования 0,1000 М раствора муравьиной кислоты 0,1000 М раствором КОН. Определите скачок титрования, подберите индикатор и рассчитайте индикаторную ошибку.
Титрант
 0,1000 М КОН HCOOH+KOH→HCOOK+H2О
0,1000 М КОН HCOOH+KOH→HCOOK+H2О ƒ( KOH)=1,000;

 (КОН)=100%
(КОН)=100%ƒ ( НСООК) =1,000;
 (НСООК)=100%
(НСООК)=100% Кк =1,80*10-4
0,1000 М НСООН рКк =3,75
Аналит 100,0 см3
Расчёт проводится без учёта разбавления системы.
 до титрования до ТЭ ТЭ после ТЭ
до титрования до ТЭ ТЭ после ТЭ


НСООН+НСООК НСООК+КОН
НСООН буферный раствор НСООК раствор гидроли-




 р-р слабой слабой кислоты р-р гидролизую- зующейся соли
р-р слабой слабой кислоты р-р гидролизую- зующейся соликислоты и гидролизующейся щейся соли и щелочи
 соли
соли РАСЧЁТНЫЕ ФОРМУЛЫ
РАСЧЁТНЫЕ ФОРМУЛЫ- До титрования
[H+]=
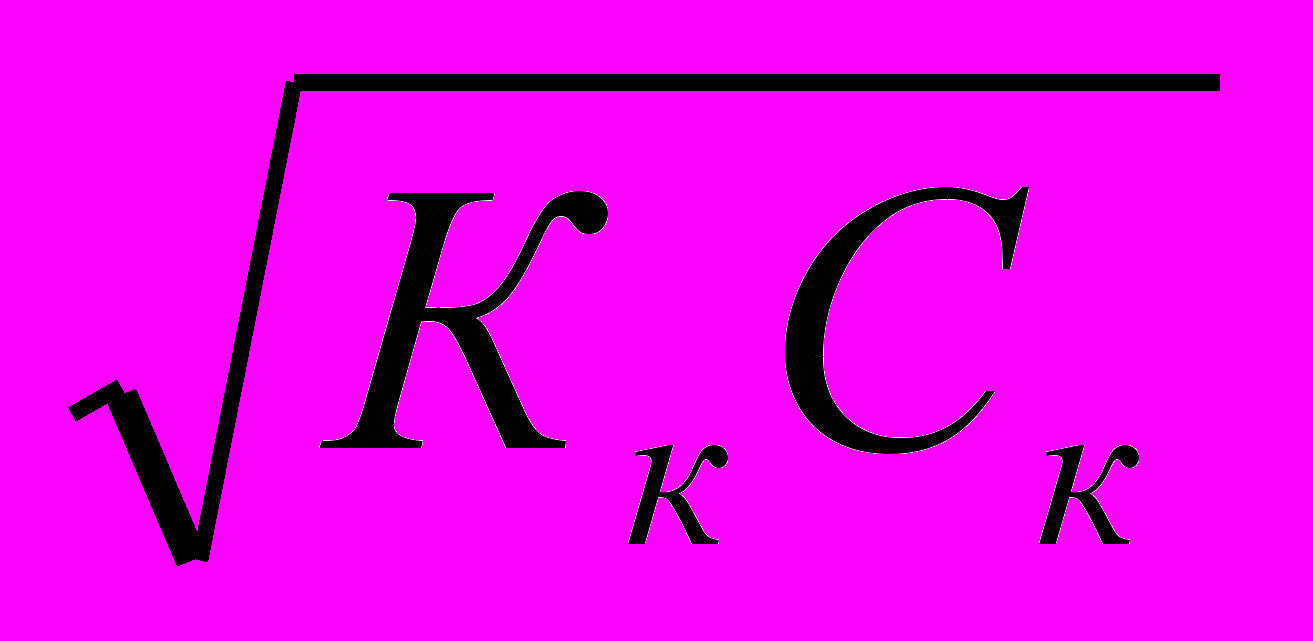 pH=0,5(pКк-ℓgCк)
pH=0,5(pКк-ℓgCк)- До ТЭ
[H+]=Кк*
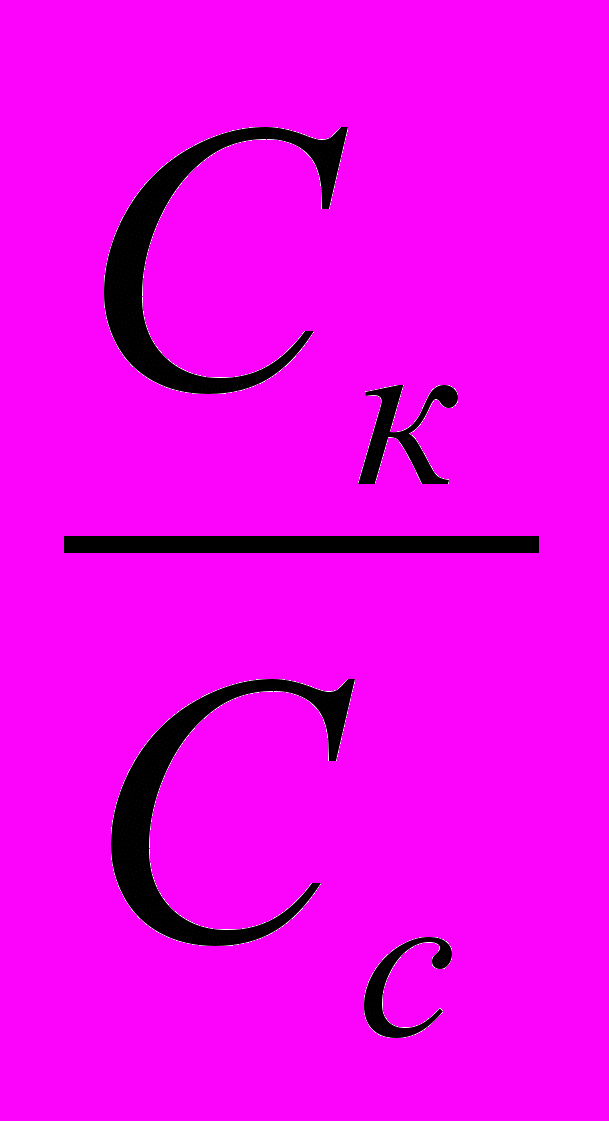 pH=pКк-ℓg
pH=pКк-ℓg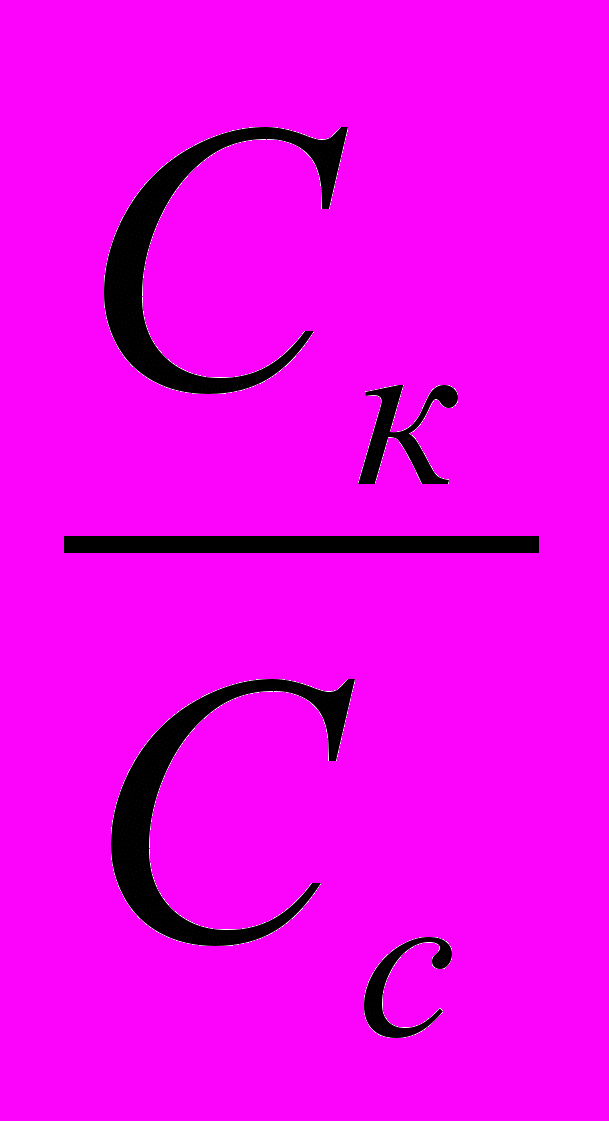
Cк=
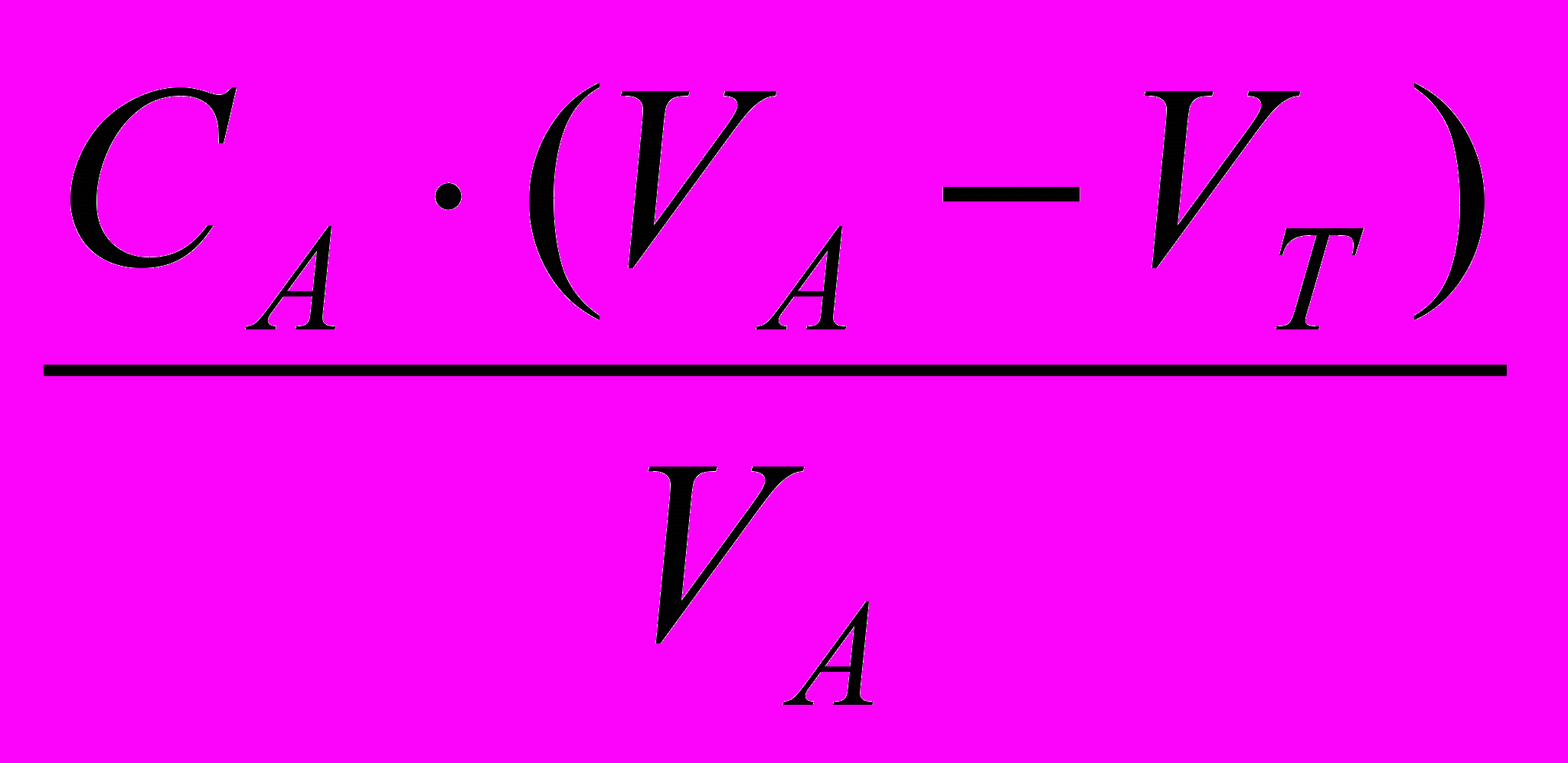 , т.к. СА=СТ
, т.к. СА=СТСс=
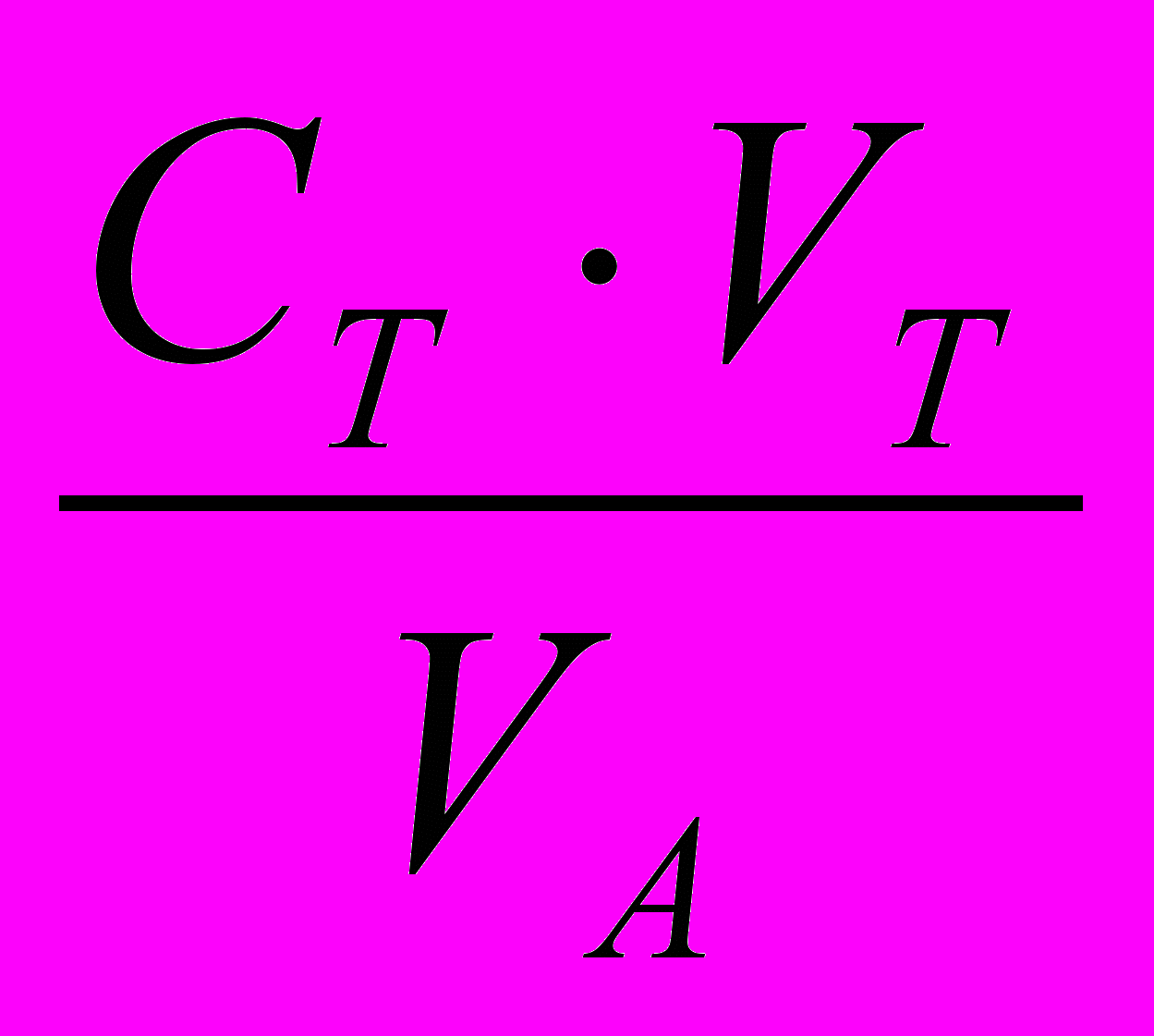 ;
; 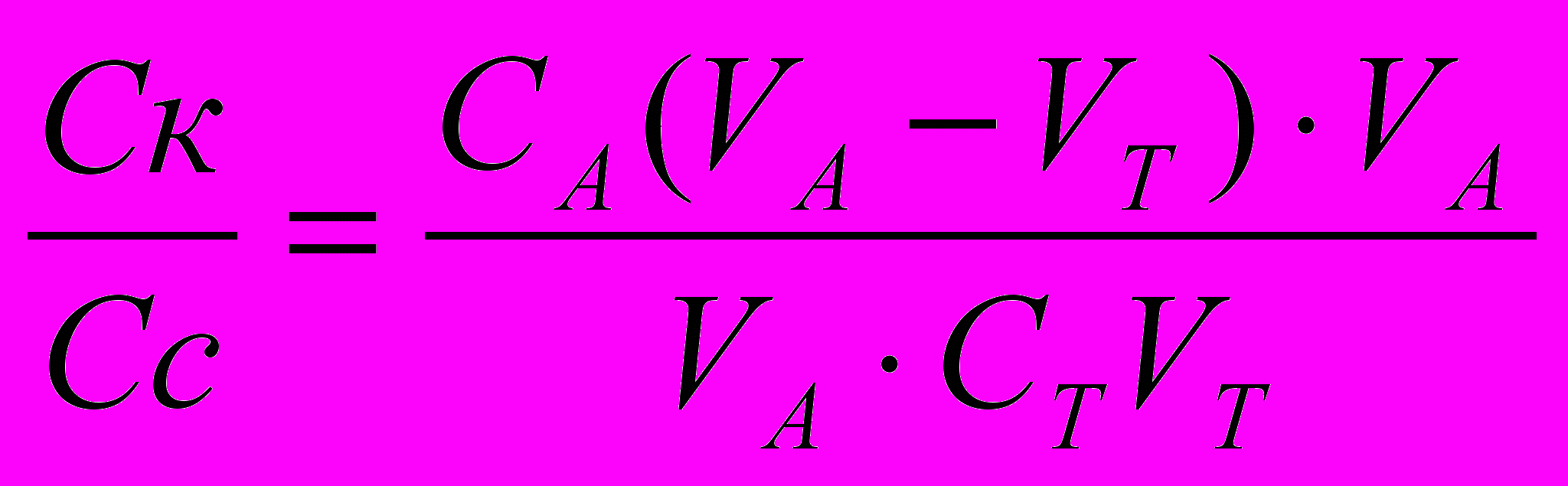 ; СА=СТ
; СА=СТ или
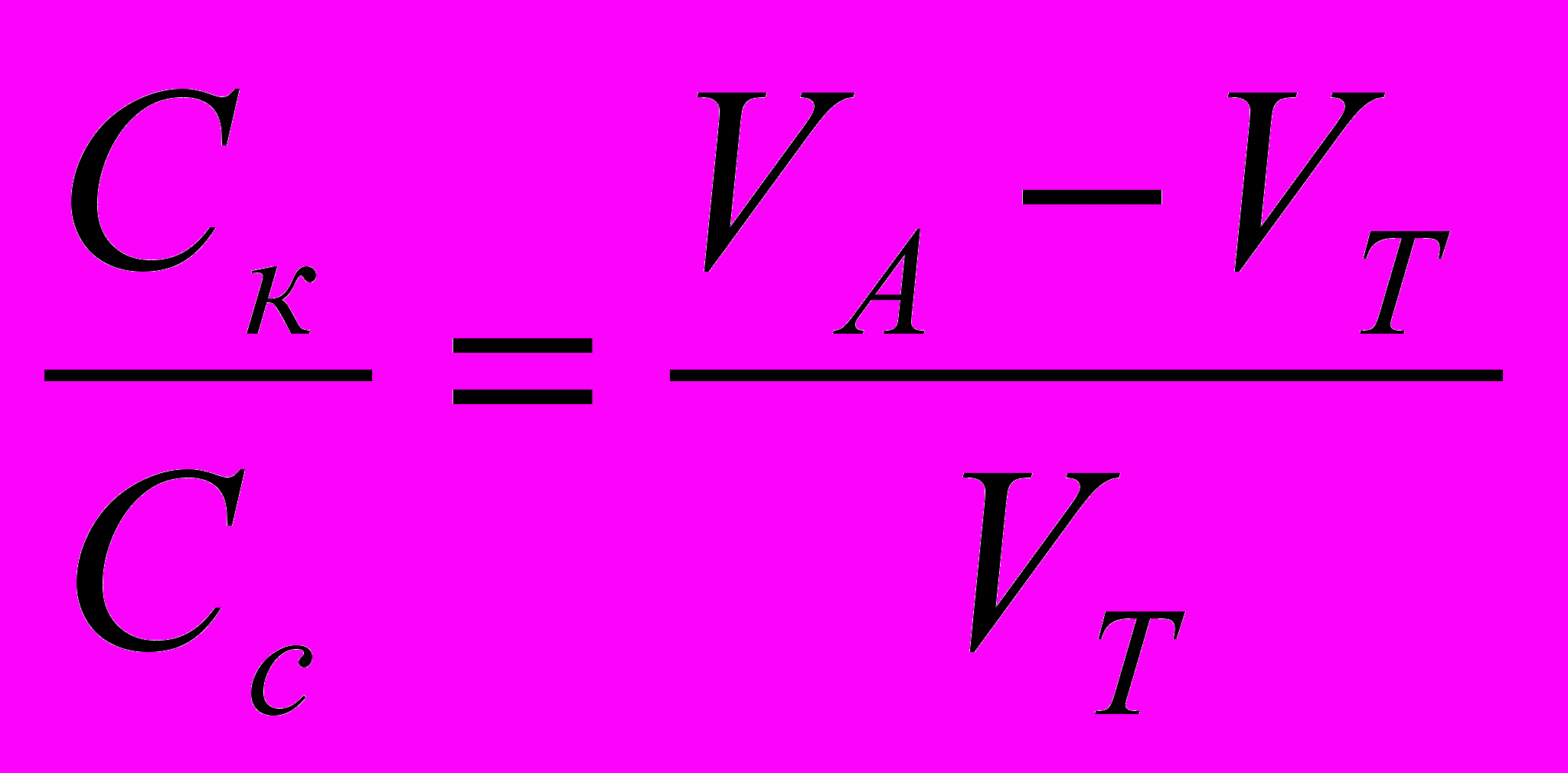
Вывод: при СА=Ст в расчётную формулу для вычисления рН можно подставлять соотношения объёмов
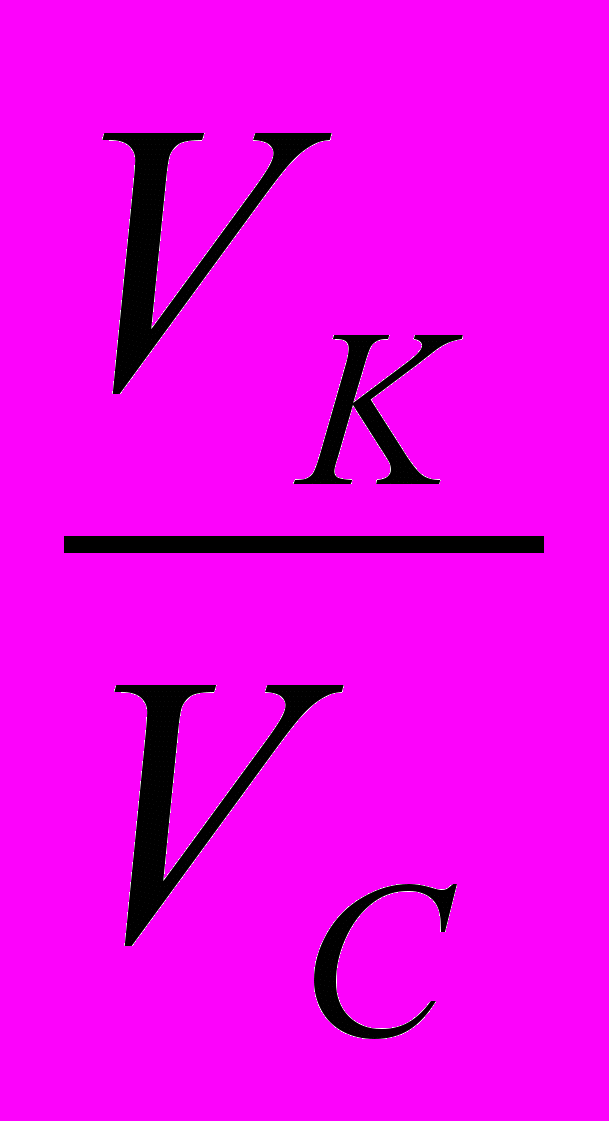 pH=pKк-ℓg
pH=pKк-ℓg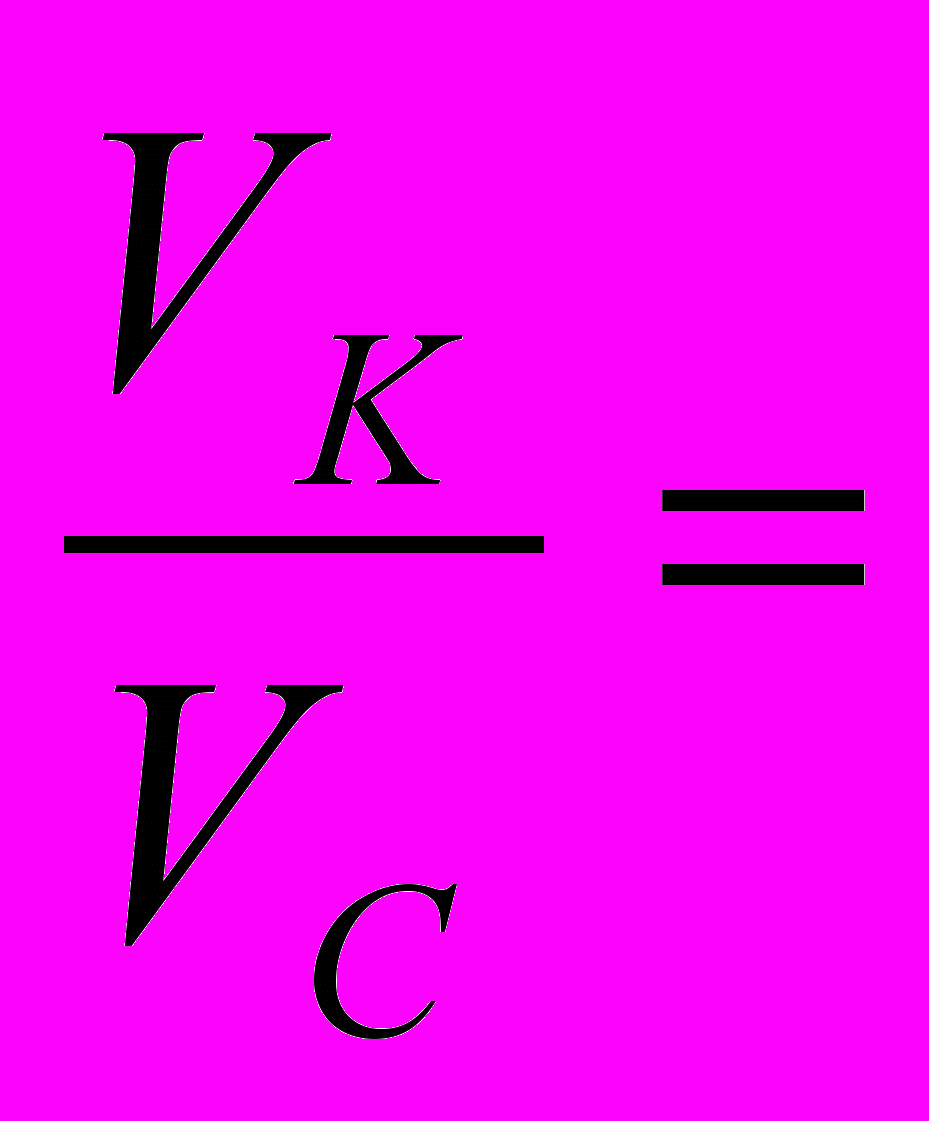 pKк-ℓgVк+ℓgVс
pKк-ℓgVк+ℓgVс3.В ТЭ
[ОH-]=
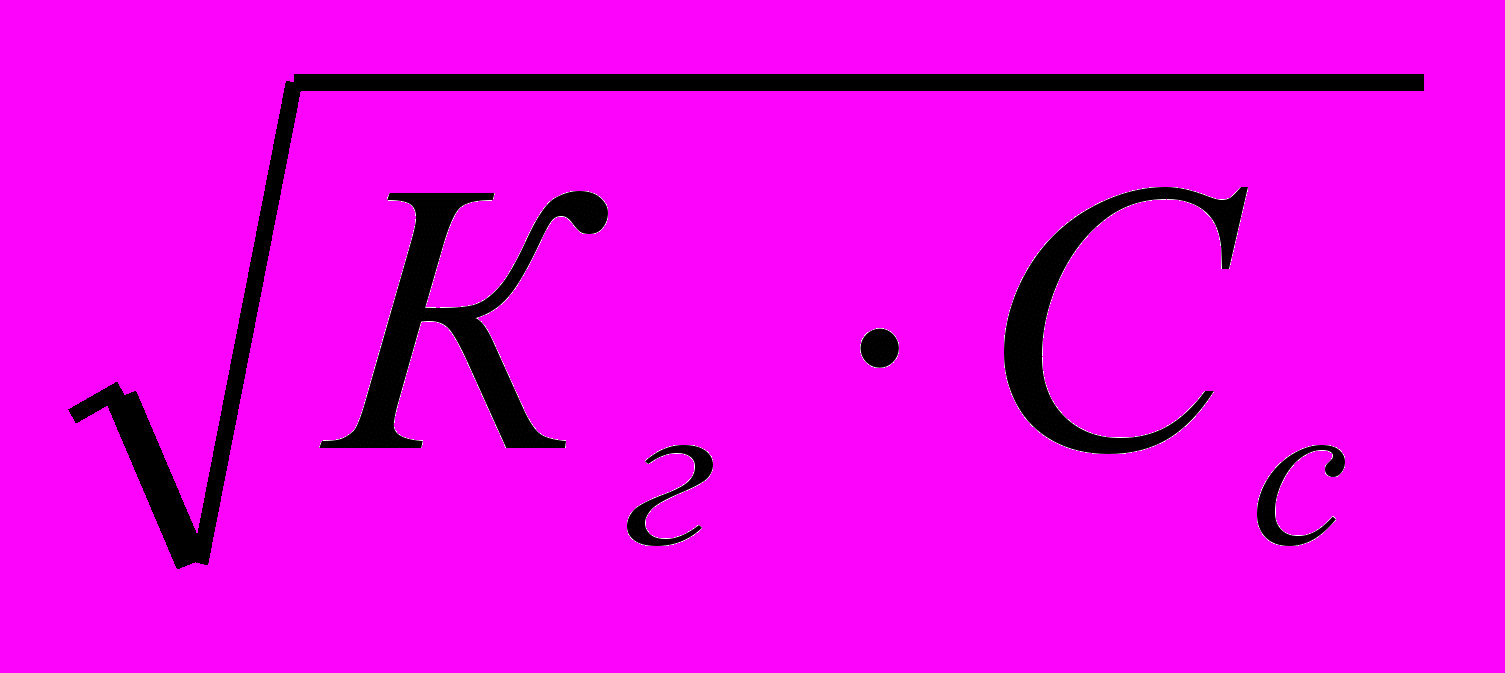 ;
; 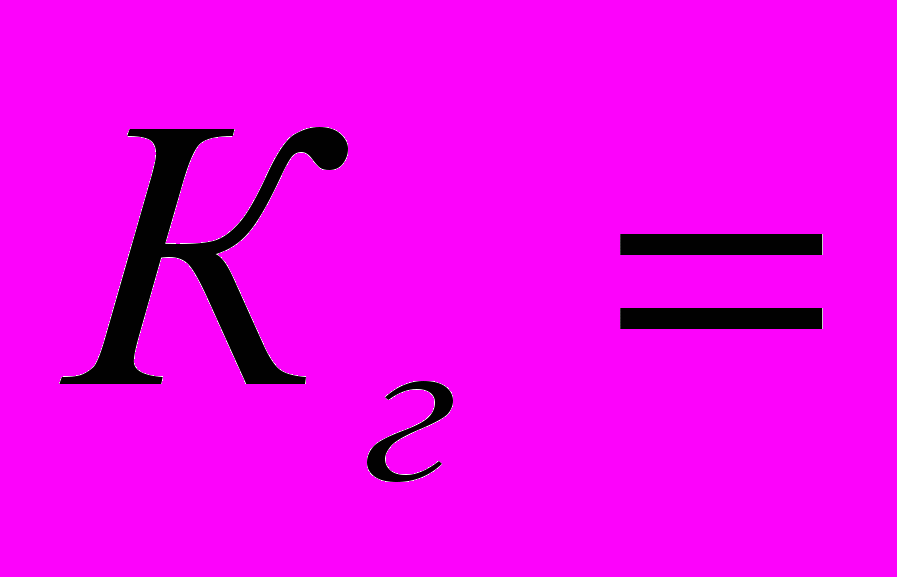
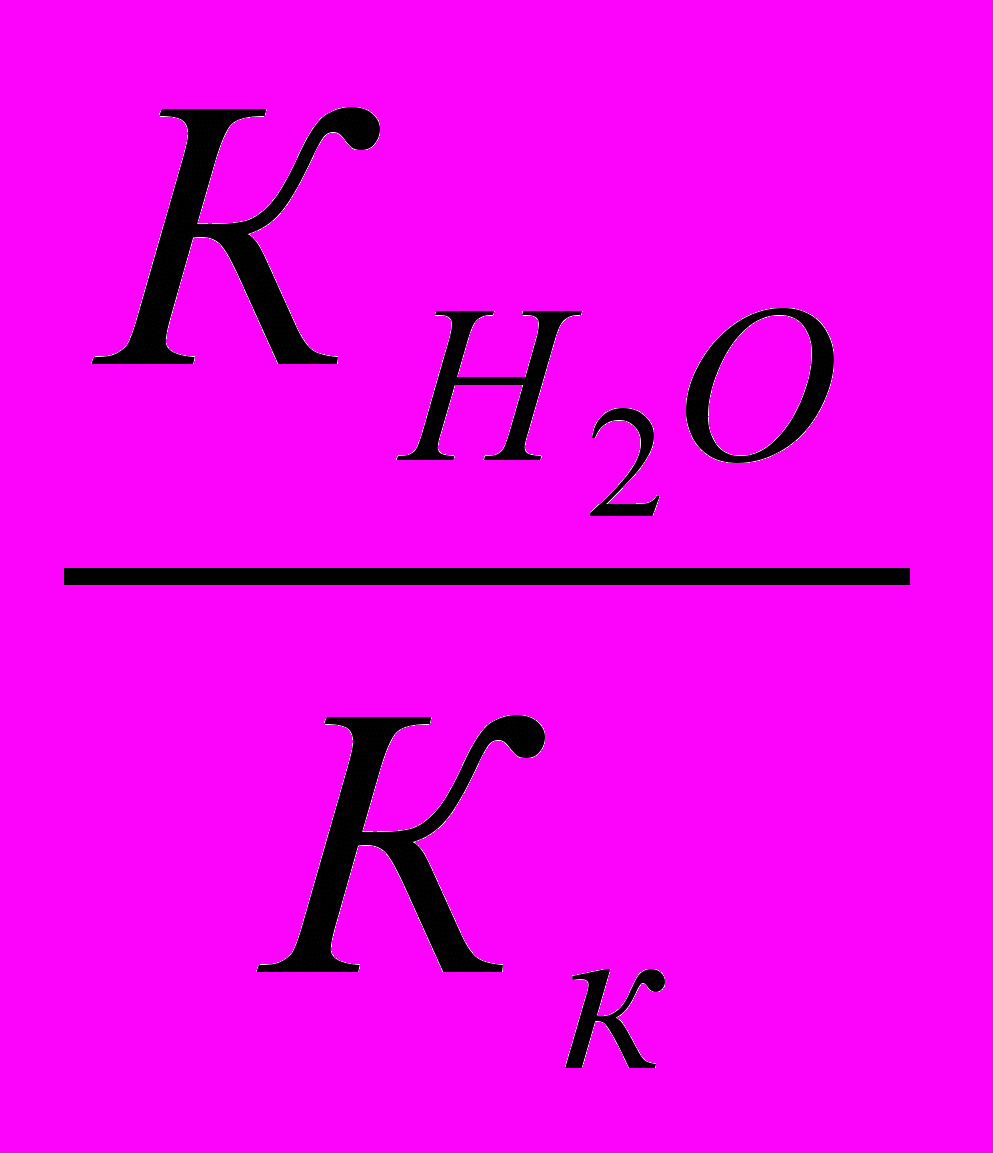 ; [ОH-]=
; [ОH-]=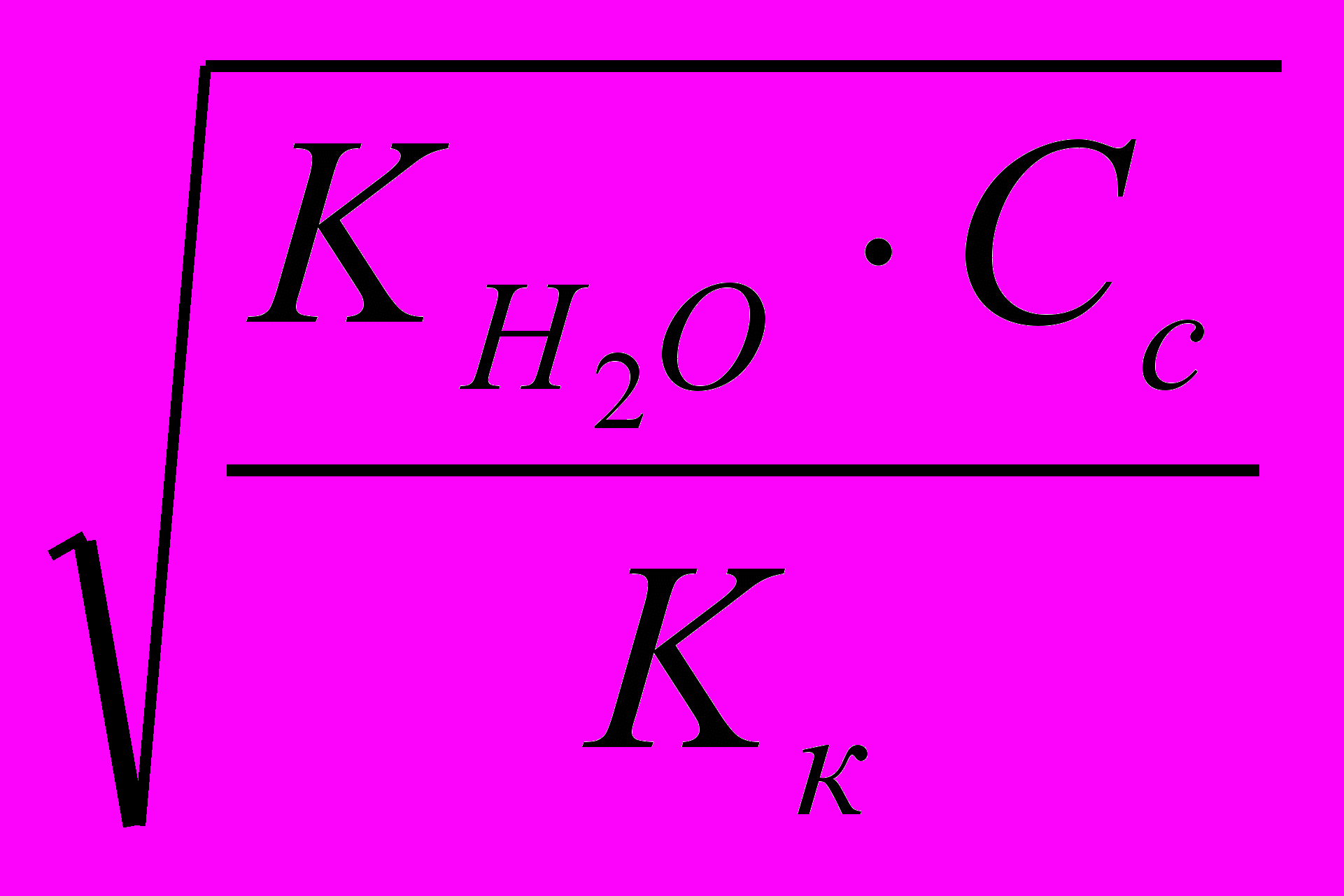 =
=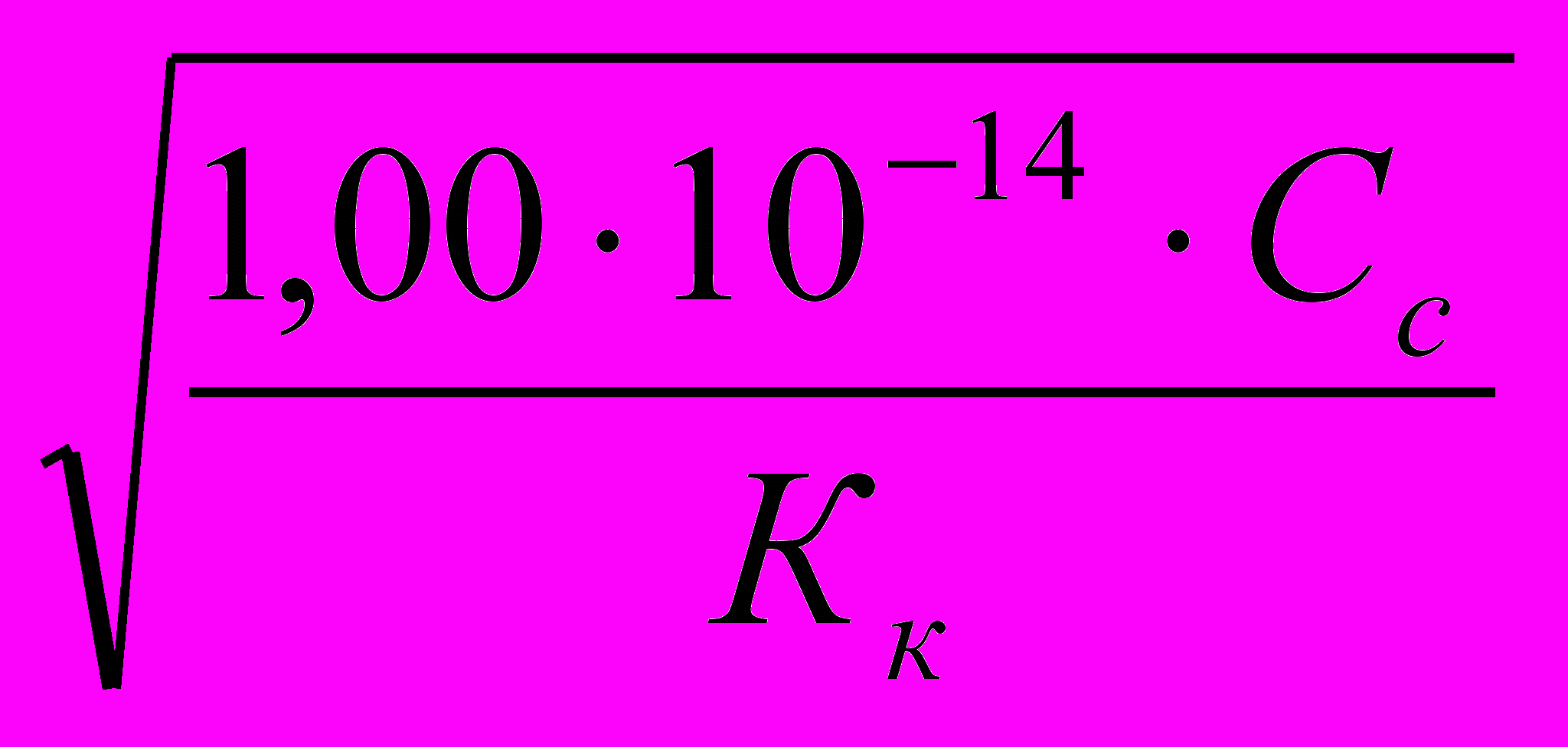
pH=7,00+0,50(ℓgCс-ℓgKк)= 7,00+0,50(pKк+ℓgCс)
- После ТЭ
[OH-]=
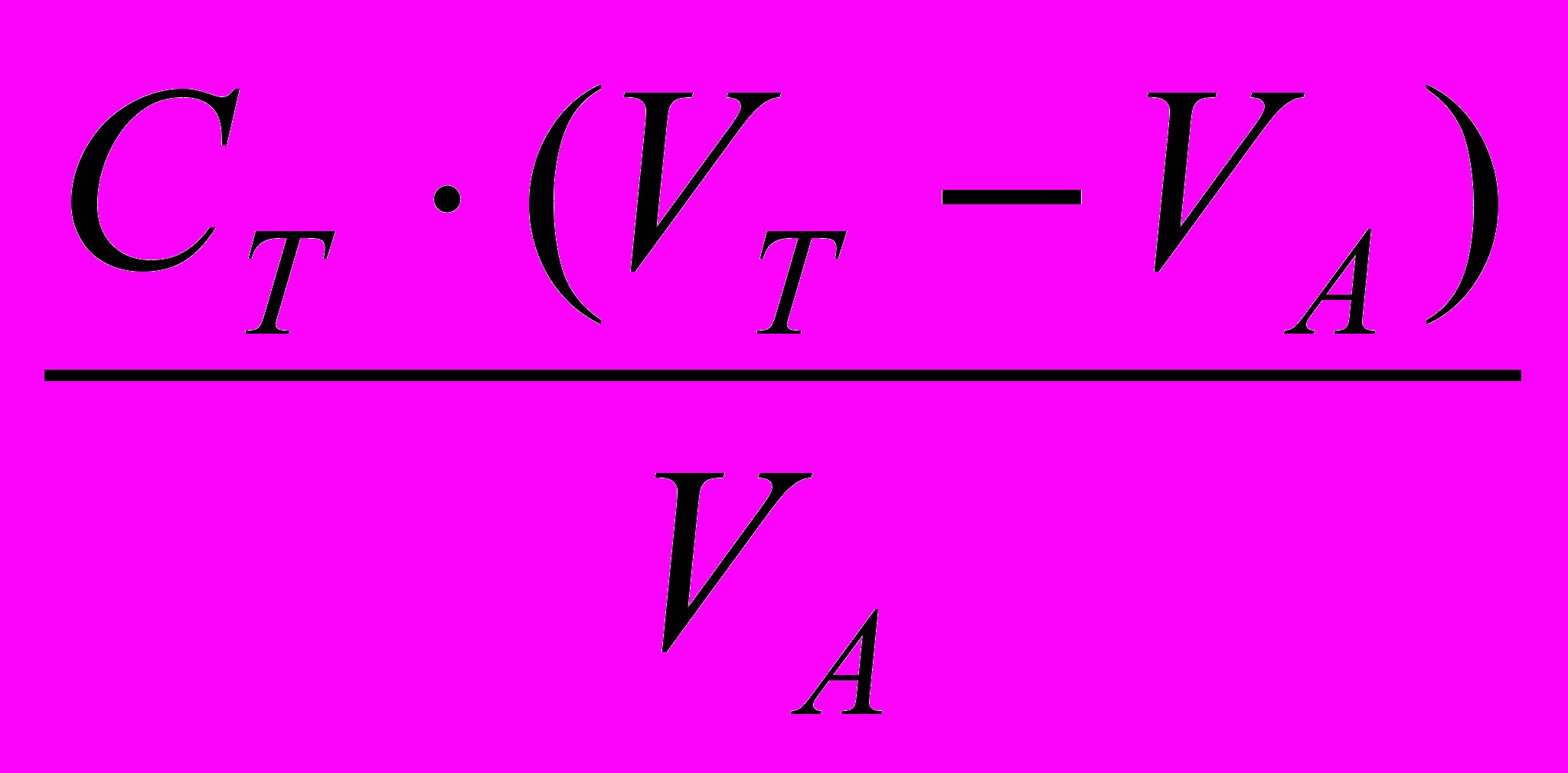 [H+]=
[H+]=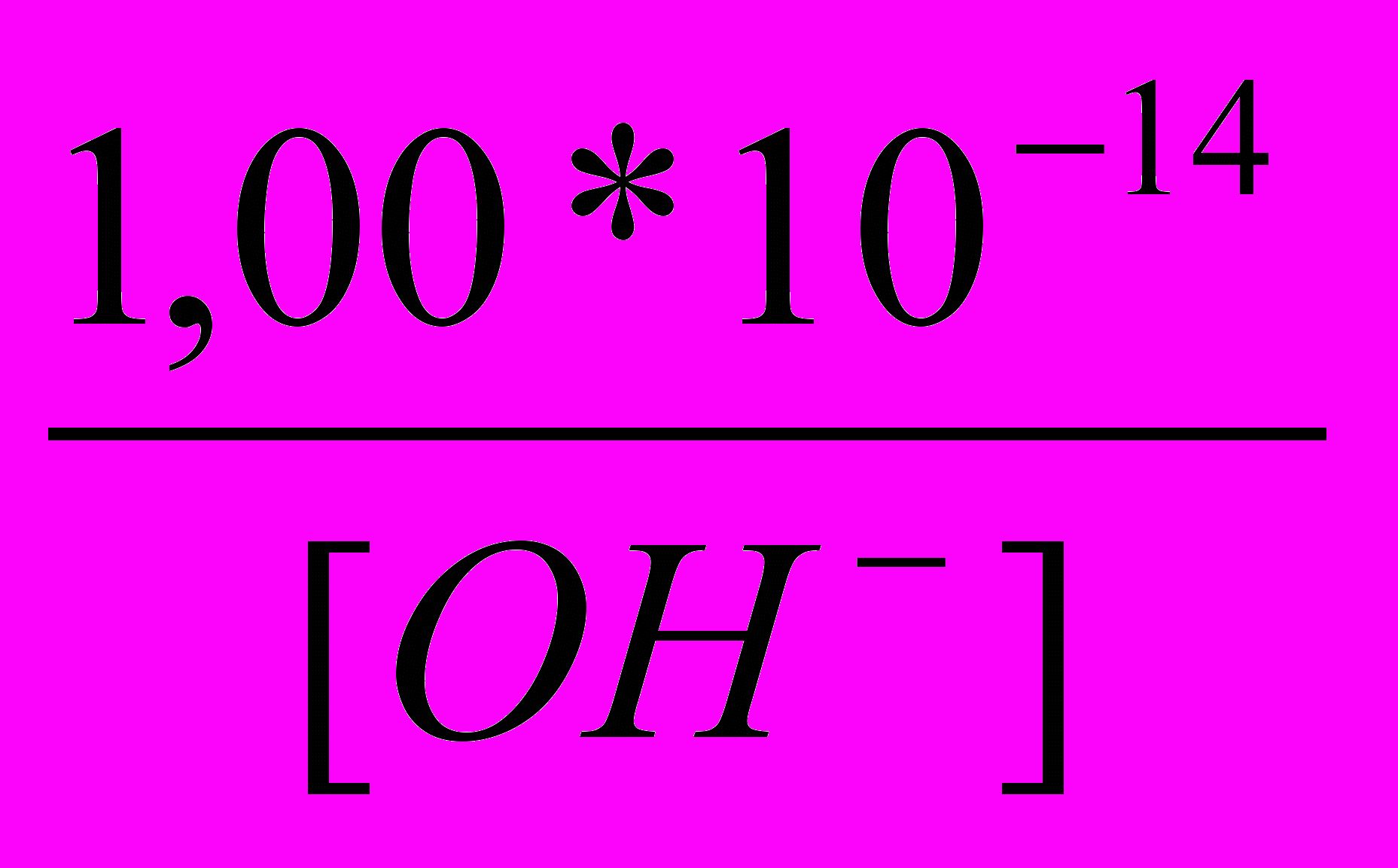
Примечание. Концентрация ионов [OH-] , появляющихся в растворе за счёт гидролиза формиата калия, не учитывается, так как гидролиз соли подавляется вводимым избытком щёлочи.
Тема 22. Теоретические представления в органической химии. Классы органических соединений[1]
Изучите предмет и задачи органической химии. Обратите внимание на явление изомерии. Рассмотрите основные классы органических соединений.
Тема 23. Углеводороды [1]
Алканы. Гомологический ряд предельных углеводородов. Общая формула. Изомерия. Первичный, вторичный и третичный атомы углерода. Номенклатура предельных углеводородов. Алкильные радикалы. Способы получения алканов. Физические свойства предельных углеводородов. Закон перехода количественных изменений в качественные.
Химические свойства алканов. Галогенирование, нитрование. Радикальный механизм реакций замещения. Цепные реакции. Окисление и дегидрирование, превращения при высоких температурах.
Алкены. Гомологический ряд этиленовых углеводородов. Общая формула. Изомерия: структурная и пространственная (цис-, транс- изомерия). Номенклатура. Способы получения. Дегидрирование и крекинг предельных углеводородов как промышленный метод получения этиленовых углеводородов.
Физические свойства. Химические свойства. Каталитическое гидрирование. Присоединение галогенов, галогеноводородов, серной кислоты. Гидратация. Правило Марковникова и его современная трактовка. Окисление с разрывом цепи.
Этилен, пропилен, бутилен, технические способы их получения и использование.
Алкины. Общая формула. Изомерия и номенклатура. Физические свойства. Химические свойства. Присоединение водорода, галогеноводородов, воды, спиртов, карбоновых кислот, синильной кислоты.
Ацетилен. Винилацетилен.
Алкадиены. Классификация алкадиенов. Номенклатура. Углеводороды с сопряженными двойными связями. Способы получения дивинила: из бутан-бутеновой фракции крекинггазов, из спирта (С.В. Лебедев). Получение изопрена из пентан-пентеновой фракции, из формальдегида и изобутилена.
Физические свойства. Особенности химического поведения алкадиенов с сопряженными двойными связями. Реакции присоединения водорода, галогенов, галогеноводородов.
Развитие представлений о строении бензола. Современные электронные представления о строении бензола. Гомологический ряд бензола. Номенклатура и изомерия. Физические и химические свойства бензола и его гомологов. Реакции электрофильного замещения (алкилирование, галогенирование, нитрование, сульфирование) и их механизм. Правила замещения в бензольном ядре.
Реакции присоединения: водорода, галогенов, озона. Окисление бензола и его гомологов. Толуол, ксилолы, кумол, стирол. Понятие о многоядерных ароматических углеводородах с конденсированными и неконденсированными ядрами.
Нафталин, его строение. Замещения в ряду нафталина.
Антрацен и антрахинон. Понятие об ароматических красителях.
Тема 24. Производные углеводородов
Галогенпроизводные. Классификация. Способы получения.
Физические свойства. Химические свойства. Реакции нуклеофильного замещения галогена (SN). Механизмы реакций. Другие реакции галогенопроизводных: дегалогенирование, дегидрогалогенирование, получение гомологов бензола реакцией Фриделя-Крафтса. Четыреххлористый углерод, 1,2-дихлорэтан, винилхлорид, хлоропрен, тетрафторэтилен и их использование.
Оксисоединения и их производные. Классификация алифатических спиртов.
Одноатомные спирты. Классификация. Изомерия. Понятие о первичных, вторичных и третичных спиртах. Номенклатура спиртов. Способы получения спиртов. Физические свойства. Водородная связь, ее влияние на температуру кипения и растворимость спиртов.
Химические свойства. Общая характеристика. Реакции со щелочными металлами, галогеноводородными кислотами, галогенидами фосфора, тионилхлоридом. Образование простых и сложных эфиров.
Многоатомные спирты. Классификация. Двухатомные спирты (гликоли). Методы получения. Физические свойства. Особенности химических свойств. Окисление. Этиленгликоль. Получение и применение.
Глицерин как представитель трехатомных спиртов. Получение из жиров, брожением сахаристых веществ и из пропилена. Физические свойства глицерина. Химические свойства: образование глицератов, галогенгидринов, сложных эфиров, дегидратация, окисление. Нитроглицерин. Применение глицерина в промышленности.
Фенолы. Изомерия и номенклатура. Выделение фенолов из каменноугольной смолы. Получение из изопропилбензола (кумола).
Физические свойства фенолов. Химические свойства. Кислотные свойства фенолов. Образование простых и сложных эфиров.
Оксосоединения. Строение, изомерия и номенклатура альдегидов и кетонов. Получение альдегидов и кетонов.
Получение ароматических карбонильных соединений.
Физические свойства. Химические свойства. Реакции присоединения к карбонильной группе водорода, синильной кислоты, магнийорганических соединений.
Реакции присоединения-отщепления. Образование полуацеталей и ацеталей. Окисление альдегидов и кетонов. Качественные реакции на альдегидную группу: реакция серебряного зеркала, восстановление фелинговой жидкости. Использование альдегидов для синтеза полимерных материалов.
Карбоновые кислоты и их производные. Классификация карбоновых кислот.
Одноосновные кислоты. Изомерия. Номенклатура. Природа карбоксильной группы. Способы получения кислот.
Физические свойства. Химические свойства. Общая характеристика. Кислотность. Индуктивный эффект и сила кислот. Получение и свойства функциональных производных кислот: галогенангидридов, ангидридов, сложных эфиров, амидов и нитрилов. Механизм реакции этерификации.
Высшие жирные кислоты. Мыла. Жиры.
Предельные двухосновные кислоты. Их химические свойства.
Адипиновая кислота. Терефталевая кислота.
Непредельные одноосновные кислоты – акриловая и метакриловая. Сложные эфиры акриловой и метакриловой кислот. Акрилонитрил.
Производные угольной кислоты. Фосген. Мочевина.
Тема 25. Азотсодержащие органические соединения
Нитросоединения. Общая формула. Строение нитрогруппы. Получение нитросоединений.
Физические свойства нитросоединений. Химические свойства. Восстановление нитросоединений в нейтральной, щелочной и кислой средах.
Амины. Строение, изомерия, классификация. Первичные, вторичные и третичные амины. Получение аминов из галогенпроизводных восстановлением нитросоединений, нитрилов. Значение реакции Зинина для развития анилинокрасочной промышленности. Физические свойства аминов. Химические свойства. Основность аминов. Образование солей, алкилирование, ацилирование, действие азотистой кислоты. Четвертичные аммониевые основания и соли.
Диазо- и азосоединения ароматического ряда. Реакция диазотирования и ее механизмы. Строение и таутомерия диазосоединений.
Азосоединения. Связь между строением и окраской органических соединений. Хромофорные и ауксохромные группы.
Производные изоциановой кислоты. Изоцианаты. Получение уретанов.
Тема 26. Серосодержащие соединения
Меркаптаны, их строение, свойства. Алифатические и ароматические сульфокислоты. Реакции сульфирования, сульфохлорирования и десульфирования. Хлорангидриды и амиды сульфокислот. Сульфоксиды.
Тема 27. Аминокислоты
Аминокислоты. Классификация и номенклатура. Получение аминокислот гидролизом белков, из галогензамещенных кислот.
Физические свойства. Химические свойства. Общая характеристика. Амфотерные свойства. Понятие о биполярном ионе. Изоэлектрическая точка. Реакция по карбоксильной группе и аминогруппе. Полипептиды.
Тема 28. Углеводы
Углеводы как особая группа оксиальдегидов и оксикетонов. Классификация углеводов. Распространение углеводов в природе и их практическое значение. Моносахариды. Классификация. Стереохимия моносахаридов. D- и L-ряды моносахаридов. Глюкоза как представитель моносахаридов (моноз). Открытая и циклическая (полуацетальная) форма глюкозы. Мутаротация.
Анноза и галактоза. Фруктоза как представитель кетогексоз, ее строение.
Химические свойства моносахаридов. Реакции альдегидной группы:
реакция серебряного зеркала, восстановление фелинговой жидкости, взаимодействие с синильной кислотой. Реакции гидроксильных групп: с метиловым спиртом, с йодистым метилом, с уксусным альдегидом. Эпимеризация.
Дисахариды: мальтоза, целлобиоза и сахароза. Образование дисахаридов при неполном гидролизе крахмала и целлюлозы.
Полисахариды: крахмал и целлюлоза. Распространение в природе. Продукты гидролиза крахмала. Применение крахмала и декстринов в промышленности. Целлюлоза как основа растительного мира.
Нитроцеллюлоза (коллоксилин и пироксилин) и ее практическое применение.
Тема 29. Гетероциклические соединения
Понятие о строении гетероциклических соединений. Распространение гетероциклических соединений в природе и их значение. Гетероциклические пятичленные соединения с ароматическим характером; влияние гетероатомов на их ароматичность. Общая характеристика свойств.
Индол и индиго. Шестичленные гетероциклы. Пиридин: строение, ароматичность, основность, особенности распределения электронной плотности. Реакции нуклеофильного и электрофильного замещения. Винилпиридины и их полимеризация. Понятие об активных красителях.
Тема 30. Классификация высокомолекулярных соединений [2]
Изучите способы классификации высокомолекулярных соединений: по происхождению, химической природе, по отношению к термовоздействию. Приведите примеры природных органических и неорганических высокомолекулярных соединений (ВМС).
Тема 31. Реакции полимеризации и поликонденсации[2]
Изучите реакции полимеризации по гомо- и гетеролитическому типу. Ознакомьтесь с радикальной и ионной полимеризацией. Изучите влияние внешних условий на образование ВМС. Изучите реакции гомо и гетерополиконденсации. Выявите различие между реакциями полимеризации и поликонденсации.
Тема 32. Химические превращения полимеров[2]
Рассмотрите химические превращения ВМС на примере получения перхлорвинила и поливинилового спирта.
Тема 33. Строение полимеров и их агрегатные и фазовые состояния[2]
Изучите способы классификации полимеров по их строению. Рассмотрите агрегатное и фазовое состояние цепных и гетероцепных полимеров.
Тема 34. Растворы полимеров и их свойства[2]
Рассмотрите условия получения растворов полимеров. Выделите основные характеристики растворов ВМС. Обратите внимание на подбор растворителей и нерастворителей для полимеров.
Тема 35. Отдельные представители ВМС[2]
Изучите физические и химические свойства полиэтилена, полипропилена, полиизобутилена, поливинилхлорида, перхлорвинила, полиамидов, полиуретанов, лавсана, синтетических каучуков и смол.
Тема 36. Механические и термомеханические свойства полимеров[2]
Рассмотрите гибкость и конформацию молекул ВМС. Определите их вклад в механические свойства полимеров. Разберите три физических состояния ВМС: стеклообразное, высокоэластичное и вязкотекучее. Найдите их на термомеханической кривой.
