Сергей александрович
| Вид материала | Автореферат диссертации |
- Сопредседатели Оргкомитета: филатов сергей Александрович, 3085.97kb.
- Есенин, Сергей Александрович, 15.32kb.
- Московский государственный институт международных отношений, 1027.57kb.
- Сергей Александрович Кудряшев. Классификация в системных исследованиях. М.: Центр системных, 378.9kb.
- Есенин Сергей Александрович Анна Снегина, 244kb.
- С. Кара-Мурза, А. Александров, М. Мурашкин, С. Телегин, 6654.45kb.
- С. Кара-Мурза, А. Александров, М. Мурашкин, С. Телегин, 6654.32kb.
- Тест по литературному чтению. 2-й класс., 14.41kb.
- Управление стратегическими изменениями и рисками руководитель курса, 276.88kb.
- Мальцев Сергей Александрович – Невидимая битва, 11848.11kb.
На правах рукописи
АЛЕНТЬЕВ
СЕРГЕЙ АЛЕКСАНДРОВИЧ
ЭНДОВАСКУЛЯРНЫЕ И ЭНДОБИЛИАРНЫЕ ВМЕШАТЕЛЬСТВА В ГЕПАТОПАНКРЕАТОБИЛИАРНОЙ ХИРУРГИИ
14.01.17 – хирургия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург
2010
Работа выполнена в ФГОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ
Научный консультант:
Заслуженный деятель науки РФ
доктор медицинских наук профессор Зубарев Петр Николаевич
Официальные оппоненты:
доктор медицинских наук профессор ^ Борисов Александр Евгеньевич
доктор медицинских наук профессор Таразов Павел Гадельгараевич
доктор медицинских наук профессор Королев Михаил Павлович
^ Ведущее учреждение
ГУ «Санкт-Петербургский научно-исследовательский институт скорой помощи им. И.И. Джанелидзе»
Защита диссертации состоится 21 июня 2010г. в 14 часов на заседании совета по защите докторских и кандидатских диссертаций Д 215.002.10 при ФГОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ по адресу: 194044, Санкт-Петербург, ул. Акад. Лебедева д. 6.
С диссертацией можно ознакомиться в фундаментальной библиотеке ФГОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ.
Автореферат разослан «___» марта 2010 года
Ученый секретарь совета
доктор медицинских наук профессор
Сазонов Андрей Борисович
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Заболевания гепатопанкреатодуоденальной зоны на настоящий момент занимают одно из ведущих мест среди причин нетрудоспособности и смертности. Их социальная значимость повсеместно возрастает во всех странах мира и в первую очередь связана с увеличением заболеваемости злокачественными опухолями этой области. В последние десятилетия отмечается неуклонный рост заболеваемости первичным и метастатическим раком печени. Ежегодно в мире регистрируется более 600 000 новых случаев гепатоцеллюлярного рака (ГЦР) (Базин И.С., 2008;). В структуре онкологической заболеваемости ГЦР занимает 6 место среди всех регистрируемых случаев рака в мире (Мерабишвили В.М., 2007; Llovet J.M., 2009).
Метастатическое поражение печени выявляется в 20-30 раз чаще ГЦР и встречается у 30-50% всех онкологических пациентов (Патютко Ю.И., 2005). Синхронные или метахронные метастазы в печень диагностируются у 50-75% больных с диссеминированным колоректальным раком. В 25-30% случаев печень является единственным органом, пораженным метастазами (Гарин А.М., Базин И.С., 2006).
Хирургический метод является определяющим в лечении первичного и метастатического рака с изолированным поражением печени. Однако к моменту диагностики резекция печени возможна только у 10-12% пациентов (Cance W.G. et al., 2000). Кроме того, у 80% пациентов, перенесших резекцию, в отдаленном периоде наблюдается прогрессирование опухолевого поражения печени (Вишневский В.А. с соавт., 2003).
На настоящий момент результаты изолированного хирургического лечения метастатического и первичного рака печени хорошо изучены. Благодаря применению современных методов диагностики и оперативного лечения удается достичь пятилетней выживаемости в 20-40% (Патютко Ю.И. с соавт., 2008; Little S.A., Fong Y., 2001). Дальнейшее улучшение результатов лечения данной группы больных может быть связано вероятнее всего с использованием комбинированных методов лечения. В качестве этапа комбинированной терапии может использоваться адъювантная и неоадъювантная химиотерапия (Nordlinger B. et al., 2009). При этом перспективным является регионарное введение цитостатиков с помощью эндоваскулярного артериального или портального доступа – селективная химиоинфузия в печеночную артерию или воротную вену и масляная химиоэмболизация печеночной артерии или портальной вены (Гранов А.М. с соавт., 2003; Таразов П.К., 2008; Ducreux M. et al., 2005).
Применение в регионарной химиотерапии новых эффективных химиопрепаратов, таких как оксалиплатин, позволяет надеяться на улучшение результатов лечения больных с метастатическим колоректальным раком (Cohen A. D. et al., 2003). В современной литературе имеются лишь единичные сообщения о возможности и безопасности использования этих препаратов перед обширными резекциями печени и в послеоперационном периоде, а также для регионарной химиотерапии при нерезектабельных метастазах в печень (Kern W. et al., 2001; Ducreux M. et al., 2005). Объем имеющихся исследований мал и не позволяет оценить эффективность лечения.
Рак поджелудочной железы к началу третьего тысячелетия остается самой прогностически неблагоприятной опухолью. В индустриально развитых странах он находится на 4-5 месте среди причин смертности и сохраняет устойчивую тенденцию к росту заболеваемости (Мерабишвили В.М., 2007; Carpelan-Holmstrom M. et al., 2005). В мире по заболеваемости рак поджелудочной железы занимает 13 место, а по смертности – 8 место. Основным методом лечения рака поджелудочной железы является хирургический (Кубышкин В.А., 2003). Несмотря на внедрение в клиническую практику расширенных резекций поджелудочной железы с лимфодиссекцией, пластикой сосудов выживаемость при данной патологии остается очень низкой. Так, в течение первого года после радикального удаления опухоли 80–96% больных умирают от прогрессирования заболевания. Трех и пятилетняя выживаемость наблюдается только у части больных с I–II стадиями заболевания (Гарин А.М., Базин И.С., 2006). Для улучшения результатов лечения рака поджелудочной железы может использоваться регионарное введение современных цитостатиков (гемзар) в неоадъювантном, адъювантном и лечебном режимах (Гранов Д.А. с соавт, 2003; Павловский А.В., 2006; Lorenz M. et al., 2000).
Грозным осложнением опухолей гепатопанкреатодуоденальной зоны является механическая желтуха, которая развивается у 20-80% больных злокачественными новообразованиями данной локализации (Борисов А.Е. с соавт., 2003; Гальперин Э.И., Долгушин Б.И. с соавт., 2005; Ветшев П.С., 2006). Подавляющему большинству больных (до 90%) выполняются различные паллиативные оперативные вмешательства, направленные на декомпрессию желчных протоков. Окончательным методом лечения у данной категории больных все чаще становятся малоинвазивные чрескожные рентгеноэндобилиарные и эндоскопические манипуляции (Борисова Н.А., 1996; Ившин В.Г., Лукичев О.Д., 2003). Несмотря на совершенствование методов желчеотведения у неоперабельных больных, их социальная адаптация продолжает оставаться трудной и до конца не разрешенной проблемой, которая требует разработки и внедрения новых технологий дренирования и стентирования желчных путей.
Не менее актуальной в гепатопанкреатобилиарной хирургии является проблема диагностики и лечения осложнений синдрома портальной гипертензии. Социальная значимость данной проблемы возрастает во всех странах мира и в первую очередь связана с ростом заболеваемости циррозом печени, вирусной этиологии (Лобзин Ю.В., 2003; Hu K.Q. et al., 2004). Согласно материалам ВОЗ в мире насчитывается около 1 млрд. человек инфицированных вирусом гепатита В и С, из которых у 5-10% впоследствии развиваются хронические формы с исходом в цирроз печени.
Прогрессирование заболеваний печени и портальной гипертензии сопровождается развитием тяжелых осложнений: кровотечения, асцит, гиперспленизм, злокачественные опухоли и др. Одним из наиболее эффективных методов коррекции портальной гипертензии является наложения декомпрессивных венных анастомозов (Ерюхин И.А., 1976, Котив Б.Н., 1998; Зубарев П.Н., 2000, Назыров Ф.Г. с соавт., 2008; Adam R. et al., 1992; Wong L. L. et al., 2002; Livingstone A.S. et al., 2006). Однако в части случаев данные вмешательства сопровождаются развитием тромбоза, стеноза шунта, прогрессированием варикозного расширения вен пищевода, рецидивом асцита (Orloff M.J. et al., 1997; Orea Martinez J.G. 2005). Большинство больных с тромбозом наложенного портокавального анастомоза погибает (Ерамишанцев А.К., 2008). Тактика лечения больных в данной ситуации остается нерешенной проблемой.
Прогрессирование гиперспленизма при синдроме портальной гипертензии приводит к развитию геморрагического синдрома, делает невозможным дальнейшее хирургическое лечение больных. Предложенные традиционные оперативные вмешательства - спленэктомия, перевязка селезеночной артерии - сопровождаются высокой частотой осложнений (Ерамишанцев А.К., 2008). Перспективным для лечения гиперспленизма является широкое применение малоинвазивных эндоваскулярных методик (Лыткин М.И. с соавт., 1990; Черкасов В.А., 1998; Борисов А.Е., с соавт., 2003; Лазуткин М.В., 2006).
Несмотря на определенные успехи и большой накопленный опыт в гепатопанкреатобилиарной хирургии лечение очаговых и диффузных заболеваний печени, опухолей поджелудочной железы остается нерешенной проблемой. Наряду с традиционными хирургическими вмешательствами в последнее время широкое развитие получили методы эндоваскулярной, эндобилиарной хирургии, которые существенно расширили возможности оказания помощи наиболее тяжелой категории больных (Гранов Д.А. с соавт., 2002; Борисов А.Е. с соавт., 2003; Таразов П.Г. с соавт, 2008; Conn H.O., 1995).
Вместе с тем остается немало спорных и до конца не решенных вопросов, связанных с диагностикой и лечением этих сложных видов патологии. Последовательность использования различных эндоваскулярных и эндобилиарных методов лечения в сочетании с традиционными оперативными вмешательствами у больных с очаговыми и диффузными заболеваниями печени, опухолями поджелудочной железы недостаточно полно отражены в периодической литературе и нуждаются в дальнейшем изучении.
Целью настоящего исследования является улучшение результатов диагностики и лечения заболеваний гепатопанкреатодуоденальной зоны путем сочетанного использования методов эндоваскулярной, эндобилиарной и традиционной хирургии.
Задачи исследования:
- Определить показания к применению новых неинвазивных и малоинвазивных методов визуализации в диагностике очаговых и диффузных заболеваний печени, а так же в оценке эффективности и прогнозировании результатов комбинированного лечения в гепатопанкреатобилиарной хирургии.
- Оценить результаты применения различных видов эндоваскулярных вмешательств в комбинированном и паллиативном лечении первичного и метастатического рака печени, рака поджелудочной железы.
- Определить показания к применению и оценить лечебную эффективность чрескожного чреспеченочного дренирования и стентирования желчных протоков при механической желтухе опухолевой природы.
- Провести сравнительную оценку металлических стентов различной конструкции в коррекции механической желтухи опухолевого генеза.
- Усовершенствовать технику эндоваскулярных и эндобилиарных вмешательств в лечении заболеваний гепатопанкреатодуоденальной зоны.
- Разработать эффективный метод эндоваскулярной коррекции гиперспленизма при синдроме портальной гипертензии и оценить ближайшие и отдаленные результаты его применения.
- Выработать рациональную тактику применения неинвазивных и малотравматичных современных методов диагностики и лечения у больных с диффузными и очаговыми заболеваниями печени.
Научная новизна исследования заключается в следующем:
- Впервые для оценки эффективности эндоваскулярного лечения метастатического рака печени применена совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ/КТ).
- Для контроля проходимости портокавальных анастомозов разработана и использована методика магнитно-резонансной ангиографии - шунтографии.
- На достаточном клиническом материале доказана эффективность масляной химиоэмболизации печеночной артерии с использованием оксалиплатина при колоректальных метастазах в печень
- Для верификации опухолевого поражения желчных протоков разработана и применена на практике методика эндобилиарной трепан-биопсии.
- Разработана и применена на практике методика пункционного холедоходуоденоанастомоза при механической желтухе опухолевого генеза.
- Для остановки эндобилиарного кровотечения из распадающейся опухоли головки поджелудочной железы впервые успешно применена имплантация металлического саморасширяющегося стента с покрытием.
- Для закрытия микроперфорации холедоха при распаде опухоли желчных протоков успешно применена имплантация металлического саморасширяющегося стента с покрытием.
- Проведена сравнительная оценка проходимости металлических саморасширяющихся стентов с покрытием и без, определены основные причины рецидива механической желтухи после стентирования.
- Разработана методика поэтапной редукции артериального кровотока к селезенке с хронической эмболизацией селезеночной артерии (СА), позволяющая эффективно, безопасно и на длительный срок купировать гиперспленизм при синдроме портальной гипертензии.
- Впервые для эмболизации варикозно расширенных вен пищевода и желудка применен доступ через мезентерикокавальный и спленоренальный «Н»-анастомозы.
- Разработан способ выполнения селективной катетеризации портокавальных анастомозов.
- При тромбозе мезентерикокавального Н»-шунта разработана и применена на практике методика реканализации анастомоза.
- Впервые произведено стентирование декомпрессивного венного анастомоза при его остром тромбозе.
- Определены показания для стентирования внутрипеченочного отдела нижней полой вены (НПВ) при синдроме Бадд-Киари и циррозе печени.
- Доказана неэффективность баллонной ангиопластики при стенозах внутрипеченочного отдела НПВ, вызванных синдромом Бадд-Киари и циррозом печени.
Положения, выносимые на защиту:
В комбинированном лечении злокачественных заболеваний гепатопанкреатодуоденальной зоны перспективным является применение эндоваскулярных, эндобилиарных методик в сочетании с традиционными оперативными вмешательствами.
- Масляная химиоэмболизация артерий является безопасным и эффективным методом лечения первичного и метастатического колоректального рака печени, рака поджелудочной железы, который должен применяться как в составе комбинированного противоопухолевого лечения, так и изолированно при паллиативной терапии. Предоперационная масляная химиоэмболизация печеночной артерии с использованием оксалиплатина при метастатическом колоректальном раке печени не приводит к развитию химического гепатита и синдрома «Blue liver».
- Эндобилиарное стентирование при механической желтухе опухолевого генеза с использованием металлических саморасширяющихся протезов с полимерным покрытием в большинстве случаев позволяет отказаться от наложения обходных билиодигестивных анастомозов благодаря обеспечению длительной, пожизненной проходимости желчных путей. Выполнение обходных билиодигестивных анастомозов оправдано при интраоперационном выявлении неоперабельности опухолевого процесса, при одновременном развитии кишечной непроходимости и механической желтухи, при невозможности внутреннего дренирования желчных протоков (многократные неудачные попытки перевода наружного дренирования во внутреннее).
- Применение регионарной химиотерапии у пациентов с купированной опухолевой механической желтухой приводит к увеличению выживаемости и улучшению качества жизни больных.
- Методика поэтапной редукции артериального кровотока к селезенке с хронической эмболизацией СА позволяет купировать гиперспленизм при синдроме портальной гипертензии, снизить риск геморрагических осложнений при последующих шунтирующих операциях, лигировании вен пищевода, трансплантации печени.
Практическая ценность заключается в следующем:
Совмещенная ПЭТ/КТ позволяет не только оценить эффективность эндоваскулярного и комбинированного лечения метастатического колоректального рака печени, но и прогнозировать его отдаленные результаты.
Применение УЗИ с ЦДК, МР-ангиографии и КТ-ангиографии в мониторинге проходимости портокавальных шунтов позволяет сократить необходимость использования инвазивных методов визуализации.
Показана высокая эффективность и безопасность стентирования желчных протоков с использованием металлических саморасширяющихся стентов, что позволяет рекомендовать данную методику в большинстве случаев наружно-внутреннего дренирования.
Регионарная химиотерапия у пациентов с купированной механической желтухой позволяет за счет частичного ответа опухоли гепатопанкреато-дуоденальной зоны облегчить перевод наружного дренирования во внутреннее.
Реканализация и стентирование портокавальных анастомозов в случае их острого тромбоза является альтернативой повторных шунтирующих операций.
Поэтапная редукция артериального кровотока к селезенке с хронической эмболизацией СА позволяет малоинвазивно купировать гиперспленизм не только у первичных больных, но и при рецидиве тромбоцитопении после перевязки СА и шунтирующих операций.
Выполнение трансюгулярного интрапеченочного портокавального шунтирования (TIPS) у больных с циррозом печени класс С (Child-Pugh), выраженным варикозным расширения вен пищевода, пищеводными кровотечениями, диуретикорезистентным асцитом, явлениями печеночной недостаточности позволяет снизить риск развития тяжелых осложнений синдрома портальной гипертензии и поставить пациентов на лист ожидания трансплантации печени.
Использование в повседневной практике усовершенствованных методик эндоваскулярных и эндобилиарных вмешательств у больных с диффузными и очаговыми заболеваниями печени позволяет уменьшить частоту осложнений и снизить лучевую нагрузку на пациента и хирурга.
Реализация и апробация работы. Результаты исследований и основные положения работы доложены и обсуждены на: научной конференции, посвященной 195-летию кафедры общей хирургии Военно-медицинской академии (Санкт-Петербург, 1995); научной конференции “Актуальные вопросы клиники, диагностики и лечения” (Санкт-Петербург, 1995); юбилейной научно-практической конференции, посвященной 160-летию 442 Окружного военного клинического госпиталя им. З.П.Соловьева (Санкт-Петербург, 1995); научной конференции “Актуальные вопросы клиники, диагностики и лечения” (Санкт-Петербург, 1997); международной научной конференции «Актуальные вопросы хирургического лечения синдрома портальной гипертензии» (Санкт-Петербург, 1999), конференции молодых ученых «Реконструкция – основа современной хирургии» в РНЦХ РАМН (Москва, 2000), конференции хирургов Ленинградской области (Санкт-Петербург, 2002), заседаниях Санкт-Петербургского хирургического общества Пирогова (Санкт-Петербург, 1998, 2001, 2002), VІІІ и IX Всероссийских научно-практических конференциях «Актуальные вопросы клиники, диагностики и лечения больных в многопрофильном лечебном учреждении» (Санкт-Петербург, 2007, 2009), IX, X, XI, XII Российских онкологических конгрессах (Москва, 2005, 2006, 2007, 2008), Невском радиологическом форуме (Санкт-Петербург, 2006, 2007, 2008), XI, XIV, XV и XVI Международных конференциях хирургов-гепатологов России и стран СНГ (Омск, 2004; Санкт-Петербург, 2007; Казань 2008; Екатеринбург 2009).
Публикации. По теме диссертационного исследования опубликовано 75 печатных работ, в том числе 18 – в журналах, рекомендованных ВАК Минобрнауки РФ. Оформлено 5 рационализаторских предложений, получено 3 приоритетные справки на изобретения.
Полученные результаты широко используются в лечебной практике клиник общей хирургии, госпитальной хирургии Военно-медицинской академии, в практической деятельности хирургов в онкохирургическом отделении Медико-санитарной части №70, 442 Окружного военного клинического госпиталя им. З.П.Соловьева, Госпиталя УВД г. Санкт-Петербурга и Ленинградской области. Результаты исследования используются в лекциях и на практических занятиях со слушателями факультетов подготовки врачей, I и VI факультетов Военно-медицинской академии.
Объем и структура работы. Диссертация состоит из введения, 5 глав, заключения, выводов, практических рекомендаций и списка литературы, изложена на 316 страницах, иллюстрирована 106 рисунками, содержит 43 таблицы. Библиографический список представлен 302 источниками, из них 132 – отечественных и 170 – иностранных авторов.
^ СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В основу настоящего исследования положен анализ клинических наблюдений за 460 пациентами с заболеваниями гепатопанкреатодуоденальной зоны, которые находились на обследовании и лечении в клиниках общей хирургии и госпитальной хирургии Военно-медицинской академии с 1994 по 2009 год (i). Критерием включения больных в основную группу исследования послужила необходимость применения на диагностическом или лечебном этапах интервенционных методик - чрескожных эндоваскулярных и эндобилиарных вмешательств. Всего 460 пациентам было выполнено 1829 диагностических процедур (ii). Лечебные интервенционные вмешательства в количестве от 1 до 21 (всего 1182) произведены 386 больным (v, vi). В контрольную группу входили пациенты, которым выполнялись только традиционные оперативные вмешательства или системная химиотерапия по поводу основного заболевания (n=78).
Пациенты основной группы разделены на две подгруппы:
- больные со злокачественными опухолями гепатопанкреатодуоденальной зоны (n=293);
- больные с синдромом портальной гипертензии (n=167) (i).
Распределение больных по характеру патологии гепатопанкреатодуоденальной зоны
| Основной диагноз заболевания | Число больных |
| 1 подгруппа (больные со злокачественными опухолями гепатопанкреатодуоденальной зоны) n=293 | |
| Первичный рак печени (всего) | 47 |
| Гепатоцеллюлярный рак | 44 |
| Холангиоцеллюлярный рак | 2 |
| Гепатохолангиоцеллюлярный рак | 1 |
| Метастатический рак печени (всего) | 146 |
| Метастазы колоректального рака | 102 |
| Метастазы рака желудка | 24 |
| Метастазы рака поджелудочной железы | 14 |
| Метастазы злокачественного карциноида | 6 |
| Рак поджелудочной железы (всего) | 78 |
| Рак внепеченочных желчных протоков (всего) | 12 |
| Рак большого дуоденального сосочка (всего) | 7 |
| Рак желчного пузыря (всего) | 3 |
| 2 подгруппа (больные с синдромом портальной гипертензии) n=167 | |
| Внутрипеченочный блок (цирроз печени) | 131 |
| Подпеченочный блок (всего) | 30 |
| Тромбоз ствола воротной вены | 5 |
| Тромбоз воротной вены и ее притоков | 22 |
| Тромбоз долевых ветвей воротной вены | 1 |
| Изолированный тромбоз селезеночной вены | 2 |
| Надпеченочный блок (всего) | 6 |
| Стеноз внутрипеченочного отдела нижней полой вены | 1 |
| Стеноз или окклюзия печеночных вен | 2 |
| Окклюзия печеночных вен и стеноз нижней полой вены | 3 |
| Всего | 460 |
Среди обследованных пациентов мужчин было 244, женщин - 216. Возраст пациентов - от 14 до 82 лет. Основное число наблюдений (76,6%) приходилось на больных трудоспособного возраста - от 20 до 60 лет.
Распределение больных по характеру патологии гепатопанкреатодуоденальной зоны представлено в таблице 1. У большинства пациентов первой подгруппы отмечалось метастатическое поражение печени различной этиологии (n=146). У остальных больных диагностированы первичный рак печени (n=47), злокачественные опухоли поджелудочной железы (n=78), внепеченочных желчных протоков (n=12), большого дуоденального сосочка (n=7) и желчного пузыря (n=3).
Диагностические интервенционные вмешательства
| Вид исследования | Число исследований |
| Дигитальная субтракционная артериогепатография | 561 |
| Дигитальная субтракционная артериопортография | 487 |
| Флебогепатография, концевая окклюзионная флебогепатография | 178 |
| Кавография и манометрия | 152 |
| Чрескожная спленопортография и манометрия | 25 |
| Чрескожная чреспеченочная портография и манометрия | 76 |
| Трансюгулярная транспеченочная портография и манометрия | 8 |
| Прямая портография и портоманометрия (интраоперационная) | 22 |
| Селективная катетеризация портокавального анастомоза | 86 |
| Чрескожная чреспеченочная холангиография | 152 |
| Чрескожная чреспеченочная эндобилиарная биопсия | 79 |
| Трансюгулярная транспеченочная биопсия | 3 |
| Всего исследований | 1829 |
Среди обследованных пациентов мужчин было 244, женщин - 216. Возраст пациентов - от 14 до 82 лет. Основное число наблюдений (76,6%) приходилось на больных трудоспособного возраста - от 20 до 60 лет.
У 132 пациентов со злокачественными опухолями гепатопанкреатодуоденальной зоны при поступлении выявлены явления механической желтухи. Распределение больных с механической обструкцией желчных протоков по виду опухоли представлено в таблице 3.
Распределение больных с механической желтухой по локализации и виду опухоли
| Гистологическая форма | Число больных |
| Рак поджелудочной железы | 74 |
| Метастатический рак печени | 30 |
| Первичный рак печени | 6 |
| Рак внепеченочных желчных протоков | 12 |
| Рак желчного пузыря | 3 |
| Рак большого дуоденального сосочка | 7 |
| Всего | 132 |
В группе больных с опухолями гепатопанкреатодуоденальной зоны традиционные оперативные вмешательства выполнены 108 из 293 больных, которым в общей сложности произведено 125 оперативных вмешательств (iv).
Виды традиционных оперативных вмешательств, выполненных у пациентов с опухолями гепатопанкреатодуоденальной зоны
| Вид оперативного вмешательства | Количество операций | |
| абс. | (%) | |
| Резекция печени | 55 | 44,0 |
| Гастропанкреатодуоденальная резекция | 18 | 14,4 |
| Дистальная резекция поджелудочной железы | 6 | 4,8 |
| Резекция гепатикохоледоха с наложением гепатикоэнтероанастомоза | 5 | 4,0 |
| Резекция левой или правой доли печени с гепатикохоледохом | 2 | 1,6 |
| Лапароскопическая холецистостомия | 4 | 3,2 |
| Холецистостомия из минидоступа | 2 | 1,6 |
| Холецистоэнтероанастомоз | 5 | 4,0 |
| Холедохоэнтероанастомоз | 18 | 14,4 |
| Гепатикоэнтероанастомоз | 10 | 8,0 |
| Всего | 125 | 100 |
Лечебные интервенционные вмешательства выполнялись у 270 из 293 пациентов этой группы (v). Причем в большинстве случаев лечебное пособие производилось неоднократно - от 2 до 21 процедуры. В среднем на одного пациента - приходилось около трех вмешательств.
Виды лечебных интервенционных вмешательств у пациентов с опухолями гепатопанкреатодуоденальной зоны
| Вид оперативного вмешательства | Число вмешательств |
| Масляная химиоэмболизация печеночной артерии | 554 |
| Масляная химиоэмболизация артерий поджелудочной железы | 34 |
| Селективная артериальная химиоинфузия | 164 |
| Масляная химиоэмболизация воротной вены | 24 |
| Механическая эмболизация воротной вены | 5 |
| Имплантация кавафильтра | 3 |
| Чрескожное чреспеченочное дренирование желчных протоков | 132 |
| Чрескожное чреспеченочное стентирование желчных протоков | 40 |
| Пункционный холедоходуоденоанастомоз | 4 |
| Всего | 960 |
Во второй основной подгруппе (больные с синдромом портальной гипертензии) большинство составили пациенты с внутрипеченочным блоком воротного кровотока, вызванным циррозом печени (n=131). Подпеченочная форма портальной гипертензии отмечена у 30 больных с нарушением проходимости воротной вены и ее основных притоков (i). Надпеченочная форма портальной гипертензии наблюдалась у 6 пациентов и связана с поражением печеночных вен или внутрипеченочного отдела нижней полой вены.
Пациентам второй подгруппы выполнялись традиционные оперативные вмешательства по поводу осложнений синдрома портальной гипертензии: варикозного расширения вен пищевода и желудка, пищеводно-желудочных кровотечений (n=100); диуретикорезистентного асцита (n=15); гиперспленизма (n=13).
На этапе обследования, при выборе метода коррекции портальной гипертензии и ее осложнений, а так же при контроле эффективности традиционных и интервенционных вмешательств пациентам второй подгруппы выполнено 694 диагностических эндоваскулярных пособия (ii).
Лечебные интервенционные вмешательства произведены у 116 из 167 пациентов этой группы (vi). Причем в большинстве случаев лечебное пособие производилось неоднократно - от 2 до 7 процедур.
Лечебные интервенционные вмешательства у пациентов с портальной гипертензией
| Вид оперативного вмешательства | Число вмешательств |
| Эмболизация селезеночной артерии | 126 |
| Эмболизация левой желудочной артерии | 15 |
| Эмболизация правой желудочной артерии | 8 |
| Эмболизация гастродуоденальной артерии | 4 |
| Имплантация кавафильтра | 1 |
| Чрескожная чреспеченочная эмболизация левой желудочной и коротких вен желудка | 8 |
| Эмболизация левой желудочной и коротких вен желудка через портокавальный анастомоз | 15 |
| Эмболизация левой желудочной и коротких вен желудка через трансюгулярный интрапеченочный портосистемный шунт | 5 |
| Баллонная дилатация устьев печеночных вен | 4 |
| Баллонная дилатация внутрипеченочного отдела НПВ | 5 |
| Стентирование внутрипеченочного отдела НПВ | 3 |
| Трансюгулярное интрапеченочное портосистемное шунтирование | 5 |
| Реканализация портокавального анастомоза | 6 |
| Баллонная дилатация зоны стеноза или окклюзии портокавального анастомоза | 8 |
| Стентирование зоны стеноза или окклюзии портокавального анастомоза | 5 |
| Реканализация венозной магистрали перитонеовенозного шунта | 4 |
| Всего | 222 |
Обследование больных обеих основных подгрупп проводилось по алгоритму, включавшему тщательное изучение жалоб, анамнеза заболевания, данных объективного обследования, а также лабораторных, инструментальных, рентгенологических и ультрасонографических методов исследования.
Для диагностики синдрома портальной гипертензии и опухолевого поражения гепатопанкреатодуоденальной зоны, для выбора вида оперативного лечения, а так же в послеоперационном периоде широко применялись ультразвуковые методы исследования: сканирование в В-режиме и дуплексное сканирование, цветовое и энергетическое допплеровское картирование.
Ангиографические исследования производились в условиях рентгенооперационной при помощи установок для дигитальной субтракционной ангиографии CAS-10A DFP-60A фирмы "Toshiba" (Япония), Polistar и Angiostar фирмы “Siemens” (Германия). Артериография выполнялась по стандартной методике. При необходимости производилась суперселективная катетеризация артериальных ветвей 2-3 порядка с последующим контрастированием.
Для исследования венозного русла применялись следующие методы: селективная флебогепатография, окклюзионная концевая флебогепатография и тонометрия, кавография, прямая портография, чрескожная чреспеченочная портография, чрескожная чресселезеночная спленопортография.
Флебогепатография выполнялась по методике Г.А. Моргунова (1987), усовершенствованной в нашей клинике. Так как в предоперационном периоде большинству больных устанавливался подключичный катетер для инфузионной терапии, то для уменьшения травматичности и упрощения процедуры использовался уже существующий подключичный доступ (рац. предложение № 5575).
Прямое контрастирование воротной вены и ее притоков осуществлялось с помощью чрескожной чреспеченочной портографии (ЧЧПГ), чрескожной спленопортографии, трансюгулярной транспеченочной портографии и шунтографии через портокавальный анастомоз. Первые две методики широко применялись в клинике до появления дигитальной субтракционной артериопортографии в 1994г.
ЧЧПГ и катетеризация воротной вены выполнялись по методике, разработанной Н.А. Борисовой (1985). Выбор ориентиров для пункции производился во время предварительного ультразвукового обследования пациента. После освоения пункции воротной вены под УЗ-контролем, с 1997г. исследование стали выполнять с использованием ультразвукового и рентгенологического методов визуализации.
Для оценки эффективности декомпрессивных операций и подтверждения проходимости портокавальных анастомозов широко применялось такое ангиографическое исследование, как шунтография. В клинике разработан или усовершенствован комплекс ангиографических методов визуализации применительно к исследованию портального кровотока после наложения декомпрессивных венных анастомозов. В зависимости от конкретных условий использовалось несколько способов данного исследования: селективная катетеризация анастомоза бедренным доступом, чрескожным чреспеченочным доступом или трансюгулярным транспеченочным доступом, возвратная портография, КТ-ангиография, МР-ангиография.
Наиболее информативной являлась шунтография, выполняемая при селективной катетеризации анастомоза. Чаще всего применяли бедренный доступ, реже яремный, подключичный, чрескожный или яремный чреспеченочный варианты катетеризации.
Поиск декомпрессивного венного шунта связан с трудностями, обусловленными выраженной вариабельностью места наложения сосудистого соустья и необходимостью проведения катетера через извитые сосуды, деформированные анастомозы. Для облегчения катетеризации соустья предложено рентгеноконтрастное кольцо-метка, которое изготавливалось из танталовой или стальной МРТ-совместимой проволоки диаметром 0.3 мм (рац. предложение № 5457). Во время выполнения шунтографии рентгеноконтрастное кольцо показывало локализацию анастомоза (vi). Для атравматичного прохождения через соустье применялись гидрофильные катетеры и проводники, микрокатетерная техника.
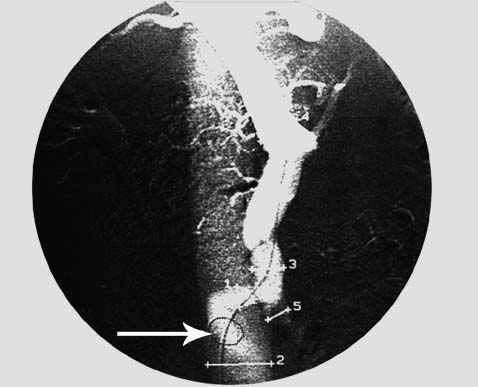
Селективная катетеризация воротной вены через мезентерикокавальный «Н»-анастомоз. Для облегчения поиска шунта используется рентгеноконтрастное кольцо-метка (стрелка).
В качестве неинвазивного метода визуализации анастомоза применялась спиральная компьютерная томоангиография (КТ-ангиография). Исследование производилось с использованием спирального компьютерного томографа SOMATOM PLUS 4A или SOMATOM Volume Zoom фирмы “Siemens” (Германия). Процедура начиналась с выполнения топограммы, на которой ориентируясь на рентгеноконтрастное кольцо-метку выбиралась зона интереса. Больному в течение 35-40 с вводилось в кубитальную вену 100-120 мл (1.8-2.0 мл/кг) 76% контрастного препарата. С задержкой 35-45 с производилось двухсерийное спиральное сканирование с шагом томограммы 0,1 -0,3 см и шагом спирали 0,5 см. В первую фазу исследования получалось изображение как венозных, так и артериальных структур. Во вторую фазу преобладало изображение вен. На основе фронтальных срезов производилась объемная реконструкция изображения в выбранных проекциях с исключением мешающих структур.
Для визуализации портокавальных анастомозов совместно со специалистами кафедры рентгенологии и радиологии с клиникой рентгенорадиологии ВМедА впервые в 2000 г. была разработана и применена на практике МР-ангиография - шунтография. В доступной литературе нет описаний более раннего использования данной методики.
МР-ангиография - шунтография выполнялась после высокопольной МРТ печени, желчных путей, поджелудочной железы, селезенки и сосудов на МР-томографе “Magnetom Symphony” фирмы “Siemens” (Германия) с напряженностью магнитного поля 1.5 Т. Применялась поверхностная матричная катушка для тела CP Body Array Coil (имеющей два сегмента – В1 и В2). Для проведения расчета времени прибытия контрастного вещества в зону интереса выполнялся Test bolus на основе TurboFlash последовательности с параметрами: TR – 1000 мс, TE – 3.2 мс, FA – 10о, матрица – 128 256, FoV – 400 мм, толщина среза – 10 мм, количество срезов – 40, ТА – 40 сек (без задержки дыхания). Для удобства оценки эти срезы ориентировали в аксиальной плоскости. После получения 4 серий тонких (толщиной 1.5 мм) срезов выполнялась их постпроцессорная обработка с построением 3D-реконструкции. Кроме этого, производился углубленный анализ тонких срезов, что позволило выявить детали анатомического строения сосудов и состояния наложенных венозных шунтов.
Лечебный эффект в группе пациентов с опухолевыми заболеваниями гепатопанкреатодуоденальной зоны определяли в соответствии с рекомендациями комитета экспертов ВОЗ в течение всего времени лечения больного: полный эффект, частичный эффект, стабилизация и прогрессирование. Размеры, количество, местоположение опухолевых очагов оценивали при УЗИ, КТ, МРТ по стандартным методикам, изложенным в соответствующих руководствах.
Совместно со специалистами кафедры рентгенологии и радиологии с клиникой рентгенорадиологии ВМедА впервые в 2003 г. была разработана и применена на практике методика контроля лечебного эффекта регионарной химиотерапии при метастатическом раке печени с помощью позитронно-эмиссионной томографии совмещенной с КТ (ПЭТ/КТ). Диагностическая процедура производилась перед эндоваскулярным вмешательством и через 1 мес. после. Методика заключалась в одновременном выполнении спиральной компьютерной ангиотомографии (внутривенно болюсно вводили 150-200 мл омнипака 350) и позитронно-эмиссионной томографии (внутривенно водили 300-400 MBq 18 F – фтордезоксиглюкозы) с последующим построением реформаций изображения (MPR, FUSION) и получением совмещенных ПЭТ/КТ изображений. Исследование выполняли на компьютерном комплексе «Biograph» фирмы «Siemens»: КТ «Somatom Emotion Duo», ПЭТ «Ecat-exact». Полученные пред- и послеоперационные данные сопоставлялись, оценивались размеры, кровоснабжение очаговых образований печени, накопление ими радиофармпрепарата в динамике. Полученную информацию сопоставляли с результатами УЗИ, КТ, МРТ исследований.
Наиболее значимым критерием эффективности лечения пациентов с опухолевыми заболеваниями гепатопанкреатодуоденальной зоны считали выживаемость больных. Рассчитывали показатели медианы общей и безрецидивной выживаемости с использованием методики Каплан-Мейера (актуриальная выживаемость с учетом дожития). Качество жизни пациентов оценивали с помощью опросника SF-36 (автор – J.Е.Ware, 1992), модифицированного опросника FACT G.
Полученные данные обрабатывались с использованием статистических методов: сравнительного анализа с применением коэффициента Стьюдента и корреляционного анализа. Статистические подсчеты осуществлялись с помощью программ Excel XP, Access XP и Statistica 5.0 для персонального компьютера.
^ РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Эндоваскулярные вмешательства при злокачественных опухолях гепатопанкреатодуоденальной зоны
Селективная артериальная химиоинфузия (САХИ) выполнялась следующими доступами: через установленный ангиографический катетер; через имплантированный интраоперационно порт; через имплантированный чрескожно порт.
Первая методика являлась продолжением диагностической ангиографии. Катетер суперселективно устанавливался в сосуд, кровоснабжающий опухоль.
Вторая методика заключалась в подкожной имплантации порта для длительной регионарной химиотерапии во время лапаротомии по поводу удаления первичной опухоли (гемиколэктомия, передняя резекция прямой кишки и др.). Третий способ САХИ осуществлялся с помощью пункционно устанавливаемого постоянного катетера в печеночной артерии (Arai Y. et al., 1992). В клинике применялась усовершенствованная в ЦНИРРИ методика чрескожной имплантации системы для длительной химиоинфузии в печеночную артерию. Пункционно чрезбедренным доступом в гастродуоденальную артерию устанавливался катетер с концевым и боковым отверстиями. Боковое отверстие располагалось на уровне собственной печеночной артерии. Концевое отверстие эмболизировалось спиралью. Периферический конец катетера соединяется на бедре с подкожным портом. Для проведения химиоинфузии пациенту выполнялась пункция приемной камеры порта на бедре и инфузоматом вводилось необходимое количество химиопрепарата (Генералов М.И. с соавт., 2007).
Для регионарной химиотерапии использовались стандартные схемы химиотерапии, предложенные для конкретных видов опухолей. Для лечения колоректальных метастазов в печень применялись схемы Мейо, XELOX, FOLFOX. При первичном раке печени использовался фарморубицин (60-80 мг/м2).При раке поджелудочной железы применялась монотерапия гемзаром (1000 мг/м2).
При масляной химиоэмболизации выполнялась катетеризация артерий, которые кровоснабжают опухоль. Чаще всего производилась химиоэмболизация собственной печеночной артерии (МХЭПА), раздельная подолевая химиоэмболизация печеночной артерии, химиоэмболизация артерий поджелудочной железы. В катетер под рентгеноскопическим контролем вводили эмульсию цитостатика в масляном контрастном препарате (сверхжидкий липиодол - Lipiodol Ultrafluid, Guerbet Lab., Франция). Химиопрепарат выбирали в зависимости от морфологической структуры опухоли.
Масляная химиоэмболизация артерий поджелудочной железы при опухолях данной локализации выполнялась по впервые предложенной в ЦНИРРИ методике (Гранов Д.А. с соавт., 2003; Павловский А.В., 2006).
^ Результаты эндоваскулярных вмешательств при первичном раке печени
Всем пациентам с первичным раком печени основной группы выполнялось комбинированное лечение, которое включало предоперационную регионарную химиотерапию, резекцию печени, послеоперационную регионарную химиотерапию.
Контрольную группу составили 10 больных с резектабельным первичным раком печени, которым выполнялось только хирургическое лечение - резекция печени.
Предоперационная МХЭПА была выполнена у 12 больных с первичным раком печени. Всего 22 процедуры.
Тяжелых осложнений после предоперационной МХЭПА не отмечено. Постэмболизационный синдром купировался в сроки 2-14 дней. Абсцедирования опухоли и других осложнений, требующих оперативного лечения не было. Во всех наблюдениях отмечено уменьшение размеров опухолевого поражения - средний размер опухолевых узлов снизился с 7,8 см до 5,3 см. В 2 (16,7%) случаях зафиксировано уменьшение объемов резекции с расширенной до обычной гемигепатэктомии.
В 3 (9,0%) наблюдениях проведение лечебной регионарной химиотерапии в виде 1-4 курсов МХЭПА позволило добиться возможности резекции печени за счет уменьшения размеров или исчезновения опухолевых очагов. Таким образом, у этих пациентов лечебная регионарная химиотерапия оказалась и предоперационной.
Всего в группе комбинированного лечения больных гепатоцеллюлярным раком печени было выполнено 15 резекций печени различного объема.
Резекция печени после одного курса предоперационной регионарной терапии проходила типично. Макроскопически доля печени, подвергшаяся эмболизации, выглядела неизмененной. В части случаев отмечались рыхлые спайки с соседними органами, иногда рубцовые втяжения в месте расположения опухолевых очагов. Повышенной кровоточивости, выраженного воспалительного инфильтрата вокруг опухолевых узлов не зафиксировано.
Иная картина наблюдалась в 4 случаях многократных курсов предоперационной регионарной терапии (2-4 курса). Интраоперационно отмечались множественные плотные рубцовые спайки с соседними органами. В двух наблюдениях наблюдались фиброзные изменения в печеночно-двенадцатиперстной связке, что затрудняло выделение сосудистых структур в ходе резекции печени. В одном случае фиксирована повышенная кровоточивость ткани печени во время разделения паренхимы. Однако при микроскопическом исследовании, каких либо признаков химического гепатита не выявлено. В двух наблюдениях диагностирован жировой гепатоз непораженной опухолью паренхимы печени, связать который с воздействием химиопрепаратов невозможно.
При морфологическом исследовании удаленных препаратов во всех опухолевых узлах отмечались явления некроза и лечебного патоморфоза опухоли различной степени. Однако тотальный некроз очагов отмечен только в одном случае. В ткани опухоли находили большое количество жировых включений (масляный химиоэмболизат). Кроме того, МКП выявляли и в удаленных лимфоузлах печеночно-двенадцатиперстной связки, что свидетельствует о противоопухолевом воздействии процедуры не только на очаги в печени, но и на регионарные лимфоузлы.
Непосредственные результаты резекций печени после предоперационной МХЭПА и без нее не отличались. Явлений печеночной недостаточности не связанных с большим объемом резекции не отмечено. В раннем послеоперационном периоде умер один пациент. Летальный исход развился в связи с исходно тяжелым состоянием пожилого пациента с выраженной сопутствующей патологией.
Полученный опыт свидетельствует, что предоперационная регионарная химиотерапия может выполняться в виде 1 курса МХЭПА, что позволяет избежать осложнений во время последующей резекции печени. Процедура во всех случаях приводит к частичному или полному некрозу опухоли, что уменьшает вероятность интраоперационного метастазирования и снижает риск рецидива опухоли. Кроме того, предоперационная регионарная химиотерапия позволяет уменьшить размеры опухоли и в 15% случаев снизить объем последующей резекции печени.
Послеоперационная или адъювантная регионарная химиотерапия выполнена 14 пациентам в виде МХЭПА с фарморубицином. Всего 39 процедур. Пациенту проводилось от 3 до 6 курсов терапии. В случае появления измеряемых опухолевых очагов в печени МХЭПА проводилась по стандартной лечебной схеме. При возникновении отдаленных метастазов регионарная химиотерапия отменялась.
Отдаленные результаты прослежены для 14 больных. Медиана выживаемости составила 46,2 мес. У пациентов контрольной группы с изолированным хирургическим лечением первичного рака печени (без регионарной химиотерапии) выживаемость значимо меньше (медиана выживаемости 28,6 мес, р< 0,05). В основной группе у 7 (50%) пациентов развился рецидив опухоли в оставшейся части печени, у 2 больных появились отдаленные метастазы. В контрольной группе местный рецидив диагностирован у подавляющего числа больных (6 из 7).
Таким образом, комбинированное лечение первичного рака печени с использованием предоперационной регионарной терапии, резекции печени и послеоперационной регионарной терапии приводит к увеличению выживаемости больных, снижению частоты рецидивов опухоли в оставшейся части печени. Использование эндоваскулярных методик не сопровождается тяжелыми осложнениями и хорошо переносится пациентами.
При нерезектабельном первичном раке печени выполнялась лечебная регионарная химиотерапия в объеме МХЭПА с механическим компонентом и ХИПА с фарморубицином. МХЭПА проведена 32 пациентам. Из них у 25 больных опухолевое поражение печени было первично нерезектабельным. У 7 пациентов лечебная регионарная химиотерапия производилась в связи с рецидивом опухоли в оставшейся части печени через 3-28 мес после резекции. Всего выполнено 83 курса регионарной химиотерапии. Постэмболизационный синдром после лечебной МХЭПА протекал менее благоприятно в связи с большим объемом поражения печени и жесткой схемой процедуры и продолжался 2-14 сут. В двух случаях купирование постэмболизационного синдрома производилось в условиях отделения интенсивной терапии в связи с развитием явлений печеночной недостаточности тяжелой степени. Отмечен один летальный исход в начале исследования в связи с развитием печеночной комы у больной с гепатоцеллюлярным раком на фоне цирроза печени (Child C). В дальнейшем наличие цирроза печени (Child C) считали противопоказанием к МХЭПА.
Отдаленные результаты прослежены для 24 больных с первично нерезектабельным поражением печени. Наблюдался один полный ответ у пациента с гепатоцеллюлярной карциномой на фоне цирроза печени Child В. Больной умер через 8 мес после отмены регионарной химиотерапии от прогрессирования хронической печеночной недостаточности на фоне цирроза печени. На аутопсии опухолевых очагов не выявлено.
Частичный ответ после первой процедуры наблюдался у 8 пациентов, у 12 - стабилизация, и у 4 - прогрессирование. Медиана выживаемости составила 19,4 мес. В 3 (12,0%) наблюдениях проведение лечебной регионарной химиотерапии в виде 1-4 курсов МХЭПА позволило добиться возможности резекции печени за счет уменьшения размеров опухолевых очагов.
ХИПА проведена 8 пациентам. Всего выполнено 42 курса регионарной химиотерапии. Тяжелых осложнений, связанных с техникой выполнения процедуры не отмечено. Системной токсичности химиопрепаратов тяжелой и средней степени тяжести не наблюдалось. У одного пациента с гепатоцеллюлярной карциномой на фоне цирроза печени Child С прогрессировала печеночная недостаточность, которая привела к гибели больного через 14 сут. после очередного (шестого) курса терапии.
Отдаленные результаты прослежены для 7 больных. Медиана выживаемости составила 10,2 мес.
Таким образом, выживаемость пациентов на фоне МХЭПА оказалась значимо выше, чем при САХИ (медиана выживаемости 19,4 мес против 10,2 мес, р< 0,05). Проведение регионарной химиотерапии у пациентов с первичным раком и циррозом печени связано с высоким риском развития тяжелой печеночной недостаточности. Определение возможности эндоваскулярных вмешательств у данной группы больных должно сопровождаться оценкой функциональных резервов печени. Наличие цирроза печени Child С является противопоказанием для регионарной химиотерапии.
