Экспериментальное определение кинетических и термодинамических параметров сложных химических реакций и численный анализ их идентифицируемости
| Вид материала | Автореферат |
Содержание5.1. Модель состояния и модель наблюдения 5.2. Исследование кинетики быстрых реакций переноса протона в водном растворе 5.3. Исследование кинетики других быстрых реакций в водном растворе |
- Исследование сложных процессов методом дта, 38.19kb.
- Iii кинетика и механизм гетерогенных каталитических реакций, влияние реакционной среды, 1807.15kb.
- Работников образования Кафедра естествознания реферат на тему: классификация химических, 424.08kb.
- 3. Принципы классификации и классификация термодинамических процессов. Ответ, 215.06kb.
- Урок химии в 11классе по теме «Классификация химических реакций», 65.15kb.
- Лекция 12. Энергетический обмен, 50.55kb.
- Программа спецкурса «методы расчета физико-химических свойств веществ» для студентов, 40.47kb.
- Календарно-тематический план лекций, 50.91kb.
- Календарно-тематический план лекций на 2011/2012 уч г. Фармацевтический факультет,, 75.88kb.
- Методические указания и контрольные задания по дисциплине Физическая и коллоидная химия, 320.37kb.
5.1. Модель состояния и модель наблюдения
Кинетика обратимой химической реакции описывается автономной системой о.д.у. Ее заменяют равносильной системой, описывающей отклонения концентраций от равновесных величин. Поскольку эти отклонения невелики, пренебрегают нелинейными относительно отклонений членами. Далее выражают линейно зависимые отклонения через ключевые отклонения
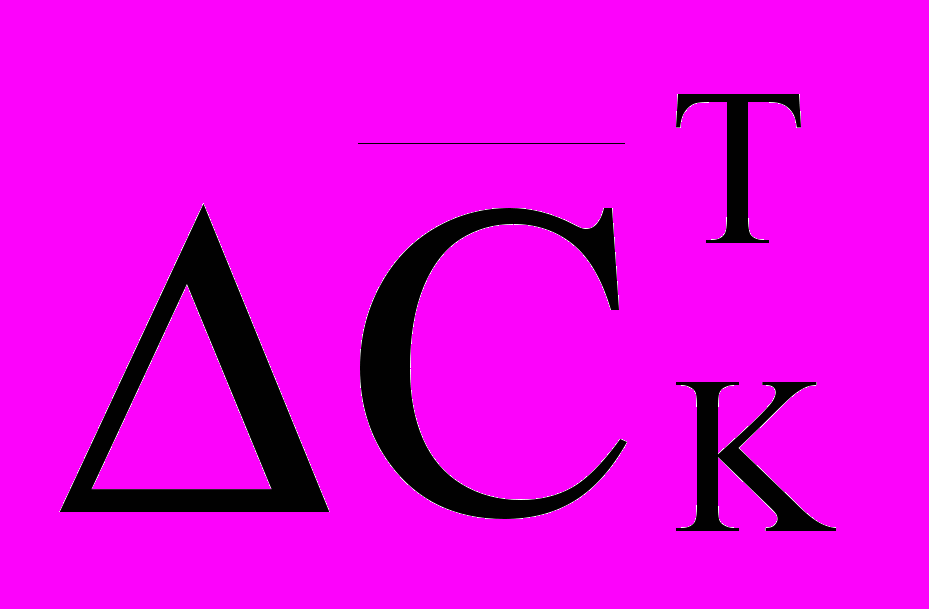 и исключают линейно зависимые уравнения. Полученную нормальную систему о.д.у. рассматривают как модель состояния
и исключают линейно зависимые уравнения. Полученную нормальную систему о.д.у. рассматривают как модель состояния 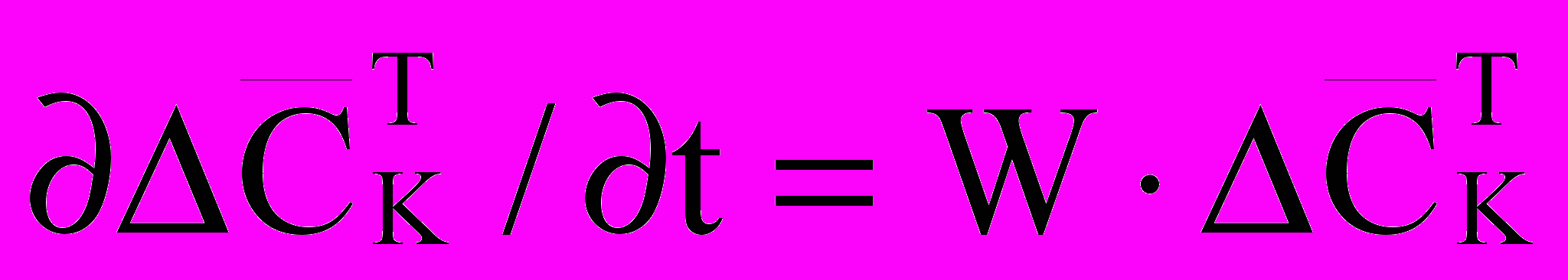
Матрицу постоянных коэффициентов W часто называют релаксационной матрицей.
Решение нормальной системы о.д.у. имеет вид

где
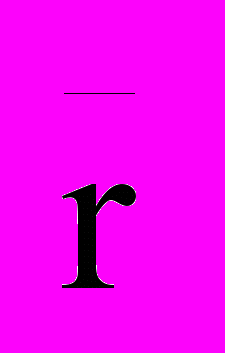 – константы релаксации, а матрица A содержит амплитуды процесса релаксации.
– константы релаксации, а матрица A содержит амплитуды процесса релаксации. Таким образом, рассматриваемое решение представляет собой линейную комбинацию затухающих экспонент, число которых равно числу уравнений в модели состояния. Набор констант релаксации иногда называют релаксационным спектром.
Константы релаксации (обратные времена релаксации) являются корнями характеристического уравнения релаксационной матрицы
Det (W-E) = 0
Если времена релаксации существенно различаются, говорят о хорошо разрешенном релаксационном спектре.
В рассматриваемом методе регистрируют временную зависимость интенсивности излучения, прошедшего через изучаемую систему. При малых отклонениях от конечного значения она пропорциональна оптическому поглощению с обратным знаком. Таким образом, наблюдают линейную комбинацию экспонент, а чаще одну экспоненту. Ее декремент затухания принимается за экспериментально измеренное значение компонента модели наблюдения.
5.2. Исследование кинетики быстрых реакций переноса протона в водном растворе
Методом скачка температуры со спектрофотометрической регистрацией при температурах от 8 до 50°C и постоянной ионной силе 0.1 (перхлорат натрия) в присутствии цветных кислотно-основных индикаторов выполнены экспериментальные измерения времен релаксации в водных растворах ряда слабых кислот и оснований. Определены значения констант скорости и активационные параметры быстрых реакций переноса протона. Численный анализ идентифицируемости параметров применяли для построения плана эксперимента, который преимущественно обеспечивал точность определения констант скорости требуемых реакций с участием изучаемой кислоты или основания.
Найдено, что константы скорости быстрых реакций протонирования 11 изученных оснований (гидроксильных и амидных комплексов металлов, азотсодержащих оснований и анионов цветных кислотно-основных индикаторов) лежат в области значений, характерной для контролируемых диффузией процессов. Для некоторых из них, например, -аллилпалладий акваоксокомплекса и гидроксиламина, энергия активации существенно превышает ожидаемое значение 2-4 ккал/моль. Это объяснено перестройкой структуры сольватной оболочки, приводящей к увеличению эффективного кинетического сечения реакции с ростом температуры. Такое объяснение предполагает эстафетный механизм переноса протона через сольватную оболочку, постулированный М. Эйгеном для реакции рекомбинации ионов водорода и гидроксила в воде в кристаллическом и жидком состояниях.
Для быстрых реакций протонирования всех изученных оснований кислотной формой индикатора значения активационных параметров соответствуют диффузионному контролю скорости с учетом стерического фактора от 1/6 до 1/2. Это предполагает непосредственный перенос протона от кислоты к основанию, что вполне объяснимо для крупной и мало склонной к сольватации молекулы индикатора.
5.3. Исследование кинетики других быстрых реакций в водном растворе
Разработанный подход был применен при планировании эксперимента и обработке полученных данных для других быстрых реакций. При этом на изученных системах была показана его эффективность.
Из этих работ технологически значимым является изучение кинетики реакции гидролиза брома в водных растворах хлоридов и бромидов, которая описывает среду процесса извлечения брома из содержащей бромиды рапы.
Выводы
- Разработан метод численного анализа идентифицируемости параметров кинетических и термодинамических моделей физической химии. Он основан на отыскании однозначно оцениваемых нелинейных параметрических функций (НПФ). Для этого вычисляют производные НПФ по искомым параметрам путем скелетного разложения на сомножители информационной матрицы или матрицы чувствительности.
- Разработанный подход позволяет в некорректно поставленных задачах параметризации выполнять анализ до, во время и после эксперимента; различать однозначно оцениваемые параметры и НПФ; рассчитывать погрешности их определения; упрощать модели без значимого ухудшения адекватности; обоснованно уменьшать размерность задач параметризации; планировать эксперименты для идентификации требуемых параметров; отбирать гипотезы по критерию требуемой идентифицируемости; корректно вводить идентифицирующую информацию; эффективно использовать данные разных моделей наблюдения.
- Разработанный метод практически применен в экспериментальном исследовании кинетики, термодинамики и стехиометрии ряда важных химических реакций, например, алкилирования бензола пропиленом на фосфорнокислотном катализаторе, алкилирования изобутана бутенами-2 и деградации 2,2,4 триметилпентана в присутствии трифликовой кислоты, эпоксидирования аллилового спирта пероксидом водорода на вольфраматном катализаторе.
- Вычисленные согласно предложенному методу относительные погрешности НПФ проверены с положительным результатом известным методом статистических испытаний на примере модели кинетики алкилирования бензола пропиленом.
- Полученные с применением разработанного подхода результаты нашли применение в ряде технологических работ, например, обосновании выбора оптимального реактора для синтеза глицидола, синтеза изопропилбензола, окислительного метилирования толуола.
- С применением предложенного метода сформированы физико-химические основы технологии производства глицидола, осуществленного в опытно-промышленном масштабе, а также других кислородсодержащих продуктов.
