Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж
| Вид материала | Документы |
Содержание1. Перманганатометрія. 2. Йодометрія. Самостійна робота № 7. |
- Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж одеської, 869.19kb.
- Міністерство освіти І науки, молоді та спорту україни, 59.16kb.
- Міністерство освіти І науки, молоді та спорту України, 61.58kb.
- Міністерство освіти І науки, молоді та спорту україни технічний коледж тернопільського, 361.4kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 139.07kb.
- Міністерство освіти І науки, молоді та спорту України двнз «Івано-Франківський коледж, 1070.95kb.
- Міністерство освіти І науки, молоді та спорту україни, 35.62kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 369.69kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 182.18kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 53.88kb.
1. Перманганатометрія.
2. Йодометрія.
3. Характеристика розчинів, які використовують в йодометрії.
Стислі теоретичні відомості
- Перманганатометрія.
Пермангонатометрія – це метод титриметричного аналізу, у якому речовину визначають титруванням розчину перманганату калію. Перманганат – іон, є окисником, може відновлюватись в залежності від умов до іона двухвалентного марганцю (Мn2+), до оксиду марганцю (ІV) (МnО2), а точніше до його гідрату МnО(ОН)2 або марганат-іону МnО42-. У кислому середовищі МnО4- відновлюється до Мn2+.
5Fe2+ + МnО4- + 8H+ = 5Fe3+ + Мn2+ + 4H2O
1
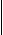 МnО4- + 8H+ + 5e = Мn2+ + 4H2O
МnО4- + 8H+ + 5e = Мn2+ + 4H2O5 Fe2+ - e = Fe3+
Еквівалент окисника і відновника залежить від реакції, в якій приймає участь речовина. У даній реакції еквівалентна маса дорівнює:
М (КМnО4)од. =
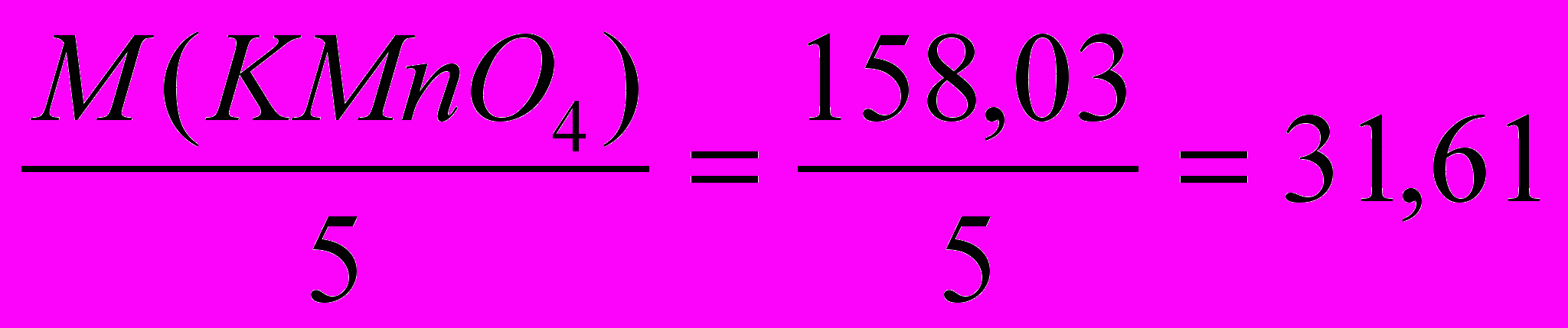 г/моль
г/мольЕквівалентна маса відновника FeSO4 дорівнює:
М (FeSO4)од. = М (FeSO4) = 152 г/моль.
У нейтральному, слабокислому або слаболужному середовищі іон МnО4- приймає три електрони, при цьому утворюється осад МnО2 або МnО(ОН)2 бурого кольору:
МnО4- + 3H2О + 3e = МnО(ОН)2 + 4ОН-.
У лужному середовищі іон МnО4- приймає тільки один електрон, при цьому утворюється іон МnО42- зеленого кольору.
МnО4- - е = МnО42-
Перманганатометричні визначення частіше всього проводять у кислому середовищі і дуже рідко у слабокислому і нейтральному, так як утворення темно-бурого осаду МnО2 затрудняє встановлення точки еквівалентності, в той час як у кислому середовищі цю точку легко встановити по обезбарвленню перманганату у результаті відновлення його до безкольорового іону Мn2+.
Перманганат калію є сильним окисником. Його нормальний окисно-відновний потенціал при відновленні до Мn2+ дорівнює:
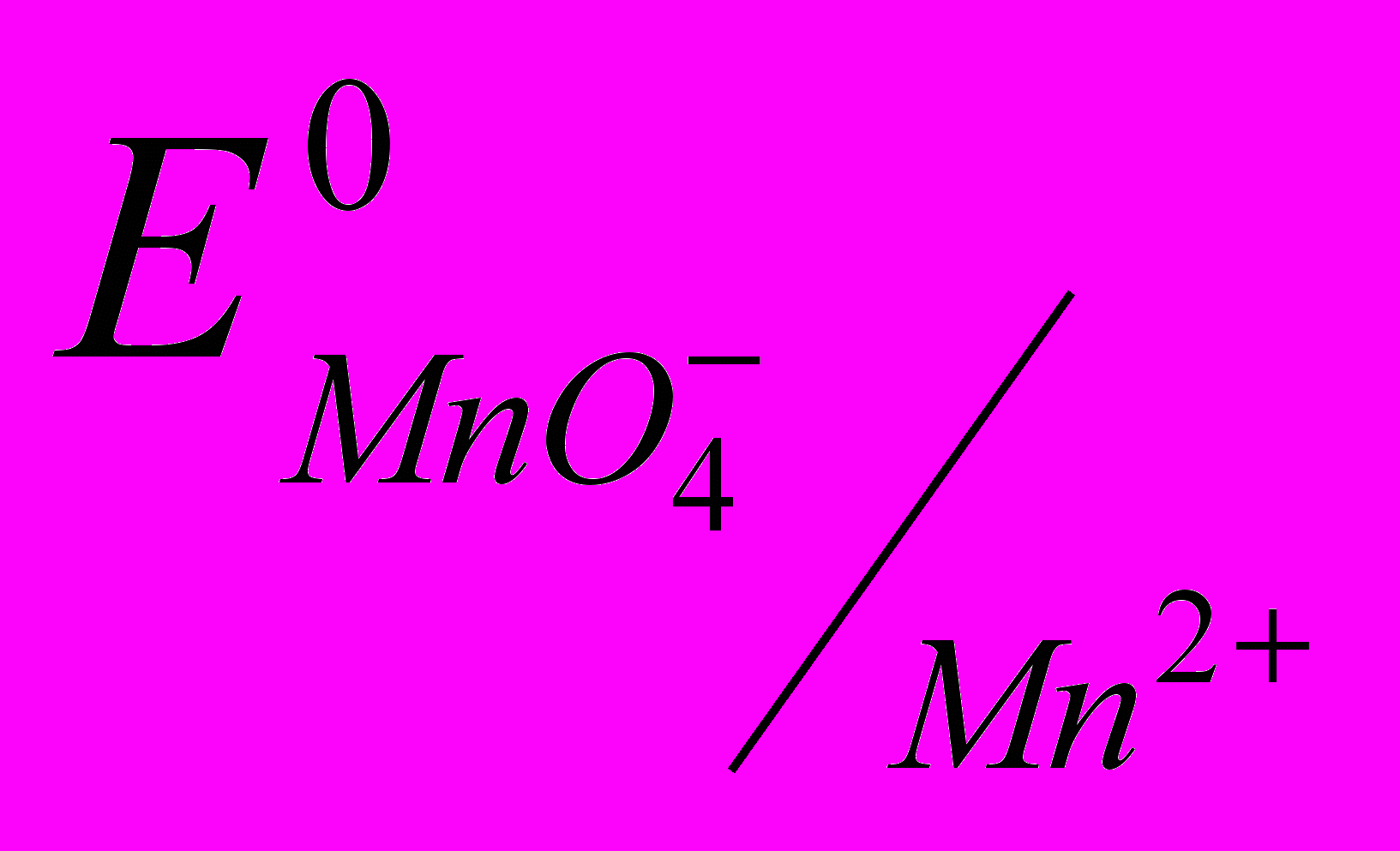 = +1,52 В.
= +1,52 В.Нормальний окисно-відновний потенціал пари MnO-4 / MnO2 дорівнює:
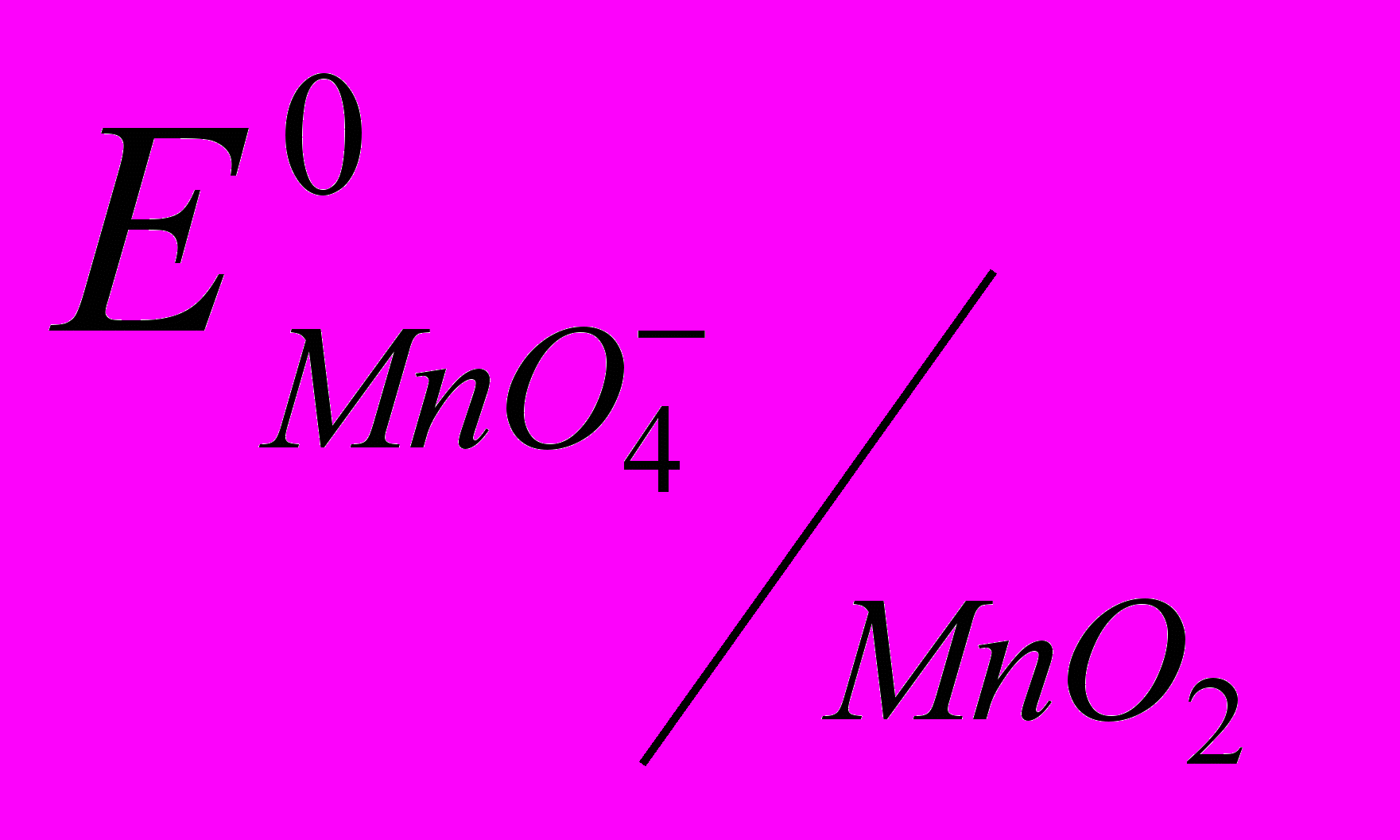 = +0,59 В.
= +0,59 В.Значить, окисна способність КМnО4 у кислому середовищі незрівнянно вище, чим у лужному.
Кислотність титруємих розчинів краще всього здійснювати додаванням сірчаної кислоти. Соляна кислота непридатна, так як може окислювати НСІ перманганатом калію до хлору.
Перманганатометрію використовують для кількісного визначення не тільки відновників, но і окисників. Визначая окисники, використовують метод титрування по осаду, а значить до аналізуємого розчину окисника додають надлишок розчину відновника відомої концентрації, а потім залишок відновника відтитровують розчином перманганату калію.
- Йодометрія.
Йодометрія належить до найбільш використовуємого і точного титриметричного методу аналіза. В її основі лежать окисно-відновні процеси, які пов’язані з відновленням І2 до йодид-іонів (І-) або окисненням йодид-іонів до І2.
J2 + 2е- = 2J
2J - 2е = J2
Йод є окисником середньої сили. Тому у водних розчинах сильні відновники легко окислюються, а сильні окисники виділяють вільний йод із розчинів йодидів. У зв’язку з цим методом йодометрії можна кількісно аналізувати як окисники, так і відновники. Умови проведення прямої і зворотньої реакції різні. Пряма реакція проходить в слаболужному середовищі при мінімальній концентрації йодид-іонів. Зворотній реакції більш підходить кисле середовище і висока концентрація йодид-іонів.
Для кількісного визначення вільного йоду у розчині по методу йодометрії використовують взаємодію його з тіосульфатом натрію. Присутність у тіосульфат-іоні S2O32- сірки, з ступенем окиснення мінус два, визначає його сильні відновлювальні властивості, які приводять у результаті реакції до виникнення дисульфатної групи –S – S - .
Йод взаємодіє з тіосульфатом натрію слідуючим чином:
І2 + 2Na2S2O3 = 2NaІ + Na2S4O6
І2 + 2S2O32- = 2І- + S4O62-
1
 І2 + 2е = 2І-
І2 + 2е = 2І-1 2S2O32- - 2е = S4O62-
Із рівняння реакції видно, що еквівалентна маса йоду дорівнює молярній масі йоду поділенної на два, а еквівалентна маса тіосульфату дорівнює його молярній масі.
М (І2)од. =
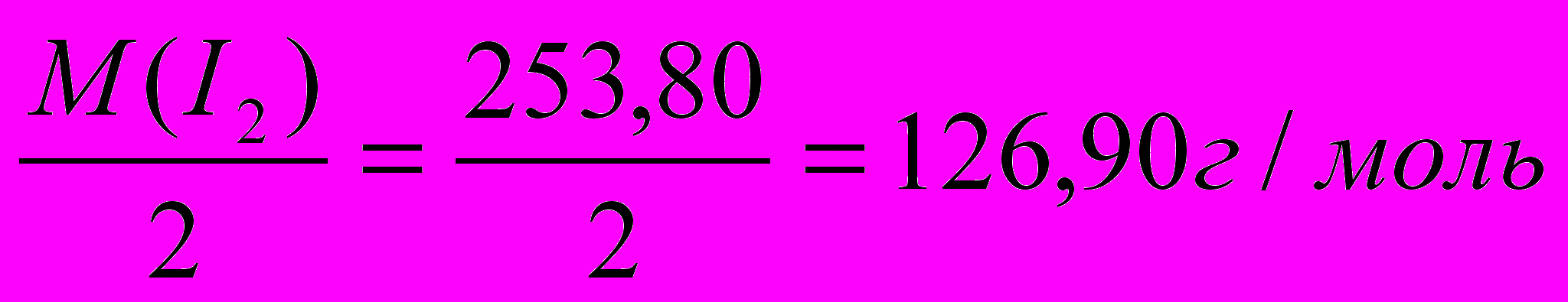
М (Na2S2O3 5Н2О)од. = М (Na2S2O3 5Н2О) = 248,12 г/моль.
При йодометричному визначенні сильних окисників в розчин вводять надлишок йодиду калію, після чого виділяється еквівалентна кількість йоду:
Cr2O72- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O
ClO3- + 6I- + 6H+ = 3I2 + Cl- + 3H2O
H2O2 + 2I- + 2H+ = I2 + 2H2O
2Fe3+ + 2I- = I2 + 2Fe2+
2MnO4 + 10I- + 16H+ = 5I2 + 2Mn2+ + 8H2O
Йод, який утворився титрують розчином тіосульфату натрію у присутності індикатору (розчин крохмалю) і визначають масу або кількість окисника. Йодометрично можна визначити також і концентрацію кислот у розчині, наприклад:
6НСІ + 5КІ + КІО3 = 3І2 + 6КСІ + 3Н2О.
Кількість йоду, який виділився у результаті реакції, еквівалентно кількості іонів водню. Тому, відтитрував йод розчином тіосульфату, визначають концентрацію кислоти у розчині.
Косвенний спосіб йодометричного визначення окисників та кислот називають методом заміщення, так як при цьому речовини, не взаємодіють з розчином тіосульфату натрію, заміщають еквівалентною кількістью йоду, який потім визначають.
Існують слідуючі помилки при йодометричному визначенні. Йод і його розчини є леткими, тому, щоб зменшити помилки із-за леткості йоду, усі роботи необхідно, по можливості, виконувати у закритих склянках або колбах і на холоді. При аналізі окисників у розчині утворюють великий надлишок йодиду калію, щоб перевести молекулярний йод, який утворюється при реакції, у розчин і зменшити його леткість, про що вказувалося вище. Другою причиною помилок є окислення йодиду калію киснем повітря:
4I- + 4H+ + О2 = 2I2 + 2H2O
Тому не слід залишати на тривалий час підкислені розчини йодиду калію.
У йодометрії в якості індикатору використовують розчин крохмалю, який утворює з йодом сполуку синього коліру. Крім того, крохмаль адсорбірує багато йоду і дуже повільно десорбірує його у розчин. Тому, щоб не виникло помилки при титруванні йоду тіосульфатом, крохмаль додають почти у самому кінці титруванні, коли вільного йоду у розчині залишається мало і буре забарвлення розчину стає блідно-жовте (солом’яного коліру).
3. Характеристика розчинів, які використовують у йодометрії.
Розчин йоду.
Кристалічний йод не відповідає вимогам, які пред’являються до стандартних речовин, так як йод містить воду, хлор, бром та інші домішки. Для приготування розчину йоду використовують очищений сублімацією йод.
Концентрація розчину йоду, який зберігається при освітленні сонця і на повітрі поступово збільшується. Розчини йоду необхідно зберігати у герметично закритих склянках із темного скла.
Розчин тіосульфату натрію.
Стандартний розчин тіосульфату не можна готовити по стандартній масі солі, так як вона не відповідає вимогам, які пред’являються до стандартним речовинам. Концентрація розчину тіосульфату натрію не є постійною і в перші 10 днів з моменту приготування – збільшується. Це обусловлено взаємодією тіосульфат-іону з вугільною кислотою, яка розчинна у воді, і утворенням гідросульфіт-іону.
Na2S2O3 + Н2СО3 = NaНСО3 + NaНSO3
У свою чергу гідросульфіт-іон також реагує з йодом:
NaНSO3 + I2 + H2O = НІ + NaІ + Н2SO4
Потім конценрація розчину повільно зменшується, так як окислюється тіосульфат-іон киснем повітря і разкладання його тіобактеріями:
Na2S2O3 + О2 = 2S + Na2SO4
Концетрацію розчину тіосульфату натрію встановлюють кожний раз перед початком роботи по стандартному розчину діхромату калію.
Для підвищення стійкості розчину тіосульфату натрію дотиримуються слідуючих вимог:
- розчини зберігають у посуді із темного скла, закриті пробкою з хлоркальцієвою трубкою, яка заповнена натронним вапном для захисту від СО2;
- для зменшення розкладу розчину тіобактеріями до нього додають йодид ртуті;
- додавання до розчину об’ємом 1л Na2СО3 масою 0,2г попереджує почти повним розкладанням його під впливом СО2, так як оксид вуглецю (ІV) реагує головним чином, з карбонат-іоном: СО32- + Н2СО3 = 2НСО3-.
Розчин крохмалю.
Єдиним і в одночас незвичайно чутливим індикатором в йодометрії є розчин крохмалю. У присутності йодиду калію чутливість крохмалю до водного розчину йоду збільшується. Считається, що водний розчин крохмалю утворює адсорбціонну сполуку синього кольору у присутності полійдид-іону (І3-). Чутливість індикаторної реакції зменшується зі збільшенням температури і залежить від способу приготування індикатору. Правильно приготовлений розчин індикатору повинен забарвлюватися у чисто синій колір від додавання обнієї краплі йоду (С = 0,01 моль/л). Неправильно приготовлений розчин індикатору або розчин, який зберігали тривалий час, утворює з йодом сполуку фіолетового коліру. Він непридатний для йодометричного визначення.
Завдання для виконання самостійної роботи
Відповісти на запитання:
Характеричтика методу перманганатометрії.
2. Приготування та зберігання розчину перманганату калію.
3. Індикатори методу перманганатометрії.
4. Стандартні речовини у методі перманганатометрії.
5. Умови зберігання стандартизованого розчину перманганату калію.
6. Перманганатометричне визначення відновників, окисників та речовин, які не є окисниками і відновниками.
7. Характеристика методу йодометрії.
8. Приготування стандартизованого розчину йоду і тіосульфату.
- Умови зберігання розчину йоду і тіосульфату.
- Індикатори методу йодометрії.
- Йодометричне визначення окисника, відновника і кислот.
Скласти рівняння реакцій:
- Напишіть окисно-відновні реакції метод електронного балансу та напівреакції:
Fe + HNO3 Fe(NO3)2 + NH4NO3 + H2O
KMnO4 + H2O2 + H2SO4 K2SO4 + MnSO4 + O2 + H2O
Bi2O3 + Cl2 + KOH Bi2O5 + KCl + H2O
K2Cr2O7 + FeSO4 + H2SO4 K2SO4 + Fe2(SO4)3 + Cr2(SO4)3 + H2O
САМОСТІЙНА РОБОТА № 7.
Тема: Комплексонометричний метод аналізу.
Повинні знати: поняття про комплексони особливість будови молекули трилону Б та механізм його взаємодії з іонами кальцію та магнію особливості впливу рН середовища на змінення хімічної рівноваги реакції комплексоутворення вплив буферного розчину та механізм дії індикатора використання методу для контролю сировини харчових виробництв
Повинні вміти: написати хімізм реакції комплексоутворння показати особливості будови молекули трилону Б та механізм його взаємодії з іонами кальцію та магнію
План:
- Комплексонометричне титрування.
- Класифікація прийомів комплексонометричного титрування.
