Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж
| Вид материала | Документы |
СодержаниеЗавдання для виконання самостійної роботи Самостійна робота № 5. Стислі теоретичні відомості Зворотне титрування Завдання для виконання самостійної роботи Самостійна робота № 6. |
- Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж одеської, 869.19kb.
- Міністерство освіти І науки, молоді та спорту україни, 59.16kb.
- Міністерство освіти І науки, молоді та спорту України, 61.58kb.
- Міністерство освіти І науки, молоді та спорту україни технічний коледж тернопільського, 361.4kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 139.07kb.
- Міністерство освіти І науки, молоді та спорту України двнз «Івано-Франківський коледж, 1070.95kb.
- Міністерство освіти І науки, молоді та спорту україни, 35.62kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 369.69kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 182.18kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 53.88kb.
- Порядок титрування.
Правильне визначення кінця титрування залежить не тільки від вибору індикатору, но і від принятого в роботі порядку титрування. Під порядком титрування розуміють ту послідовність, в якій розчини приливають друг до друга. Якщо до розчину лугу приливают розчин кислоти, то в цьому випадку називають ацидометричне титрування (від лугу до кислоти). При зворотному порядке, коли до розчину кислоти приливають розчин лугу називають алкаліметричне титрування (від кислоти до лугу).
В ацидометричному титруванні, концеве титрування буде різним в залежності від різних сил взятих індикаторів. У присутності метилоранжа, тобто жовтий до рожевого забарвлення розчину, завжди затрати кислоти більші, чим потрібно для нейтралізації. Цей надлишок кислоти є водневою похибкою. Остання тим більша, чим менший показник титрування індикатору. У присутності фенолфталеїну кінець титрування співпадає з моментом нейтралізації.
В алкаліметричному титруванні кислотні індикатори під впливом водневих іонів кислоти будуть знаходитись в молекулярному стані. У присутності метилоранжу, тобто від рожевого забарвлення до жовтого, змінення забарвлення точно відмічає момент нейтралізації від безкольорового до малинового. У присутності фенолфталеїну потрібно затратити деякий надлишок розчину лугу.
- Кількість додавання індикатору.
Коли до титруємого розчину додають індикатора більше чим потрібно, то допустима похибка. Чим більше індикатора у розчині, тим важче помітити змінення його забарвлення, тобто воно може відбуватися повільніше.
Для встановлення момента еквівалентності має значення не стільки інтенсивність забарвлення розчина, скільки чіткість її вимірювання. Дослідницьким шляхом знайдено, що при титруванні розчину об’ємом 10 … 15 мл слід додати одну краплю індикатору, а при об’ємі 25 мл не більш 2-х крапель. Концентрація індикатора при цьому повинна бути загальноприйнятою.
При титруванні рекомендується користуватися для самоконтролю розчином «свідка». Наприклад, в колбу для титрування наливають приблизно такий об’єм води, який буде дорівнювати об’єму розчину в конці титрування (= 50 мл), і до нього додають 2 краплі розчину метилоранжу, 2 краплі розчину кислоти, яку використовують для титрування; щоб з’явилось помітне оранжове забарвлення розчину. Титрування досліджує мого розчину лугу проводять до появи такої ж інтенсивності та забарвлення розчину як і у «свідка».
Завдання для виконання самостійної роботи
Відповісти на запитання:
1. Які речовини називають кислотно-основними індикаторами?
2. Які сполуки використовують в якості кислотно-основних індикаторів?
3. Як пояснюється змінення забарвлення індикатора з точки зору іонної теорії? Вказати недоліки цієї теорії.
4. Назвіть основні характеристики кислотно-основних індикаторів.
5. Що називається інтервалом переходу індикатору?
6. Який взаємозв’язок між константою дисоціації та інтервалом переходу індекатору?
7. Якими способами підбирають індикатори при титруванні по методу нейтралізації?
8. Назвіть типи індикаторних похибок.
9. При яких умовах можна проводити ступінчате титрування багато основних кислот або суміші кислот?
10. Наведіть приклади титрування: прямого; зворотного; по заміщенню – у методі нейтралізації.
11. Що таке твердість води? Як визначають тимчасову і постійну твердість води?
12. Сутність кислотно-основного титрування.
13. Як выбирають індикатор для різних випадків титрування?
14. Що таке показник титрування?
Розв’язати задачі:
1. Скільки см3 нітратної кислоти з густиною 1,007 г/см3 розчину з еквівалентною молярною концентрацією 0,025 мольекв/дм3?
2. Маємо розчин соляної кислоти з еквівалентною молярною концентрацією 0,1 мольекв/дм3. Визначити титр розчину соляної кислоти та титр розчину соляної кислоти по гідроксиду калію.
3. Для встановлення титру розчину сірчаної кислоти наважку 1,6452 г бури розчинили у мірній колбі на 50 см3. Визначте концентрацію бури (тетраборату натрію).
4. Наважка хлориду калію 0,9120 г розчинили у мірній колбі на 1 л. Розчин довели до мітки. Чому дорівнює титр отриманого розчину по робочій речовині?
САМОСТІЙНА РОБОТА № 5.
Тема: Оксидиметричний метод аналізу.
Повинні знати: правила користування таблицями окисно-відновних потенціалів.
Повинні вміти: визначати еквівалентні маси окислювачів і відновників.
План:
1. Методи окисно-відновного титрування.
Стислі теоретичні відомості
1. Методи окисно-відновного титрування.
В оксидиметричному методі аналізу зустрічаються з трьома видами титрування: прямим, зворотнім та титруванням по заміщенню.
При прямому титруванні досліджує мий розчин титрують стандартним розчином.
Зворотне титрування використовують у тому випадку, коли досліджуємо речовина не реагує зі стандартним розчином або реагує повільно.
Титрування по заміщенню використовують у випадках, коли визначають іон.
Особливістю цього методу являється визначення еквівалентних мас окисника та відновника.
Під еквівалентною масою слід розуміти кількість речовини в г/моль, еквівалентне одному прийнятому електрону однією молекулою окисника в даній реакції.
Е =
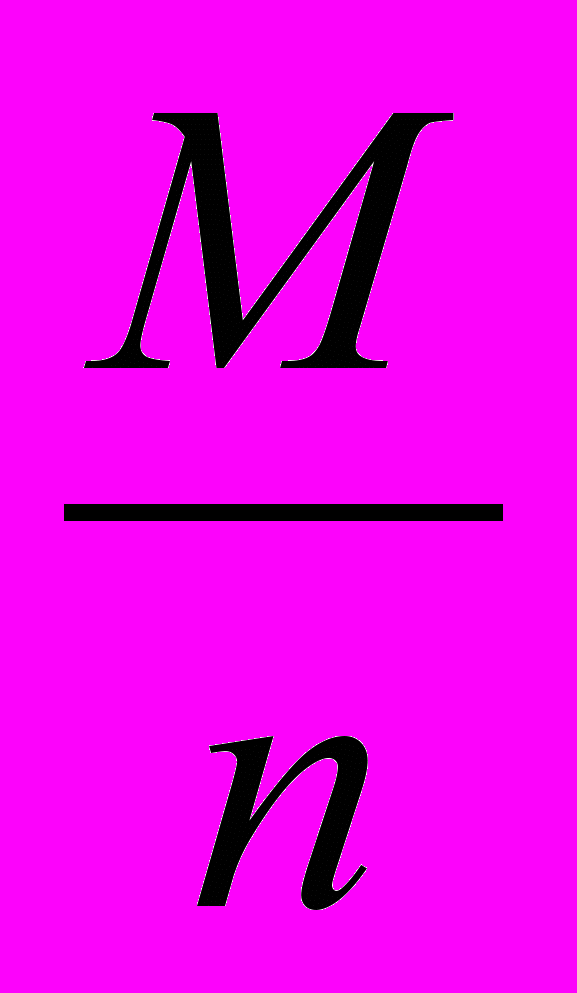
де М – молярна маса окисника
n – число прийнятих електронів молекули окисника в даній реакції.
Під еквівалентною масою відновника розуміють кількість речовини в г/моль, яке еквівалентно одному відданому електрону однією молекулою відновника в даній реакції.
Е =
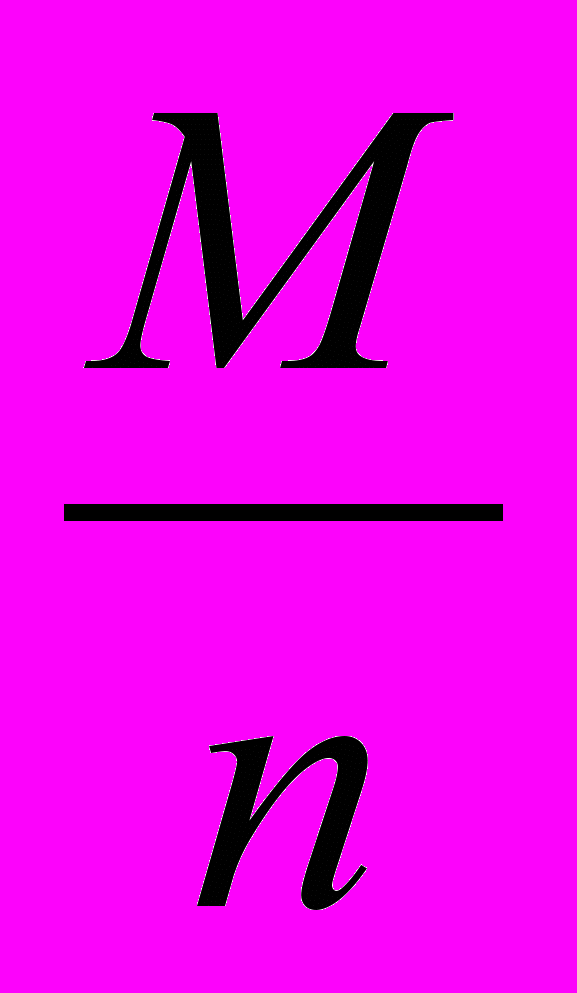
де М – молярна маса відновника
n – число прийнятих електронів, відданих однією молекулою відновника в даній реакції.
Окисник взаємодіє з розчином відновника в об’ємах, зворотно пропорційних їх еквівалентним концентраціям. Таке титрування називають прямим.
При зворотному титруванні точний об’єм невідомого окисника обробляється точним надлишковим об’ємом відомого відновника, лишок якого відтитровується еквівалентним об’ємом відомого окисника.
При титруванні по заміщенню точний об’єм відомого окисника з розчину йодиду калію у кислому середовищі виділяє еквівалентну кількість йоду, яке відтитровується еквівалентним об’ємом розчину тіосульфату натрію.
У процесі титрування по методу окислення-відновлення змінюються окисно-відновні потенціали взаємодіючих один з одним речовин. Якщо реакція проходить з участью іонів водню, то її можна записати в загальному виді:
аОк + nН+ +nе вВос. +
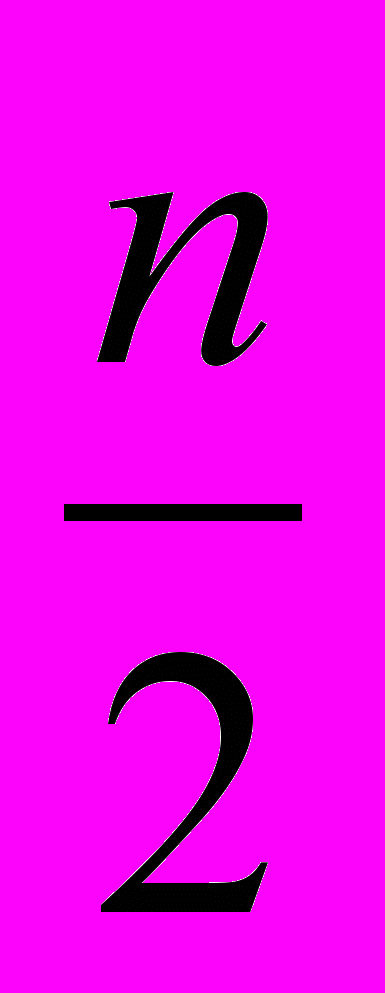 Н2О.
Н2О.Залежність окисно-відновного потенціалу від концентрації окисленої та відновленої форми, і концетрації іонів водню виражається за рівнянням Нериста:
Еок/від = Е0ок/від +
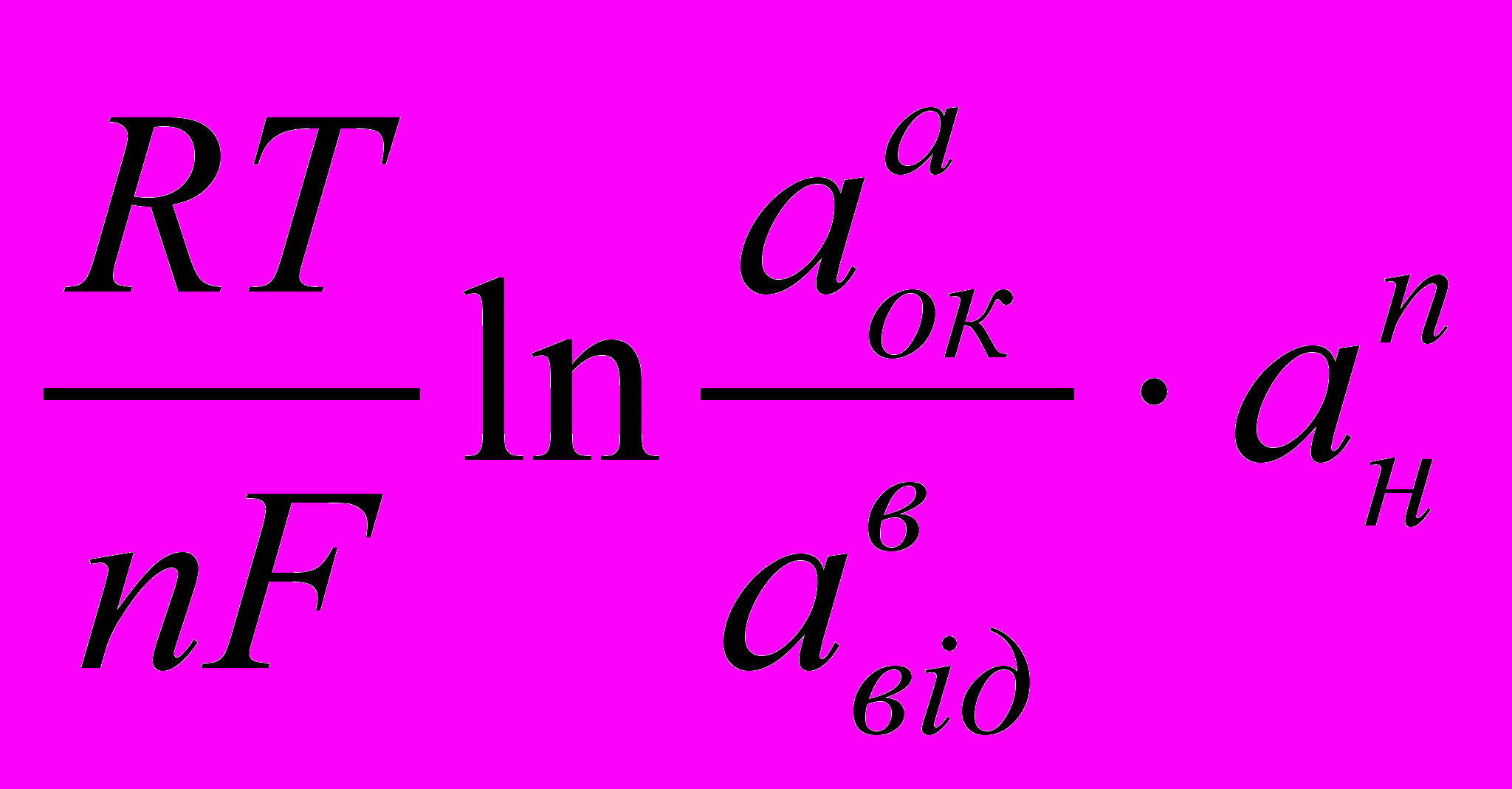
де аок, авід – концентрації іонів окисленої та відновненої форми, моль/л;
ан – концентрація іонів водню, моль/л;
Еок/від – окисно-відновний потенціал, В;
Е0ок/від – стандартний окисно-відновний потенціал, В;
R – молярна газова постійна, Дж/мольК;
n – кількість електронів, які приймають участь у окисно-відновній реакції, моль;
T – абсолютна температура, К;
F – постійна Фарадея, 96500 Клмоль-1;
a,b,n – стехіометричний коефіцієнт.
Якщо підставити числове значення констант, відповідних 200С, і перейти до натуральних логорифмівдо десятичних, то рівняння Нериста прийме вид:
Еок/від = Е0ок/від +
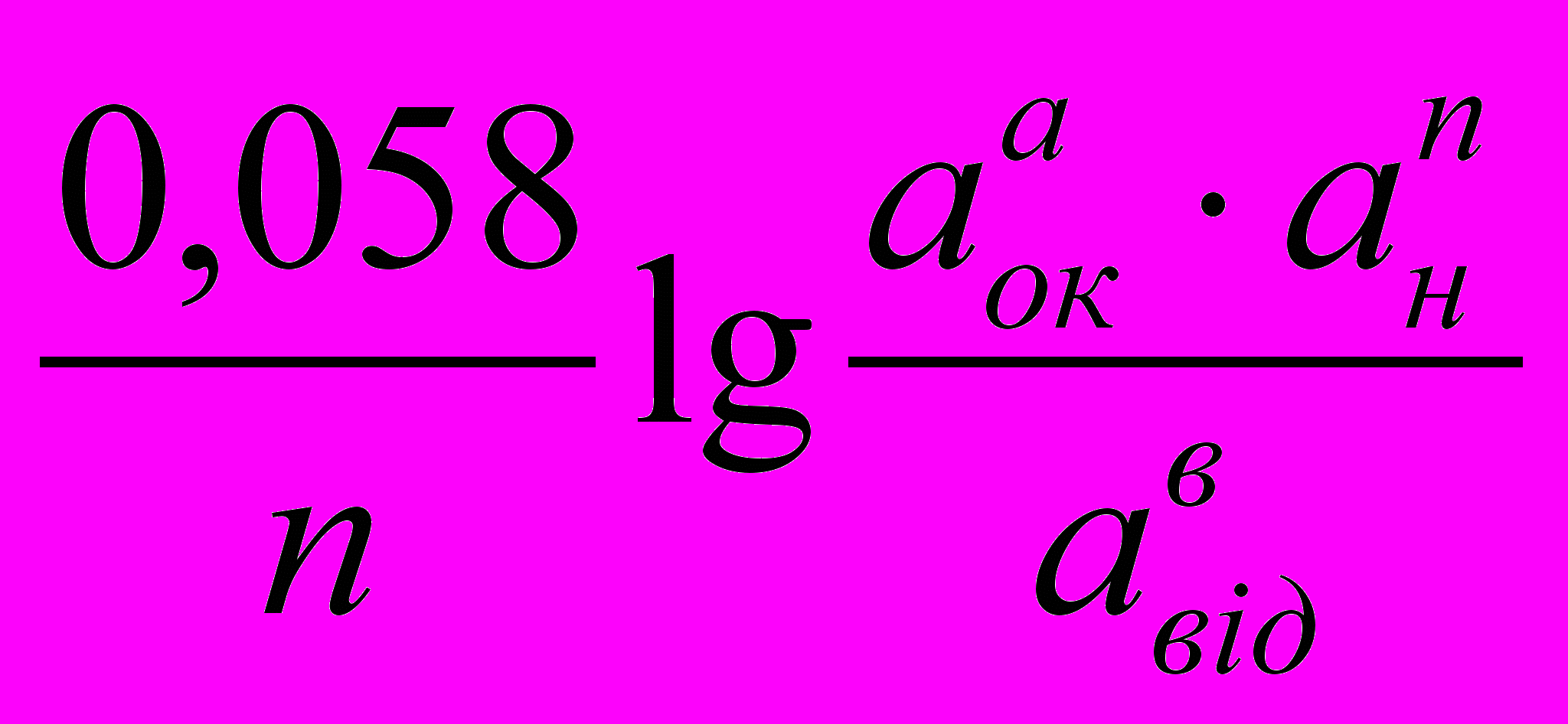
Багато окисно-відновних реакцій зворотні. Напрямок і повноту протікання окисно-відновної реакції можна визначити, виходячи із константи рівноваги.
2Fe3+ + Sn2+ 2Fe2+ + Sn4+
в момент рівноваги наступає рівності потенціалів реагуючих речовин

Стан динамічної рівноваги характеризується константою:
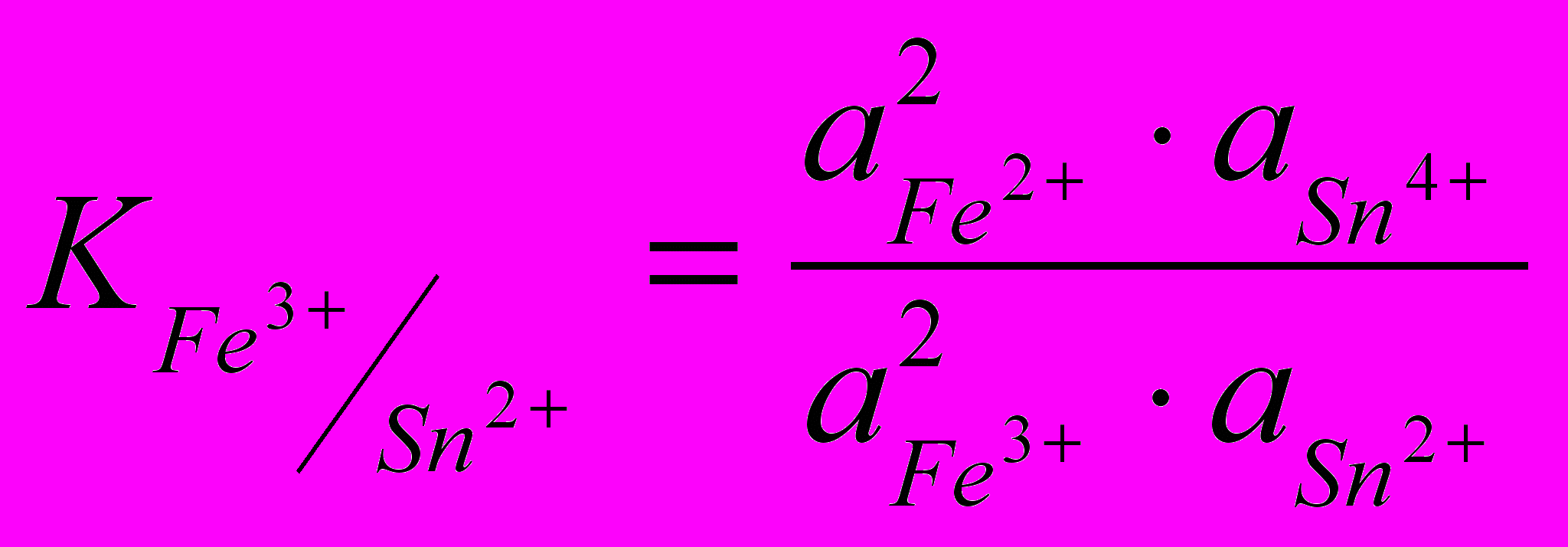
де
 - концентрація іонів заліза окисленої та відновненої форми, моль/л;
- концентрація іонів заліза окисленої та відновненої форми, моль/л; - концентрація іонів олова окисленої та відновненої форми, моль/л.
- концентрація іонів олова окисленої та відновненої форми, моль/л.Значення константи дозволяє оцінити повноту протікання реакції. Для визначення константи рівноваги необхідно використовувати рівняння, які виражають її залежність від нормальних окисно-відновних потенціалів реагуючих пар:
lgK =
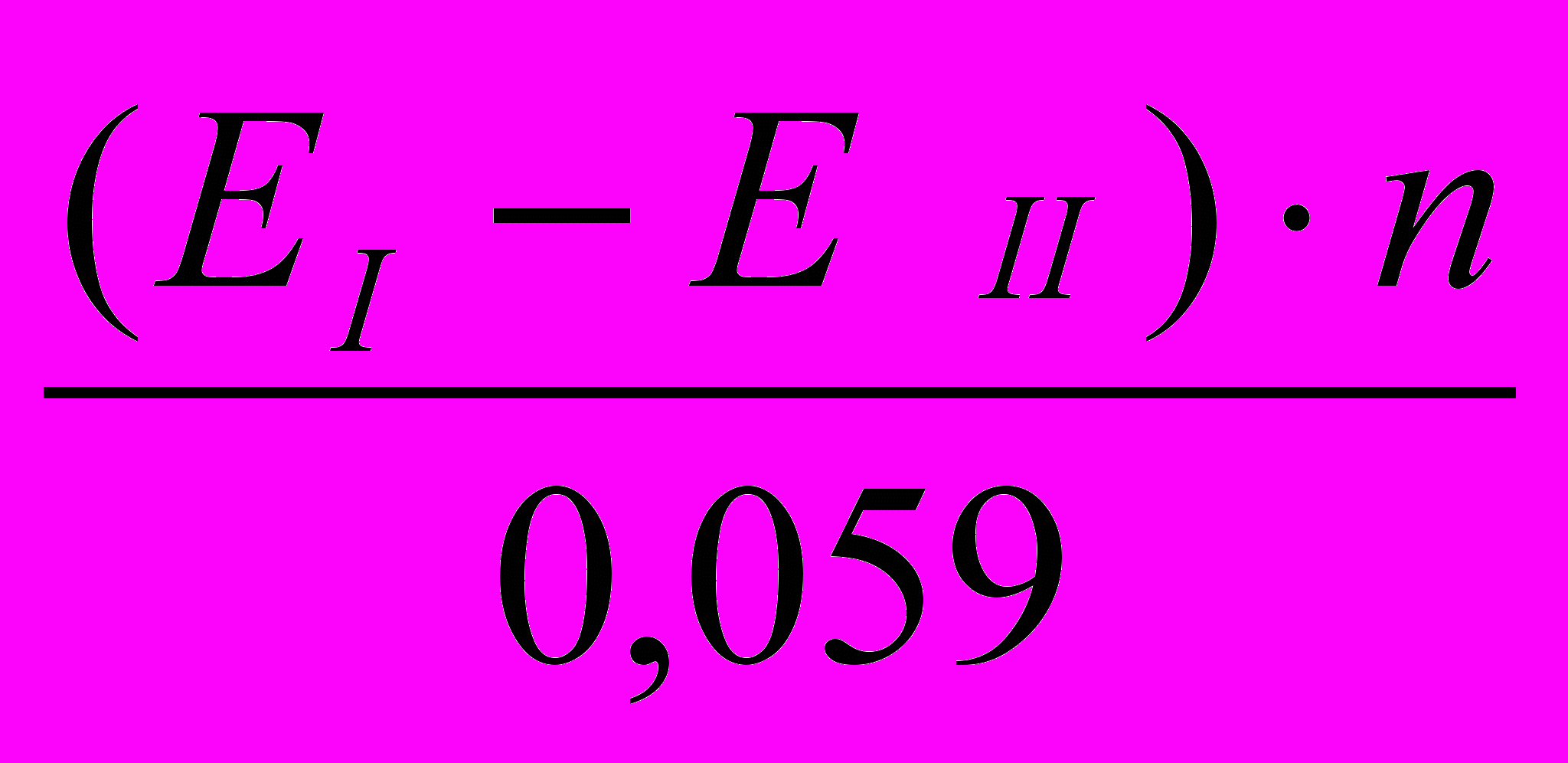
де
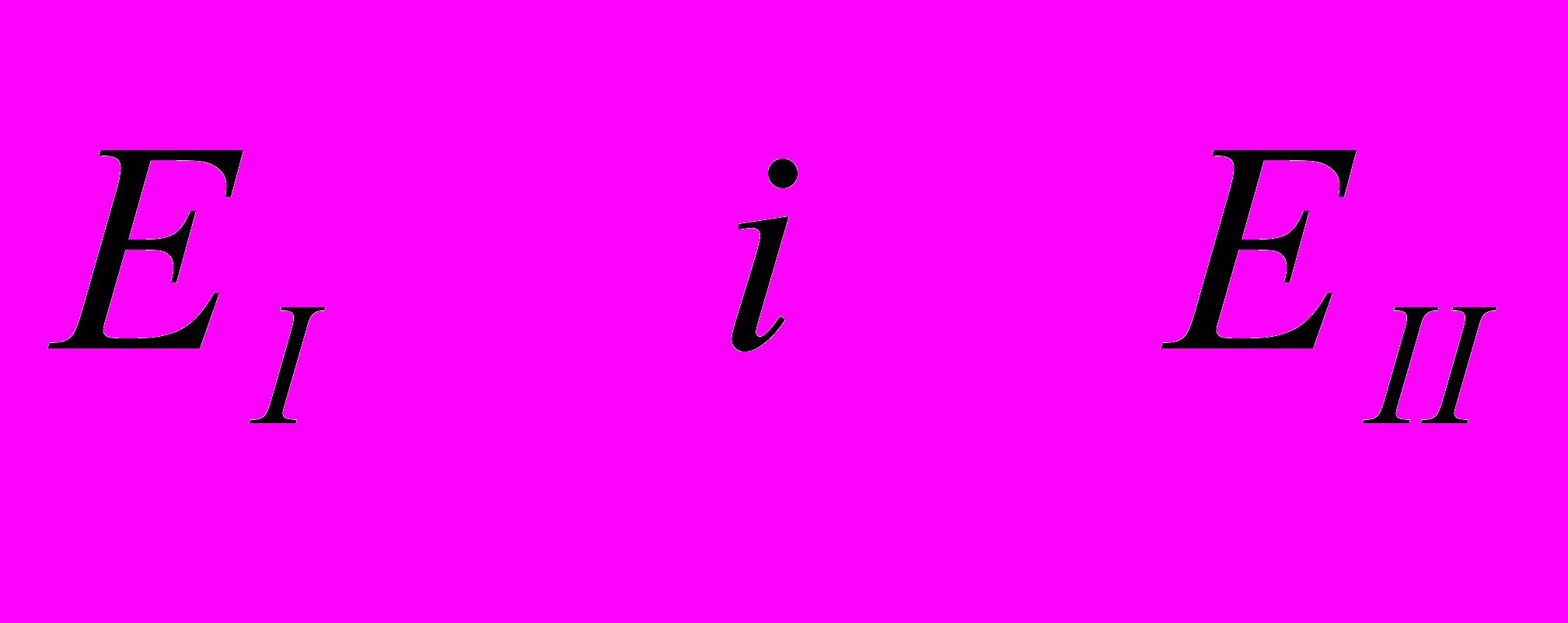 - стандартні окисно-відновні потенціали окисника та відновника, В;
- стандартні окисно-відновні потенціали окисника та відновника, В;n – кількість електронів, які приймають участь у віденовленні 1 моль окисника, моль.
Велике значення константи рівноваги значать, що реакція є практично незворотньою і тому використовується у кількісному аналізі.
Реакція окислення-відновлення, відрізняється від реакції нейтралізації, осадження і комплексоноутворення, протікає з вимірювальною швидкістью. Тому при використанні окисно-відновних реакцій у титриметричному методі аналізу використовують засоби для підвищення швидкості реакції: збільшують концентрацію реагуючих речовин, підвищують температуру, вводят каталізатор.
В процесі оксидиметричного титрування, у зв’язку зі зміненням концентрації реагуючих іонів, безпереривно змінюється потенціал системи. Після додавання кожної порції розчину в системі буде встановлюватись рівновага потенціалів реагуючих речовин. Коли стан системи приближується до еквівалентного співвідношення реагуючих компонентів, потенціал системи змінюється довольно різко, таке явище називають “стрибком” потенціалу, а при досягненні системою еквівалентності, потенціал системи має данне значення. Графічне зображення змінення потенціалу системи у координатах: додаваємого окисника або відновника – потенціал системи, називають кривою редокс-титрування.
Досягнення системою еквівалентності при титруванні окисника або відновника визначають за допомогою індикаторів, які в залежності від хімічної природи проявляють різні властивості.
Незворотні – це індикатори, які розрушаються під дією окисника. Наприклад, у броматометрії використовують індикатор метиловий червоний.
Зворотні – це індикатори, які змінюють забарвлення у залежності від окисно-відновного потенціалу системи. Наприклад, при титруванні окисника використовують індикатор дифеніламін або його похідні.
Специфічні – це індикатори, які дають специфічну кольорову реакцію з розчинами речовин, які титрують або якими титрують. Наприклад, розчин крохмалю є специфічним індикатором на йод.
Безіндикаторні методи. Наприклад, розчин перманганату калію має забарвлення червоно-фіолетового кольору, тому при титруванні цим розчином момент еквівалентності легко встановити по рожевому забарвленню, яке виникає у розчині після того, як весь відновник окислений і до розчину додали невеликий надлишок окисника.
Завдання для виконання самостійної роботи
Відповісти на запитання:
- Загальна зарактеристика методів окислення-відновлення.
- Вимоги, які пред’являють до реакцій у методах оксидиметрії.
- Вплив різних факторів на швидкість окисно-відновної реакції.
- Змінення окисно-відновного потенціалу у процесі титрування.
- Окисно-відновні індикатори.
- Інтервал переходу забарвлення окисно-відновного індикатору.
- Класифікація методів оксидиметрії.
- Визначення окисника, відновника і речовин, які не є окисниками і відновниками.
Скласти рівняння реакцій:
1. Визначте еквівалент окисника та відновника у рівнянні реакції:
2КМnO4 + 5Н2С2О4 + 3H2SO4 2МnSO4 + 10СO2 + К2SO4 + 8H2O
Bi2S3 + HNO3 Bi2(SO4)3 + NO + H2O
Na2MoO4 + HCl+ Al MoCl2 + AlCl3 + NaCl + H2O
KMnO4 + NaNO2 + KOH K2MnO4 + NaNO3 + H2O
Sb2O3 + HbrO3 Sb2O5 + HBr
Fe + HNO3 Fe(NO3)2 + NH4NO3 + H2O
САМОСТІЙНА РОБОТА № 6.
Тема: Методи перманганатометрії та йодометрії.
Повинні знати: сутність перманганатометрії та йодометрії; визначення прямого та зворотного титрування титрування по заміщенню, та галузь їх застосування у технохімічному контролі харчових виробництв
Повинні вміти: визначати еквівалентні маси окислювачів і відновників; пояснювати особливості окислювання перманганату калію в різних середовищах
План:
