Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж
| Вид материала | Документы |
- Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж одеської, 869.19kb.
- Міністерство освіти І науки, молоді та спорту україни, 59.16kb.
- Міністерство освіти І науки, молоді та спорту України, 61.58kb.
- Міністерство освіти І науки, молоді та спорту україни технічний коледж тернопільського, 361.4kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 139.07kb.
- Міністерство освіти І науки, молоді та спорту України двнз «Івано-Франківський коледж, 1070.95kb.
- Міністерство освіти І науки, молоді та спорту україни, 35.62kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 369.69kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 182.18kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 53.88kb.
Стислі теоретичні відомості
- Періодичний закон і періодична система елементів
ДІ Менделєєва та її значення в аналітичній хімії Якісний аналіз.
Періодичний закон Д.І. Менделєєва відіграв велике значення в розвитку аналітичної хімії. Аналітична класифікація катіонів, полягає в основі сірководневого методу аналіза, органічно пов’язана з періодичною системою елементів. В ході систематичного аналізу іони виділяються із складних сумішів не по одному, а невеликими групами з врахуванням однакового відношення їх до деяких реактивів. Реактиви, за допомогою яких виділяють із складних сумішів цілу групу іонів, називають груповими. Дія групових реактивів складається не тільки в осадженні, но і у розчиненні складових частин осаду. Зручність використання групових реактивів заклечається в тому, що вони дозволяють складну аналітичну задачу поділити не декілька прості. Крім того, якщо груповий реактив не дає осаду, то це вказує на відсутність цілої групи катіонів.
Катіони розподіляються на п’ять аналітичних груп. Кожна група має свій груповий реактив-осаджувач, який утворює нерозчинну сполуку одночасно зі всіма катіонами даної групи. Винятком є перша група: ці катіони не мають групових реагентів, так як не існує аніона, який утворивби осад зі всіма катіонами цієї групи.
Перша аналітична група – це катіони лужних металів та іони амонію і магнію.
Друга аналітична група – це катіони лужноземельних металів. Вони характеризуються тим, що їх карбонати у воді нерозчинні, а сульфіди розчинні. Груповим реагентом є карбонат амонію.
Третя аналітична група – це катіони елементів третьої групи періодичної системи та метали четвертого періоду, крім катіону міді. Вони характеризуються тим, що утворені ними сульфіди та гідроксиди нерозчинні у воді. Но розчинні у кислотах. Груповим реагентом є сульфід амонію у нейтральному або лужному середовищі.
Четверта аналітична група – це катіони міді та катіони металів п’ятого і шостого періодів періодичної системи. Виключенням є катіони металів, сульфіди яких володіють кислотними властивостями (миш’як, сурма, олово). Сульфіди цієї групи нерозчинні ні в воді, ні в кислотах. Груповим реагентом є сірководень, який осаджує сульфіди із розведених солянокислих розчинів.
П’ята аналітична група – це іони, сульфіди яких розчиняються у полісульфіді амонію. До них відносяться іони миш’яка, олова і сурми. Катіони цієї групи утворюють сульфіди, які осаджуються сірководнем у кислому середовищі. Сульфіди цієї групи розчинні у розчинах полісульфіда амонія або у лужному розчині сульфіду калію або натрію.
Взаємозв’язок між сульфідною класифікацією катіонів та положенням елементів у періодичній системі добре помітний при розгляданні періодичної системи, в якій римськими цифрами показана зарядність катіонів, а арабськими – кількість електронів на їх енергетичному рівні. Катіони, сульфіди яких розчинні у воді, розташовані у лівій частині періодичної системи, де перша та друга аналітичні групи цілком співпадають з пешою і другою групами періодичної системи Д.І. Менделєєва.
Класифікація аніонів основана на різній розчинності барієвих, кальцієвих, срібних та інших солей відповідних кислот. Методи аналізу аніонів можна поділити на 3 основні групи:
- систематичні методи, основані подібно класичному сірководневому методу аналізу катіонів на розподіл аніонів на групи; при цьому аналіз ведеться із одної порції досліджує мого розчину шляхом послідуючого розподілу аніонів;
- дрібні методи аналізу, основані на відкритті аніонів з окремих порцій досліджує мого розчину;
- полу систематичний метод, оснований на розподілі аніонів на групи, аналіз досліджує мого розчину відбувається не з однієї порції, а з де кількох порцій.
В аналізі аніонів немає потреби їх поділяти окремо, так як більш за все у залежності від попередніх дослідів, які дозволяють в деякому ступені встановити присутність або відсутність тих чи інших аніонів, багато аніонів можуть бути знайдені у присутності друг друга в окремих порціях розчину.
Аналітична класифікація тісно пов’язана з електронною структурою іонів. Катіони першої та другої груп, а також катіони третьої, які осаджуються у виді гідроксидів, мають відмінності у закінченні електроного рівня з 2 або 8 зовнішніми електронами. У катіонов третьої, четвертої та п’ятої аналітичної групи, які дають нерозчинні сульфіди, мають або закінчені 18-електроні завнішні рівні, або незакінчені, но перехідні від 8 до 18 електронів на рівні. Серед катіонів з незакінченим зовнішнім електроним рівнем одні мають у попередньому рівні 8 електронів, утворюють сульфіди, розчині у кислотах, і відносяться до третьої аналітичної групи, а інші мають у попередньому рівні 18 електронів, утворюють нерозчинні в кислотах сульфіди і відносяться до четвертої і п’ятої аналітичної групи.
При взаємодії атомів між ними виникає хімічний зв'язок,в результаті якого утворюються молекули, іони.
Ступенем окиснення називається умовний заряд атома в речовині, обчислений з допущенням, що вона складається з іонів. При обчисленні ступенів окислення виходять з електронегативності речовини: сума ступенів окиснення всіх атомів у сполуці дорівнює нулю.
Ступінь окиснення може бути позитивним і негативним. Він позначається арабською цифрою із знаком “плюс” або “мінус” над символом атома, наприклад К+1, СІ-1. Ступені окиснення атомів у простих речовинах приймаються такими, що дорівнюють нулю, наприклад Н20, Р40. У прикладах з простими речовинами видно невідповідність валентностей й абсолютного значення ступеня окиснення. Так, у молекулі Н2 водень одновалентний, але його ступінь окиснення дорівнює 0.
- Теорія електролітичної дисоціації
Сутність теорії електролітичної дисоціації полягає в наступному:
При розчиненні у воді електроліти розпадаються (дисоціюють) на позитивні та негативні частки, які називають іонами. Іон – це атом або група атомів, які несуть електричний заряд. Кожний електроліт розпадається на два види іонів: катіони – іони з позитивним зарядом та аніони – іони з негативним зарядом.
При проходженні електричного струму крізь розчин обо розплав електроліта позитивні іони (катиони) двигаються до катоду, а негативні (аніони) – до аноду. В електродів іони розряджуються і перетворюються в атоми або молекули.
Не всі електроліти в однаковому ступені розкладаються на іони. Ступень розпаду залежить від природи електроліту, його концентрації, температури та від характеру розчинника. Процес електролітичної дисоціації є зворотнім. Тому при написанні реакцій дисоціації потрібно використовувати знак зворотності ().
Дисоціація кислот. Згідно теорії електролітичної дисоціації кислотами називають речовини, які у водних розчинах утворюють в якості катіонів іони водню Н+. Одноосновні кислоти дисоціюють на іони в одну ступень.
Наприклад: НNО3 Н+ + NО3-
Двуосновні кислоти розпадаються на іони в дві ступені:
Наприклад: Н2SO4 Н+ + НSO4-
НSO4- Н+ + SO4-2
Трьохосновні кислоти дисоціюють по трьом ступеням:
Наприклад: Н3РО4 Н+ + Н2РO4-
Н2РO4- Н+ + НРO4-2
НРO4-2 Н+ + РO4-3
Дисоціація гідрооксидів. Згідно теорії електролітичної дисоціації гідроксидами називають речовини, які у водних розчинах у якості аніонів містять тільки іони гідроксила ОН-. Речовини, які дисоціюють і як кислоти, і як основи називають амфотерними сполуками. До них відносяться гідроксиди деяких металів.
Дисоціація солей Солі – це електроліти, при дисоціації яких утворюються катіони металів (або катіон амонію NH4+) й аніони кислотних залишків, наприклад: KNO3 K+ + NO3-; NH4CI NH4 + CI-.
Розрізняють кілька типів солей: середні, кислі й основні, подвійні, комплексні.
Середні солі дисоціюють практично повністю, наприклад:
CaCI2 Ca+2 + 2CI-;
Fe2(SO4)3 2Fe3+ + 3SO42-
В результаті утворюються тільки катіон металу й аніони кислотного залишку.
У кислих солей дисоціація проходить по декілька ступеням, наприклад:
КНSO4 К+ + НSO4-
НSO4- Н+ + SO4-2
Основні солі – це солі молекули яких крім іонів металу і кислотного залишку містять іони гідроксогрупи. Наприклад, МgОНСІ.
МgОНСІ Мg(ОН)+ + СІ-
Якщо атом водню в багато основній кислоті заміщується атомами двух різних металів, то сіль називається подвійною. Наприклад: КАІ(SO4)2 12Н2О
КАІ(SO4)2 К+ + АІ3+ + 2SO42-
При дисоціації комплексних солей утворюються прості і комплексні іони. Наприклад: К4[Fe(CN)6].
К4[Fe(CN)6] К+ + [Fe(CN)6]4-
Електроліти володіють різною здібністю до дисоціації, тому розрізняють сильні та слабкі електроліти. Сильні електроліти практично повністю дисоціюють у розчинах на іони. В розчинах слабкого електроліта йдуть одночасно два процеси: процес дисоціації (розпад) молекул на іони і протилежний йому процес асоціації (з’єднання іонів в молекули), наприклад:
Дисоціація КСІ К+ + СІ-;
Асоціація К+ + СІ- К+СІ-
Ступіню електролітичної дисоціації називається число, яке вказує, яка частина молекул розчинного електроліту розпадається на іони.
α =

Реакції обміну в розчинах електролитів відбуваються до кінця (тобто є практично незворотніми) в тих випадках, коли утворюються слабкі електролити, малорозчинні та газоподібні продукти. Наприклад, при зваємодії в розчині сульфату міді (ІІ) і гідроксиду натрію випадає осад гідроксид міді (ІІ):
CuSO4 + 2NaOH = Cu(ОН)2 + Na2SO4
Написане рівняння звичайно називають рівнянням у молекулярній формі. Його можна зобразити в іоній формі (іноді таку форму запису називають іонно-молекулярною). Якщо формули розчинних сильних електролитів записати у вигляді тих іонів, на які вони дисоціюють у розчині, а формули слабких електролитів – у вигляді молекул, то рівняння реакції можна подати у вигляді:
Cu2+ + SO42- + 2Na+ + 2OH- = Cu(ОН)2 + 2Na+ + SO42-
Визначаючи з даного рівняння однакові іони в лівій та правій частинах, дістанемо запис рівняння у скороченій іонній (іонно-молекулярній) формі:
Cu2+ + 2OH- = Cu(ОН)2
Таке рівняння показує, що реакції між сульфатом міді (ІІ) і гідроксидом натрію зводиться до взаємодії між іонами міді (ІІ) і гідроксид-іонами з утворенням гідроксиду міді (ІІ). З точки зору терії електролітичної дисоціації іони SO42- і Na+ не беруть участі в реакції.
3. Хімічна рівновага в гомогенних та гетерогенних системах Добуток розчинності
Коли хімічна реакція завершується за малий проміжок часу, то кажуть, що вона має велику швидкість, і навпаки, якщо перетворення триває довго – воно має малу швидкість. Наприклад, кисень взаємодіє з воднем миттєво (реакція має велику швидкість), а з міддю – повільно (реакція має малу швидкість). Відомі настільки повільні реакції, що людина їх навіть не помічає, зокрема перетворення в гірських породах (відбуваються протягом мільйонів років).
Швидкість хімічної реакції залежить від багатьох чинників, серед яких 5 основних: природа реагуючих речовин, їх температура, концентрація, ступінь подрібненості й наявність каталізаторів.
Залежність швидкості реакції від концентрації виражається законом діючих мас: швидкість хімічної реакції при даній температурі прямо пропорційна добутку концентрації реагуючих речовин. Наприклад, для реакції А + В = С + Д швидкість реакції пропорційна добутку концентрації речовин А і В. Позначив швидкість даної реакції через υ, молярні концентрації реагуючих речовин через [А] і [В], коефіцієнт пропорційності через К, можна записати закон діючих мас:
υ = К [А] ∙ [В]
Коефіцієнт пропорційності К називають константою швидкості даної реакції. Значення константи швидкості залежить від природи реагуючих речовин і від температури, но не залежить від концентрації.
Реакції, що відбуваються у двох взаємно протилежних напрямках, називаються зворотніми. Ці реакції записуються не двома, а лише одним хімічним рівнянням, у якому позначаються дві стрілки, направлені у протилежні боки. Стрілка направлена вправо, означає пряму реакцію, вліво – зворотню: Н2О + СО2
 Н2СО3
Н2СО3
Хімічні реакції, що відбуваються тільки в одному напрямку, називаються незворотніми. Цих реакцій значно менше, ніж зворотніх. Для них характерні такі ознаки:
- Виділення газу. Zn + H2SO4 ZnSO4 + H2
- Виділення тепла. 2Mg + O2 2Mg + Q
- Утворення води або випадання осаду. NaOH + HCl NaCl + H2O
Стан, коли швидкість прямої і зворотньої реакцій стають однаковими, називається хімічною рівновагою. Вона зовні непомітна. Наприклад, коли дивитися на закриту пляшку з газованою водою, то ніякі ознаки хімічних реакцій не спостерігаються, хоча насправді реакції відбуваються. Стан хімічної рівноваги може зберігатися як завгодно довго в ізольованій системі. Наприклад, в запаяній ампулі.
Наприклад, розглянемо рівняння: А + В С + Д. Швидкість прямої реакції υ1 = К1 [А] ∙ [В], швидкість зворотної реакції υ2 = К2 [С] ∙ [Д] (К1 і К2 – константи прямої і зворотної реакції; [А], [В], [С], [Д] – концентрації взятих та отриманих речовин у відповідності до рівноваги). Коли досягли хімічної рівноваги швидкості прямої і зворотної реакцій дорівнюють, тобто υ1 = υ2 та К1 [А] ∙ [В] = К2 [С] ∙ [Д]. Тоді


Так як К1 і К2 – величини постійні при незмінній температурі, то їх співвідношення теж постійне; позначається К і називається константою рівноваги.
Дисоціація електроліта – процес зворотній. Використовуючи закон діючих мас до процесу дисоціації, отримаємо наступне рівняння константи рівноваги, яка називається константою дисоціації: Кд =
 .
.Константа дисоціації даного електроліта дорівнює відношенню добутку концентрації іонів у розчині до концентрації недосоціюючих молекул цього електроліта.
Система, яка має в складі одне середовище, тобто розчин-розчин або газ-газ називається гомогенною системою. Система, яка має в складі різні середовища, наприклад: розчин-тверда речовина, називається гетерогенною системою. Гетерогенні системи мають велике значення у аналітичній хімії. З ними стикаєшся у процесі осадження, відділення іонів, розчинення і промивання осадів.
Швидкість розчинення твердої фази у стані рівноваги постійна і дорівнює деякій постійній величині К1:
υ1 = К1.
Швидкість протилежного процесу – осадження – υ2 визначається числом зіткнення іонів з одиницею поверхні кристала. Вона буде пропорційна добутку концентрацій іонів. Звідси
υ2 = К2 [Н+] ∙ [ОН-].
де К2 – величина постійна при данній температурі.
К1 = К2 [Н+] ∙ [ОН-];
 [Н+] ∙ [ОН-]
[Н+] ∙ [ОН-]Відношення двух постійних величин
 є величина постійна, яка позначається через ДР
є величина постійна, яка позначається через ДР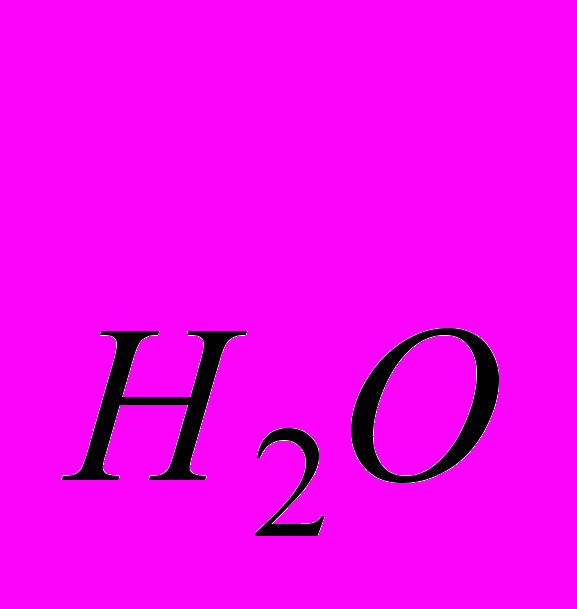 :
: ДР
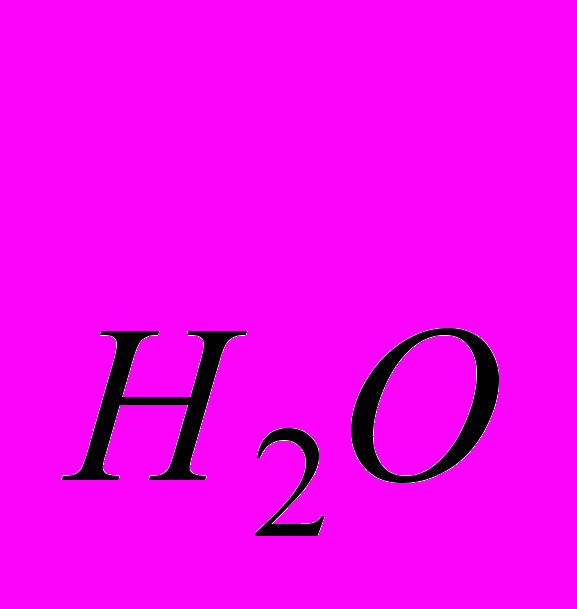 = [Н+] ∙ [ОН-]
= [Н+] ∙ [ОН-]Таким чином, добуток концентрації іонів малорозчинного електроліта у насиченому розчині є величина постійна при даній температурі, яка називається добутком розчинності і позначається ДР з індексом того електроліта, про який йде мова.
4. Іонне добування води Водневий показник.
Вода як слабкий електроліт дисоціює на іони Н+ і ОН-, які знаходяться у рівновазі з недисоціюючими молекулами: Н2О Н+ + ОН-.
Добуток концентрацій іонів водню та гідроксид-іонів у воді називають іонним добутком води (позначають Кв). При данній температурі Кв – величина постійна, дорівнює при 220С 10-14.
Кв = [Н+][ОН-] = 10-7 ∙10-7 = 10-14
Із постійності добутку [Н+][ОН-]слідує, що при збільшенні концентрації одного з іогів води відповідно зменшується концентрація другого іона. Це дає можливість визначити концентрацію Н+ -іонів, якщо відома концентрація ОН—іонів, і навпаки. Наприклад, якщо у ворному розчині [Н+] = 10-3 моль/л, то [ОН-] визначають так:
[ОН-] =
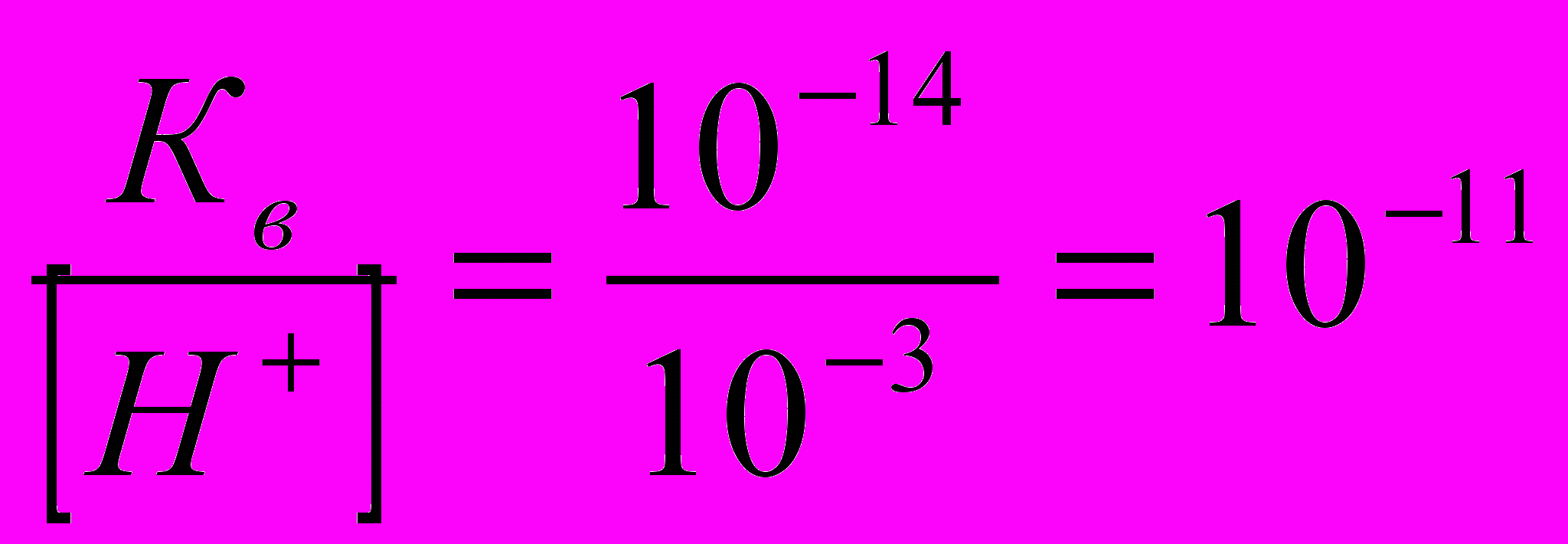 моль/л
моль/лТаким чином, кислотність та лужність розчинів можна виразити через концентрацію або іонів Н+, або іонів ОН-. Тоді для нейтрального розчину [Н+] = 10-7, для кислого[Н+]>10-7, для лужного [Н+]<10-7моль/л.
Водневим показником рН називають десятинний логарифм концентрації водневий іонів, які взяті зі зворотнім знаком.
рН = -lg [Н+] або [Н+] = 10-рН
де [Н+] – концентрація іонів водню, моль/л.
За допомогою рН реакції розчинів характеризують: нейтральна – рН 7, кисла – рН <7, лужна – рН > 7. Чим менше рН, тим більше концентрація іонів Н+, тобто вище кислотність середовища; і навпаки, чим більше рН, тим менше концентрація іонів Н+, тобто вище лужність середовища.
Наведемо приклади декількох найбільш відомих розчинів з вказанням відповідного середовища: шлунковий сік – рН 1,7 (сильно кисла реакція), волопровідна вода – рН рН 7,5 (слаболужна), кров – рН 7,4 (слаболужна), слюна – рН 6,9 (слабокисла), сльози – рН 7 (нейтральна). Велике значення рН у харчовій промисловості для визначення кислотності хлібобулочних виробів, лужності печева та ін..
Буферні розчини (буфери) – це розчини, в яких концентрація іонів водню (або виражаючий її водневий показник рН) мало змінюється при розбавленні цих розчинів і при додаванні до них невеликої кількості сильної кислоти або лугу. В якості буферних розчинів використовують розчини слабких кислот або слабких основ у присутності солей. Наприклад, ацетатний буфер – це розчин оцтової кислоти і ацетату натрію.
Буферні розчини широко використовуються у аналітичній хімії. Коли процес потрібно проводити при визначеному рН, до розчину додають відповідну буферну суміш. Наприклад, буферна суміш NH4OH + NH4Cl використовують для осадження гідроксид алюмінію, який при дії тільки одного розчину аміаку частково розчиняється у надлишку аміаку.
Завдання для виконання самостійної роботи
Відповісти на запитання:
- Дайте характеристику електрона, протона та нейтрона (заряд, маса).
- Що таке ізотопи? Як його позначають? Приклад.
- Якими чотирма квантовими числами характеризується стан електрона в атомі?
- Вкажіть число підуровнів у кожному енергетичному рівні. Як позначають різні підуровні?
- Вкажіть максимальне число електронів на кожному підуровні.
- Сформулюйте закон діючих мас.
- Які реакції називають зворотніми?
- Який стан системи реагуючих речовин називають хімічною рівновагою?
- Що таке константа хімічної рівноваги? Як її виражають?
- Які речовини називають електролітами?
- Що таке іон?
- Які основи називають амфотерними?
- Що таке сильні та слабкі електроліти?
- Чим визначається сила кислот та основ?
- Що таке ступінь дисоціації?
- Що таке іонний добуток води?
- Яке значення іонного добутку води при 220С?
- Яка концентрація іонів водню у нейтральному, кислому та лужному середовищі?
- Що називається буферними розчинами?
- Що таке добуток розчинності?
- Від яких факторів залежить швидкість хімічної реакції?
- Що таке константа дисоціації?
- Від яких факторів залежить константа дисоціації?
- Чому при відкритті катіонів другої групи від катіонів першої групи, крім карбонат амонію, додають NH4ОН та NH4СІ?
- Чим відрізняються катіони третьої аналітичної групи від катіонів першої та другої груп?
- У виді яких сполук випадають в осад катіони третьої групи під дією групового реагенту?
- Гідроксиди яких катіонів третьої групи володіють амфотерним характером?
- Назовіть характерні реакції для кожної групи аніонів.
Скласти рівняння реакцій та електронні формули:
- Складіть електронні формули для атомів наступних елементів: хлора, заліза, міді.
- Намалюйте схеми розташування електронів по енергетичним (квантовим) ячейкам у атома: кисню, азоту, хлору.
- Складіть рівняння дисоціації наступних речовин: Na3PO4, NaHPO4, Fe2(SO4)3.
- Напишіть рівняння дисоціації гідроксиду алюмінію.
- Складіть рівняння реакції у трьох формах між слідуючими речовинами: хлоридом калію та нітратом срібла; гідроксидом амонію та сульфатною кислотою; гідроксидом натрію та нітратною кислотою.
- Напишіть повне та скорочене іонне рівняння реакцій між розчинами: сірчаною кислотою та нітратом плюмбуму; хлоридом алюмінія та нітратом срібла; хлоридом кальцію та фосфатом калію.
- Яким реактивом можна відкрити К+? Напишіть рівняння реакцій у молекулярному та іонному виді.
- Вкажіть характерні реакції на Na+. Напишіть рівняння реакцій у молекулярному та іонному виді.
- Вкажіть характерні реакції на іони NH4+ та Mg2+. Напишіть рівняння цих реакцій у молекулярній та іонній формі.
САМОСТІЙНА РОБОТА № 2.
Тема: Кількісний аналіз. Гравіметричний метод аналізу.
Повинні знати: сутність методу типи визначень сутність кожного визначення його розрахунки та операції гравіметричного методу аналізу
Повинні вміти: виконувати розрахунки величини наважки для аналізу вибрати осаджувач виконувати його розрахунки; провести розрахунок аналітичного фактору; добре провести операції осадження фільтрування висушування прокалювання розрахунки проценту визначеного компонента у зразку аналізуємого продукту
План:
- Кількісний аналіз. Гравіметричний метод. Задачі. Особливості методу.
- Типи вагових визначень.
- Операції гравіметричного методу.
- Обчислення у гравіметричному аналізі.
