Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж
| Вид материала | Документы |
СодержаниеСтислі теоретичні відомості |
- Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж одеської, 869.19kb.
- Міністерство освіти І науки, молоді та спорту україни, 59.16kb.
- Міністерство освіти І науки, молоді та спорту України, 61.58kb.
- Міністерство освіти І науки, молоді та спорту україни технічний коледж тернопільського, 361.4kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 139.07kb.
- Міністерство освіти І науки, молоді та спорту України двнз «Івано-Франківський коледж, 1070.95kb.
- Міністерство освіти І науки, молоді та спорту україни, 35.62kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 369.69kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 182.18kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 53.88kb.
Стислі теоретичні відомості
- Сутність метода кислотно-основного титрування
Залежно від типу реакції, яка відбувається під час титрування, розрізняють кілька методів об’ємного аналізу, які найчастіше використовують: кислотно-основний метод (метод нейтралізації), метод оксидиметрії (сюда входять перманганатометрія і йодометрія), метод комплексонометрії.
У кожному методі використовують свої стандартні розчини та індикатори.
В залежності від сили кислоти і основи можливі слідуючі типи кислотно-основного титрування між:
а) сильною кислотою та сильною основою;
б) сильною кислотою та слабкою основою;
в) слабою кислотою та сильною основою;
г) слабою кислотою та слабкою основою.
В першому випадку при титруванні сильної кислоти розчином сильної основи або навпаки утворюється сіль. Такі солі в водних розчинах не підлягають гідролізу і в точкі еквівалентності рН розчину дорівнює 7. Наприклад:
HCI + NaOH = NaCI + H2O
2КОН + Н2SO4 = К2SO4 + 2H2O
Н+ + ОН- = H2O
В другому випадку, в точкі еквівалентності утворюється сіль сильної кислоти і слабкої основи, яка в водних розчинах гідролізує. В точкі еквівалентності реакція середовища буде кислою, тому при титруванні слабкої основи сильною кислотою рН 7. Наприклад:
NH4ОН + HCI H2O + NH4CI
NH4+ + H2O NH4ОН + Н+
В третьому випадку, при титруванні сильної основи слабкою кислотою утворюється сіль сильної основи і слабкої кислоти, яка в водних розчинах підлягає гідролізу. Наприклад:
NaOH + СН3СООН СН3СООNa + H2O
СН3СОО- + H2O СН3СОО + OH-
тому в точкі еквівалентності реакції розчину буде лужною рН 7.
В четвертому випадку при взаємодії слабкої кислоти з слабкою основою в точкі еквівалентності утворюється сіль слабкої кислоти і слабкої основи. Наприклад:
СН3СООН + NH4ОН СН3СООNH4 + H2O
СН3СООNH4 + H2O СН3СООН + NH4ОН
СН3СОО- + NH4+ + H2O СН3СООН + NH4ОН
В цьому випадку реакція розчину залежить від сили кислоти і основи.
Титрування слабою кислотою та слабкою основою і навпаки здійснити на практиці є неможливим, так як перехід титрування добре не виражений, при цьому вибір індикатору практично неможливий. Для цього використовують хімічні методи, які підвищують їх силу (ступінь дисоціації і відповідно константу дисоціації).
У методі нейтралізації для визначення кінця титрування використовують індикатори, або інструментальні методи аналізу; практично неможливо підібрати індикатор, який би у точкі еквівалентності змінив забарвлення розчину. Момент кінця титрування, який визначається індикатором, називається точкою кінця титрування. Точка кінця титрування завжди відрізняється від точки еквівалентності. Тому даже при правильному виборі індикатору допускається погрішність, яка називається індикаторною помилкою титрування.
Індикатори, які використовують у методі нейтралізації, можна, по одній із теорії індикаторів, розглядати, як слабкі органічні кислоти або основи. Характерний стан їх в молекулярній і іонній формах, вони мають різне забарвлення. Існують однокольорові або двухкольорові індикатори.
Однокольорові індикатори забарвлені тільки однією, звичайно в іонній (солоній) формі. Двухкольорові змінюють своє забарвлення в залежності від рН середовища, тобто перехода із молекулярної форми в солеву (іонну) або навпаки.
У водних розчинах кислотні індикатори дисоціюють:
НIn H+ In-,

Константа дисоціації дорівнює:
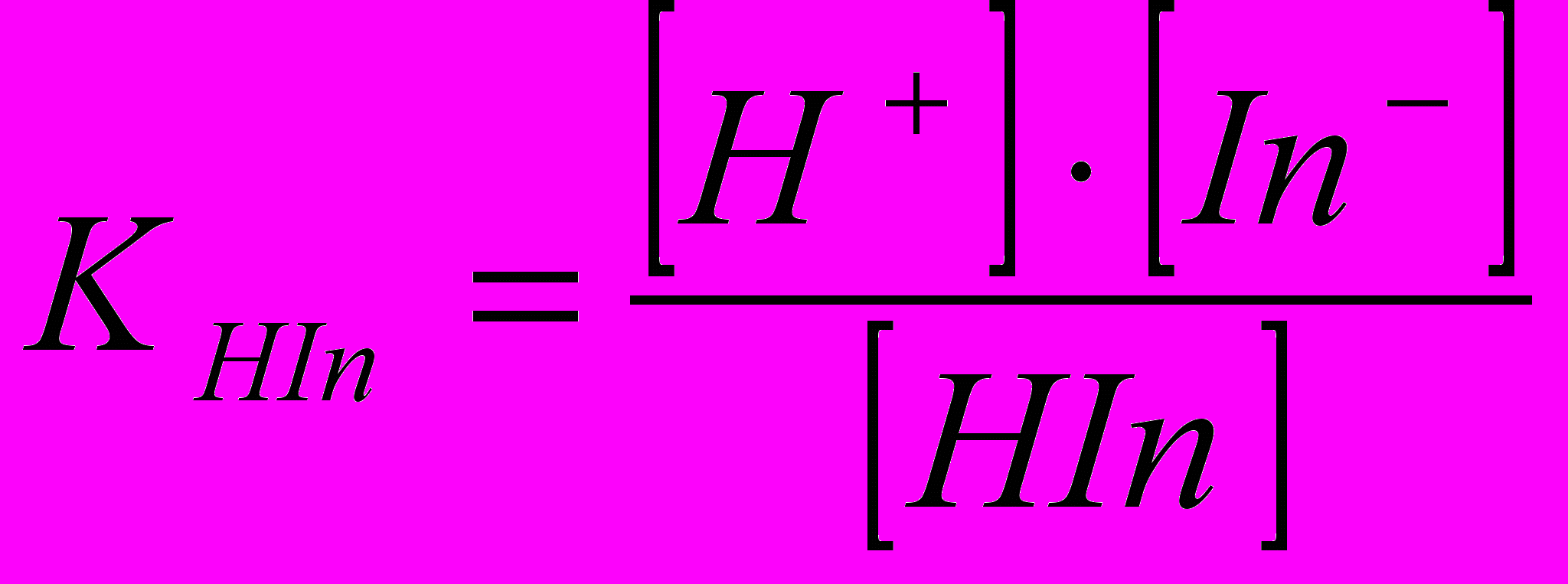
В залежності від значення константи дисоціації кислотно-основні індикатори розподіляють на: сильні, проміжні та слабкі.
Сильні індикатори характеризуються значенням КHin 10-7. Представником цієї групи є метилоранж, забарвлення якого змінюється в межах рН 3,4 … 4,3.
Індикатори проміжної сили змінюють своє забарвлення при рН = 7. До цієї групи відноситься лакмус, змінює своєзабарвлення в межах рН 6,8 … 7,2.
Слабкі індикатори змінюють своє забарвлення у слабо лужному середовищі. До цієї групи індикаторів відноситься фенолфталеїн, який змінює своє забарвлення в межах рН 8,2 … 10.
При виборі індикатору (для часного випадку кислотно-основного титрування) користають наступними правилами:
- показник титрування індикатору рН повинен бути по можливості ближче до значення рН розчину при досяганні еквівалентності між взаємодіючими компонентами;
- інтервал переходу забарвлення індикатора (інтервал кислотного розчину, в межах якого відбувається помітне для людського ока змінення забарвлення індикатора) повинен бути не менше частки «стрибка титрування»;
- індикатори, в яких забарвлення обох форм лежить в спектрі дуже близько друг до друга (наприклад, перехід від червоного забарвлення розчину до оранжевого) мало придатні для індикації точки еквівалентності.
Інтервал перехода забарвлення деяких індикаторів.
Індикатор | Інтервал переходу рН | Значення рН | Забарвлення | рК | |
| у кислому середовищі (молекулярна форма) | у лужному середовищі (іонна форма) | ||||
| Тимоловий блакитний | 1,2 … 2,8 | 2 | червоний | жовтий | 1,7 |
| Метиловий оранжевий | 3,1 … 4,4 | 4 | червоний | жовтий | 3,7 |
| Метиловий червоний | 4,4 … 6,2 | 5 | червоний | жовтий | 5,1 |
| Лакмус | 5,0 … 8,0 | 7 | червоний | жовтий | - |
| Феноловий червоний | 6,4 … 8,0 | 7 | жовтий | червоний | 8,0 |
| Фенолфталеїн | 8,0 … 10,0 | 9 | безкольоровий | червоний | 9,2 |
| Алізариновий жовтий | 10,0 … 12,0 | 11 | жовтий | сиреньовий | 10,7 |
