Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж
| Вид материала | Документы |
- Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж одеської, 869.19kb.
- Міністерство освіти І науки, молоді та спорту україни, 59.16kb.
- Міністерство освіти І науки, молоді та спорту України, 61.58kb.
- Міністерство освіти І науки, молоді та спорту україни технічний коледж тернопільського, 361.4kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 139.07kb.
- Міністерство освіти І науки, молоді та спорту України двнз «Івано-Франківський коледж, 1070.95kb.
- Міністерство освіти І науки, молоді та спорту україни, 35.62kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 369.69kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 182.18kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 53.88kb.
3. Сутність кулонометричного аналізу.
Кулонометрія має ряд переваг перед іншими методами аналізу: надійне визначення дуже малих концентрацій, легкість автоматизації, можливість використання нестійких реагентів, виключення стандартних розчинів і можливість аналізу без передчасної калібровки прибору по зразкам з відомим вмістом визначаємого компонента.
Визначення кількості електролізу який пройшов через досліджуємий розчин називається кулонометрією. Кількість електролізу визначається за допомогою кулономера. Кулономер це електролізер, який вмикають у електромережу послідовно з ячійкою для електроаналізу. Для кулономера підбирать електрохімічний процес, який проходить зі стовідсотковим виходом по струму та який супроводжується виділенням конкретної речовини, кількість якої легко і точно установити тим чи іншим способом.
Методи кулонометрії








потенціоностатична гальваностатична

















пряме внутрішній ваговий пряма інверсійна
електроліз електро-
 аналіз кулонометричне
аналіз кулонометричнетитрування
мал. 1. Класифікація кулонометричних методів.
Якщо електрохімічна реакція, яка полягає у основі кулонометричного визначення, відбувається на поверхні робочого електроду, тоді визначення ведуть при постійному потенціалі, який забеспечує здійснення цього процесу.
Наприклад: визначення трьохоцтової кислоти. У аміачному середовищі відбувається кількісне відновлення її до діхлороцтової кислоти. Процес йде на ртутному електроді зі 100%-ним виходом по струму.
Метод володіє високою вибірливостью та дозволяє вести визначення в присутності моно- та діхлорпохідних.
Дуже цікавий метод, який получив назву кулонометричне титрування. Від титрування він відрізняється тим, що тут відбувається електролітичне генерірування титранта, притому що у більшості випадків безпосередньо у тому ж розчині, в якому знаходиться і визначаєма речовина. Електрогенеріруваний реагент взаємодіє з речовиною та появою найменшого надлишку, який свідчить про закінчення титрування, бистро фіксується спеціально розробленою для цього індикаторною системою. Необхідно, щоб титруюча речовина реагувала швидко та кількісно, не взаємодіяла з іншими які знаходяться в даній пробі.
У кулонометрії електроліз проводиться при потенціалі робочого електроду, який змінюється– потенціоностатичний метод або при струмі який не змінюється через електрод – гальвоностатичний метод. Для проведення аналізу методом прямої кулонометрії та кулонометричним титруванням необхідно дотримуватися умов:
- електроліз слід проводити в умовах, щоб проходила тільки одна електрохімічна реакція, т. ч. вихід по струму повинен дорівнювати 100%. Для цього потрібно знати поляризовані криві і = f() для усіх речовин, які присутні у розчині.
- необхідно мати спосіб для знайдення кінця електрохімічної реакції при прямому кулонометричному визначенні або точки еквівалентності при кулонометричному титруванні;
- для визначення маси електрохімічно прореагувавшої речовини необхідно визначити кількість витраченого на реакцію струму. Для визначення маси користуються законом Фарадея:
W =
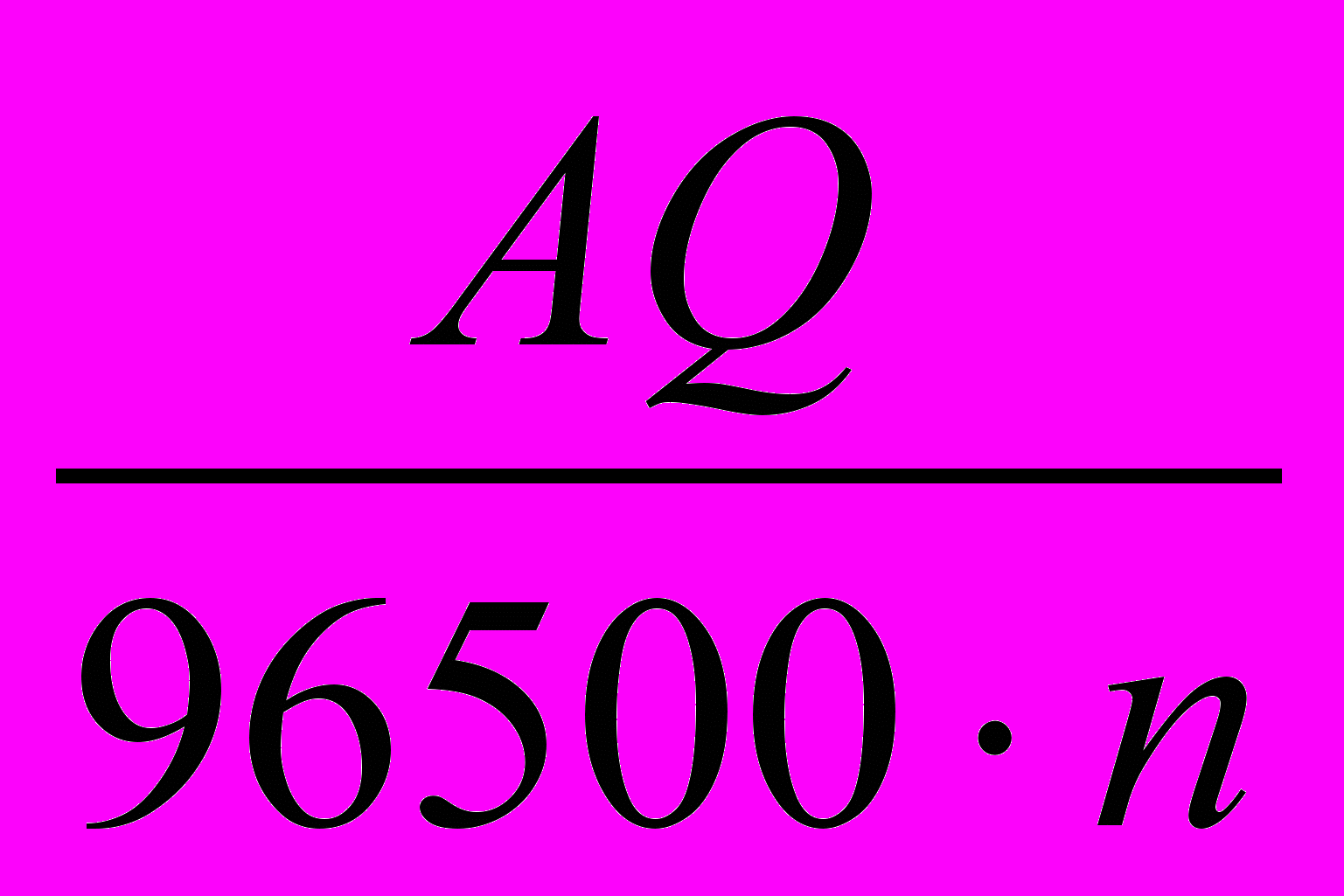
де А – атомна вага елемента
n– валентність
Q – кількість струму.
4. Сутність кондуктометричного аналізу .
Кондуктометричний метод аналізу – метод, оснований на вимірюванні електропровідності розчинів.
Електропровідність розчинів залежить від концентрації та природи присутніх заряджених частин. Тому змінення електропровідності можна використовувати для кількісного визначення хімічного складу розчину.
В практиці виробничих лабораторій кондуктометрію використовують при аналізі різних сольових розчинів, при визначенні концентрацій кислот та розчинів органічних сполук.
Усі провідники які існують у природі, залежно від механізму переносу струму, при проходженні через них електричного струму можна поділити на три класи: електронні, іонні, змішані.
До класу електронних провідників, у яких переносчиками електричних зарядів є електрони, відносяться метали, напівпровідники, більшість металевих сплавів, вуглець та деякі тверді солі.
До класу іонних провідників входять гази та електроліти, в яких переносчиками електричних зарядів є іони та проходження струму, який супруводжується переносом речовин.
Клас змішаних провідників складається з речовин, які володіють частково електронною та частково іоною проводимістью. До них відносяться розчини лужних та лужноземельних металів у рідкому аміаку, деякі рідкі сплави та солі, характер проводимості яких змінюється в визначному інтервалі температур, та інших речовин.
Область вимірювання електропровідності електролітів як одна із областей електрохімічних вимірювань, які охоплюють класи іоних та змішаних провідників.
Області використання кондуктометрії можна поділити на три великі групи.
Кондуктометрія у фізико-хімічних дослідах, як один із методів дослідження будови чистої речовини, розчинів та кінетики фізико-хімічних процесів.
Аналітична кондуктометрія та автоматичні методи, які використовують для контролю виробничих процесів, як один із методів електролітичного аналізу речовин.
Кондуктометричне титрування заключає автоматичні методи кодуктомет-ричного титрування, як один із методів об’ємного хімічного аналізу, при якому крапка еквівалентності встановлюється кондуктометрично.
Аналітичну кондуктометрію розподіляють на дві групи методів: пряма та косвена кондуктометрія.
В методах прямої кондуктометрії концентрація речовини визначається по електропровідності розчину, якщо між ними існує пряма пропорційність. Можливе також визначення одного із компонентів у двухкомпонентному розчині, якщо концентрація другого компонента незмінюється.
Пряма кондуктометрія дозволяє вирішувати багато практичних задач аналітичної хімії. Вона визначається для контролю технологічних процесів, для визначення концентрації сольових розчинів за допомогою сольомерів, для контролю очищення води, сточних вод, для визначення вмісту солей в мінеральній, морській та річній воді, для контролю якості харчових продуктів.
Косвена кондуктометрія заключається у визначенні одного компоненту в багатокомпонентному розчині, при використанні для аналізу, крім кондуктометрії, ще другого методу фізико-хімічного аналізу (визначення рефракції, густини, рН та ін.). До косвеної кондуктометрії відносяться також визначення концентрації різних газів.
При кондуктометричному титруванні електропровідність вимірюють після додовання кожної порції титранта. Залежність електропровідності розчину від кількості доданого титранта показують графічно. Добутий графік називається кривою кондуктометричного титрування.
Недоліком кондуктометричного методу аналізу є відсутність вибору при роботі з багатокомпонентним розчином. Точність визначення від 0,1 до 2%.
5. Сутність полярографічного аналізу.
Електрохімічний метод аналізу, в основі якого полягає залежність між характером поляризації робочого електрода та складом розчину, в якому він знаходиться, називається полярографією. Любий процес, та процес поляризації електрода, може бути записаний у вигляді кривої, яку креслять у координатах, які характеризують хід цього процесу. У полярографії та крива називається полярограмою. Аналіз цієї кривої – дозволяє судити про те, які іони із визначених та в якій кількості містяться у розчині.
Полярографічний метод аналізу відрізняється простотою, точністью, швидкістью визначення та високою чутливістью.
Перевага полярографічного методу аналізу полягає у слідуючому:
- можливість одночасного встановлення якісного та кількісного складу проби;
- можливість аналітичного визначення ряду речовин (іонів) при їх спільній присутності без перечасного поділення;
- можливість здійснення повторних визначень при користуванні однією і тією ж пробою.
Полярографія використовується для контролю виробництва високополімерів, синтетичних волокон, напівпровідників, елементів та їх сполук, різних сплавів, харчових продуктів.
6. Сутність діелектрометричного аналізу .
Діелектрометрія – метод оснований на вимірюванні діелектрочної проніцаємості.
Першим аналітичним використанням вимірювань діелектричного потенціалу було визначення вмісту вологості у органічних сполуках (Берлінер, Рютер 1929). Пізніше були розроблені методи визначення чистих сполук, методи аналізу бінарних органічних систем, та у 1950 – 1960 рр. вперше були видані методи діелектричного титрування органічних систем.
Діелектрична проніцаємість.
Відносна діелектрична проніцаємість визначається як відношення ємкості С конденсатора, діелектриком у якого є досліджуєма речовина, до ємкості С0 конденсатора, діелектриком у якому є вакуум.
=
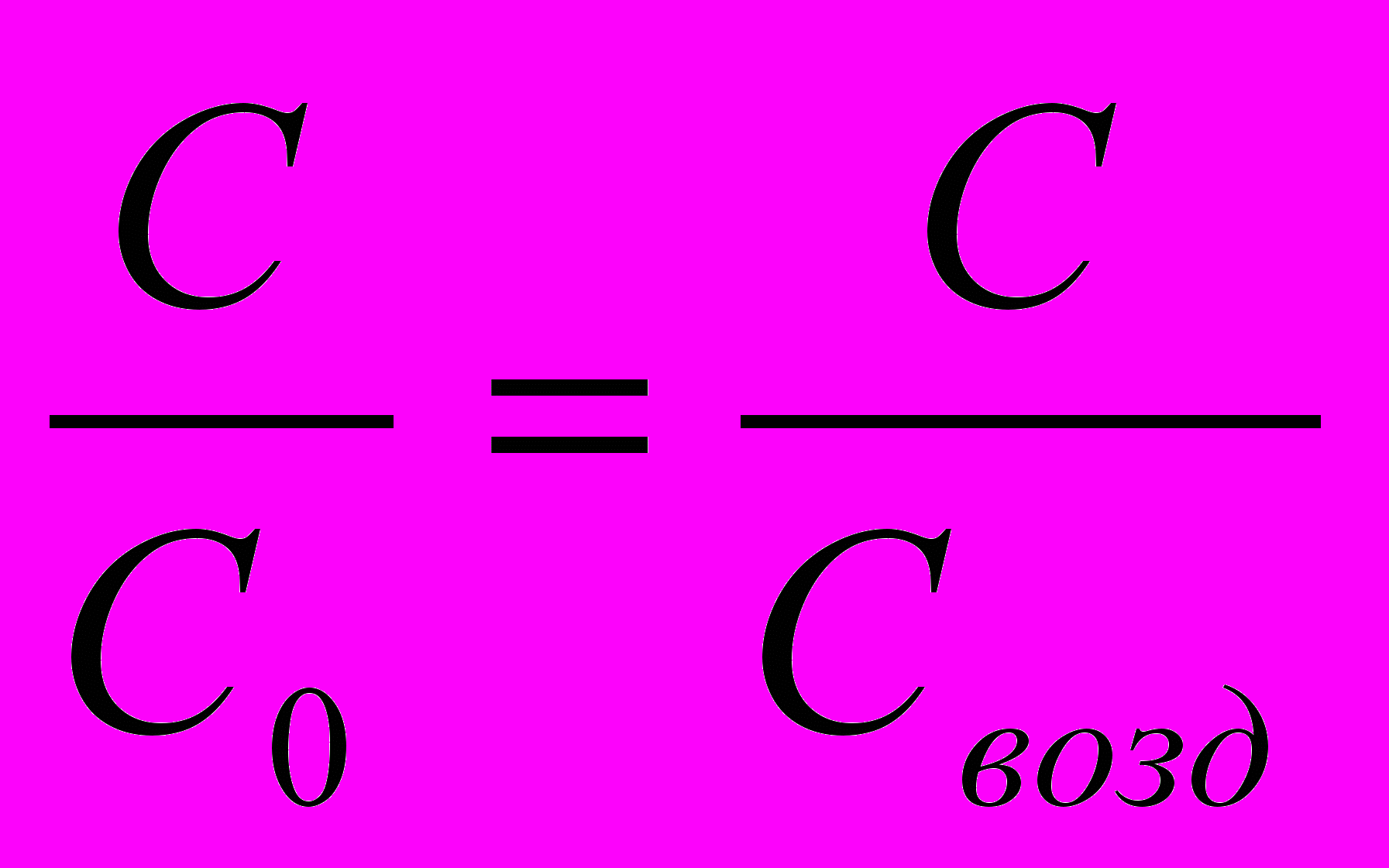
із відношення видно, що відносна діелектрична проникаємість є величиною безрозмірною і не залеже від вибору системи одониць.
Абсолютна діелектрична проніцаємість а, відрізно від відносної діелектричної проніцаємості, має розмір фм-1. Між абсолютною та відносною діелектричною проніцаємість існує слідуюча залежність а = 0, де 0 - діелектрична проніцаємість вакуума.
Діелектрична проніцаємість залежить від слідуючих факторів:
- частоти;
- температури;
- структури молекули;
- агрегатного стану речовини.
Завдання для виконання самостійної роботи
Відповісти на запитання:
1. У чому сутність фізико-хімічних методів?
2. На якому фізичному явищі засновані електрохімічні методи?
3. Яка методика визначення нітратів у харчових продуктах?
4. Класифікація електрохімічних методів.
5. Характеристика індикаторних електродів.
6. Що називається стандартним електродом?
7. Методика роботи прибору іономеру.
8. Класифікація потенціонометричного методу.
9. Переваги кулонометрії. Сутність кулонометрії.
10. Класифікація кулонометричного методу.
11. Який прибор використовують для визначення кількості струму?
12. Класифікація методу кондуктометрії.
13. Використання кондуктометрії.
14. Характеристика провідників.
15. Сутність полярографічного методу. Його переваги.
16. Використання полярографії.
17. Характеристика діелектрометричного методу аналізу.
18. Характеристика хлорно-срібного електроду.
19. Сутність потенціонометричного методу аналізу.
20. Електродний та нормальний електроди.
21. Потенціонометричне титрування.
22. Стандартний електрод.
23. Індикаторні електроди. Їх характеристика.
24. Скляний електрод, його характеристика.
25. Абсолютна потенціонометрія.
26. Застосування потенціонометричного титрування.
27. Каломельний електрод.
САМОСТІЙНА РОБОТА № 13.
Тема: Хроматографічний метод аналізу.
Повинні знати: сутність хроматографічного методу аналізу Галузь використовування методів в харчовій промисловості
Повинні вміти: дати характеристику кожному хроматографічному методу
План:
1. Сутність хроматографічного методу аналізу Мета і задачі.
2. Іонообмінна хроматографія.
3. Розподільна хроматографія.
4. Паперова хроматографія.
5. Тонкошарова хроматографія.
6. Газова хроматографія.

