Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж
| Вид материала | Документы |
- Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж одеської, 869.19kb.
- Міністерство освіти І науки, молоді та спорту україни, 59.16kb.
- Міністерство освіти І науки, молоді та спорту України, 61.58kb.
- Міністерство освіти І науки, молоді та спорту україни технічний коледж тернопільського, 361.4kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 139.07kb.
- Міністерство освіти І науки, молоді та спорту України двнз «Івано-Франківський коледж, 1070.95kb.
- Міністерство освіти І науки, молоді та спорту україни, 35.62kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 369.69kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 182.18kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 53.88kb.
2.1. Емісійний спектральний аналіз.
2.2. Походження емісійних спектрів.
2.3. Абсорбціоний аналіз.
2.4. Атомно - абсорбціоний аналіз.
2.5. Молекулярно-абсорбціоний аналіз.
Стислі теоретичні відомості
1. Сутність фізико-хімічних методів аналізу.
Вплив фізики та фізичної хімії на аналітичну хімію дуже великий, що сучасні інструментальні методи аналізу використовують фізико-хімічні, або фізичні властивості системи в залежності від її складу.
Фізико-хімічні методи аналізу основані на фізико-хімічних властивостях речовин: при зміненні хімічного складу змінюються фізичні властивості речовин.
Найбільше розповсюдження мають слідуючі методи:
- Оптичні методи. Вони встановлюють залежність між складом аналізуємої речовини та його оптичними властивостями. До них відносяться:
- Колориметрія. Метод оснований на зміненні поглинення світла речовиною;
- Рефрактометрія. Метод оснований на визначенні показника приломлювання досліджуємої речовини;
- Поляриметрія. Метод оснований на вивченні поляризованого світла;
- Люмінісцентний аналіз. Метод оснований на здібності деяких речовин віддавати поглинену енергію у виді світлового випромінювання.
- Електрохімічні. Основані на електрохімічних властивостях речовин. Наприклад, на зміненні електропровідності розчину, на зміненні електродного потенціалу.
- Хроматографічні методи. Основані на явищі адсорбції.
Фізико-хімічні методи аналізу дозволяють проводити аналізи містящих малі кількості речовини швидко і з високою точністью. Особлива цінність цих методів у тому, що за їх допомогою можна здійснити у промисловості безпереривний контроль сировини, напівфабрикатів, готових виробів та регулювати технологічний процес, т. ч. здійснювати автоматизацію виробництва. Велике розповсюдження ці методи мають у хімічній, нафтохімічній, металургічній та ін. промисловості.
2.Оптичні методи аналізу.
Оптичні методи аналізу основані на використанні (вивченні) оптичних властивостей системи, яка міститьдосліджуєму речовину.
Атоми кожного елементу при переході зі збудженого в стаціонарний стан спускають електромагнітне випромінювання певної довжини хвилі, яке називають характеристичним випромінюванням. Разом з цим атоми електронів поглинають електромагнітне випромінювання таких же довжин хвиль, які самі ж пускають. Таким чином, довжина хвилі електромагнітного випромінювання, яке поглинається атомами електронів, співпадає з довженою хвилі з його характеристичним випромінюванням. Подібними властивостями володіють і молекули деяких речовин.
З врахуванням вказаних вище оптичних властивостей системи, методи аналіза, які вивчаються можна розподілити на декілька груп:
- Методи, засновані на регистрації випромінювання, яке спускається збудженими атомами або молекулами. До цієї групи методів відносять емісійний спектральний аналіз та його різновиди - фотометрія полум’я, люмінісцентний аналіз, рентгенолюмінісцентний аналіз, радіоактивний аналіз.
- Методи, засновані на поглинання випромінювання атомами або молекулами. До цієї групи методів відносять молекулярно-абсорбціоний аналіз, атомно-абсорбціоний аналіз, метод ядерно-магнітного резонансу, метод парамагнітного резонансу та інші.
- Метод, заснований на явищах переломі світла, який проходить крізь розчин аналізуємої речовини – рефрактометрія.
- Методи, засновані на регистрації відображення та поглинання випромінювання зважених у розчині часток – нефелометрія, турбідиметрія.
- Методи, засновані на вимірюванні швидкості хімічної реакції, якщо вони використовують оптичні методи аналізу, які контролюють швидкість реакції. В них використовуються гомогенні каталітичні реакції. Визначною речовиною є каталізатор.
- Методи, засновані на використанні інших оптичних властивостей визначаємої речовини – поляриметрія та інші.
2.1. Емісійний спектральний аналіз.
В 1860 році відкрив цей вид аналізу Кирхгоф та Бунзен. Назва методу від латинського слова (emissio), що означає спускати, випуск.
Емісійний спектральний аналіз – це фізичний метод визначення хімічного складу речовини по її спектру, який спускають збуджені атоми або найпростіші радикали. Спектром называється випромінювання, впорядочене по довжині хвиль.
Використовують емісійний спектральний аналіз у харчовій промисловості при визначенні вмісту мікроелементів в об’єктах рослинного походження, харчових продуктах, консервах, та ін.. Головною перевагою методу є: а) універсальність, б) можливість одночасного кількісного визначення великого числа елементів (до 20) в складних системах, в) при визначенні малих кількостей цей вид анализу має переваги перед хімічними методами, т.я. дає можливість визначати масову частку елемента від 10-5 до 1%.
2.2. Походження емісійних спектрів.
Атоми та іони усіх елементів можуть знаходитись в двух енергетичних станах: стаціонарному (нормальному) та збудженому.
В стаціонарному стані атоми володіють мінімальним запасом енергії і при цьому не випромінюють її. Якщо атоми отримують додаткову енергію, то електрони зовнішнього електроного шару будуть переходити зі стаціонарного рівня на більш високий енергетичний рівень. Такий стан атомів називають збудженим. Через деякий час (приблизно 10-8с) у кожному збудженому атомі електрони повертаються на стаціонарні орбіти, випускаючи надлишкову енергію у виді квантів світла з частотою, яка відповідає даному переходу. Ці процеси для одного переходу електрона можна виразити формулою:
Е = Е - Е =
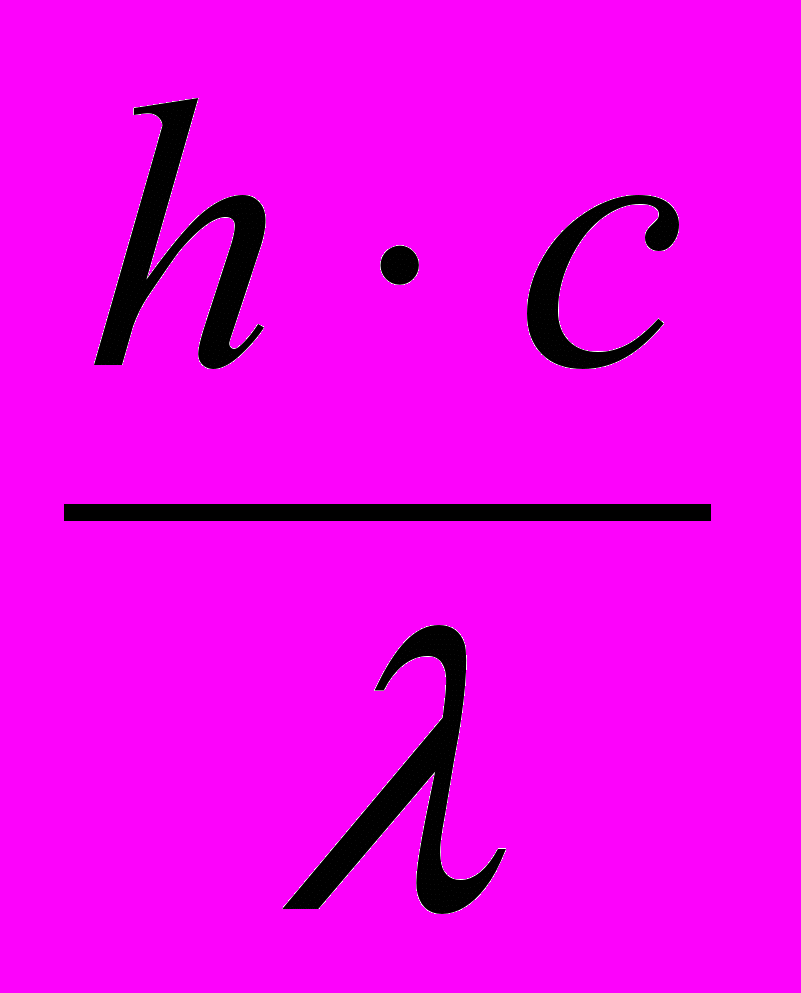 = h ,
= h ,де Е – енергія електромагнітного випромінювання, яка звільнилася, Дж.
Е’’- енергія збудженого атома, Дж.
Е’ – енергія кінцевого стану атома, Дж.
с – швидкість світу, м/с.
- довжина хвилі електромагнітного випромінювання, нм.
- частота електромагнітного випромінювання, м-1.
Джерелом збудження спектрів можуть бути полум’я, електрична дуга, електрична іскра, імпульсний та електровакуумний розряд. Особливий інтерес – фотометрія полум’я, зоснована на вимірюванні випромінювання, яке вводиться у полум’я розчину. Так, в полум’ї газу або водню при температурі 2000…3000С збуджуються атоми елементів з низьким потенціалом збудження (лужні та деякі лужноземельні елементи).
2.3. Абсорбціоний аналіз.
Методи аналіза, які зосновані на поглинанні світової енергії атомами та молекулами аналізуємих речовин, с кладають велику групу абсорбційних оптичних методів.
При поглинанні електромагнітного випромінювання атоми або молекули переходять у збуджений стан. При цьому надлишкова енергія атомів і молекул в одних випадках витрачається на підвищення їх поступову, обертальну або коливальну енергії, тобто витрачається у виді тепла. В інших випадках надлишкова енергія виділяється у виді вторічного випромінювання або витрачається на фотохімічні реакції. Таким чином, залежно від вида поглинаючих часток та способа перетворення (трансформування) надлишкової енергії збудження розрізняють:
1. Атомно-абсорбціоний аналіз, заснований на поглинанні світовой енергії атомами аналізуємих речовин.
2. Молекулярно-абсорбціоний аналіз, заснований на поглнанні світла молекулами аналізуємої речовини і складними іонами в ультрафіолетовій, видимій та інфрачервоній областях спектра.
3. Люмінісцентний аналіз, заснований на вимірюванні інтенсивності повторного випромінювання, яке викає у результаті виділення частки надлишкової енергії збудження молекулами аналізуємої речовини.
4. Аналіз по поглинанню світової енергії зваженими частками аналізуємої речовини - турбідиметрія.
5. Аналіз по розсіюванню світової енергії зваженими частками аналізуємої речовини - нефелометрія.
Нагадаємо з курсу фізики, що спектр електромагнітного випромінювання в залежності від довжини хвилі розподіляють на декілька областей:
а) ультрофіолетова (УФ) - 180…400 нм.;
б) видима - 400…700 нм.;
в) ближня інфрачервона (ІК) - 700…1100 нм.
Одиницею вимірювання довжини хвилі електромагнітного випромінювання в СІ прийнятий метр або його частка – нанометр (нм), 1 нм = 10-9 м.
2.4. Атомно - абсорбціоний аналіз.
Сутність метода складається у поглинанні (абсорбції) атомами визначає мого елемента резонансного монохроматичного електромагнітного випромінювання, характерного для даного елемента.
Для отримання вільних атомів елементів (атомного пара) використовують полум’я газової горілки або графітову піч. В якості джерела резонансного монохроматичного випромінювання використовують лампи з полим катодом або без електродні високочастотні спектральні лампи. Інтенсивність світового потоку після проходження крізь поглинаючий атомний пар визначаємого елемента зменшується і региструється за допомогою фотоелемента.
Між послабленням інтенсивності монохроматичного випромінювання, характерного для даного елемента, та концентрацією цього елемента у розчині в даному діапазоні спостерігається лінійна залежність.
Амплитудно-абсорбціоний метод аналізу володіє рядом переваг: висока виборчість, низькі межі знаходження (до 10-8… 10-5 мас. %), добра репродуктивність результатів, високий ступень автоматизації, велика продуктивність та ін..
Методом атомной абсорбции определяют более 70 элементов в веществах различной природы: металлах, сплавах, пищевых продуктах, комбикормах и многих других объектах.
2.5. Молекулярно - абсорбціоний аналіз.
Цей вид аналіза оснований на поглинанні світла визначаємою речовиною якщо промениста енергія, тобто випромінювання, поглинається молекулами визначаємої речовини, то ці молекули переходять з одного стану з меншою енергією в інший стан з більшою енергією. Якщо при цьому в молекулі змінюється енергія руху електронів, то спостерігаємий спектр називається електронним. Він лежить у видимій та ультрофіолетовій областях спектра.
До молекулярно - абсорбціоного анализу відносяться: колориметричний, фотоколориметричний та спектрофотометричний методи аналіза.
Колориметричний метод аналізу основується на порівнянні інтенсивності забарвлення досліджуємого розчину з забарвленням стандартного розчину, концентрація якого точно відома.
Інтенсивність поглинання світла залежить від присутності у розчині забарвлених молекул та іонів, які поглинають світло у значно більшій ступені, чим розчинник, т. ч. залежить від концентрації розчину.
Фотоколориметричний метод аналізу основується на вимірюванні інтенсивності поглинання світла розчином і фактично представляє собою абсорбціометрію, т.ч. аналіз по світопоглинанню. Ступень поглинання світла, який використовує розчин вимірюють за допомогою фотоелементів, а використовуємі прибори називаються фотоелектроколориметрами (ФЭК).
Спектрофотометричний метод аналізу також оснований на вимірюванні поглинання розчином випромінювання, но не поліхроматичного, а монохроматичного, як у видимій, так і в ультрофіолетовій та інфрчервоній областях спектра. Прибори, які використовують в спектрофотометрії, називають спектрофотометрами.
Видиме випромінювання (або світло) - це випромінювання, яке визиває зорові відчуття. Випромінювання, яке не визиває зорового відчуття, називають невидимим випромінюванням.
Головними оптичними характеристиками всіх забарвлених розчинів є: колір та інтенсивність його забарвлення.
1. Колір розчину. Всі забарвлені речовини характеризуються вибірковим поглинанням світла. Це значить, що забарвлення розчину зумовлене нерівномірним поглинанням окремих ділянок видимого випромінювання. Наприклад, розчин мідного купоросу синього кольору тому, що іони міді переважно (вибірково) поглинають жовту область спектру, а остальні області пропускають. Розчин, який поглинає синю область, буде здаватися жовтим, поглинаюча зелена ділянка спектра – пурпурний і т.п..
Таким чином, спостерігає мий колір розчину завжди є додатковим до кольору поглинаючого випромінювання. Речовина «білого» кольору тому, що вона видиме випромінювання не поглинає, а відбражає. Речовини «чорного» кольору тому, що рівномірно поглинає видимее випромінювання.
Для повної характеристики розчинів забарвлених сполук використовують спектри (криві світопоглинання), які показують залежність значення оптичної густини від довжини хвилі випромінювання. Спектри поглинання будуєть у координатах: А – оптична густина (характеризує ступінь поглинання світла), - довжина хвилі поглинаючого випромінювання (км).
Довжина хвилі, яка відповідає максимуму світопоглинання (max), є важливою оптичною характеристикою речовини, а саме кольору розчину.
Для збільшення чутливості та правильності фотометричних визначень слід використовувати при освітленні розчину не поліхроматичне випромінювання (білий світ), а деякою більш вузькою ділянкою спектра, яка найбільш сильно поглинає дану речовину. Для того, щоб виділити таку ділянку спектра, звичайно використовують світофільтри, а в особливих випадках - монохроматори, які виділяють монохроматичне випромінювання.
2. Інтенсивність забарвлення. Два розчини з однієї ж речовини, але з різними концентраціями однокового кольору, но відмінні по інтенсивності забарвлення.
Кількість інтенсивності забарвлення розчину значенням оптичної густини. Під оптичною густиною розуміють величину поглинання світового потоку, який пройшов крізь розчин та позначається буквою ”A” (в підручниках, давнішого видання, позначається буквою “Д”).
Основним законом світопоглинання є об’єднаний закон Бугера - Ламберта- Бера
А = LC(B),
де А – оптична густина;
С (В) – концентрація речовини, в моль/дм3;
- молярний коефіцієнт світопоглинання;
L – товщина поглинаючого шару, см.
Слід звернути увагу на то, що закон Бугера –Ламберта- Бера справедливий тільки для монохроматичного випромінювання при малих концентраціях аналізуємої речовини. Закон застосовується у тих вападках, коли частки, які поглинають світло, залишаються незмінними. Якщо характер часток буде змінюватись.
Завдання для виконання самостійної роботи
Відповісти на запитання:
1. Класифікація оптичних методів аналіза.
2. У чому відмінність між колометричним та фотометричним методами аналіза?
3. Сутність спектрофотометричного метода аналіза?
4. Що називається емісіонним спектральним аналізом?
5. Сутність метода фотометрії полум’я?
6. Назвіть головні оптичні характеристики забарвлених розчинів.
7. Що називається спектром поглинання (кривою світопоглинання)?
8. Правило вибора світофільтрів.
9. Що називається оптичною густиною і світопропусканням (прозоростью). Яка існує взаємодія між цими величинами?
10. Рівняння основного закона світопоглинання (закона Бугера-Ламберта-Бера).
САМОСТІЙНА РОБОТА № 9.
Тема: Рефрактометричний метод аналізу.
Повинні знати: основи рефрактометричного методу аналізу, будову і принцип роботи рефрактометра
Повинні вміти: використовувати знання рефрактометричного аналізу на практиці
План:
- Сутність рефрактометричного методу аналіза.
- Показник преломлення.
- Мольна та питома рефракція.
- Будова і принцип роботи рефрактометра РПЛ-3.
