Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж
| Вид материала | Документы |
- Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж одеської, 869.19kb.
- Міністерство освіти І науки, молоді та спорту україни, 59.16kb.
- Міністерство освіти І науки, молоді та спорту України, 61.58kb.
- Міністерство освіти І науки, молоді та спорту україни технічний коледж тернопільського, 361.4kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 139.07kb.
- Міністерство освіти І науки, молоді та спорту України двнз «Івано-Франківський коледж, 1070.95kb.
- Міністерство освіти І науки, молоді та спорту україни, 35.62kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 369.69kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 182.18kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 53.88kb.
2. Сутність потенціонометричного аналізу.
3. Сутність кулонометричного аналізу.
4. Сутність кондуктометричного аналізу.
5. Сутність полярографічного аналізу.
6. Сутність діелектрометричного аналізу.
Стислі теоретичні відомості
1. Сутність електрохімічних методів аналізу
Електрохімічні методи аналізу – це методи якісного та кількісного аналізу речовин, які знаходяться у газоподібному, рідкому чи твердому стані, засновані на електрохімічних явищах у досліджуємому середовищі або на межі доторкання фаз та пов’язаних зі зміненням структури хімічного складу або концентрації.
В залежності від області електрохімічного вимірювання електрохімічні методи аналізу діляться на 5 груп:
- потенціонометричний (або потенціонометрія);
- полярографічний (або полярографія);
- кулонометричний (або кулонометрія);
- кондуктометричний (або кондуктометрія);
- діелектрометричний (або діелектрометрія).
2. Сутність потенціонометричного аналізу.
Потенціонометричний аналіз полягає у визначенні вмісту іонів за допомогою вимірювання електрохімічного потенціалу електрода, зануреного у досліджуваний розчин. Потенціонометричний аналіз був розроблений наприкінці ХІХ ст., після того, як В. Г. Нернст вивів рівняння, яке пов’язує величину потенціалу металічного електрода з концентрацією іонів цього ж металу у розчині:
Ех = Е0 +
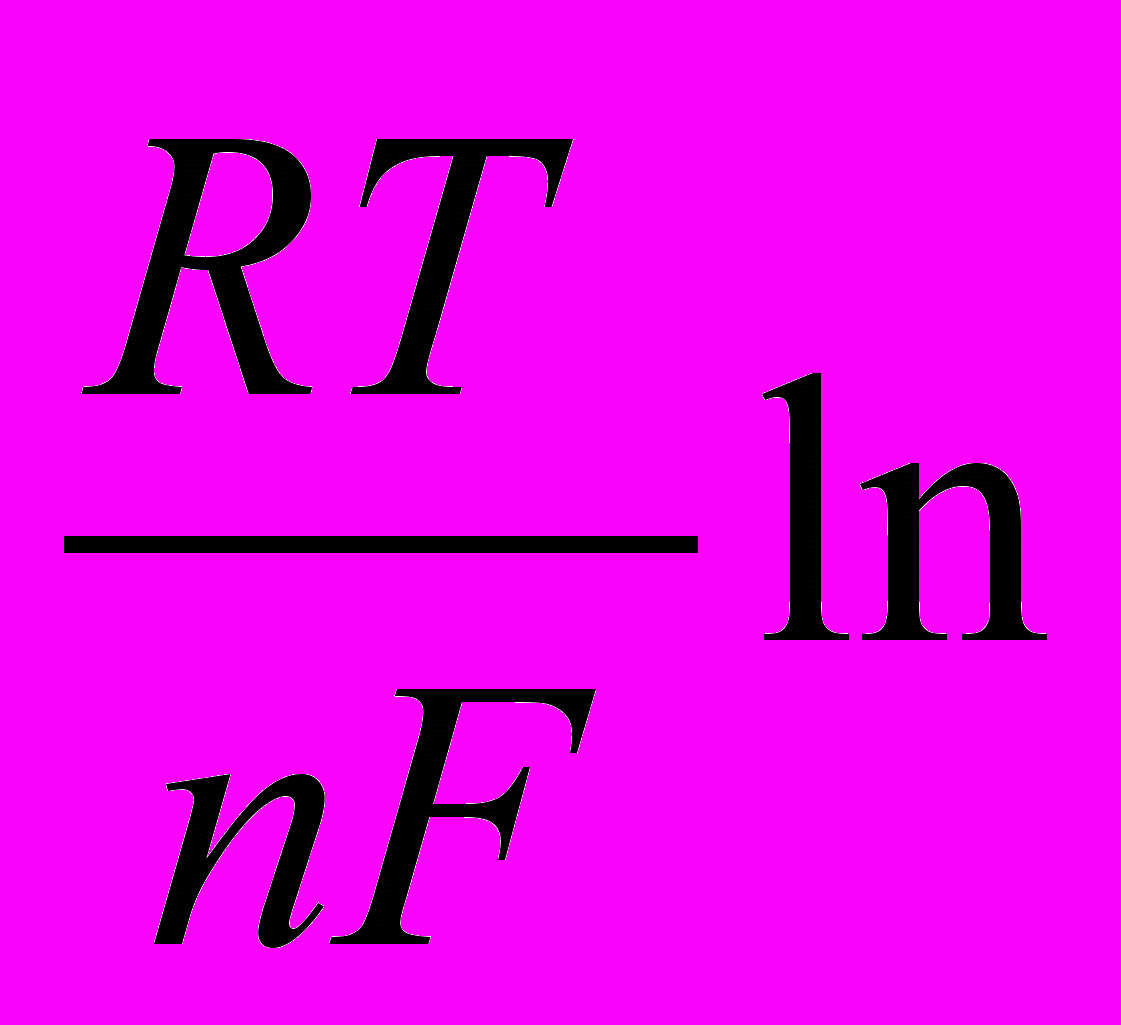 Сме (1)
Сме (1)де Ех – потенціал металічного електрода за даної концентрації іонів металу у розчині;
Е0 – потенціал цього ж електрода у розчині з концентрацією іонів, рівний одиниці (1 моль/л) – нормальний потенціал;
Сме – концентрація іонів металу;
R – газова стала (8,313 Дж);
Т – абсолютна температура;
F – число Фарадея (96500 К);
n – заряд іона металу.
Якщо підставити в рівняння (1) відповідні значення R і Т (t = 250С) і врахувати коефіцієнт переходу від натуральних логарифмів до десяткових (2,3026), то рівняння Нернста матиме такий вигляд:
Ех = Е0 +
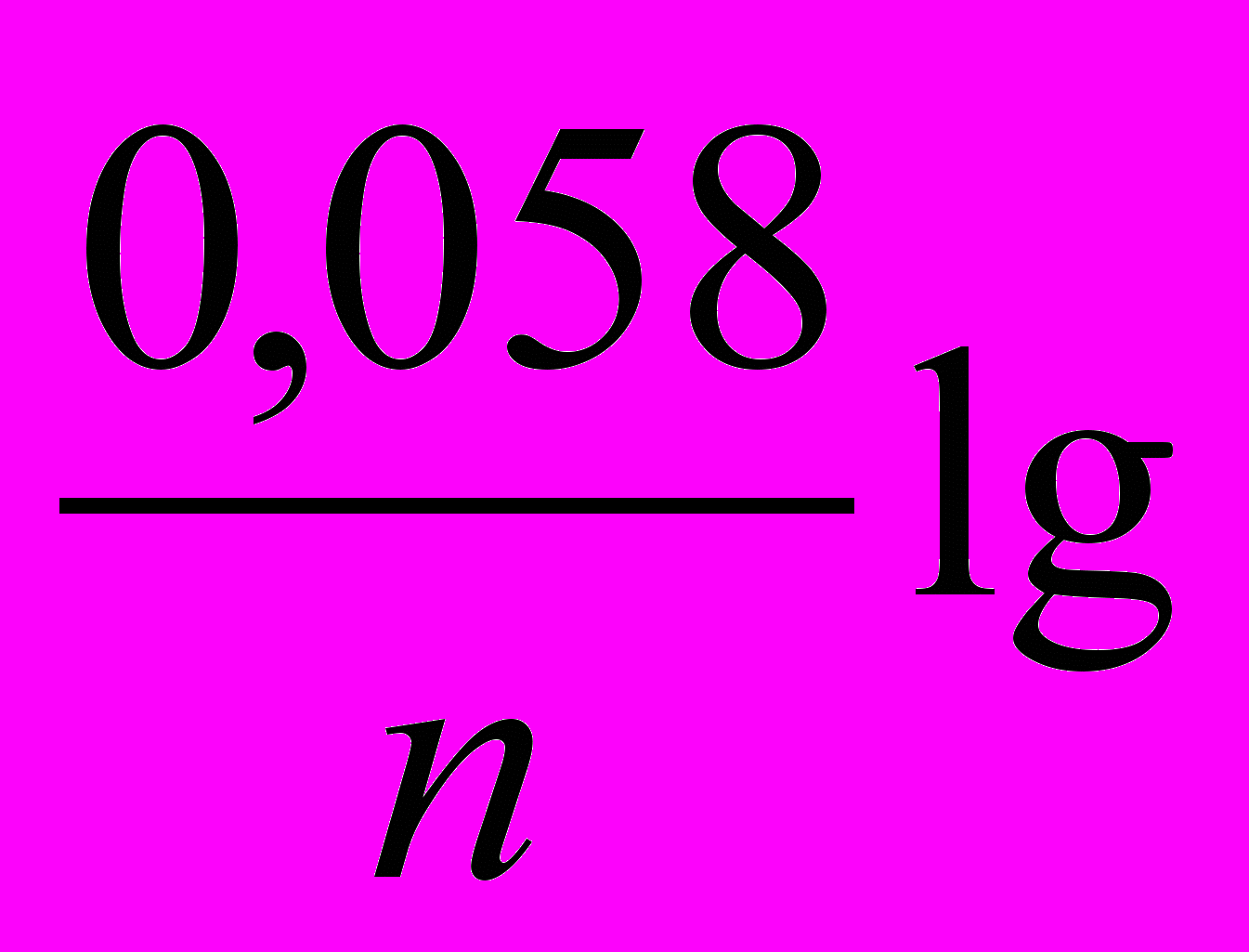 Сме (2)
Сме (2)Згадуємо, що електродний потенціал – це різниця потенціалів, яка виникає між металевою пластинкою і розчином його солі.
Нормальний (стандартний) потенціал – це потенціал, який виникає при зануренні металу у розчин з концентрацією іонів металу 1 моль/л.
Потенціонометричне титрування, полягає у тому, що в досліджуваний розчин занурюють індикаторний електрод і титрують розчин, вимірюючи у процесі титрування потенціал електрода. Концентрація іонів, що визначають, змінюється в залежності від об’єму добавленого робочого розчину нерівномірно. Спочатку ця зміна невелика, потім вона стає помітною і наприкінці, в точці еквівалентності, досягає найбільшого значення.
Потенціонометричне титрування застосовують головним чином для визначення досить великих кількостей речовини. Порівняно з іншими методами потенціометричне титрування має такі переваги: 1) дає змогу титрувати забарвлені розчини (кольорові індикатори непридатні, як і колориметричний метод); 2) легко визначити кілька речовин у суміші без попереднього їх розділення.
Залежить від типу хімічної реакції потенціонометричне титрування застосовують при: а) методах осадження і комплексоутворення; б) окислення – відновлення; в) кислотно-основного титрування.
У потенціометрії дуже важливо правильно вибрати відповідний індикаторний електрод для визначення точки еквіалентності.
Більш точним є компенсаційний метод, коли різницю потенціалів вимірюють у відсутності струму в ланцюгу за допомогою звичайного містка з натягнутим дротом-реохордом. Нині користуються спеціальними приладами-потенціометрами, які дають змогу вимірювати потенціали електродів з великою точністю.
Електроди, які використовуються для визначення концентрації іонів металів у розчинах, називаються індикаторними. Індикаторний електрод з’єднують з другим електродом у гальванічний елемент і вимірюють різницю потенціалів між обома електродами. Потенціал другого електрода постійний і його величина відома – такі електроди називають стандарними, або електродами порівняння. Знаючи різницю потенціалів між електродами і значення потенціалу стандартного електрода, обчислюють потенціал індикаторного електрода.
Електроди порівняння. Величина потенціалів електродів порівняння відомі. Це дає змогу застосовувати їх в абсолютній потенціонометрії, коли необхідно визначити абсолютну величину потенціалу, індикаторного електрода, а не тільки зміну цієї величини в процесі титрування. Найчастіше використовують такі стандартні електроди: каломельний та хлорно-срібний.
Каломельний електрод – це посудина, на дні якої є шар добре очищеної ртуті завтовшки 4 – 5 см, вкритий шаром каломельної пасти (Нg2СІ2). Зверху паста вкрита шаром кристалічного хлориду калію та його насиченим розчином. Струм від ртуті відводиться за допомогою платинової дротини, впаяної в скляну трубку.
Потенціал каломельного електрода залежить лише від концентрації іонів хлориду, яка залишається сталою.
Хлорно-срібний електрод – це срібний дріт, вкритий шаром хлориду срібла (він добре проводить електричний струм), занурений у насичений розчин хлориду калію. Хлорно-срібні електроди входять у деякі комплекси вимірювальних прилвдів.
Індикаторні електроди. Вимоги до індикаторних електродів можуть бути різними залежно від того, де вони використовуються – в абсолютній потенціонометрії чи в потенціометричному титруванні. В обох випадках індикаторні електроди повинні бути оборотними, тобто їхній потенціал повинен змінюватися із зміною концентрації іонів металу в розчині у відповідності з рівняннями Нернста. Індикаторні еленктроди повинні бути хімічно стійкими по відношенню до речовини, які містяться у розчині. У методах кислотно-основного титрування необхідно вимірювати концентрацію водневих іонів розчину. Для цього найчастіше користуються водневим, хінгідронним, скляним електродами.
Водневий електрод – це платинова пластинка, вкрита електролітично губчастою платиною, яка насичена воднем. Під час занурення такого електрода у розчин з певною концентрацією водневих іонів між воднем, адсорбованим губчастою платиною, і іонами водню у розчині встановлюється рівновага, а потенціал електрода визначається рівнянням:
Ех = Е0 + 0,058 lg Н+
де Е0 – потенціал нормального водневого електрода.
Нормальним, або стандартним, водневим електродом називається водневий електрод, у якому платиновий провідник насичений воднем під тиском 101 кПа, занурений у розчин з концентрацією іонів водню 1 моль/л при температурі 250С.
Нормальний потенціал водневого електрода прийнято вважати рівним нулю, тому
Ех = 0,058 lg Н+
Звідси
рН = -
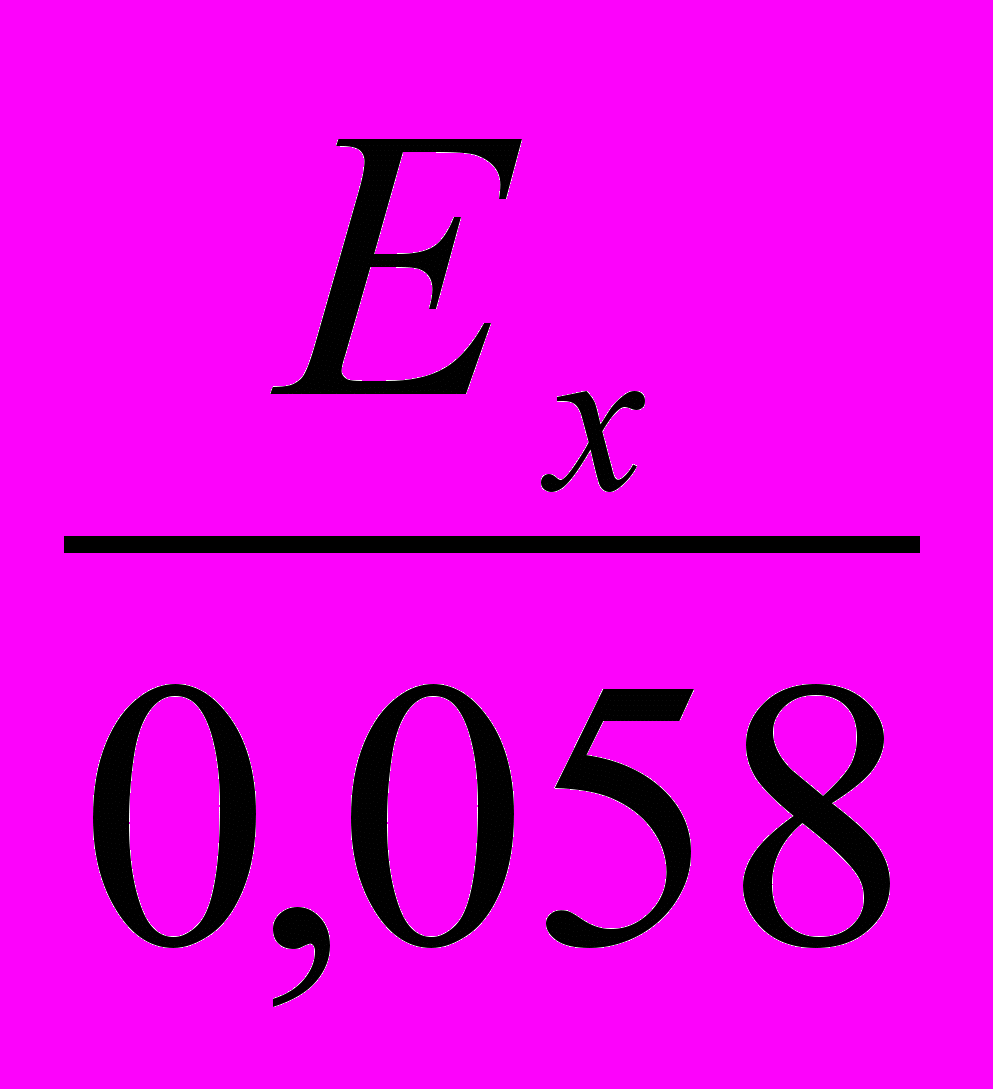
Хінгідронний електрод – це скляна посудина з платиновим електродом, зануреним у насичений розчин хінгідрону. Хінгідрон – це малорозчинна молекулярна сполука хінону і гідрохінону, яка у розчині розпадається на хінон і гідрохінон:
С6Н4О2 С6Н4(ОН)2 С6Н4О2 + С6Н4(ОН)2
хінгідрон хінон гідрохінон
В останні роки почали широко використовувати скляний електрод, що являє собою кульку з дуже тонкого спеціального скла, в яку наливають електропровідний розчин. У цей розчин занурюють срібну дротину, на поверхню якої наносять хлорид срібла. Електродна реакція в ньому полягає в обміні іонами водню між рідкою фазою (рН якої вимірюється) і склом:
Н+ Н+скла
Потенціал скляного електрода перебуває у повній залежності від концентрації іонів водню, що дає змогу використовувати його для вимірювання рН.
Стисла характеристика електродів.
| Електрод | Виготовлення | Область використання | Примітки | ||
| Індикаторні електроди. | |||||
| Срібний | Посріблена пла-тинова пластина або сітка. | Реакції осадження та ком-плексоноутворення. Визна-чаються аніони СІ-, Вr-, І-, CNS- та їх солі. Методом зворотнього титрування ро-данідних та цианідних ко-мплексів визначаються Ni2+, Сo2+, Zn2+. | Реакцію осадження галогенів краще проводити у темноті. | ||
| Ртутний | Платинова сітка електролітично покрита ртутью. | Реакції осадження та комп-лексоноутворення. Можна визначити СІ-, Вr-, І-, CNS-, CN-. Методом зворотнього титрування визначаються Ng2+ та інші. | Методом зворотнього титрування можна визначити і деякі інші іони. | ||
| Йодний | Платинова сітка у воді, насичена йо-дом. Електрод ви-користовують сві-жовиготовлений. | Реакції осадження та комп-лексоноутворення. Можна визначити СІ-, Вr-, І-, Ng2+. | У якісті робочих розчинів використовують солі срібла, ртуті та йодида калію. | ||
| Ферофериціа-нидний | Платинова сітка у розчині К3Fe(CN)6 (1 – 2 краплі). | Реакція осадження з К3Fe(CN)6, можна визна-чити іони Pb2+, Ca2+, Cu2+, Zn2+. | Робочий розчин К3Fe(CN)6 чи розчин Pb(NО3)2 для зворотнього титрування. | ||
| Водне-вий | Платина, насичена воднем. | Реакції нейтралізації у роз-чинах з рН від 1 до 13. | Дуже чутливий до розчиненого кисню, сірководню, окисни-кам. | ||
Хінгід-ронний | Платиновий дріт у насиченому роз-чині хінгідрону. | Реакції нейтралізації у розчинах з рН від 0 до 8. | Робота легче, чим з водневим електро-дом. Чутливий до окисників. У лужних розчинах більше помилок. | ||
| Сурьмя-ний | Платиновий дріт, електролітично покрита сурьма. Окись сурьми на поверхні утворю-ється самовільно. | Реакції нейтралізації у роз-чинах з рН від 2 до 7 (при рН вище 7 помилка визна-чення сильно виростає). | Використовується у присутності сильних окисників та органічних речовин. Для точних визначень невмістний. | ||
| Скляний | Тонкостіна плівка із спеціального скла. Внутрішня область заповне-на НСІ з плати-новим електро-дом в середені. | Реакції нейтралізації у розчинах з рН від 1,5 до 12. | | ||
| Плати-новий | Платинова сітка, дріт або пластина. | Використовується для реак-цій окиснення-відновлення. | | ||
| Порівняльні електроди. | |||||
Каломе-льний | Ртутний електрод у відповідному розчині хлориду калію у присут-ності каломелі. | Почти для усіх методів титрування. | | ||
| Сірчанокислий ртутний | Ртутний електрод в 1 н. розчині Н2SO4 у прису-тності Нg2SO4. | Теж саме. | | ||
| Окисно-ртутний | Ртутний електрод в 1 н. розчині NaOН у присут-ності НgO. | Як і каломельний, особливо при титруванні сильнолу-жних розчинів. | Потенціал помітно змінюється з часом. | ||
| Хлорно-срібний | Срібний дріт, по-критий АgСІ у н. або насиченому розчині КСІ. | При титруванні АgNО3 у методах осадження та ком-плексоноутворення, при виз-наченні рН. | Електрод не використовується у присутності іонів NО3-, І-, CN-. | ||
| Вольф-рамовий | Шматочок воль-фрамового дрота. | Для проскориних методів потенціонометричного тит-рування. | | ||
| Графіт-ний | Графітна паличка. | Теж саме. | | ||
| Карбо-рундо-вий | Шматочок селіто-вого стержня. | Теж саме. | | ||
