Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж
| Вид материала | Документы |
СодержаниеСтислі теоретичні відомості Зворотне титрування Молярна концентрація Самостійна робота № 4. |
- Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж одеської, 869.19kb.
- Міністерство освіти І науки, молоді та спорту україни, 59.16kb.
- Міністерство освіти І науки, молоді та спорту України, 61.58kb.
- Міністерство освіти І науки, молоді та спорту україни технічний коледж тернопільського, 361.4kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 139.07kb.
- Міністерство освіти І науки, молоді та спорту України двнз «Івано-Франківський коледж, 1070.95kb.
- Міністерство освіти І науки, молоді та спорту україни, 35.62kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 369.69kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 182.18kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 53.88kb.
Стислі теоретичні відомості
1. Сутність титриметричного аналізу.
У титриметричному аналізі основною операцією є вимірення об’єму двух взаємодіючих розчинів, один з яких містить аналізуєму речовину, а концентрація другого завчасно відома. Не відому концентрацію досліджує мого розчину визначають, знаючи співвідношення об’ємів реагуючих розчинів та концентрацію одного з них.
Титриметричний аналіз – це совокупність методів кількісного аналізу, які основані на виміренні кількості речовини або маси реагенту, необхідного для взаємодії з даним компонентом системи у розчині або газової суміші. Процес титрування – це додавання невеликими порціями розчину реагенту до точно отриманого об’єму розчину до отримання системою стану еквівалентності, визначаємого спеціальними речовинами або інструментом, використовуючи фізико-хімічні властивості системи.
Широке використання титриметричного аналізу зумовлене великою швидкістью проведення аналізу.
Для цього методу аналізу існують деякі обмеження, які звужують круг використання методу:
- швидкість взаимодії реагуючих речовин повинна бути великою;
- реакція повинна проходити у відповідності з стехіометричним законом;
- побічні реакції повинні бути відсутні;
- закінчення титрування повинно бути чітко зафіксоване.
У титриметрії необхідно чітко виконувати слідуючі операції:
- приготування стандартного розчину, який є первинним лабораторним стандартом для даного методу аналізу, по якому атестують інші розчини;
- точне вимірювання титруємих об’ємів розчинів або мас речовин;
- точне вимірювання об’ємів розчинів титрантів;
- вибір індикатору, за допомогою якого можна точно визначити систему еквівалентності титруємої речовини – титрант.
Процес титрування – це одна з відповідальних операцій у титриметричному аналізі, від якої залежить правельне виконання аналізу. Для підготовки і виконання титрування необхідно виконувати слідуючі правила:
- хімічна посуда повинна бути чистою;
- відмірювання об’єму розчину для титрування і перенесення його у колбу для титрування відбувається за допомогою піпетки Мора, а при її відсутності піпетками інших конструкцій;
- розчин із піпетки повинен витікати самостійно, а в кінці необхідно кінчиком піпетки доторкатися до дна колби або її стінки;
- для титрування бажано використовувати конічні колби, такі щоб об’єм розчину не був більше ½ місткості колби;
- колбу з титруємим розчином при титруванні тримають у правій руці, при цьому розчин круговими рухами взбовтують;
- пальцями лівої руки регулюють швидкість подачі розчину титранту із бюретки в колбу для титрування, при цьому кінчик піпетки повинен знаходитися у колбі, но не доторкатися її стінки;
- швидкість титрування повинна бути такою, щоб можна було більш точно і чітко визначити систему еквівалентності;
- кожен раз в кінці титрування визначають об’єм розчину, який пішов на титрування, з точністью до половини поділу шкали бюретки;
- перше титрування завжди є орієнтировочним і неточним;
- кожне послідуюче титрування начинають з заповнення бюретки до відмітки “0”;
- титрують аналізуємий розчин стільки раз, щоб із всіх виміряних об’ємів розчинів титранта можна вибрати не менше трьох з відхиленнями по об’єму 0,1 мл.
Титрування – це визначення об’ємів двух розчинів, в яких міститься еквівалентна кількість взаємодіючих речовин. При титруванні встановлюють момент кінця реакції, тобто момент, коли у додавшому об’ємі стандартного (титрованого) розчину містится кількість речовини, еквівалентне кількості визначаємої речовини. Цей момент називають моментом еквівалентності або точкою еквівалентності.
Розрізняють три методи титрування: пряме, зворотне (по залишку), титрування по заміснику.
При прямому титруванні досліджує мий розчин титрують стандартним розчином.
Зворотне титрування використовують у тому випадку, коли досліджуємо речовина не реагує зі стандартним розчином або реагує повільно.
Титрування по заміснику використовують у випадках, коли визначають іон.
2. Розчини у титриметричному аналізі.
У титриметрії використовують розчини молярної концентрації еквівалентів.
В залежності від способу встановлення концентрації розрізняють розчини стандартні і стандартизовані.
Стандартний розчин – це розчин, який добутий розчиненням точної маси стандартної речовини у точному об’ємі розчину. Такий розчин є первиним лабораторним стандартом.
Еквівалент – це умовні частинки речовин в tв раз менше, чим відповідні їм одиниці, де tв називається числом еквівалентності.
Стандартними називають речовини, які задовільняють вимогам:
- максимально можлива хімічна чистота;
- великі молярна і еквівалентно молярна маси;
- негігроскопічні і нелеткі;
- постійний склад, відповідного його хімічній формулі.
Стандартизований розчин – це розчин, концентрація якого встановлена по стандартному розчину, і є другим лабораторним стандартом.
Розчином називається гомогенна система змінного складу, що складається з двох або більшого числа компонентів, які подрібнені до розмірів атомів, іонів або молекул. Склад розчину кількісно прийнято виражати через безрозмірні відносні величини – частки (масову, об’ємну, молярну) і розмірні величини – концентрації.
Концентрацією розчину називається кількість розчиненої речовини, яка знаходиться в визначеній вагомій чи об’ємній кількості розчину чи розчинника.
Існує декілька засобів вираження концентрації розчинів.
- Молярна концентрація – це відношення кількості розчиненої речовини до об’єму розчину.
См =
 V, моль/дм3
V, моль/дм3де m – маса розчиненої речовини, г;
М – молекулярна маса розчиненої речовини, моль/г;
V - об’єм розчину, дм3.
- Еквівалентна концентрація – це відношення кількості речовини до об’єму розчину.
Секв =
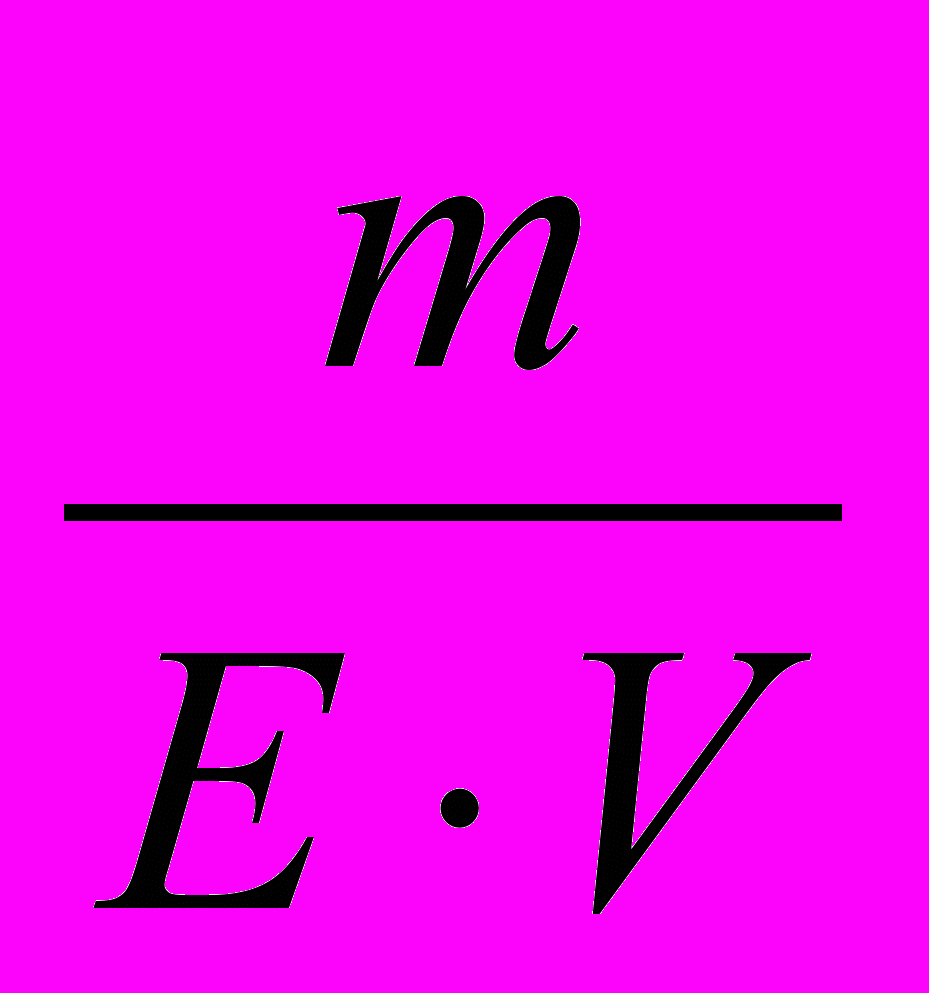 , моль∙екв/дм3
, моль∙екв/дм3де m – маса розчиненої речовини, г;
Е – еквівалент розчиненої речовини, г/моль;
V – об’єм розчину, дм3.
Якщо відома концентрація однієї з реагуючих речовин і об’єми розчинів обох речовин, що беруть участь у реакції, можна визначити еквівалентну концентрацію другого розчину.

Такі розрахунки проводять при визначенні концентрації речовин методом титрування.
3. Моляльна концентрація – відношення кількості розчиненої речовини до маси розчинника.
См =
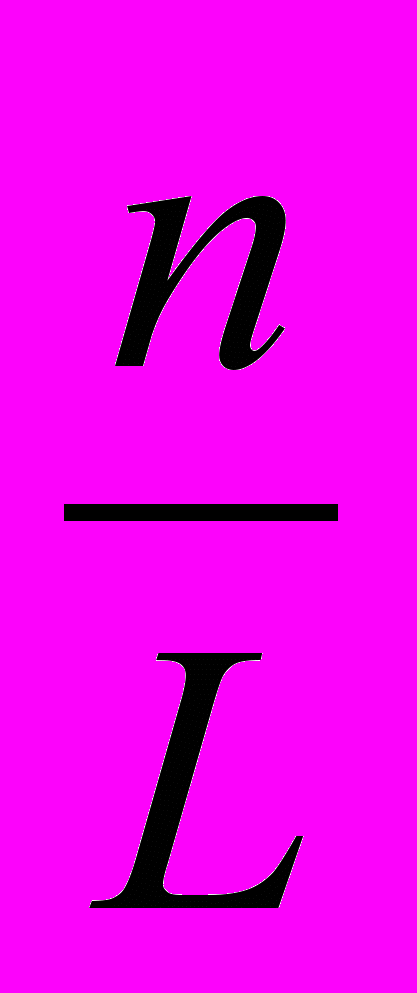 , моль/кг
, моль/кгде n – кількість молів розчиненої речовини.
L – маса розчинника, кг
так як n =
 , то
, тоСм =
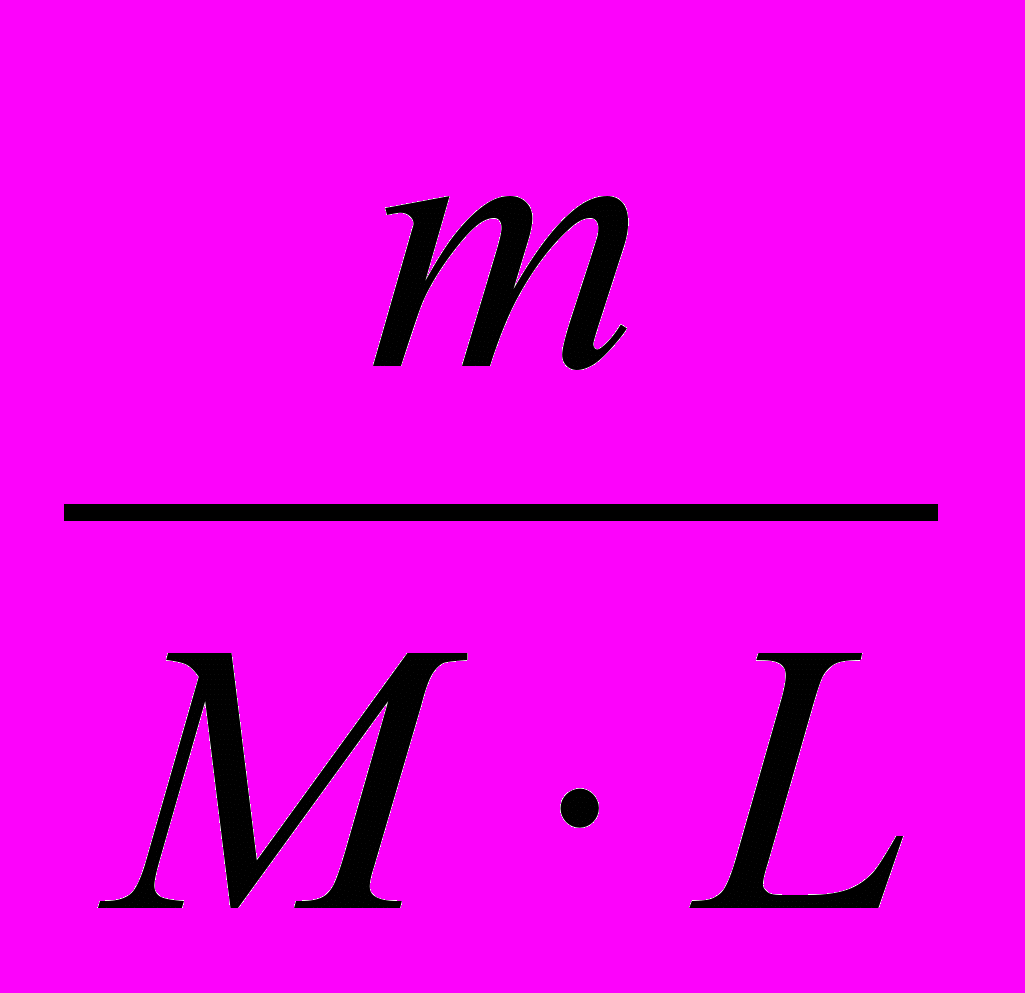 , моль/кг.
, моль/кг.де m – маса розчинної речовини, г
М – молекулярна маса розчиненої речовини, г/моль
L – маса розчинника, кг.
Моляльність розчину, на відмінність від його молекулярності, не змінюється при змінені температури.
Для переводу масової частки розчиненої речовини у еквівалентну молярну концентрацію використовують наступні формули:
Титр-кількість грамів речовини, яке міститься в 1г см3 розчину визначається по формулі:
а) Т =
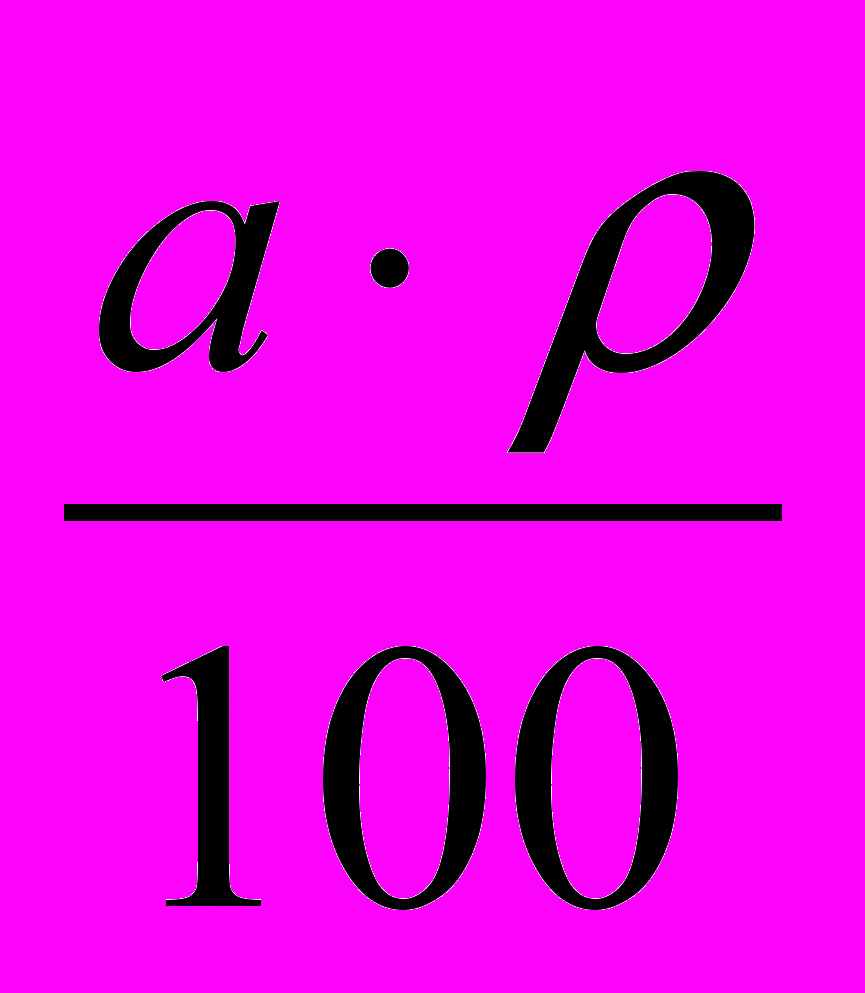 , г/см3
, г/см3де
 - відсотковий склад речовини кислоти, визначається по таблиці
- відсотковий склад речовини кислоти, визначається по таблиці - густина розчину, визначається шляхом досліду ареометра, зануренним в циліндр з розчином кислоти.
- густина розчину, визначається шляхом досліду ареометра, зануренним в циліндр з розчином кислоти.б) Т =
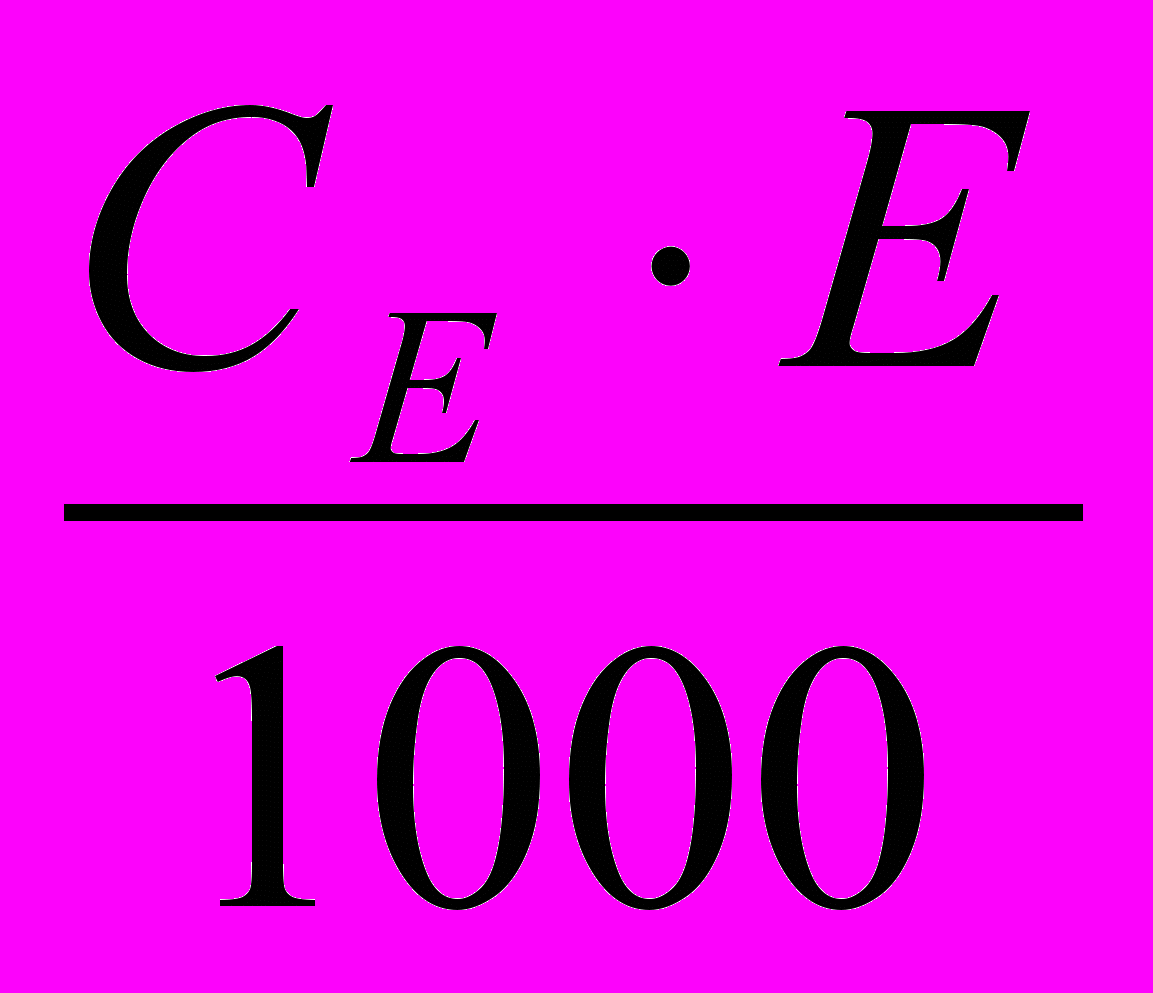 , г/см3
, г/см3де СЕ – еквівалентна молярна концентрація, мольекв/дм3
Е – еквівалент, г/моль.
в) Т =
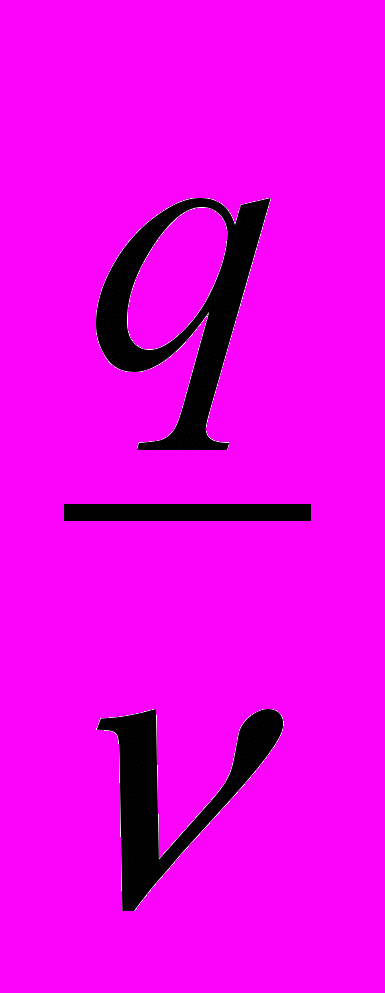 , г/см3
, г/см3де
 - наважка, г
- наважка, г - об’єм, см3
г) Т раб.р-ра/ов =
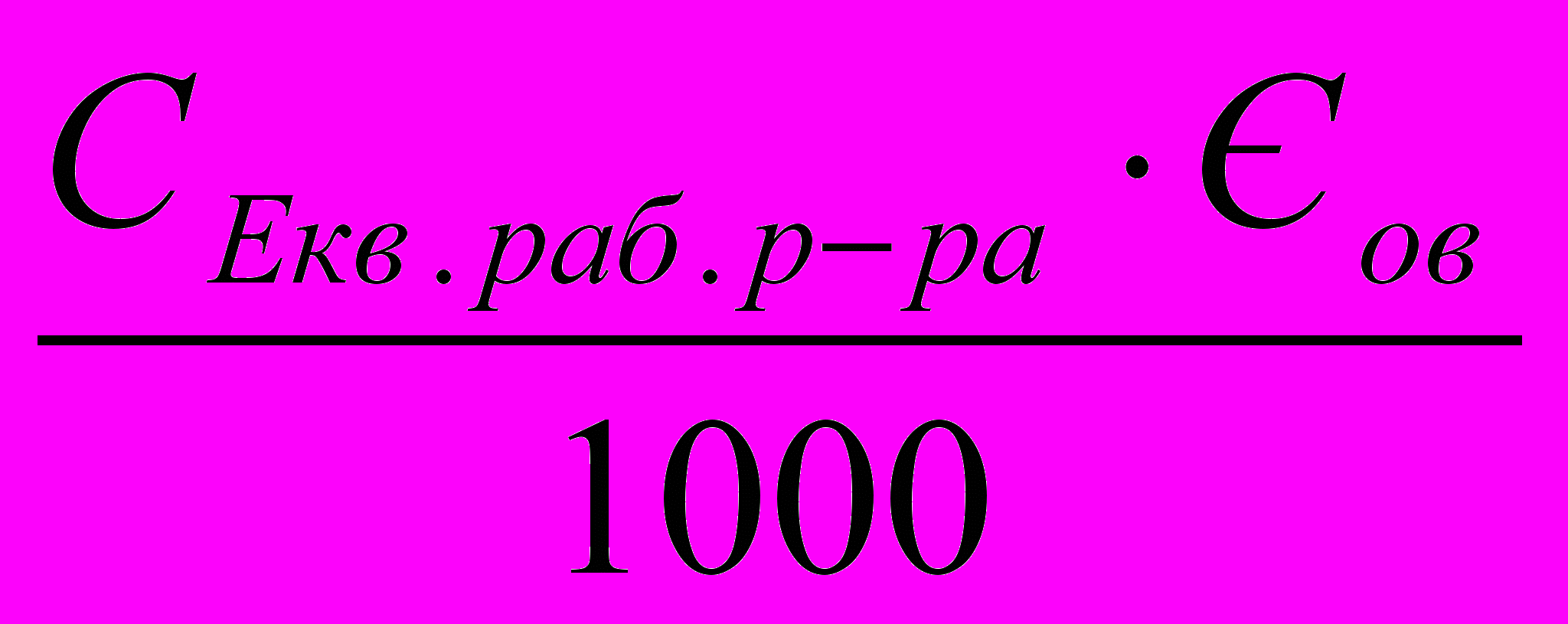 , г/см3
, г/см3де СЕкв.раб.р-ну – еквівалентна молярна концентрація робочого розчину, мольекв/дм3
Ев.р. – еквівалент визначаємої речовини, г/моль.
Еквівалентна молярна концентрація розчину визначається по формулі
Се =
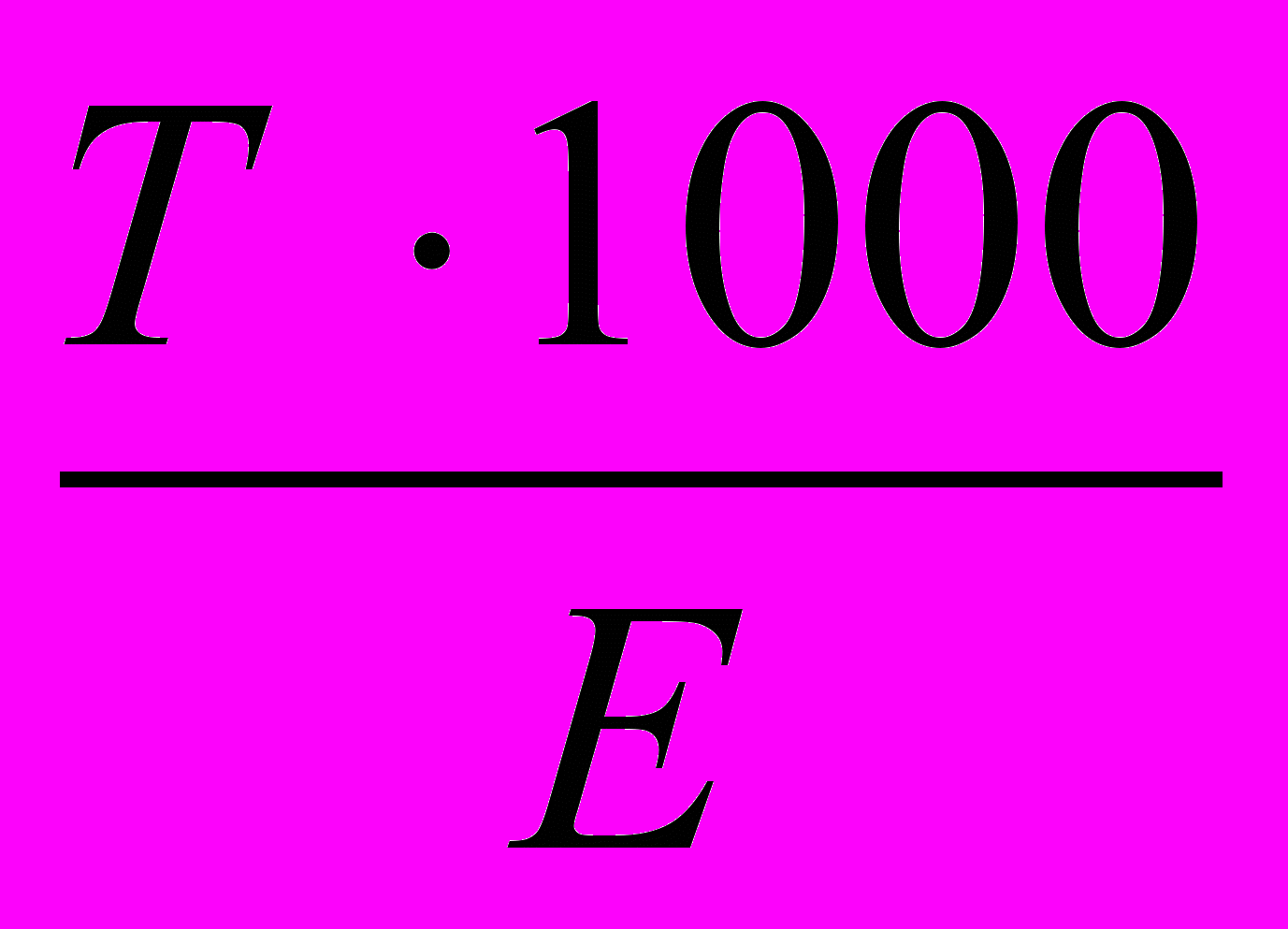 , мольекв/дм3
, мольекв/дм3де Т – титр, г/см3
Е – еквівалент, г/моль
3. Приготування стандартних розчинів.
Самий простий і точний спосіб приготування стандартного розчину полягає в тому, що зважування необхідної маси на аналітичних терезах і розчиненні її у воді або іншому розчиннику з доведенням розчину до об’єму. Ці розчину готують у мірній колбі.
Якщо знаємо масу стандартної речовини (г) і об’єм розчину (мл), визначаємо концентрацію розчину та молярну концентрацію еквівалентів речовини за формулою:
Сод(В) =
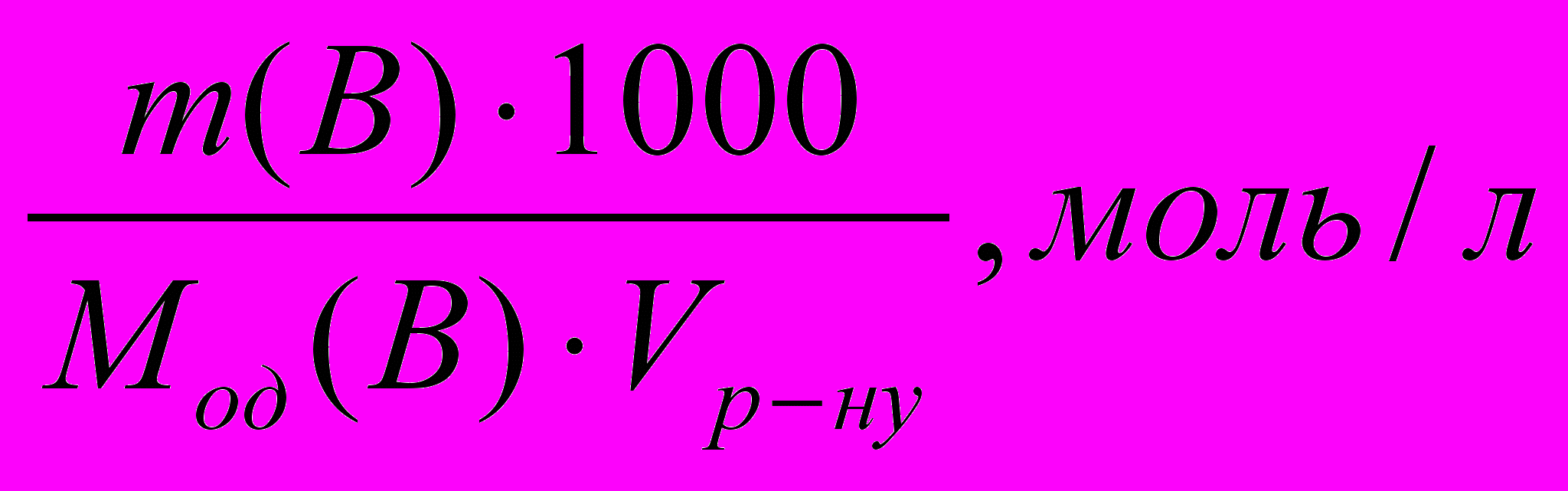
де m (В) – маса стандарної речовини В, г;
Vр-ну – еквівалентна маса речовини В, г/моль;
M од (В) – об’єм стандарного розчину, мл.
4. Приготування стандартизованих розчинів.
Якщо речовина не може бути віднесена до стандартних речовин у зв’язку з його хімічною природою і властивостями, тоді з нього готують розчин приблизної концентрації.
Речовина при титруванії реагує у кількості еквівалентів, які дорівнюють один одному:
nод (В) = nод (В)
де nод (В) і nод (В) – кількість еквівалентів речовин В і В, моль.
Кількість еквівалентів речовини у об’ємі розчину можна виразити залежністью:
nод (В) = сод (В) V, моль
де V – об’єм розчину, л.
Підставляємо вираження цих двух рівнянь:
сод (В) V = сод (В) V, моль
де V і V – об’єми титруємого розчину і розчину титранту, л.
Розраховуємо концентрацію атестуємого розчину:
сод (В) =
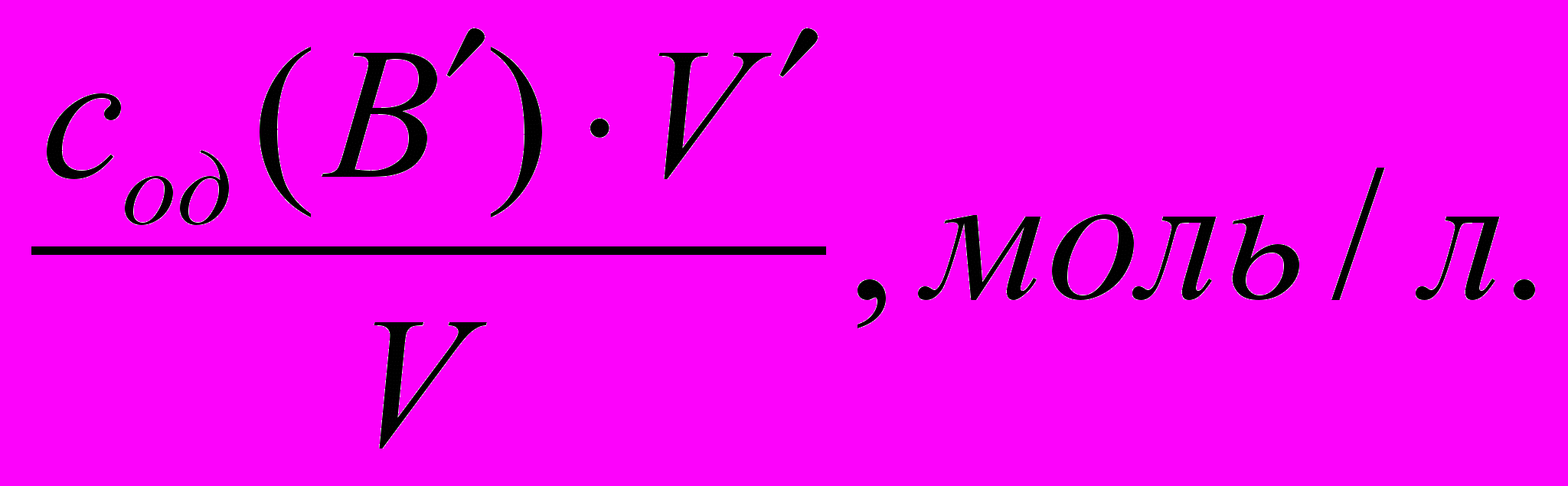
Завдання для виконання самостійної роботи
Відповісти на запитання:
1. Які вимоги до реакцій у об’ємному аналізі?
2. Що називають грам-еквівалент у реакціях нейтралізації?
3. Що таке робочий (стандартний, титрований) розчин? Які концентрації робочих розчинів звичайно використовують у методі нейтралізації?
4. Як виражають концентрацію розчину у титриметричному аналізі? Дати визначення поняттю: титр, нормальність, нормальність з поправочним коефіцієнтом, титр по визначаємій речовині.
5. Напишіть формули для розрахунку нормальності робочого розчину, якщо відомо: титр розчину, титр розчину по визначає мій речовині.
6. Що називають кривою титрування?
7. Що таке точка еквівалентності? У якій області рН (кислій, нейтральній, лужній) лежить точка еквівалентності при титруванні розчину: сильної кислоти сильною основою; слабкої кислоти сильної основи; слабкої основи сильної кислоти?
8. Що називають стрибком титрування?
9. Як практично фіксується точка еквівалентності?
10. Сутність титриметричного аналізу.
11. Методи титрування.
12. Еквівалентна кількість речовини, еквівалентна маса і їх визначення.
13. Приготування розчинів.
14. Техніка титрування.
Розв’язати задачі:
- Який об’єм розчину їдкого калію з еквівалентною концентрацією 0,05 моль∙екв/дм3 буде витрачений на реакцію з 15 см3 розчину хлориду заліза (ІІ) з еквівалентною концентрацією 0,5 моль∙екв/дм3?
- Визначити об’єм розчину нітратної кислоти з густиною = 1,05 г/см3, необхідної для приготування 2 л 0,01 М розчину сірчаної кислоти?
- Визначити еквівалентну концентрацію розчину карбонату калію з масовою часткою розчиненої речовини 17 %, густина якої 1,02 г/см3.
4. Скільки дм3 води потрібно прилити до 2 дм3 25%-го розчину сульфатної кислоти (ρ=1,4), щоб отримати 30%-й розчин сульфатної кислоти?
5. Скільки кілограмів 19%-го розчину КOH та 40%-го розчину КOH потрібно змішати, щоб отримати 200дм3 15%-го розчину КOH (ρ = 4,275)?
САМОСТІЙНА РОБОТА № 4.
Тема: Кислотно-основне титрування.
Повинні знати: сутність кислотно-основного титрування‚ особливості фіксування моменту еквівалентності; інтервали рН-переходу забарвлення індикаторів‚ значення методу та використання його в технохімічному контролі харчових виробництв.
Повинні вміти: використовувати криве титрування при виборі індикаторів.
План:
1. Сутність метода кислотно-основного титрування.
2. Порядок титрування.
3. Кількість додавання індикатору.
