Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж
| Вид материала | Документы |
- Міністерство освіти І науки, молоді та спорту україни одеський технічний коледж одеської, 869.19kb.
- Міністерство освіти І науки, молоді та спорту україни, 59.16kb.
- Міністерство освіти І науки, молоді та спорту України, 61.58kb.
- Міністерство освіти І науки, молоді та спорту україни технічний коледж тернопільського, 361.4kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 139.07kb.
- Міністерство освіти І науки, молоді та спорту України двнз «Івано-Франківський коледж, 1070.95kb.
- Міністерство освіти І науки, молоді та спорту україни, 35.62kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 369.69kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 182.18kb.
- Міністерство освіти І науки, молоді та спорту україни інститут інноваційних технологій, 53.88kb.
Стислі теоретичні відомості
1. Кількісний аналіз. Гравіметричний метод. Задачі. Особливості методу.
Кількісним аналізом називають розділ аналітичної хімії, в якому визначають кількісний склад досліджуємих речовин. Кількісне визначення складу сировини, напівфабрикатів та готової продукції – обов’язкова складова частина контролю виробничих процесів харчової промисловості.
Виконуючи кількісний аналіз зразка, потрібно знати його якісний склад. В залежності від цього вибирають той чи інший спосіб кількісного визначення окремих складових частин. При кількісному визначенні у більшості випадків використовують ті самі хімічні реакції, що і при якісному аналізі. Наприклад, знаючи масу отриманого осаду, можна визначити кількість іонів у розчині. Такий метод кількісного визначення називають гравіметричним (ваговим) аналізом.
Мірою кількості речовини у гравіметричному аналізі є наважка. Тому слід уміти правильно її розраховувати при визначенні вологості сировини або готового виробу, % кристалічної води у кристалогідраті мідного купоросу або хлориду барію при визначенні складової частини речовини шляхом переведення її в важкорозчинні сполуку у вигляді кристалічного або аморфного осаду.
Необхідно пам’ятати оптимальну масу аморфного осаду та кристалічного, тільки після цього можна буде провести необхідні розрахунки. Для аморфного осаду оптимальна маса 0,1 – 0,3г, а для кристалічного 0,4 – 0,6г.
Ваговий аналіз є найбільш вивченим методом кількісного аналізу. Він відомий з того часу, як виникла аналітична хімія, і є основним методом вивчення відносних атомних мас елементів. За допомогою цього аналізу встановленний хімічний склад більшості речовин, ним користуються для встановлення чистоти речовин. Ваговий метод аналізу має ряд недоліків, головний із них – велика затрата часу на виконання визначення.
Суть вагового аналізу полягає в тому, що складову частину речовини, яку визначають, відокремлюють осаджуванням у вигляді важкорозчинної сполуки відомого сталого складу і потім зважують.
Щоб визначити той чи інший іон ваговим методом, необхідно, щоб осад, який утворюється, відповідав таким вимогам:
- осад має бути практично нерозчинним, тобто після осадження в розчині іона, що визначають, повинно бути менше, ніж можна зважити на аналітичних терезах. Чутливість аналітичних терезів становить 0,0001г (110-4 г). Коли розчинність осаду буде менше від 110-4 г, то втрати такої кількості речовин не впливатимуть на результати вагового визначення;
- склад осаду після висушування або прожарювання має відповідати певній формулі;
- розмір зерна осаду повинен бути більшим, ніж пори фільтра, тобто осад повинен добре відокремлюватись від розчину фільтрування;
- відносна молекулярна маса вагоаої форми осаду повинна бути по можливості великою, щоб похибка визначення як найменше впливала на результати.
У гравіметричному аналізі умови осадження визначаються такими факторами:
- Кількість речовини. Кількість речовини, яку беруть для анализу, повинна забеспечити достатню точність зважування проби і вагової форми осаду. Установлено, що при аналізі певних сполук для визначення основного компонента рекомендується брати 0,01 еквівалентної маси речовини для кристалічних і 0,005 еквівалентної маси речовини для аморфних осадів. Отже, наважка залежно від величини еквівалентної маси досліджуваної речовини повинна бути 0,1 - 1,0 г. Для визначення мікрокомпонентів беруть наважки від 10 до 100г.
- Вибір осаджувача і його концентрація. Найкращим осаджувачем є такий, який утворює з іоном, що визначають, найменш розчинну сполуку, не утворює нерозчинних сполук з іншими іонами, присутніми у розчині. Однак специфічності реакції важко добитися тільки вибором осаджувача, її досягають певними умовами проведення реакції – створенням певної кислотності розчину, введеням комплектоутворювачів тощо.
На практиці осаджувача беруть в 1,5 раза більше, ніж потрібно за стехіометричним рівнянням. Внаслядок впливу однойменного іона надлишок осаджувача зменшує розчинність осаду.
- Концентрація водневих іонів. Найчастіше в аналізі застосовують осаджувачі, які являють собою солі слабких кислот (оксалати, фосфати), або слабкі кислоти (сірководень). Вміст аніонів цих осаджувачів залежить від вмісту іоінів водню в досліджуваному розчині. Розчинність відповідних осадів (фосфатфі, сульфідів) значно збільшується при збільшенні вмісту водневих іонів. Концентрація іонів водню повинна бути такою, щоб забеспечувалася достатня концентрація іона осаджувача для практично повного осадження іона, що визначається.
- Концентрація розчинів під час осадження. Для осадження кристалічних осадів користуються розведеними розчинами. У цих умовах осади утворюються у формі більших кристалів (менше забруднюються). Аморфні осади (особливо гідроксиди металів) осаджують із концентрованих розчинів. Цим досягається зменшення загальної поверхні осаду, а тому і зменшення адсорбції сторонніх іонів.
- Температура. При осадженні аморфних осадів нагрівання сприяє коагуляції колоїдних чапстинок і збвльшенню частин осаду. Осадження кристалічних осадів з гарячих розчинів сприяє збільшенню їх розчинності, внаслідок чого виникає менше центрів кристалізації і утворюються крупні кристали.
3. Типи вагових визначень.
У гравіметричному методі використовуються три типи вагових визначень:
- Визначення вилучаємої складової частини аналізуємої речовини (вологості). Розрахунок розміру наважки ведеться виходячи з очікуємого % вологості.
- Визначення видаленої складової частини аналізуємої речовини (зольності). Розрахунок розміру наважки ведеться виходячи з очікуємого % золи.
- Визначення складової частини аналізуємої речовини шляхом переведення її в осад. Розрахунок розміру наважки ведеться виходячи з оптимальної маси отриманого осаду.
4. Операції гравіметричного методу.
Відокремлення осаду.
- Відстоювання. Після осадження осад доцільно залишити стояти під шаром маточного розчину. При відстоюванні відбувається повніше осадження. Але іноді при цьому забруднюється осад (відбувається процес після осадження). Кристалічні осади залишають стояти з маточним розчином на 0,5 – 24 години. Для аморфних осадів відстоювання не обов’язково.
- Фільтрування. Осад відокремлюють від маточного розчину фільтруванням через беззольні фільтри.
- Промивання. Щоб видалити домішки, осад часто примивають гарячою водою (якщо розчинність осаду менша за практично допустиму), а краще промивати розведенним розчином відповідного електроліту (усувається пептизація). При промиванні слід витрачати як найменше промивної рідини.
- Переосадження. Коли потрібно мати осад дуже високої чистоти, застосовують переосадження. Для цього осад розчиняють у кислоті або переводять в осад іншим способом і повторюють осадження.
Переведення осаду у вагову форму.
Осад перед зважуванням переводять у сполуку певного складу – вагову форму. Склад вагової форми залежить від характеру осаду.
Важкорозчинні осади цілком певного складу іноді можна зважувати одразу після висушування, бо склад осаду збігається з хімічним складом вагової форми.
Якщо ж склад важкорозчинної сполуки не відповідає певній хімічній формулі, то вагова форма утворюється після прожарювання осаду.
- Висушування осадів без нагрівання. Переведення деяких осадів у вагову форму зводиться до видалення води, що залишилась після промивання осаду. Для цього осад фільтрують за допомогою вакууму через фільтруючий тигель, промивають спиртом, ефіром.
- Висушування осаду при слабкому нагріванні. Воду видаляються із осаду висушування при температурі 100 – 1100С. При цьому, як і при висушуванні без нагрівання, маса висушеного осаду більша за масу речовини, що утворюється при прожарюванні, і тому визначна помилка при зважуванні менша.
- Прожарювання осадів. Прожарювання – найбільш універсальний засіб утворення вагової форми. Осад прожарюють до сталої маси; тигель з осадом прожарюють 20 – 30 хвилин і після охолодження зважують, потім знову прожарюють 15 – 20 хвилин і зважують. Сталості маси достигнуто, якщо маса при повторному зважуванні змінилася не більше як на 0,0002 – 0,0003 г. Температура і час прожарювання залежать від складу і властивостей осаду.
Осади, хімічний склад яких збігається із складом вагової форми, прожарюють при невисокій температурі (300 – 6000С). При високій температурі може відбутися термічний розклад (ВаSО4 ВаО + SО3). Коли склад вагової форми відрізняється від складу осаду, осад треба прожарювати при температурі 1000 – 11000С. Це стосується насамперед гідроксидів заліза (ІІІ),алюмінію, магнію, амонію, фосфату та ін.
При прожарюванні, крем термічної дисоціації, можуть відбуватись і інші побічні процеси (Fe2O3 може відновлюватися до FeO). Це треба пам’ятати і застосовувати спеціальні заходи, щоб уникнути побічних процісів. Крім цього, причиною неправильних результатів аналізу може бути гігроскопічність осадів після прожарювання. Тому перед зважуванням тиглі з осадами вміщують для охолодження в ексикатори.
Зважування – одна із головних операцій кількісного аналізу. Тому необхіднео добре ознайомитись із принципом дії, будовою аналітичних терезів і технікою зважування.
5. Обчислення у гравіметричному аналізі.
Завданням кількісного аналізу є визначення масової частки елементу у пробі, яку обчислюють, виходячи із маси наважки і вагової форми осаду. Розглянемо приклад обчислення масової частки магнію у сплаві з алюмінієм, виходячи із таких даних: наважка сплаву 2,0270 г; склад вагової форми Мg2P2O7, маса вагової форми – 0,2855 г.
Спочатку обчислюємо масу магнію, що містить у дифосфаті магнію масою 0,2855 г. Складаємо пропорцію:
Мg2P2O7 – 2 Мg
222,59 г – 48,64 г
0,2855 г – х
звідки х =
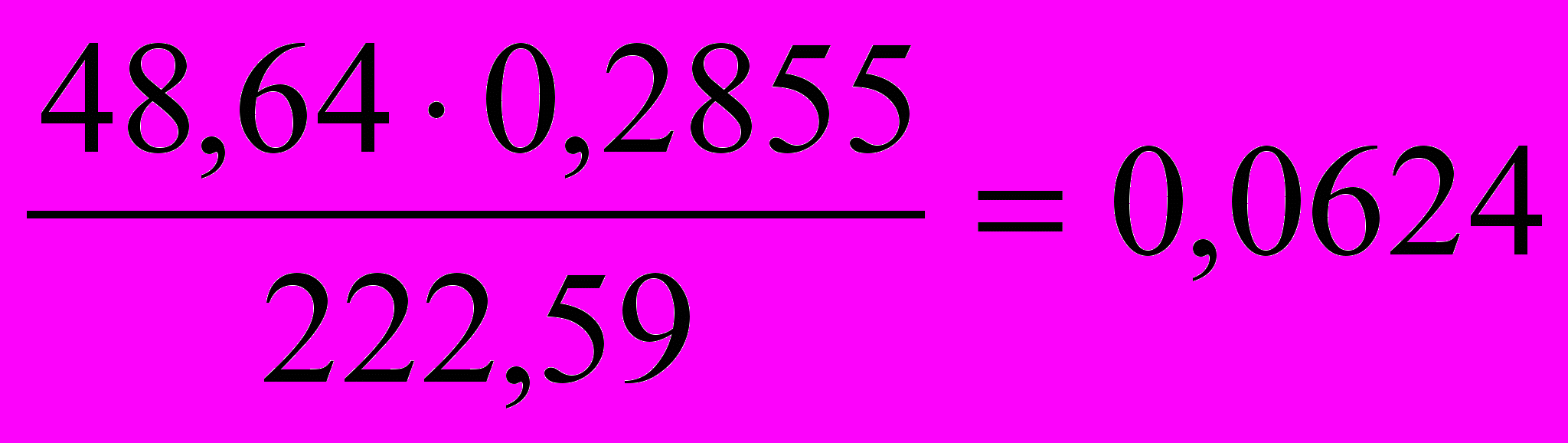 г
где 222,59 – відносна молекулярна маса дифосфату магнію;
48,64 – подвоєна відносна атомна маса магнію.
Обчислюємо масову частку магнію в наважці:
2,0270 г – 100%
х – Х %
Х =
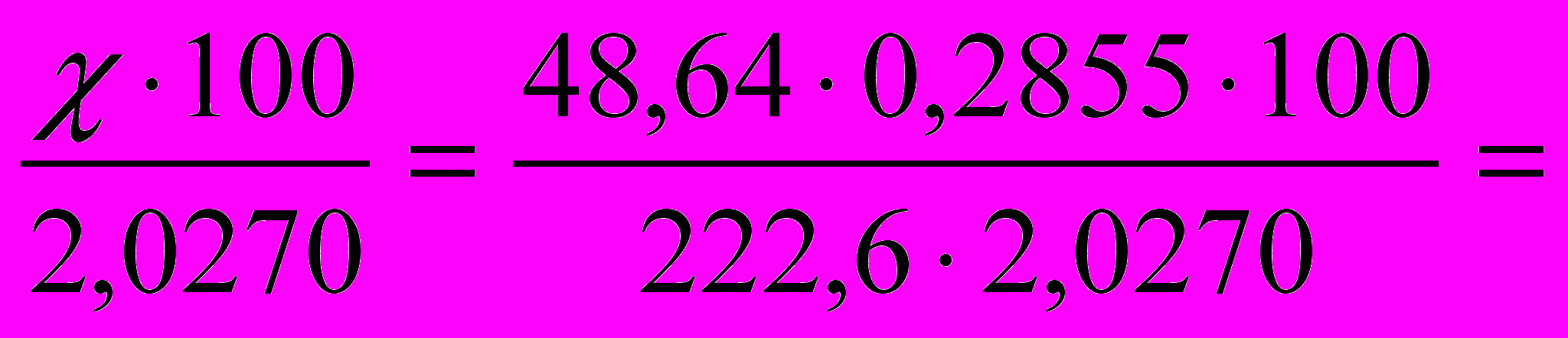 3,0777%
3,0777%У загальній формі рівняння для обчислення масової частки магнію має такий вигляд:
Х =
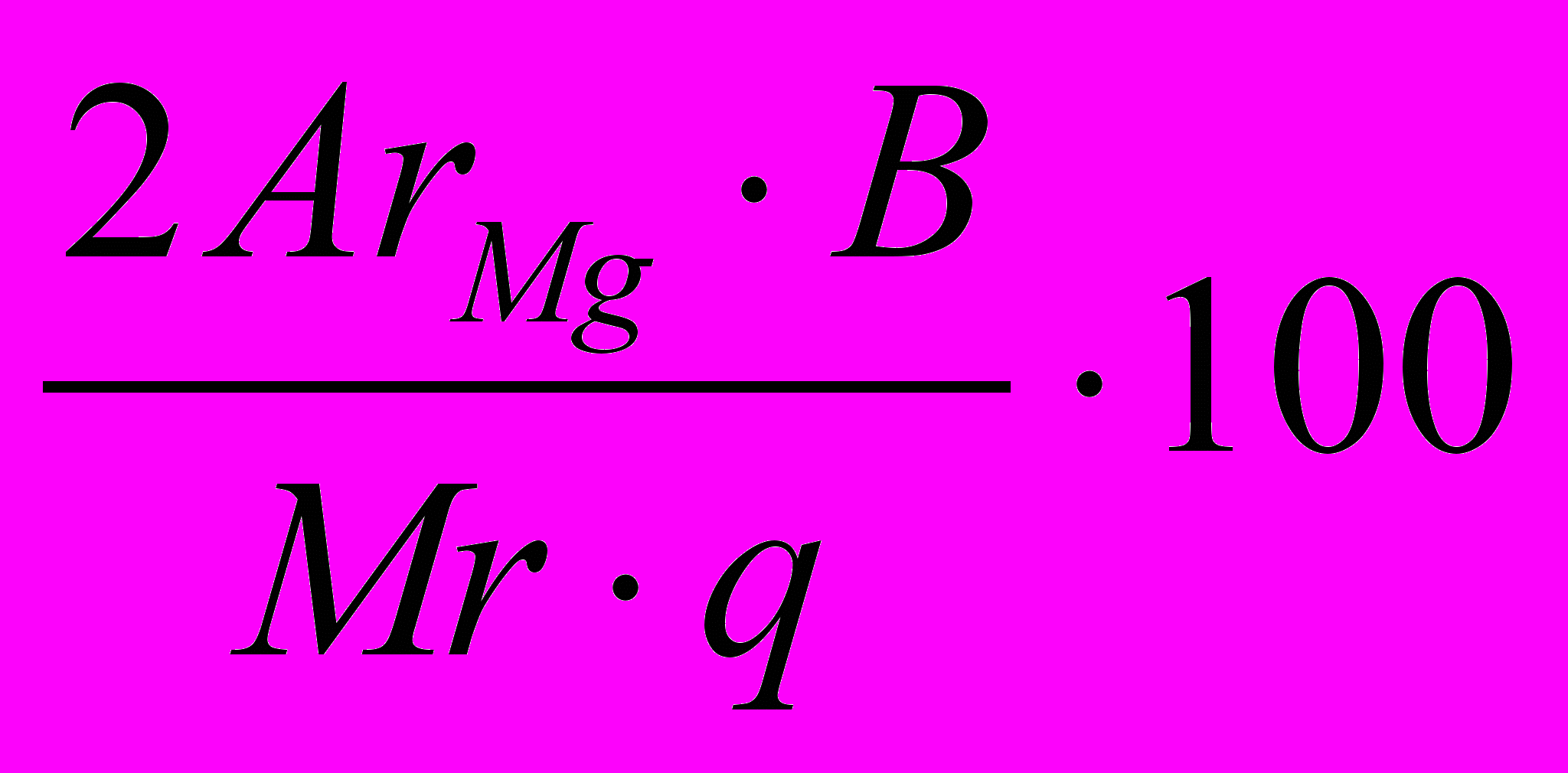 %
%де АrMg – відносна атомна маса магнію, тобто елемента, масову частку якого визначають;
Мr – відносна молекулярна маса вагової форми осаду;
В – маса осаду вагової форми в грамах;
q – наважка в грамах.
Для прискорення розрахунків відношення
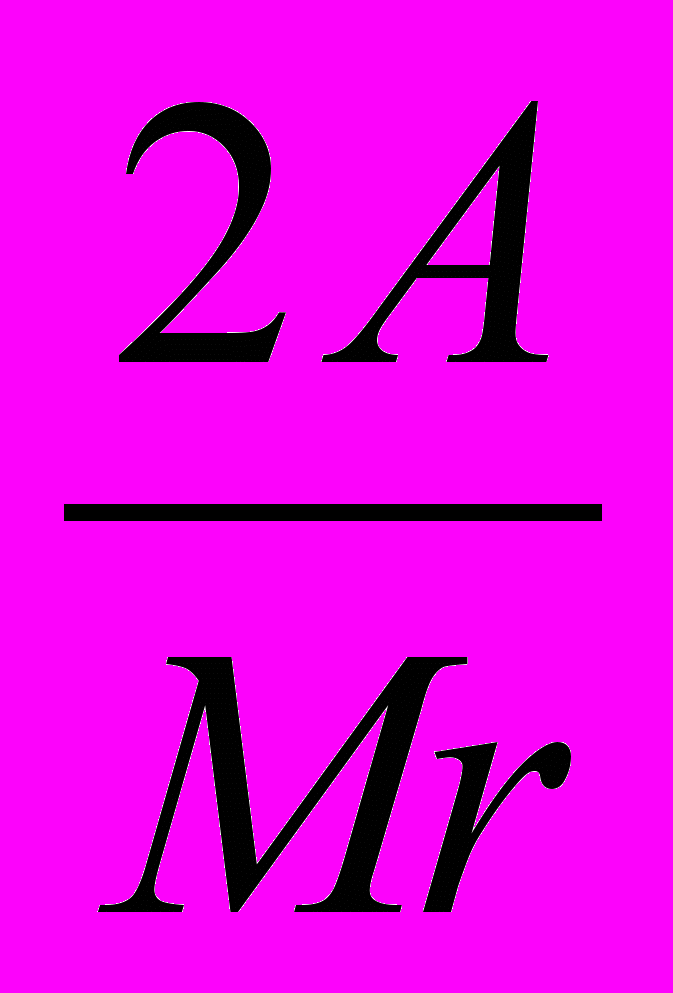 обчислюють зазделегіть; це відношення називається фактором перерахунку.
обчислюють зазделегіть; це відношення називається фактором перерахунку.В гравіметричному методі розрізняють три типа вагових визначень.
До першого типу відноситься визначення вологості. Вологість визначається за формулою:
W =
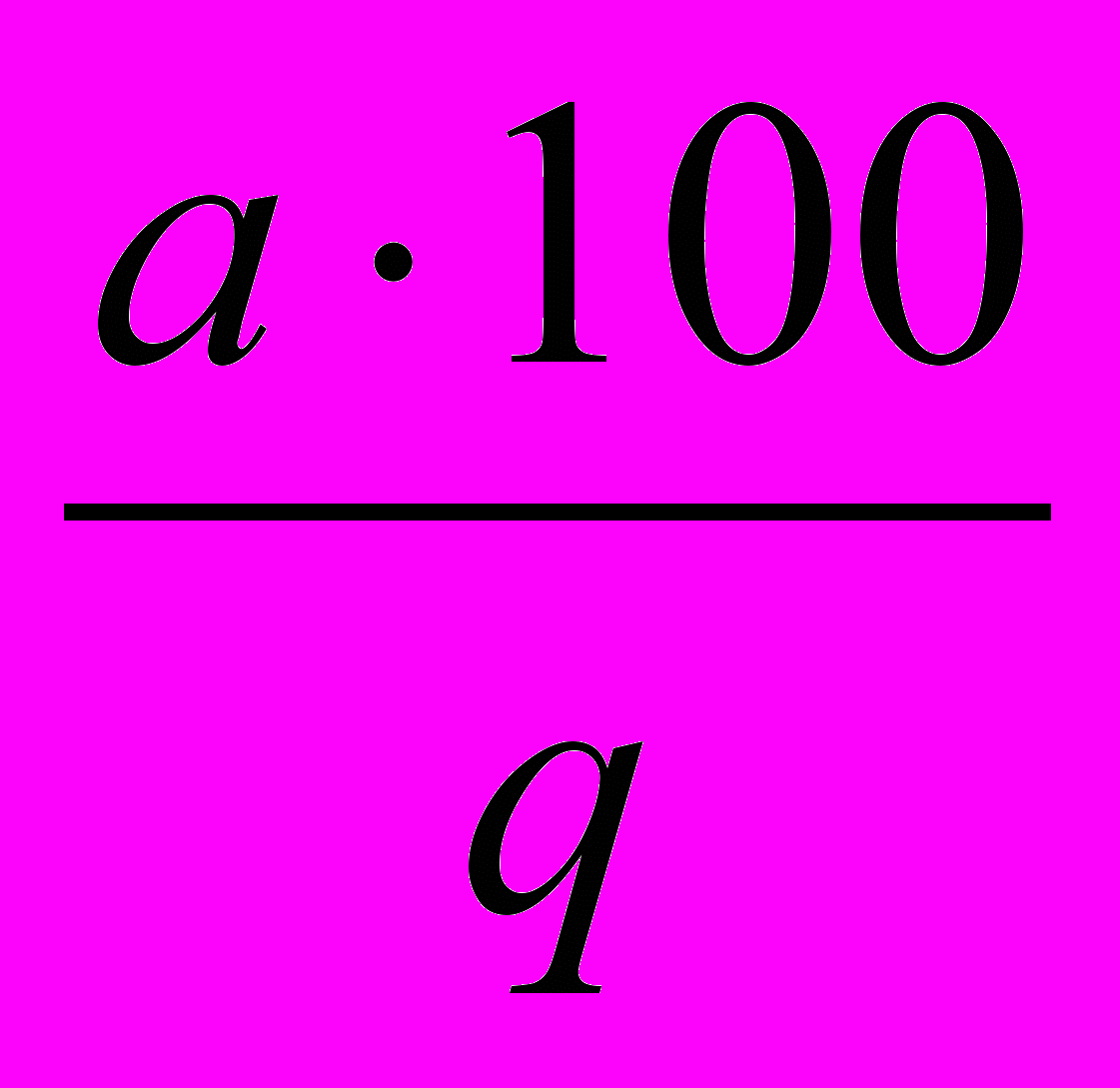 , %
, %де а – кількість усувної вологості;
q – наважка.
До другого типу відноситься визначення зольності:
Х =
 , %
, %де в – маса золи;
q – наважка.
До третього типу вагових визначень відноситься визначення % - складу речовини. % склад визначається за формулою:
% А =
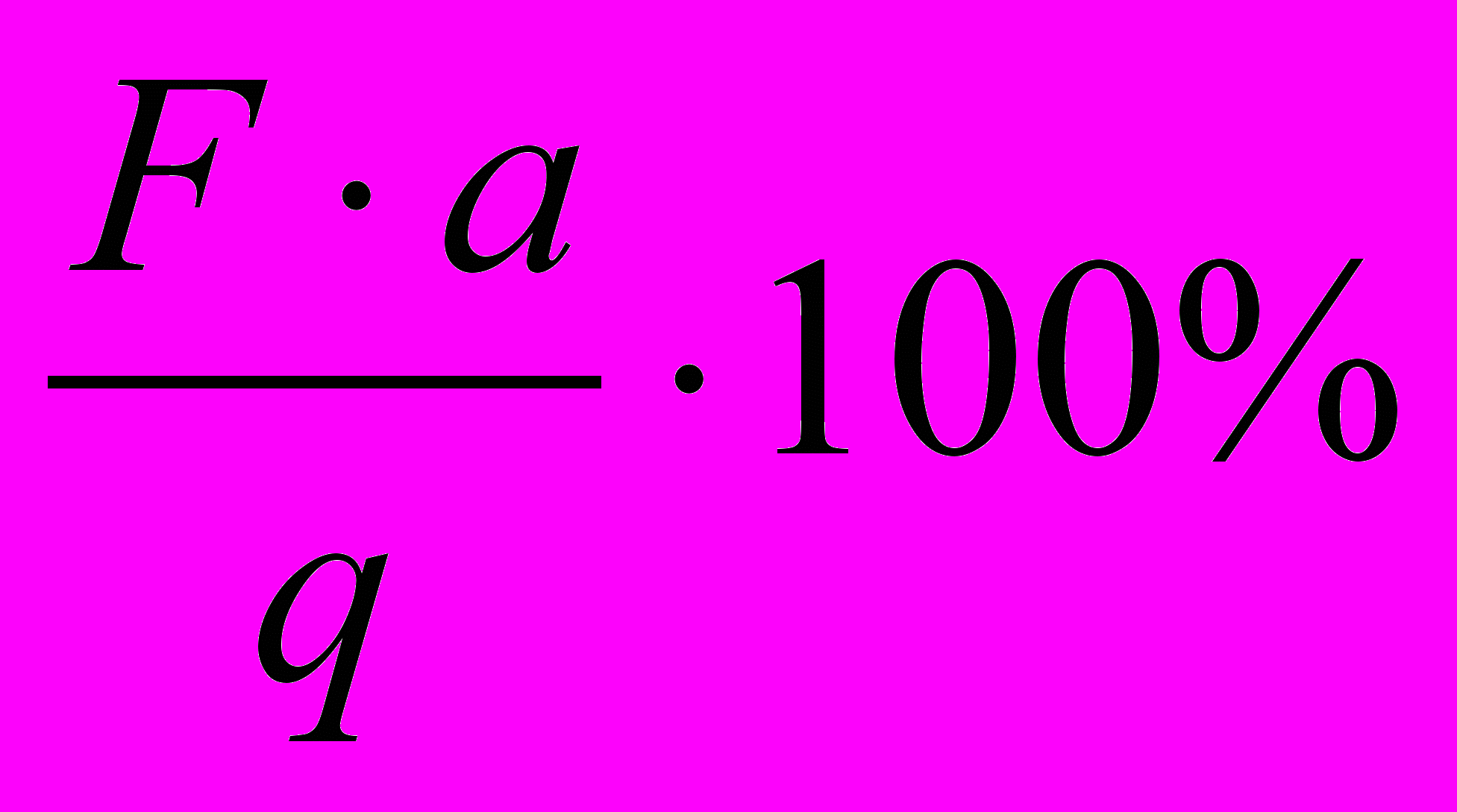
де % А - % склад речовини;
а – маса осаду;
q – наважка.
Завдання для виконання самостійної роботи
Відповісти на запитання:
- Назовіть основні операції гравіметричного аналізу.
- Що таке вагова форма і які вимоги до неї?
- Як впливають на повнуту осадження: температура розчину, кількість осадника, присутність сторонніх електролітів?
- Як залежить розчинність осаду від розміра його часток?
- Чому осадження сульфату барію відбувається: із розбавлених розчинів, у кислому середовищі, при нагріванні розчинів, у присутності солей амонію?
- Які умови осадження аморфних осадів? Чому їх осадження проводять із концентрованих розчинів?
- Як впливає кількість промивної рідини та кратність промивання на ефективність промивання?
- У чому сутність метода декантації?
- Що таке фактор переліку та яке його фізичне значення?
- Вкажіть переваги і недоліки гравіметричного аналізу.
Розв’язати задачі:
1. Обчислити масову частку сірки у природному гіпсі, виходячи із таких даних: наважка гіпсу 0,5025 г, склад вагової форми ВаSO4, маса вагової форми 0,6375 г.
2. Обчислити масову частку оксиду алюмінію у бокситі, якщо для аналізу взяли наважку 0,3115 г, осадили алюміній у вигляді гідроксиду після відокремлення всіх інших компонентів. Після прожарювання добули 0,2213 г оксиду алюмінію.
3. Для аналізу торфу взяли наважку 1,6340 г. Прокалив її до постійної маси, одержали 0,4102 г золи. Яка зольність зразка?
4. Визначити фактор перерахунку алюмінію у оксиді алюмінію.
5. Для аналізу зразка хлориду барію взяли наважку 0,6878 г. З неї вилучили прокалений осад ВаSO4 0,6556 г. Визначити %-ий склад барію в зразку.
6. Яку наважку торфу потрібно взяти для аналізу на вологість, якщо очікуємо вологість близько 15%?
7. Визначити фактор перерахунку барію у сульфаті барію.
8. Визначити фактор перерахунку калію у сульфаті калію.
САМОСТІЙНА РОБОТА № 3.
Тема: Титриметричний метод аналізу.
Повинні знати: сутність методу його особливості вимоги до реакцій в об’ємному аналізі Основний закон титриметричного аналізу Способи вираження титру розчину
Повинні вміти: пояснити принцип класифікації титриметричного аналізу визначати момент еквівалентності Приготувати титранти різними способами виконувати всі необхідні розрахунки з використанням електронно-обчислювальної техніки
План:
1. Сутність титриметричного аналізу.
2. Розчини у титриметричному аналізі.
3. Приготування стандартних розчинів.
4. Приготування стандартизованих розчинів.
