Н. В. Яблокова химия-11 Учебное пособие
| Вид материала | Учебное пособие |
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.
- Д. Д. Яблокова (1896-1993) Карпов, 153.37kb.
- Учебное пособие г. Йошкар Ола, 2007 Учебное пособие состоит из двух частей: «Книга, 56.21kb.
НИЖЕГОРОДСКИЙ ИНСТИТУТ РАЗВИТИЯ ОБРАЗОВАНИЯ
В.А. Яблоков, Т.П. Монич, Н.В. Яблокова
ХИМИЯ-11
Учебное пособие
Нижний Новгород
2007
УДК 373.167.1
ББК 24 я 72
Я 13
Р е ц е н з е н т ы:
Д.Ф. Гришин, член-корр. РАН, докт. хим. наук, профессор
Ю.А. Лебедев, член-корр. РАО, докт. фил. наук, профессор
Я 13 Яблоков В.А., Монич Т.П., Яблокова Н.В.
Химия - 9: Учебное пособие. – Н. Новгород:
Нижегородский гуманитарный центр,
Издание второе, переработанное, 2007. – с., илл.
ISBN 5-7565-0228-9
Условные обозначения:
*Задания повышенной сложности
**Материал для углубленного изучения
Учебное пособие построено на принципах системного анализа, позволяет легко понять сущность химических процессов и запомнить основные химические свойства вещества. Предназначено для учащихся и учителей общеобразовательных учреждений как естественного, так и гуманитарного направлений, а также для студентов вузов, готовящихся к педагогической деятельности
ББК 24 я 72
ISBN 5-7565-0228-9
ÓЯблоков В.А., Монич Т.П., Яблокова Н.В., 2007
ВВЕДЕНИЕ
Кто занимается научными исследованиями? Ответ на этот вопрос очевиден, конечно, ученые! Но вот кто эти люди, которые называются учеными? В любой области знаний ученые ищут истину, если под истиной понимать то, что они хотят узнать. На такие поиски уходят годы и десятилетия, а некоторые тайны раскрываются только усилиями многих поколений ученых. Обратите внимание на фразу «если под истиной понимать то, что они хотят узнать». А узнать им нужно, что же находится там, где природа прячет свои тайны. Познание это движение в неизвестное, без этого стремления наука не существует. В этом стремлении заключена та движущаяся сила, которая вызывает к жизни научную деятельность. Но это не означает, что нет других причин. Некоторые посвящают себя науке, стремясь проявить свои интеллектуальные возможности. Они честолюбивы и чувствуют свое интеллектуальное превосходство перед другими. Другие отдают свои силы и способности с холодным расчетом занять высокое положение в обществе. Для них наука служит тем ремеслом, которое позволяет иметь высокооплачиваемую работу. Кроме того, есть среди людей науки ученые, для которых, по выражению Лейбница, горячее желание увидеть «предустановленную гармонию» мира является насущной потребностью. «Душевное состояние, способствующее такому труду, подобно религии или влюбленности: ежедневное старание проистекает не из какого-то намерения или программы, а из непосредственной потребности», писал в одной из своих статей Альберт Эйнштейн.
Наконец, причиной, побуждающей заниматься наукой, может служить необходимость достижения практической цели. Например, чтобы сделать автомобиль, станок, прибор, нужно знать, как выплавляется чугун и получается сталь. Чтобы получить хорошие синтетические материалы, нужно знать механизм химических реакций полимеризации, а также какие химические вещества способны участвовать в этих реакциях и при каких условиях. Успешно бороться с теми или иными заболеваниями можно только при тщательном изучении причин, их вызывающих и наличии средств, препятствующих развитию болезни и способствующих выздоровлению.
Интересно ли заниматься научными исследованиями? Одним интересно, другим нет. Каждый имеет право выбора. Но никому не избежать попадания в проблемные ситуации. Проблемная ситуация не обязательно должна носить научный характер. Она может быть связана с взаимоотношениями людей, с решением повседневных вопросов и т. д. Вот как выдающийся русский театральный деятель, актер и режиссер Сергей Владимирович Образцов описывает воображаемую ситуацию, из которой видно различие между исследователем и прагматиком. Два молодых человека обедают. К одному из них попадает в суп муха. Прагматик выкидывает муху и доедает суп, ограничившись решением простой задачи без эмоций и особых размышлений. Другой поступает иначе, оказавшись в такой же ситуации. Он вытаскивает муху, кладет её на стол и, доедая суп, наблюдает, как бедная муха медленно ползет по столу, оставляя жирный след. Затем она поднимает задние ножки и тщательно протирает крылышки, брюшко и спинку. То же самое она повторяет передними ножками, умываясь, как умываются лапками кошки, и улетает. Исследователю это было интересно узнать, а прагматику даже в голову не приходило нечто подобное. В этом их различие. Каждый по-своему решает те задачи, которые перед ним возникают.
В 11 классе мы завершаем курс химии, начатый в 8 -10 классах.
ТЕМА 1. РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ ОБ АТОМЕ
- Взгляды древних греков на химические
элементы
Совершим небольшой экскурс в историю химии, чтобы разобраться в цепи важнейших химических идей, открытий и теорий.
Философы древней Греции считали, что элементы мироздания можно установить умозрительно, то есть силой ума, воображения. В силу этого обстоятельства они, вероятно, стали первыми специалистами в научной области, которая сегодня называется химической теорией. Какова истинная природа вещества? На этот вопрос греческие философы (греч. phileo люблю, sofia мудрость) отвечали по-разному. Фалес (625547 до н. э.) родоначальник античной и европейской философии и науки считал, что первоначалом многообразия явлений и вещей является вода. Без воды невозможна жизнь. Существование некоего первоначала сейчас бы мы сказали элемента признавалось, но спорным оставался вопрос о том, что такое элемент. Древние греки не употребляли слово «элемент», но это очень важное понятие, и мы будем его использовать вместо «первоначала», о котором они говорили. Древнегреческий философ Анаксимен (585525 до н.э.) пришел к выводу, что таким элементом является воздух. По его мнению, воздух путем сгущения образует все вещи. Иначе подошел к этому вопросу Гераклит (род. ок. 544 до н.э.). Первоначалом он считал огонь. Путем сгущения из огня все появляется, а путем разложения в него возвращается. Но почему должно быть только одно первоначало? Почему не могут существовать несколько первоначал или элементов? Вероятно, такие размышления привели древнегреческого философа Эмпедокла (490430 до н.э.) к заключению о четырех элементах, из которых в разной пропорции образуются все вещи. Четвертым элементом помимо воды, воздуха и огня у Эмпедокла стала земля.
Представления о четырех первоначалахэлементах разделял величайший древнегреческий философ Аристотель (384322 до н.э.). Он сделал важный шаг: каждый элемент Аристотель характеризовал определенным природным набором свойств (рис. 1) и добавил к ним еще один элемент. По мнению Аристотеля свойства небесных тел отличаются от свойств веществ земного происхождения. Небесные тела вращаются вокруг Земли и никогда не изменяются. Совершенство, сияние и неизменность небесных тел связана с тем, что они состоят из «пятого элемента» эфира. Латинское quinta essentia эфир или квинтэссенция. Понятием «квинтэссенция» мы пользуемся до сих пор, когда хотим подчеркнуть, что суть вопроса («квинтэссенция») выражена в немногих словах ясно и понятно.
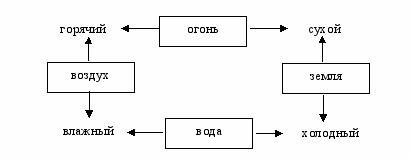
Рис. 1. Четыре первоначала-элемента и их свойства: огонь горячий и сухой; воздух горячий влажный; вода холодная и влажная; земля холодная и сухая
На Земле существуют четыре менее совершенных элемента, чем пятый элемент в небесной сфере. Огонь поднимается, потому что он горячий и сухой, земля падает, потому что она сухая и холодная. По мнению Аристотеля, все, что существует, представляет собой материю. Например, медь материя, которая может быть представлена в различных формах, например, в форме шара.
1.2. Поиск простых веществ. Количественные измерения Роберта Бойля
Как установить, является ли химическое вещество простым элементом? Впервые метод, позволявший отличить простое вещество от сложного, предложил английских химик и философ Роберт Бойль (16271691).
Бойль принадлежал к числу сторонников атомистических взглядов и признавал положение Демокрита о существовании неделимых частицатомов. В своем труде «Происхождение форм и качеств согласно корпускулярной философии», опубликованном в 1666 г., он высказывался по этому поводу следующим образом:
«В мире имеется великое множество частиц материи, каждая из которых слишком мала, чтобы, взятая отдельно, быть доступной для ощущения. Будучи целой и неделимой, такая частица непременно должна иметь определенную форму и быть очень твердой, столь незначительной и твердой, что природа едва ли способна когда-либо разделить её, и в этом смысле подобные частицы могут быть названы minima или prima naturalia. Имеется также множество корпускул, которые составлены путем объединения нескольких minima naturalia».
Переведите понятия «minima» или «prima naturalia» как «атом», а понятие «корпускулы» переведите как молекулы, построенные из атомов. Текст, приведенный выше, приобретает смысл, который соответствует современному взгляду на атомы и молекулы.
** Бойлю принадлежит заслуга введения количественных измерений в физике и химии. Исследования газов привели его к открытию в 1660 г. закона изменения объема воздуха с изменением давления. Для этого в длинную U-образную трубку, один конец которой был запаян (рис. 2), добавлялась ртуть.
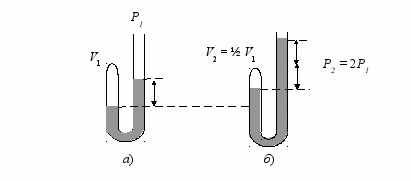
Рис. 2. Схема опыта Бойля: а) запаянное колено сосуда содержит объем воздуха (V1) при давлении Р1; б) запаянное колено сосуда содержит объем воздуха (V2) при вдвое большем давлении (Р2)
В ходе опытов было установлено, что объем данной массы воздуха обратно пропорционален давлению (1662 г.). Например, когда в длинный конец открытой трубки добавлялась ртуть, увеличивающая давление вдвое, объем воздуха в запаянном конце трубки уменьшался также вдвое. Если давление увеличивалось втрое, объем уменьшался втрое. Бойль не указывал, что эта закономерность действительна при постоянной температуре. Возможно, он понимал это и считал само собой разумеющимся. Во Франции физик Эдм Мариотт (16301684) независимо от Бойля установил соотношение объема воздуха и давления в 1676 г. При этом он особо подчеркивал, что такая зависимость объема от давления наблюдается только при постоянной температуре. По этой причине установленный учеными закон обратной зависимости объема газов от давления часто называют законом Бойля-Мариотта:
V ~ 1/Р или
PV = const при Т = const
При сопоставлении объемов и давлений одного и того же газа при одной температуре закон, которому подчиняется газ, можно выразить уравнением:
P1V1 = P2V2 ,
где Р1 и Р2 – давление, а V1 и V2 – объем газа в состояниях 1 и 2 соответственно.
Этот закон сыграл впоследствии значительную роль в установлении точных значений атомных масс.
Другая важная заслуга Бойля состояла в том, что он дал способ, позволяющий отличить элемент от сложного соединения, состоящего из элементов. Правда, нельзя было быть уверенным, что в будущем не найдется способа доказать, что вещество, которое до этого считалось элементом, является сложным соединением. Такая вероятность в методе Бойля всегда существовала. Но подход, предложенный Бойлем, давал реальную возможность приблизиться к истине, и был, в конечном счете, принят учеными.
1.3. Первые точно установленные химические элементы. Закон сохранения массы
Древним были известны семь металлов: золото, серебро, медь, железо, олово, свинец, ртуть, а также два неметалла углерод и сера. В средние века алхимики выделили мышьяк, сурьму, висмут и цинк. Было совсем не очевидно, что выделенные металлы и неметаллы есть элементы. Еще господствовал взгляд о существовании всего четырех элементов-стихий Аристотеля, из которых построены все сложные вещества. На первый, не очень внимательный взгляд суждения об элементах-стихиях могли показаться наивными. Но это не так, догадки древних греков были весьма глубоки и отражали реальное состояние материи. Замените элементы-стихии воздух, воду, землю на три агрегатных состояния газ, жидкость, твердое тело, и вы получите современную картину состояний вещества. Элемент-стихия огонь с современных позиций есть энергия.
Французский химик Антуан Лавуазье (17431794) исследовал превращение элемента-стихии воды в элемент-стихию землю, считая, как и древние натурфилософы, что такое превращение одного элемента в другой происходит при нагревании. Основания так думать о химических превращениях были. Химики знали, что при длительном кипячении воды в стеклянном сосуде появляется твердый осадок. Этот результат мог означать, что вода превращается в землю. Лавуазье 101 день кипятил воду в закрытом стеклянном сосуде, сделанном так, что водяной пар конденсировался и возвращался обратно в колбу без потерь. Он тщательно взвешивал и сосуд, и воду до и после кипячения. Осадок при этом действительно появился, но ровно настолько уменьшалась масса самого сосуда, а масса воды не изменилась. Следовательно, вода не превращалась в землю даже в небольшом количестве. Происходило простое выщелачивание стекла. Этот опыт показал, что количественные измерения позволяют установить истинные причины явлений. Они не согласовывались с теорией четырех элементов-стихий Аристотеля.
Лавуазье убедился, что при нагревании металлов (олово, свинец) с воздухом в закрытых сосудах (ретортах) химическое превращение (металл покрывался окалиной) не приводило к изменению массы веществ. Вес закрытой реторты до и после реакции оставался неизменным. В то время уже было известно, что окалина весит больше, чем сам металл. Следовательно, масса воздуха в реторте должна уменьшиться. Так и происходило. Когда Лавуазье открыл реторту, туда устремился воздух.
В 1775 г. Лавуазье выступает с докладом в Академии наук с сообщением о том, что воздух не является простым веществом-элементом. В состав воздуха входит газ, который поддерживает горение и окисляет металлы. Лавуазье назвал его кислородом. Другой составной частью воздуха является газ, который не поддерживает ни горение, ни дыхание (позднее он был назван азотом). Этот факт был серьезным ударом по элементам-стихиям. Воздух не был элементом. Он имел сложный состав. Стали понятны опыты, выполненные Лавуазье еще в 1772 г. В этом году Лавуазье с коллегами-химиками купили в складчину алмаз. Лавуазье нагревал его в закрытом сосуде с воздухом до тех пор, пока алмаз не исчез. При этом образовался газ, который получался при сжигании угля. Это был углекислый газ.
Размышляя над результатами своих исследований, Лавуазье пришел к мысли, что если учитывать все вещества, участвующие в химической реакции, то суммы масс веществ будут оставаться постоянными до и после реакции. В «Элементарном курсе химии» он писал: «Следует принять в качестве неопровержимой аксиомы, что ни в одном из процессов, осуществляемых экспериментально или в природе, ничто не создается из ничего; до начала эксперимента и после него существует равное количество материи… . На этом принципе основано все искусство проведения химических экспериментов». Это положение, известное как закон сохранения массы, стало краеугольным камнем химии XIX века.
Размышления о природе и законах химических превращений не имеют границ. К одним и тем же выводам приходят ученые разных стран. Задолго до работ, выполненных Лавуазье, в России Ломоносов (17111765) в письме к выдающемуся математику Эйлеру писал в 1748 г.: «Все встречающиеся в природе изменения происходят так, что если к чему-либо нечто прибавилось, то это отнимется от чего-то другого. Так, сколько материи прибавляется какому-либо телу, столько же теряется у другого… . Так как это всеобщий закон природы, то он распространяется и на правила движения, тело столько же теряет от своего движения, столько сообщает другому, им двинутому». Проводя опыты по обжигу металлов в запаянных сосудах, он доказал в 1756 г., что масса сосуда до и после обжига не изменялась. К сожалению, труды Ломоносова были опубликованы на русском языке, и западноевропейские химики, включая Лавуазье, не могли с ними ознакомиться.
Этап таинственных элементов-стихий Аристотеля закончился торжеством точных измерений объемов, давлений газов и масс вещества. Начался этап экспериментальных исследований. Появляется первый учебник по химии в современном понимании этого слова. Это был упоминавшийся выше «Элементарный курс химии», опубликованный Лавуазье в 1789 г. В нем содержался перечень 33 известных к тому времени элементов или, вернее, веществ, которые Лавуазье, руководствуясь определением Бойля, считал элементами, т.е. веществами, неспособными делиться на более простые вещества.
Судьба Лавуазье была трагична. Его основным занятием, обеспечивавшим ему безбедное существование и возможность проводить исследования на свои деньги, было участие в акционерном обществе «Генеральный откуп» комиссии, которая до Великой французской революции собирала для правительства налоги с населения. Председатель революционного трибунала обвинил Лавуазье в связях с аристократами и заявил: «Республика не нуждается в химиках и ученых». Работа в этой организации стоила Лавуазье жизни, он был казнен на гильотине в 1794 г.
1.4. Имеют ли химические соединения постоянный состав?
Этот вопрос не был праздным в начале XIX века. Еще не было формул химических соединений. Химические вещества назывались по тем соединениям, которые входили в их состав. Триумф количественных измерений в химии продолжался после Лавуазье. Исследование состава неорганических соединений, таких как кислоты, соли, оксиды, щелочи, требовали ответа на вопрос: если какое-либо соединение состоит из двух или большего числа элементов, всегда ли соотношение этих элементов постоянно?
С помощью тщательных количественных анализов французский химик Жозеф Пруст (17541826) показал, что карбонат меди характеризуется определенным соотношением по массе меди, углерода и кислорода вне зависимости от способа получения этого соединения: на 5,3 части меди всегда приходилось 4 части кислорода и 1 часть углерода. Во всех других случаях наблюдалось выполнение правила, названного законом постоянства состава:
все соединения содержат элементы в строго определенных пропорциях вне зависимости от условий получения этих соединений.
1.5. Создание химической атомистики
Решающий шаг в утверждении атомистической теории сделал английский химик Д. Дальтон (17661844).
Тогда считалось, что если вещество никакими химическими способами не удавалось больше разложить на вещества меньшей массы, достигалось состояние элементов. И это доказывалось взвешиванием. К элементам относили главным образом металлы и небольшое число неметаллов (сера и углерод). Дальтон писал, что химический анализ и синтез не идут дальше отделения частиц друг от друга и их обратного воссоединения. Другими словами, химики способны разрушить химическое соединение до атомов, но не более того.
Как измерить массы атомов? В 1803 г. Дальтону пришла в голову идея исходить при определении массы атомов химических элементов не из абсолютной, а из относительной массы атомов. Для этого следовало принять за единицу массу одного их них. Такой выбор он сделал, приняв за единицу массу атома водорода. Но как определить относительную массу атома, если неизвестна химическая формула?
Перед химиками стояла непреодолимая проблема: какие формулы химических соединений брать для вычисления относительных атомных масс? При наличии указанных выше трудностей все же, благодаря исследованиям Жозефа Пруста (17541826) было понятно, что природа дала соединению постоянный состав и, тем самым, поставила его в совершенно особое положение по сравнению с раствором, сплавом или смесью веществ.
Главное в работах Дальтона заключалось в выводе, что всякое химическое соединение состоит из большого числа одинаковых молекул, каждая из которых построена из одного и того же небольшого количества атомов, связанных между собой. Если будут установлены химические формулы соединений, то не составит труда установить относительные атомные массы химических элементов на основании закона кратных отношений. Этот закон Дальтона гласил: если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Появились первые химические формулы, обозначаемые начальными буквами названий химических элементов. Это было сделано по предложению шведского химика Й. Берцелиуса (17791848). Символика химических элементов и их соединений Берцелиуса стала современной символикой.
Основные положения химической атомистики Дальтона можно сформулировать следующим образом:
- Все вещества состоят из атомов.
- Атомы данного элемента одинаковы по массе и химическим свойствам.
- Атомы разных элементов различаются по массе и химическим свойствам.
- Атомы различных элементов могут соединяться в простых целочисленных отношениях.
- При разложении соединения получаются исходные атомы в неизменном виде.
1.6. Вычисление относительных атомных масс
химических элементов
Прошло немало лет, прежде чем было осуществлено точное вычисление относительных атомных масс химических элементов. Решающую роль в этом сыграли исследования Гей-Люссака и гипотеза Авогадро.
Французский химик и физик Ж. Гей-Люссак (17781850) провел в 1808 г. серию исследований с объемами реагирующих газов. Он обнаружил, что 2 объема водорода реагируют без остатка с 1 объемом кислорода. При этом образуется 2 объема водяного пара. Всегда с 1 объемом водорода реагирует 1 объем хлора с образованием 2 объемов хлороводорода. В опытах температура и давление газообразных веществ до и после реакции оставались неизменными, чтобы сравнивать объемы в одинаковых условиях.
Гей-Люссак был осторожным человеком, приверженцем идеи Бертолле о переменном составе химического соединения. Вероятно, по этой причине он не дал никаких комментариев к полученным им результатам.
В 1811 г. появилась работа итальянского физика Амедео Авогадро (17761856), который предположил, что равные объемы любых газов при одинаковой температуре и давлении содержат равное число молекул. Гипотеза Авогадро согласовывалась с опытами Гей-Люссака и давала основания утверждать, что такие газы, как водород, кислород, хлор представляют собой двухатомные молекулы (рис. 3).
Существование двухатомных молекул, состоящих из двух одинаковых атомов, никогда до этого не рассматривалось. Считалось, что между одинаковыми атомами должно быть отталкивание подобное тому, какое наблюдается между одинаковыми зарядами. Если однородные атомы соединяются в молекулы, то возникает вопрос: сколько атомов должно входить в такую молекулу? Сопоставление опытов Гей-Люссака с гипотезой Авогадро давало ответ на этот вопрос (рис. 3).
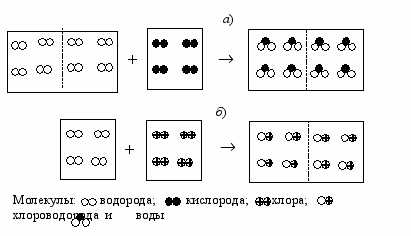
Рис. 3. Соответствие эксперимента и теории: а) 2 объема водорода и 1 объем кислорода образуют 2 объема газообразной воды (эксперимент); б) 1 объем водорода и 1 объем хлора образуют 2 объема хлороводорода (эксперимент). Реакции с таким соотношением объемов возможны только при условии, что в равных объемах газов содержится равное число молекул (теория) и исходные вещества двухатомные молекулы
На соответствие теории (гипотезы Авогадро) и эксперимента (опыты Гей-Люссака) впервые обратил внимание итальянский химик Станислао Канниццаро (18261910). Он сделал доклад на 1 Международном конгрессе химиков в Германии (1860 г.). Его строгий метод нахождения атомных масс был связан с использованием давно забытой работы Авогадро, которая была опубликована еще в 1811 г.
Канниццаро приводил следующие аргументы:
- Предположим, что атомная масса водорода равна 1, и газообразный водород состоит из двухатомных молекул Н2, как это следует из экспериментальных исследований Гей-Люссака.
- Допустим, что Авогадро сделал правильное предположение о двухатомном строении кислорода О2 и, следовательно, вода должна иметь молекулярную формулу Н2О, а не НО, как это предлагал Дальтон. Поскольку на 1 г водорода приходится 8 г. кислорода (соединительные массы) в молекуле воды, то атомная масса кислорода должна быть равна 16,0; а молекулярная масса 32,0.
- Если в равных объемах всех газов содержится одинаковое число молекул, то молекулярная масса М любого газа оказывается пропорциональной его плотности: М = kD. Для определения коэффициента пропорциональности k можно воспользоваться данными об Н2 и О2.
Предложенный Канниццаро логический ход рассуждений давал в руки исследователей метод определения атомных масс химических элементов и химических формул. Приведем пример вычисления относительной атомной массы углерода по экспериментальным значениям плотности газообразных химических соединений. Воспользуемся значениями k, вычисленными по плотности газа D и молекулярной массе M (табл. 1). Сколько бы соединений углерода не было проанализировано методом Канниццаро, масса углерода в расчете на 1 моль соединения всегда оказывалась равной 12, то же самое относилось и к другим элементам: масса хлора оказывалась равной 35,5, водорода 1 и т.д.
Т а б л и ц а 1
Определение коэффициента k по плотности и молекулярной массе водорода и кислорода
| Газ | Плотность D, г/л при 00С (273 К) | Молекулярная масса М, г/моль | Коэффициент k,* л/моль |
| Н2 | 0,0894 | 2,0 | 22,37 |
| О2 | 1,427 | 32,0 | 22,42 |
| Среднее значение | 22,4 | ||
