Н. В. Яблокова химия-11 Учебное пособие
| Вид материала | Учебное пособие |
СодержаниеПрактическая работа Обратите внимание |
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.
- Д. Д. Яблокова (1896-1993) Карпов, 153.37kb.
- Учебное пособие г. Йошкар Ола, 2007 Учебное пособие состоит из двух частей: «Книга, 56.21kb.
Решение
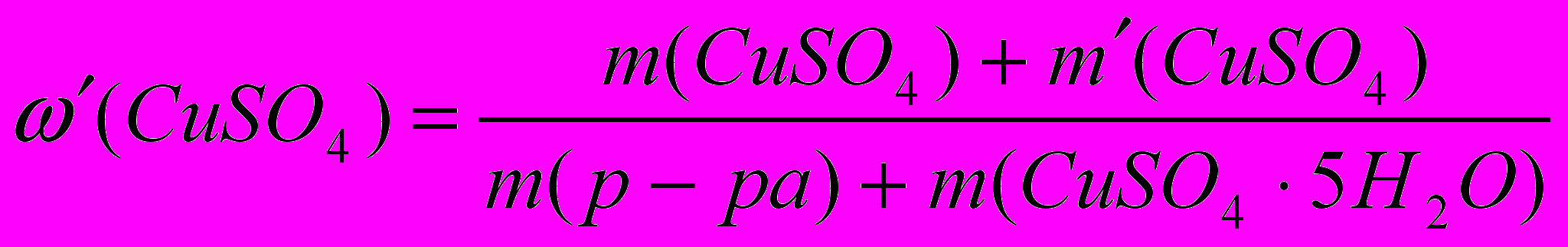 .
.Примем
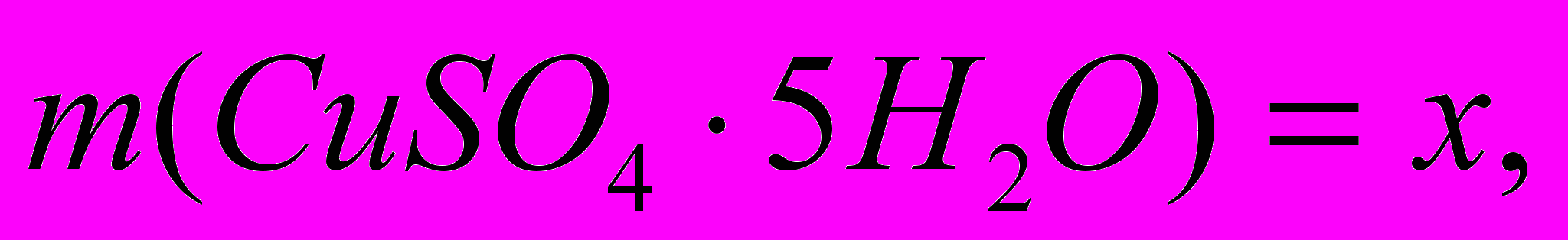 а
а 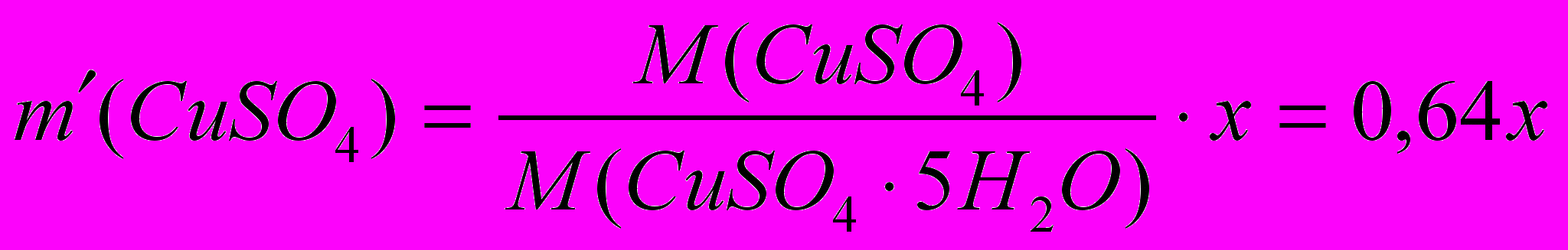 .
.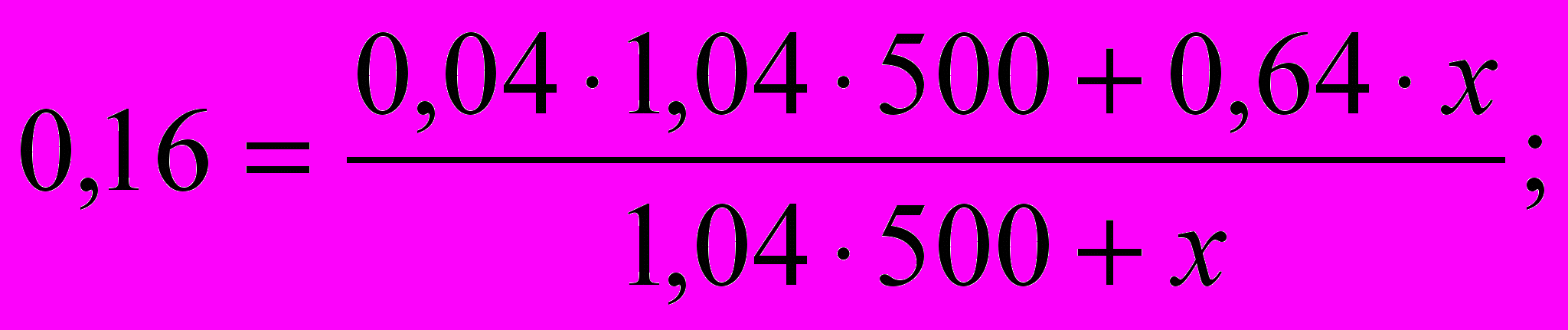 х = 130 г.
х = 130 г.Молярная доля вещества – это отношение количества вещества компонента n(X) к общему количеству вещества ni системы:
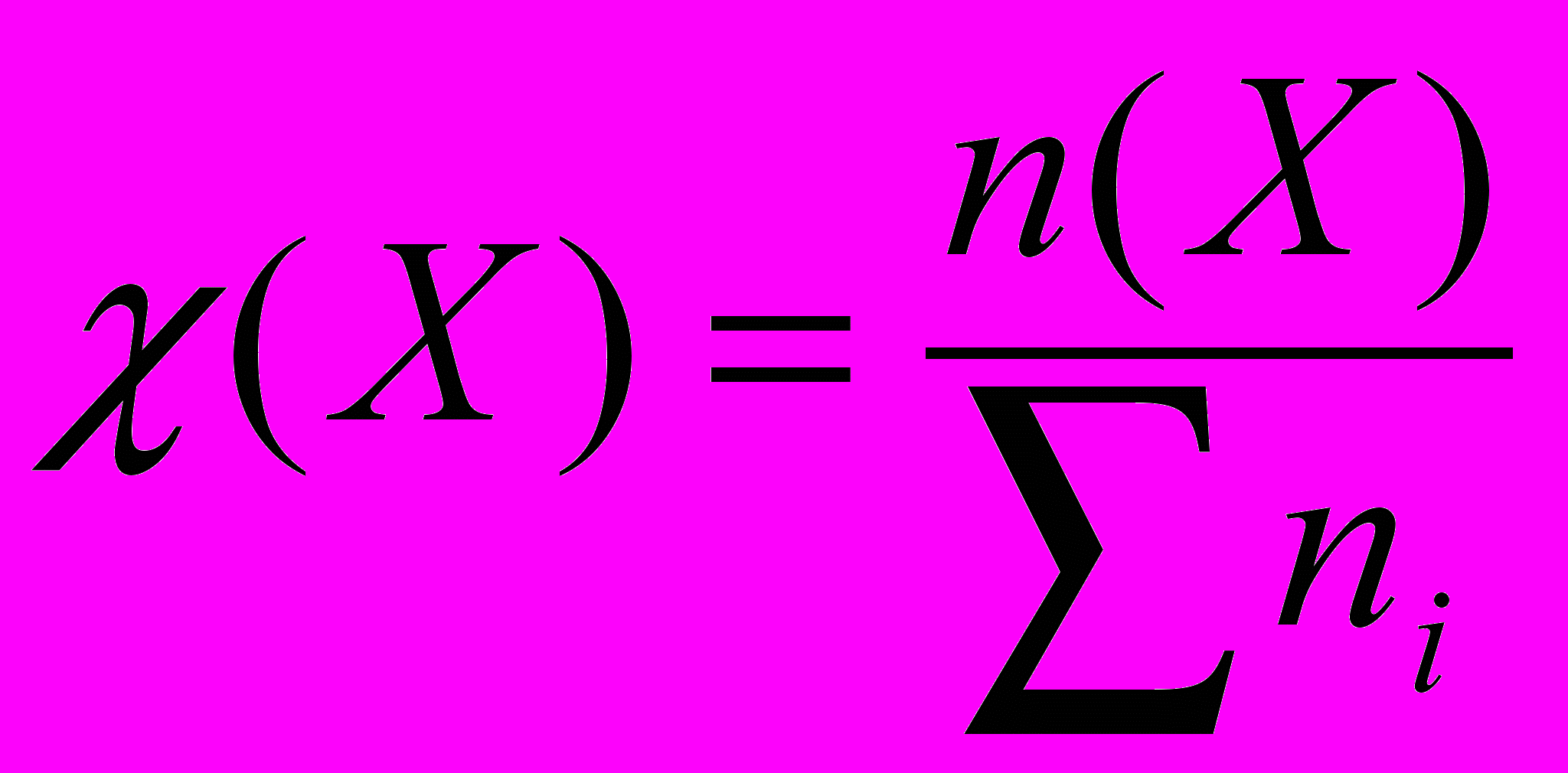 .
.Молярная концентрация вещества – это отношение количества вещества n(X), содержащегося в растворе, к объему этого раствора V.
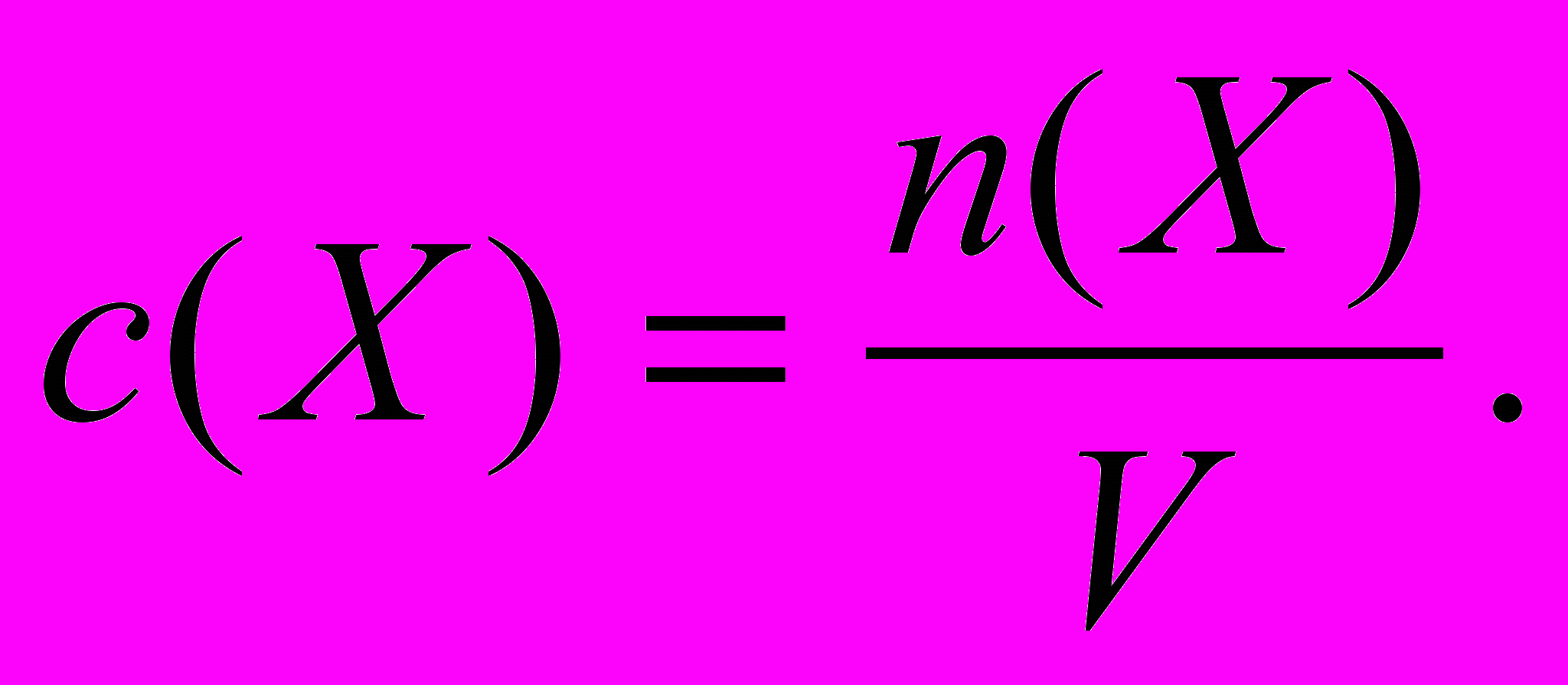 (моль/л, моль/м3)
(моль/л, моль/м3)Пример. Сколько граммов оксида фосфора Р2О5 следует взять для приготовления раствора Н3РО4 объемом 300 мл, молярная концентрация которого равна 0,2 моль/л?
Решение
n(H3PO4) = c . V = 0,2 моль/л . 0,3 л = 0,06 моль
Р2О5 + 3Н2О = 2H3PO4
0,03 моль 0,06 моль
М(Р2О5)=142 г/моль
m(Р2О5)= 142 г/моль 0,03 моль = 4,26 г
М
с = ..1000 / М и = с.М / 1000.
ежду молярной концентрацией вещества (с), массовой долей растворенного вещества() и плотностью раствора () существуют следующие соотношения:
Практическая работа
Приготовление растворов заданной концентрации
Предлагаемая практическая работа рассчитана на два урока, так как включает два способа приготовления растворов заданной концентрации.
Приготовление раствора с заданной массовой долей растворенного вещества
Задание. Приготовить 8% раствор карбоната натрия (рис. 44).
- Вычислите массу соли и воды для приготовления раствора. Масса раствора не указана, поэтому руководствуйтесь определением массовой доли (количество граммов растворенного вещества в 100 г раствора):

8 г Na2CO3
92 г H2O Na2CO3
8% р-р Na2CO3 Na2CO3
Рис. 44. Приготовление раствора с заданной массовой долей растворенного вещества (8%-ный водный раствор Na2CO3 )
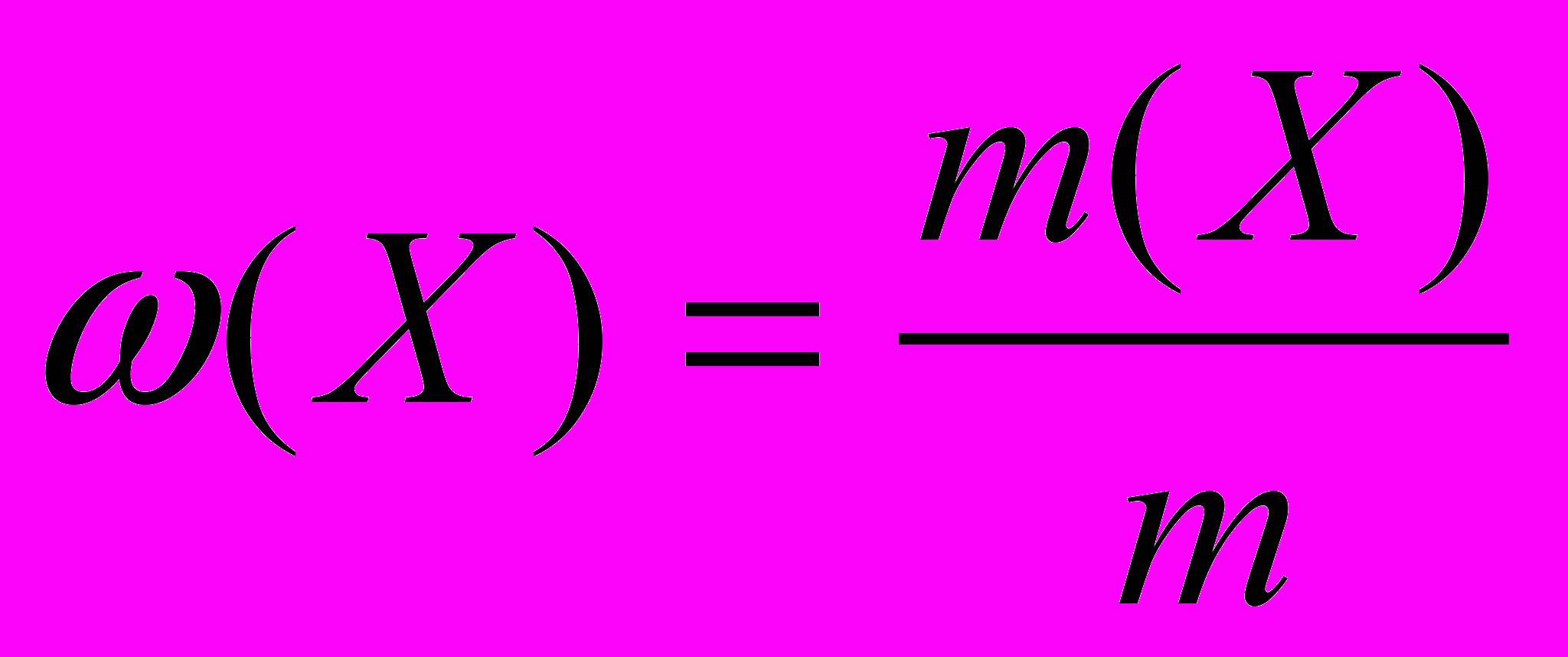
m(Na2СО3) = (Na2СО3) m(р-ра); m(Na2СО3) = 0,08 100 г = 8 г;
m(H2O) = m(р-ра) – m(Na2СО3); m(H2O) = 100 г – 8 г = 92 г.
- Взвесьте карбонат натрия. В мерный цилиндр налейте 92 мл воды (плотность воды вполне допустимо принять равной 1 г/мл.), в колбу пересыпьте взвешенную соль.
- Перелейте воду из мерного цилиндра в колбу, перемешайте содержимое колбы палочкой с резиновым наконечником до полного растворения соли.
- В отчете приведите выполненные вами расчеты, наблюдаемые при растворении явления и их объяснение, рисунок.
- Обратите внимание: для приготовления раствора с заданной массовой долей растворенного вещества необходимо рассчитать массу растворенного вещества и массу растворителя (воды).
Примеры заданий
1. Приготовьте 50 г водного раствора сахара с (С12Н22О11) 8%.
2. Приготовьте раствор сульфата меди с (CuSO4) 15%, исходя из кристаллогидрата CuSO4.5Н20. Ареометром определите плотность полученного раствора и вычислите его молярную концентрацию.
3. Растворимость хлорида натрия при 200С составляет 35,9 г в 100 г воды. Рассчитайте (NaCl) в насыщенном растворе и приготовьте 50 г насыщенного раствора поваренной соли.
4. Приготовьте 200 мл раствора гидроксида натрия с (NaOH) 20% ( = 1,22 г/мл).
Приготовление раствора заданной молярной концентрации


Р

 ис. 45. Приготовление раствора NaCl заданной (0,2 М) молярной концентрации
ис. 45. Приготовление раствора NaCl заданной (0,2 М) молярной концентрацииДля приготовления растворов используют мерные колбы различной емкости: 25, 50, 100, 200, 250, 500, 1000 мл и более (рис. 45). На колбе указана ее емкость и температура, при которой емкость соответствует указанной. В верхней части колба снабжена калибровочной меткой. На уровне метки должен находиться нижний край мениска жидкости.
При приготовлении растворов молярной концентрации количество воды не вычисляется. Объем раствора определяется емкостью мерной колбы.
Задание. Приготовить раствор хлорида натрия, молярная концентрация которого с =0,2 моль/л (0,2М NaCl).
- Рассчитайте массу растворенного вещества, исходя по формуле:
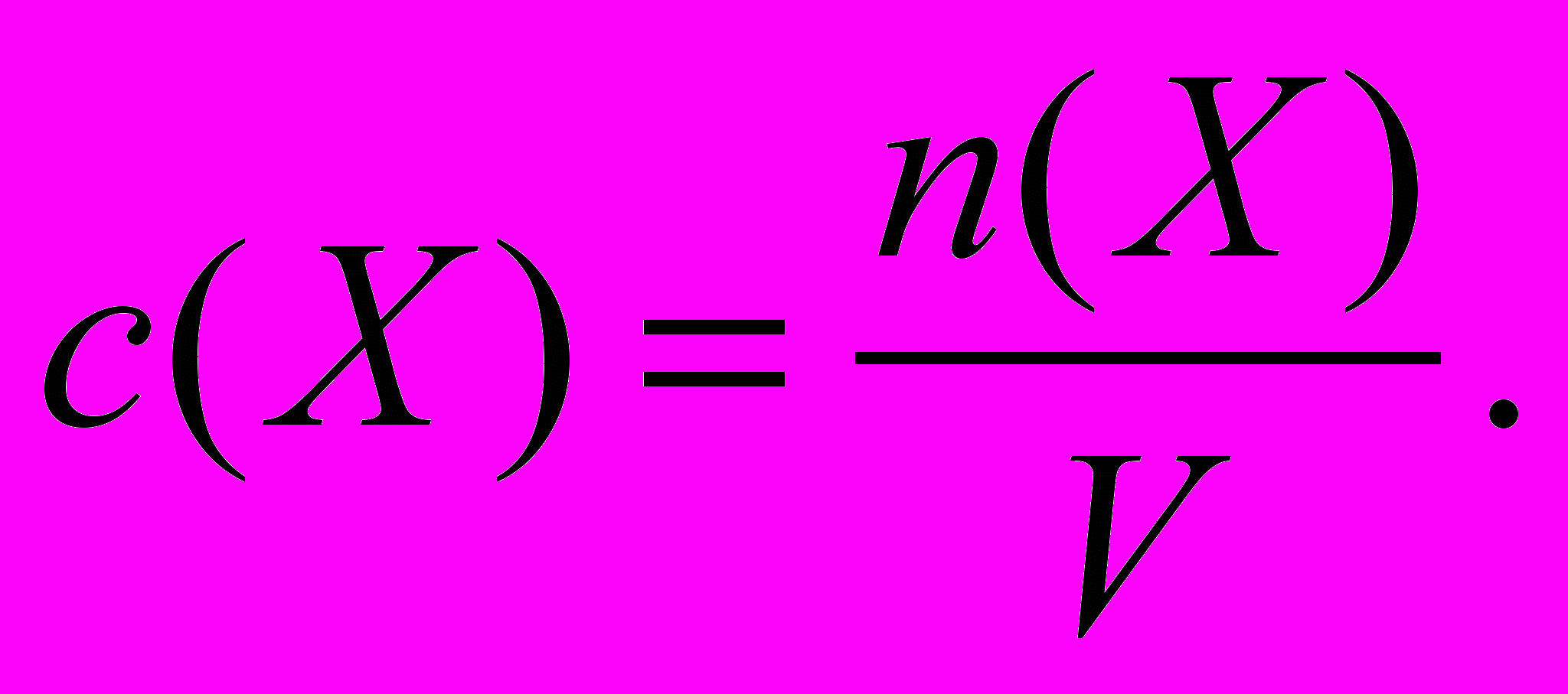
n = m / М; m = c М V; m (NaCl) = 0,2 моль/л 58,5 г/моль . 1 л =11,7 г.
- Взвесьте 11,7 г поваренной соли. Перенесите навеску в мерную колбу, добавьте немного воды и, осторожно встряхивая колбу, растворите соль (рис. 45). Долейте воды в мерную колбу до калибровочной метки. Колбу закройте пробкой и перемешайте раствор, многократно переворачивая колбу.
- В отчете приведите расчеты, наблюдаемые при растворении явления (разогревание или охлаждение раствора) и их объяснение, рисунок.
В качестве дополнительного задания можно предложить расчетные задачи.
Примеры заданий
- Приготовить 50 мл раствора соды Na2CO3, концентрация которого 0,5 моль/л.
- Приготовить 250 мл раствора сахара С12Н22О11, концентрация которого 0,15 моль/л.
- Приготовить 200 мл раствора сульфата натрия, растворив 23,4 г Na2SO4 в необходимом количестве воды. Вычислите молярную концентрацию приготовленного раствора.
Вопросы для проверки знаний
- Перечислите способы, с помощью которых можно найти содержание растворенного вещества в растворе.
- Как перейти от растворимости вещества к массовой доле растворенного вещества в насыщенном растворе?
- Какая концентрация называется молярной? Какие соотношения существуют между молярной концентрацией и массовой долей растворенного вещества?
Задачи
- Определите (КОН) в растворе, образовавшемся при смешивании 120 г раствора с (КОН) 9% и 380 г раствора, в котором (КОН) 12%. Ответ: 11,28%.
- Требуется приготовить раствор сульфата натрия объемом 1,2 л, плотностью 1,091 г/мл, с (Na2SO4), равной 10%. Сколько граммов глауберовой соли Na2SO4. 10Н2О и воды понадобятся для этого? Ответ: 297 г кристаллогидрата.
- В лаборатории необходимо приготовить 6%-ный раствор формалина. В каких количественных соотношениях нужно смешать 40%-ный формалин и воду?
- К 500 мл 0,1М раствора J2 добавили до обесцвечивания раствора 200 г раствора сульфита натрия. Определите (Na2SO3) в растворе. Ответ: 3,15%.
- Один литр 10% раствора КОН (=1,09 г/мл) смешали с 0,5 л 10% раствора НСl (=1,05 г/мл). Определите массовые доли веществ в полученном растворе. Рассчитайте их молярную концентрацию в растворе. Ответ: КОН – 1,78%; 0,334 моль/л; KCl – 6,6%; 0,9 моль/л.
- Для получения водорода в лаборатории используют реакцию цинка с серной кислотой, раствор которой готовят из кислоты (=1,84 г/мл) и воды, взятых в объемном отношении 1:5. Какова (H2SO4) в этом растворе? Ответ: 25,8%.
5.3. Растворимость твердых веществ и газов в воде
Растворимость s твердых веществ увеличивается с ростом температуры (рис. 46). В насыщенном при данной температуре растворе остаются кристаллики нерастворенного вещества.


s, г/100 г Н2О
s2
Область насыщенного
раствора









s1
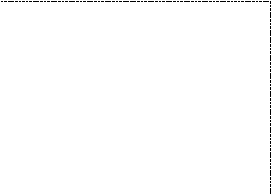









Область ненасыщенного раствора

Т, 0С
Т2
Т1
Рис. 46. Зависимость растворимости (s) от температуры
О
Количество вещества, в граммах, растворившееся при данной температуре в 100 г воды (или другого растворителя), называют растворимостью
бычно растворимость обозначают символом s.
 [г/100 г Н2О]
[г/100 г Н2О]Пример. Сколько граммов поваренной соли можно растворить при 250С в 1000 г воды? Растворимость s (NaCl) = 36 г/100 г Н2О
Решение.
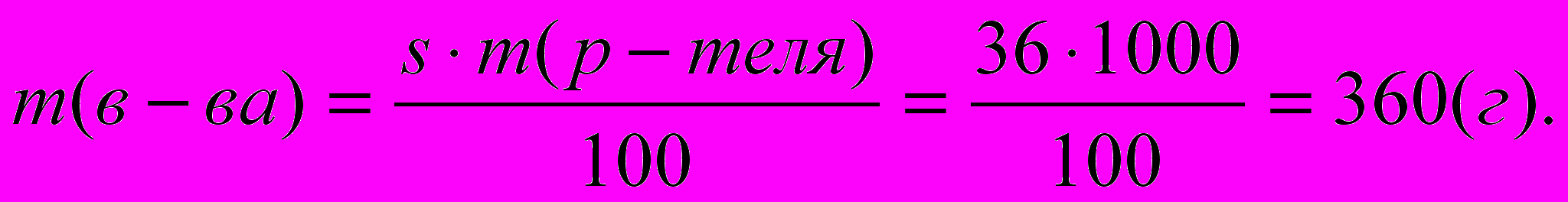
Существуют другие способы выражения растворимости. Растворимость часто выражают массой вещества, растворяющегося при данных условиях в 1 л растворителя.
Пример. Растворимость карбоната кальция при 200С равна 0,01 г/л. Сколько л воды потребуется для растворения 10 г СаСО3?
Решение.

Массовая доля вещества в насыщенном растворе связана с растворимостью соотношением:
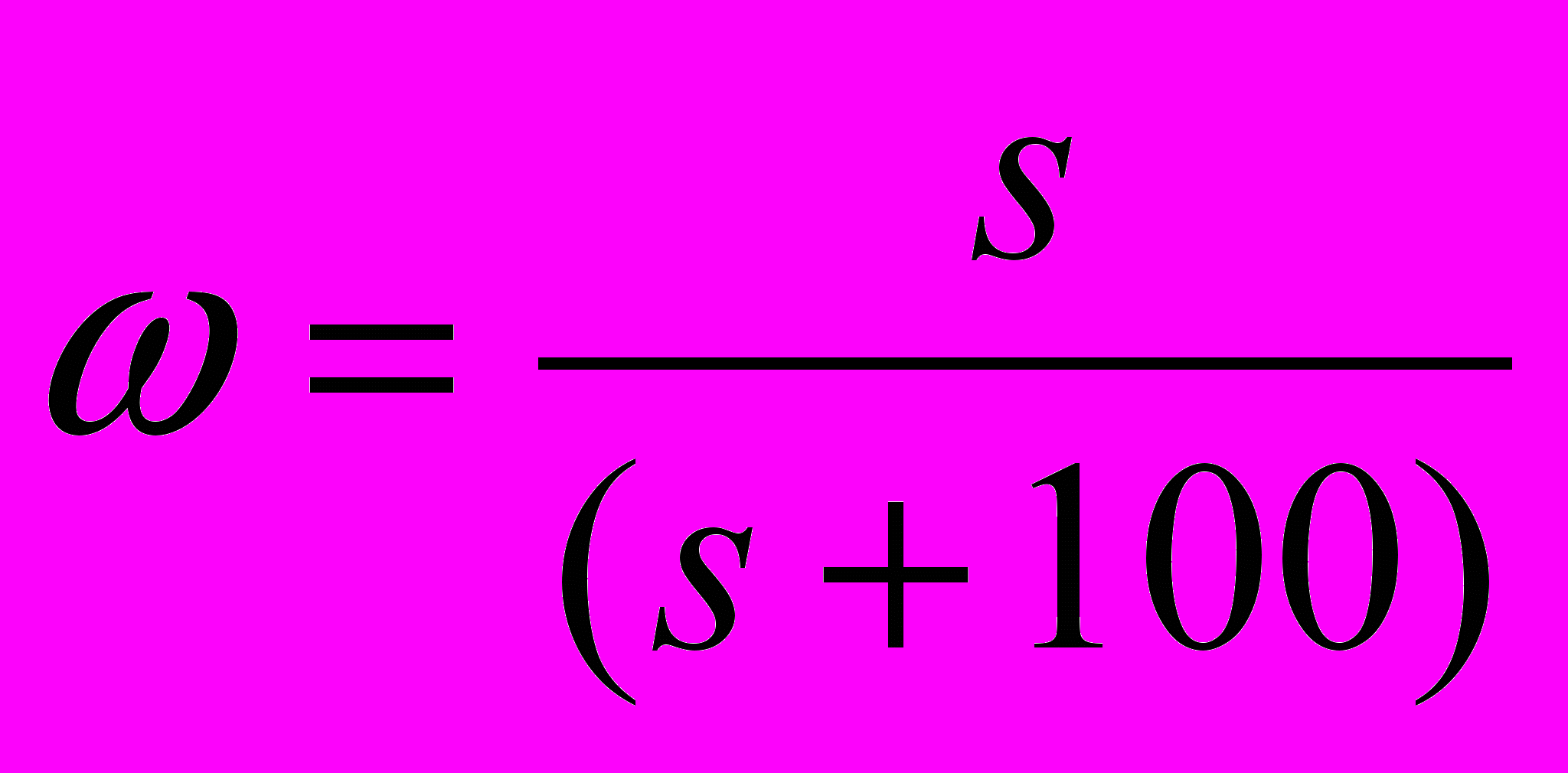
Пример. При 00С растворимость нитрата серебра равна 122 г в 100 г воды. Определите массовую долю (%) соли в растворе.
