Н. В. Яблокова химия-11 Учебное пособие
| Вид материала | Учебное пособие |
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.
- Д. Д. Яблокова (1896-1993) Карпов, 153.37kb.
- Учебное пособие г. Йошкар Ола, 2007 Учебное пособие состоит из двух частей: «Книга, 56.21kb.
Решение
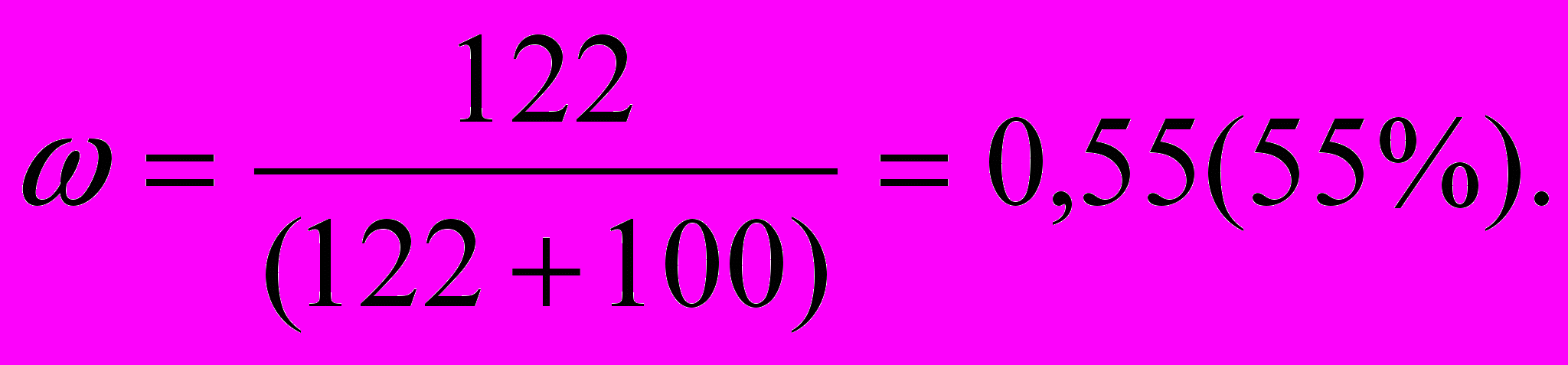
Пример. Массовая доля насыщенного при 500С раствора дихромата калия равна 27%. Вычислите растворимость этой соли.
Решение
Масса растворителя = 100 г – 27 г = 73 г.
Растворимость большинства твердых веществ с повышением температуры возрастает. Если насыщенный раствор, приготовленный при более высокой температуре, осторожно охладить, можно получить пересыщенный раствор. Пересыщенные растворы неустойчивы, при внесении в них кристалла соли или перемешивании избыток растворенного вещества самопроизвольно выделяется в виде кристаллов.
Пример. Вычислите массу хлорида калия, который выделится при кристаллизации 250 г раствора, насыщенного при 600С, если охладить его до 200С. s60KCl = 45,8, s20KCl = 34,4
Решение
Определим массу растворителя, которая не изменяется в процессе кристаллизации. При 600С в 145,8 г раствора содержится 100 г воды. В 250 г раствора содержится искомое количество х г воды:
x = 250100/145,8 = 171,5 г.
Определим массу растворенного вещества при 600С:
250 г – 171,5 г = 78,5 г.
Определим массу вещества при 200С:
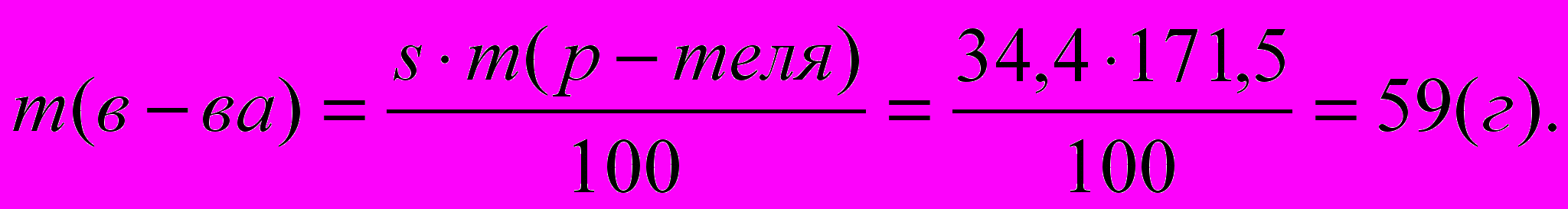
В процессе кристаллизации выделилась соль массой 78,5 г – 59 г = 19,5 г.
Перекристаллизация – один из методов очистки веществ. Понятно, что при этом неизбежны потери, равные растворимости данного вещества при температуре его охлаждения.
5.4. Свойства макросистем. Химические реакции
В химических реакциях макросистема обменивается энергией, изменяет геометрическую конфигурацию, состав и структуру атомов и молекул.
Химическая реакция (химическое взаимодействие) это превращение одних веществ в другие, обусловленное изменением строения и состава атомов и молекул.
Классификация химических реакций
Остановимся на широко распространенной классификации химических реакций по числу и характеру реагирующих и образующихся веществ, выделяющей 4 типа реакций: соединения, разложения, замещения и обмена.
В реакциях соединения из двух или большего числа веществ образуется одно вещество, а в реакциях разложения из одного вещества образуется несколько веществ:
Реакция соединения
2Hg(ж) + O2(г) ⇄ 2HgO(т)
Реакция разложения
В реакциях замещения атомы или молекулы простого вещества замещают часть атомов сложного вещества.
В реакциях обмена осуществляется обмен сложных веществ составными частями:
Реакция замещения
Zn(т) + CuSO4(р-р) ZnSO4(р-р) + Cu(т)
Реакция обмена
СuSO4 (p-р) + NaOH(р-р) Сu(OH)2(тв) + Na2SO4(р-р)
В органической химии многообразие реакций соединения можно рассмотреть на примере реакций присоединения к непредельным углеводородам (алкенам):
СН2=СН2 + Н2 СН3–СН3 (гидрирование этилена)
СН2=СН2 + Н2О СН3–СН2ОН (гидратация этилена)
Реакции отщепления (разложение) органических соединений:
СН3–СН3 СН2=СН2 + Н2 (дегидрирование этана)
СН3–СН2ОН СН2=СН2 + Н2О (дегидратация этанола)
Примером реакций замещения в органической химии являются реакции хлорирования предельных углеводородов:
СН4 + Cl2 CH3Cl + HCl
CH3Cl + Cl2 CH2Cl2 + HCl и т. д.
Реагирующие вещества (реагенты) могут находиться в разных фазах. Поверхность, разделяющая участников реакции, может оказывать сильное влияние на скорость химического превращения. Поэтому классификация химических реакций может осуществляться по фазовому состоянию реагентов. В этом случае все реакции делятся на гомогенные и гетерогенные. В гомогенных реакциях реагенты находятся в одной фазе:
NaOH(р-р) + HCl(р-р) NaCl(р-р) + H2O(ж)
N2(г) + O2(г) 2NO(г)
В гетерогенных реакциях реагенты находятся в разных фазах:
СаО(т) + Н2О(ж) Са(ОН)2(т)
СаО(т) + СО2(г) СаСО3(т)
Если классифицировать химические реакции по изменению степени окисления элементов, образующих вещества, то все реакции можно разделить на идущие с изменением и без изменения степени окисления элементов. Без изменения степени окисления идут, например, обменные реакции осаждения:
AgNO3(р-р) + KI(р-р) AgI(т) + KNO3(р-р)
Химические реакции, в которых изменяется степень окисления элементов, называют окислительно-восстановительными. К ним относятся реакции горения, процессы коррозии, реакции фотосинтеза в клетках растений, электролиз, реакции, идущие в гальванических элементах и многие другие процессы.
Горение угля:
С(т) + О2(г) = СО2(г)
Коррозия железа:
4Fe(т) + 3O2(г) = 2Fe2O3(т)
Фотосинтез глюкозы в клетке растения:
6СО2(г) + 6Н2О(ж) = С6Н12О6(т) + 6О2(г)
Электролиз расплава хлорида натрия:
2NaCl(ж) = 2Na(ж) + Сl2(г)
катод: 2Na+(ж) + 2e = 2Na(ж)
анод: 2Cl(ж) = Cl2(г) + 2e
Реакции, протекающие в гальваническом элементе, составленного из медного и цинкового электродов, погруженных в растворы их солей:
Zn(т) + CuSO4(р-р) = ZnSO4(р-р) + Cu(т)
катод: Cu2+(р-р) + 2e = Cu(т)
анод: Zn(т) = Zn2+(р-р) + 2e
Окислительно-восстановительные реакции по фазовому состоянию могут быть гетерогенными и гомогенными, а по изменению числа реагирующих и образующихся веществ могут быть реакциями соединения, разложения и замещения.
В органической химии, как правило, реакции классифицируют по типу разрыва химических связей, выделяя гомолитические (радикальные), гетеролитические (ионные) и молекулярные (без участия радикалов или ионов, когда разрыв и образование связей происходит синхронно или согласованно) реакции.
Х
 имические реакции
имические реакцииГомолитические Гетеролитические Молекулярные

 АВ А В
АВ А ВА
 В А + В АВ А+ + В СD С D
В А + В АВ А+ + В СD С DВопросы для проверки знаний
- В чем различие между реакциями соединения и разложения?
- Какие реакции называют реакциями замещения и обмена?
- В чем различие между гомогенными и гетерогенными реакциями?
- Можно ли назвать реакции соединения, разложения, обмена и замещения окислительно-восстановительными?
- Как классифицируют химические реакции по типу разрыва химической связи?
Упражнения
- Классифицируйте реакцию С(т) + О2(г) = СО2(г): а) по числу и характеру реагирующих и образующихся веществ; б) по фазовому состоянию реагентов; в) по изменению степени окисления; г) по типу разрыва химических связей.
- Докажите, что реакция Zn(т) + CuSO4(р-р) = ZnSO4(р-р) + Cu(т) является гетерогенной.
- Докажите, что горение метана является гомолитической реакцией.
** Гомолитические реакции органических соединений
В гомолитических реакциях принимают участие радикалы (атомы или молекулы), то есть частицы, имеющие неспаренные электроны. Появление радикалов связано с распариванием электронов ковалентной связи. Происходит симметричный разрыв ковалентной связи:
Н
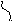 3С Н Н3С + Н
3С Н Н3С + Нрадикалы
С
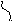 6Н5(СН3)2С Н С6Н5(СН3)2С + Н
6Н5(СН3)2С Н С6Н5(СН3)2С + Нрадикалы
В обобщенном виде гомолитическая диссоциация ковалентной связи в органическом соединении записывается следующим образом:
R
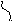 R’ R + R’
R’ R + R’где Rи R’свободные радикалы.
Обратный процесс соединение свободных радикалов:
R + R’ R : R
Для описания механизма любой конкретной реакции необходим большой объем информации.
Под механизмом в узком смысле этого слова подразумевается последовательность элементарных химических реакций превращения реагентов в продукты реакции. Подавляющее большинство неорганических и органических реакций являются сложными. В отличие от элементарной химической реакции, которая идет в один акт, в одно действие, сложная химическая реакция включает несколько элементарных химических реакций.
Галогенирование алканов является типичным примером радикальной реакции замещения. Это один из способов получения галогенпроизводных углеводородов в промышленности. Радикальное замещение происходит в несколько элементарных стадий. Начальной стадией является процесс инициирования радикальной реакции, ответственный за появление радикалов. Затем идут элементарные реакции образования продуктов реакции при участии радикалов. Следует также учитывать реакции обрыва цепи, т. е. соединения радикалов.
- Инициирование радикальной реакции:
Инициирование химическая реакция, приводящая к появлению свободных радикалов. Например, при хлорировании алканов появление свободных радикалов хлора вызывается разрывом связи в молекуле хлора:
С
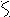 l Cl Cl + Cl
l Cl Cl + Cl2. Стадия продолжения цепи:
На этой стадии происходит образование продуктов реакции в результате непрерывно повторяющихся реакций радикального замещения:
R H + Cl R + HCl
R + Сl Cl R Cl + Cl
3. Обрыв цепи:
Гибель свободных радикалов, участвующих в стадии продолжения цепи, осуществляется в результате соединения радикальных частиц:
Cl + Cl Сl Cl
R + R R R
R + Cl R Cl
Механизм вышеуказанного радикального замещения реализуется в реакциях фотохимического хлорирования метана и этана. Ниже представлены стехиометрические уравнения сложных реакций образования хлористого метила и хлористого этила:
СН4 + Сl2 CH3Cl + HCl
C2H6 + Cl2 C2H5Cl + HCl
Реакции окисления углеводородов также относятся к реакциям радикального замещения. Они осуществляются при взаимодействии органического соединения с кислородом. В качестве инициатора используются соли металлов переменной валентности.
По механизму радикального присоединения идут реакции радикальной полимеризации и присоединения различных реагентов (галогенов, галогеноводородов и др.) к двойной и тройной связи органических соединений.
Вопросы для проверки знаний
- Какие частицы называют радикалами?
- В чем сущность инициирования радикальной реакции?
- На какой стадии радикальной реакции образуются продукты реакции?
- Какой процесс рассматривают как обрыв радикальной цепи?
- Почему радикальные реакции с участием алкенов и алкинов относят к реакциям радикального присоединения?
- К какому типу радикальных реакций (присоединения, замещения) относят реакции радикальной полимеризации?
Упражнения
- Напишите последовательность элементарных реакций образования хлористого метила при фотохимическом хлорировании метана
- Напишите последовательность элементарных реакций хлорирования этилена.
- Напишите последовательность элементарных реакций полимеризации этилена.
**Гетеролитические реакции органических соединений
В гетеролитических реакциях принимают участие ионы и молекулы, содержащие на одном из атомов неподеленную электронную пару или вакантную орбиталь. Появление ионов связано с несимметричным разрывом ковалентной связи и образованием одновременно отрицательно и положительно заряженных частиц:
N : E = N: + E+
или конкретно:
(
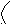 СН3)3С Cl = (СН3)3С+ + Cl
СН3)3С Cl = (СН3)3С+ + ClРеагенты, участвующие в гетеролитических реакциях, называются нуклеофилами и электрофилами. Нуклеофил (N:) частица, имеющая неподеленную электронную пару. Нуклеофил «любит» положительно заряженные частицы. К нуклеофилам относятся отрицательно заряженные частицы, такие, как бромид-ион Br, хлорид-ион Cl, гидроксид-ион НО, алкоксид-ион RO и многие другие анионы. К нуклеофилам также относятся незаряженные молекулы, имеющие неподеленную электронную пару, например, (СН3)3N:, (СН3)3Р: и др.
Электрофил (Е) частица, характеризующаяся наличием вакантной орбитали. Электрофил «любит» отрицательно заряженные ионы. К электрофилам относятся карбкатионы типа (СН3)3С+, бромид- и хлорид-ионы Br+, Cl+, ион Н3О+, нитрозил-ион NO2+ и многие другие катионы. К электрофилам относятся соединения, содержащие вакантную орбиталь, например (СН3)3Al, (СН3)3Ga.
Гетеролитические реакции органических соединений подразделяются на реакции электрофильного замещения и присоединения и нуклеофильного замещения и присоединения. Приведем пример одной из них.
Алкилирование бензола пропиленом является реакцией электрофильного замещения. В качестве катализатора используется AlCl3 или другие галогениды металлов и кислоты. Электрофильное замещение осуществляется в три стадии.
- Образование электрофила (E):
СН3СН=СН2 + НСl +AlCl3 СН3СНСН3AlCl4
(Е)
- Образование комплекса электрофилбензол:
С6Н6 + СН3СНСН3AlCl4 С6Н6 СН(СН3)2AlCl4
- Распад комплекса и образование продуктов реакции:
С6Н6 СН(СН3)2AlCl4 С6Н5С(СН3)2 + НСl + AlCl3
изопропилбензол
Эти реакции используется в промышленности для получения изопропилбензола (кумола), который в свою очередь является исходным продуктом в производстве фенола и ацетона.
По механизму электрофильного присоединения идет взаимодействие алкенов с галогенами, галогеноводородами и водой в присутствии кислот. Реакции нуклеофильного присоединения характерны для альдегидов и кетонов.
Молекулярные реакции
В молекулярных реакциях происходит согласованное перераспределение связей. Связи рвутся и образуются одновременно. Так происходит, например, перегруппировка пероксида кремния (триметил-триметилсилилпероксисилана):
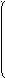
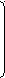
(


 CH3)3SiOOSi(CH3)3 CH3Si(CH3)2
CH3)3SiOOSi(CH3)3 CH3Si(CH3)2 | CH3OSi(CH3)2OSi(CH3)3
 OOSi(CH3)3
OOSi(CH3)3Вопросы для проверки знаний
1. Чем отличаются частицы-нуклеофилы от частиц-электрофилов?
- По какому механизму осуществляется алкилирование бензола?
- Какая особенность характеризует молекулярные реакции?
Упражнения
1. По какому механизму осуществляется приведенная ниже реакция гидролиза алкилбромида?

СН3Н2СBr + ОН СН3СН2OH + Br
5.5. Гетеролитические реакции
неорганических соединений
Прежде чем изучать гетеролитические реакции неорганических соединений рассмотрим процессы электролитической диссоциации, протекающие по гетеролитическому механизму, т.е. с участием ионов.
Электролитами называются жидкие или твердые вещества, в которых содержатся ионы, способные перемещаться и проводить электрический ток.
Электролитами являются главным образом водные растворы солей, кислот, щелочей, содержащие ионы, образующиеся в результате электролитической диссоциации. Твердыми электролитами являются ионные кристаллы солей. В узлах кристаллической решетки хлорида натрия содержатся ионы Na+ и Cl, поэтому подобные твердые вещества соответствуют определению электролита. Чтобы облегчить свободное перемещение ионов, твердый электролит можно расплавить или растворить в воде.
5.5.1. Электролитическая диссоциация
Электролитическая диссоциация это химический процесс взаимодействия электролита с растворителем, сопровождающийся образованием гидратированных (сольватированных) ионов.
Быстрое развитие электрохимии связано с появлением теории электролитической диссоциации, разработанной шведским физико-химиком С. Аррениусом (18591927). Изучая электрическую проводимость растворов ряда веществ, он обратил внимание на увеличение электрической проводимости при разбавлении растворов. На основании своих наблюдений Аррениус сформулировал вывод о самопроизвольном распаде некоторых веществ (электролитов) на заряженные частицы ионы.
Позже, независимо от Аррениуса, было доказано, что значительную роль в способности веществ распадаться на ионы играет растворитель.
Если растворителем является вода, то ионы окружаются молекулами воды. Такие ионы называют гидратированными. Если растворитель отличается от воды, то ионы окружают молекулы этого растворителя. Такие ионы называют сольватированными ионами (solvent растворитель).
При растворении в воде синильной кислоты HCN часть гидратированных молекул распадается на катионы и анионы. Устанавливаются равновесные концентрации участников электролитической диссоциации (рис. 47.).
CN
Н
+
+
+


+
+

+


+
+
+

CN

+
H+

+
+
+
+
+
+
+
+
+

+

+

+
HCN(р-р) ⇄ H+(р-р) + CN(р-р)
Рис. 47. Разрыв ковалентной связи в молекуле HCN под действием полярных молекул воды и образование гидратированных ионов
Аналогично диссоциируют уксусная и бензойная кислоты:
СН3СООН(р-р) ⇄ СН3СОО(р-р) + Н+(р-р)
С6Н5СООН(р-р) ⇄ С6Н5СОО(р-р) + Н+(р-р)
Твердые электролиты с ионной кристаллической решеткой существуют в ионном состоянии еще до растворения в воде. Поэтому кристаллы такого электролита либо полностью растворяются, распадаясь на гидратированные ионы, либо часть кристаллов остается нерастворенными в насыщенном растворе.
Появление в воде свободно перемещающихся ионов изменяет её свойства. Водный раствор электролита становиться проводником электрического тока. Если в металлических проводниках проводимость электронная, то в электролитах проводимость ионная. Правда, электролиты обладают проводимостью в десятки и сотни тысяч раз меньшей, чем металлы.
Неэлектролитами являются соединения, которые не подвергаются электролитической диссоциации, их водные растворы не проводят электрический ток. К неэлектролитам относятся, например, спирты, кетоны, углеводороды и многие другие органические соединения.
