Н. В. Яблокова химия-11 Учебное пособие
| Вид материала | Учебное пособие |
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.
- Д. Д. Яблокова (1896-1993) Карпов, 153.37kb.
- Учебное пособие г. Йошкар Ола, 2007 Учебное пособие состоит из двух частей: «Книга, 56.21kb.
**Лабораторные работы
Комплексные соединения
Опыт 1.Получение и свойства некоторых комплексных соединений аммиака.
В три пробирки внесите по 0,5 мл 1М растворов солей меди (II), никеля (II), кобальта (II). Концентрированный (25%) раствор аммиака в избытке дает с растворами этих солей растворимые комплексные соли. Добавьте в пробирки сначала равные объемы 25% раствора аммиака, перемешайте. Затем добавьте в каждую пробирку двойной избыток концентрированного раствора аммиака (по 1 мл), перемешайте.
Образуются аммиакаты меди (II) ярко-синего цвета, голубой аммиакат никеля(II) и грязно-желтый аммиакат кобальта (II):
Cu2+ + 4NH3 [Cu(NH3)4]2+
Ni2+ + 6NH3 [Ni(NH3)6]2+
Co2+ + 6NH3 [Co(NH3)6]2+
Для образования аммиаката кобальта (II) добавьте несколько кристаллов хлорида аммония (избыток ионов аммония сдвигает равновесие реакции вправо). Растворы аммиакатов устойчивы, за исключением аммиаката кобальта (II), который постепенно окисляется кислородом воздуха в аммиакат кобальта (III) [Co(NH3)6]2+ вишнево-красного цвета.
Опыт 2. В пробирке к 0,5 мл 1М раствора медного купороса добавляйте концентрированный раствор аммиака, встряхивая пробирку для лучшего перемешивания, до образования комплексной соли. В ходе опыта отметьте образование промежуточного соединения – осадка основной соли сульфата гидроксомеди (II). Разбавьте образовавшийся ярко-синий раствор равным объемом спирта и отделите образующиеся при этом кристаллы гидрата сульфата тетраамминмеди (II), растворимость которого в спиртово-водной смеси значительно меньше, чем в воде. Напишите формулы упомянутых в описании опыта комплексных соединений.
Опыт 3. Получение и свойства аквакомплексов.
. В фарфоровую чашку поместите 2 ложечки кристаллов медного купороса и прокалите. Обратите внимание на изменение цвета кристаллов. После того как фарфоровая чашка остынет, добавьте каплю воды. Как изменился цвет кристаллов? Напишите формулу медного купороса в виде комплекса: гидрат сульфата тетрааквамеди (II).
3.3. Взаимодействия в молекулах. Индуктивный эффект и эффект сопряжения
Электроотрицательность величина, характеризующая свойство атома в соединении притягивать к себе электроны.
Внутримолекулярные взаимодействия в неорганических и органических соединениях выявляют свойство атомов, входящих в состав молекул, притягивать к себе электронную пару, участвующую в образовании химической связи. Если в химической связи участвуют два атома различной электроотрицательности (), то распределение электронов тем сильнее отклоняется от идеального случая симметричного распределения, чем больше разность электроотрицательностей.
В неполярных двухатомных молекулах типа Н2, Cl2 наблюдается случай идеального распределения общей электронной пары между атомами. Центры тяжести положительных зарядов ядер и электронов совпадают. Дипольный момент ( = l) таких молекул равен нулю, т.к. l = 0:
( = 3,0) N N ( = 3,0) = 0 = 0
НН = 0
ClCl = 0
В полярных молекулах центры тяжести положительных и отрицательных зарядов не совпадают:
(
 = 3,0) N+ = O( = 3,5) 0, т.к. l 0
= 3,0) N+ = O( = 3,5) 0, т.к. l 0
Н+Cl 0
Направление поляризации связи указывается стрелкой и обозначается символами + и . При этом означает часть элементарного заряда.
**Использование дипольных моментов полезно для понимания влияния заместителей в молекулах органических соединений. С этой целью в качестве системы сравнения выбраны молекулы симметричных насыщенных углеводородов (алканов), не обладающих дипольным моментом. Причем связям СН в них произвольно приписывается нулевой дипольный момент. Замена атома водорода в молекуле алкана каким-либо заместителем приводит к образованию полярных ковалентных связей. Неполярные органические молекулы становятся полярными. Введенным заместителям приписывается положительный или отрицательный индуктивный эффект (I).
Индуктивный эффект это вид передачи электронного влияния заместителя по цепи -связей.
Индуктивный эффект в молекулах это вид взаимного влияния атомов, различающихся электроотрицательностью. Принято индуктивному эффекту приписывать знак заряда, приобретаемый заместителем (I).
Индуктивный эффект
ХСR3 HCR3 YCR3
I Стандарт, I= 0 +I
Хэлектроноакцептор Yэлектронодонор
Стрелка обозначает направление смещения электронной пары, участвующей в образовании химической связи. Если заместитель смещает электронную плотность на себя, он выступает как электроноакцептор. Роль акцептора электронов играет в приведенном выше примере заместитель Х.
Если электронная плотность смещается от заместителя на углеводородную группу, заместитель выступает как электронодонор. Роль донора электронов играет заместитель Y. Индуктивный эффект распространяется по -связям молекулы c затуханием по мере удаления от заместителя. Например, электроотрицательность атома хлора (3,0) больше электроотрицательности атома углерода (2,5), поэтому общая поляризация молекулы, например, хлорпропана может быть представлена следующей моделью:
СН3СН2СН2Cl
( часть )
Как и в предыдущих моделях молекул стрелками обозначено смещение электронной плотности по системе -связей. Индуктивный эффект наиболее часто встречающихся заместителей представлен в табл. 3.
Кроме индуктивного эффекта существует эффект сопряжения или мезомерный эффект (рис. 19).
Сопряжение или мезомерный эффект это вид взаимодействия чередующихся простых и двойных связей или двойной связи с неподеленной электронной парой заместителя. Это передача электронного влияния заместителя по системе -связей.
Мезомерный эффект обозначают символом М (греч. mesos средний, промежуточный).
Т а б л и ц а 3
Знак индуктивного эффекта некоторых заместителей
| Заместитель | Индуктивный эффект |
| Алкил (СН3, С2Н5, С3Н7 и др.) NH2 ОН Алкокси (СН3О, С2Н5О, С3Н7О и др.) Галогены (F, Cl, Br, I) NO2 COOH СО | +I I I I I I I I |
В бутадиене-1,3 (рис. 19 а) атомы углерода находятся в состоянии sp2-гибридизации. Негибридизованные р-орбитали атомов углерода расположены перпендикулярно плоскости, в которой находятся -связи, и параллельны друг другу. В результате дополнительного перекрывания р-орбиталей между вторым и третьим атомами углерода образуется дополнительная -связь. Этот вид перекрывания называется --сопряжением.
Подобное --сопряжение наблюдается не только в бутадиене-1,3, но и в акриловом альдегиде (рис. 19 б), но в отличие от бутадиена электронная плотность в акриловом альдегиде смещена в результате эффекта сопряжения в сторону более электроотрицательного атома кислорода (показано изогнутыми стрелками).
Кроме -- возможно р--сопряжениие, когда взаимодействуют -электронное облако двойной связи и р-орбиталь (рис. 19 в). Именно так происходит в фениламине. Неподеленная пара электронов атома азота (р-орбиталь) вступает в сопряжение с -электронным облаком бензольного кольца. Изогнутые стрелки показывают направление смещения электронной пары р-орбитали атома или -электронного облака, а конец стрелки связь или атом, к которым они смещаются. Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный () эффект. К таким заместителям относится аминогруппа NH2 (рис. 19 в). Заместители, оттягивающие электронную плотность из сопряженной системы, проявляют
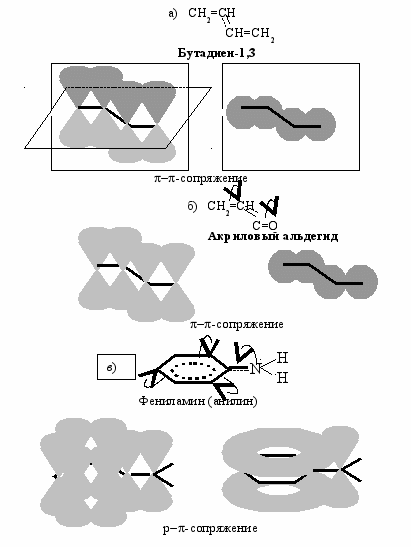
Рис. 19. Модели молекул, в которых проявляется эффект сопряжения: а) бутадиена-1,3 (-сопряжение); б) акрилового альдегида (-сопряжение); в) фениламина (р-сопряжение)
отрицательный мезомерный ( М) эффект. К таким заместителям относится карбонильная группа С=О в акриловом альдегиде (рис. 19 б).
В отличие от индуктивного эффекта мезомерный эффект передается по системе сопряженных связей на значительные расстояния практически без затухания.
Заместители в зависимости от того, повышают они или понижают электронную плотность в молекуле в результате совместного влияния индуктивного и мезомерного эффектов, рассматриваются как электронодонорные или электроноакцепторные заместители (табл. 4).
Т а б л и ц а 4
Суммарное электронное влияние заместителей
| Заместитель | Электронные эффекты | Суммарное электронное влияние заместителей | |
| Индуктивный | Мезомерный | ||
| Алкил (СН3, С2Н5 и др.) | +I | | Электронодонор |
| NH2 | I | +М | +М>I Электронодонор |
| ОН | I | +М | +М>I Электронодонор |
| Алкокси (СН3О, С2Н5Ои др.) | I | +М | +М>I Электронодонор |
| Галогены (F, Cl, Br, I) | I | +М | I > +М Электроноактептор |
| NO2 | I | М | Электроноакцептор |
| COOH | I | М | Электроноакцептор |
| SO3H | I | М | Электроноакцептор |
| C=O | I | М | Электроноакцептор |
3.4. Свойства молекул
Так же, как и атомы, молекулы проявляют свойства:
- обмениваться энергией;
- изменять геометрическую конфигурацию;
- участвовать в химических реакциях.
Свойство обмениваться энергией. Молекулы находятся в непрерывном движении. В газе они свободно перемещаются по всему занимаемому ими объему и находятся на больших расстояниях по сравнению с размерами самих молекул. Обмен энергией происходит в результате столкновений. При этом не меняется количество движения, которым обладают молекулы, если газ изолирован от окружающей среды. Происходит лишь перераспределение энергии движения между молекулами, когда они сталкиваются. Молекула может совершать одновременно поступательное, колебательное, вращательное и деформационное движения (рис. 20). Мерой движения является кинетическая энергия молекул (греч. kinetikos приводящий в движение).
В жидкости молекулы также находятся в непрерывном движении. Однако в отличие от газа в жидкости сталкивающиеся частицы находятся на очень близких расстояниях. Для молекул жидкости характерны поступательное, колебательное, вращательное и деформационное движения.
В твердых телах движение атомов, ионов или молекул, расположенных в узлах кристаллической решетки, ограничено. Частицы совершают движения относительно положения равновесия на незначительные расстояния. Говорят, что они совершают колебательные движения в узлах кристаллической решетки. Но и этого движения достаточно, чтобы обмениваться энергией с соседними частицами.
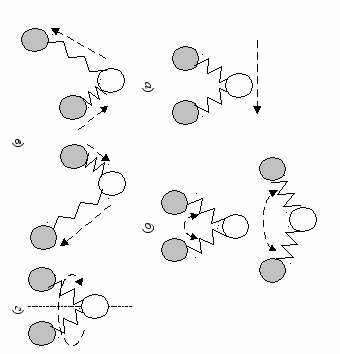
бРис. 20. Модели молекул, совершающих а) поступательное, б) деформационное, в) колебательное и г) вращательное движение
Изменять геометрическую конфигурацию молекулы могут при вращении вокруг -связи, соединяющей два атома углерода. Мы ограничимся рассмотрением некоторых стереоизомеров. Стереоизомерами называются молекулы, различающиеся расположением атомов или групп атомов в пространстве. Для передачи пространственного строения молекул используют стереохимические формулы (рис. 21). Например, стереохимические формулы молекулы этана изображены в заторможенной (рис. 21 а) и заслоненной (рис. 21 б) конформациях.
В заторможенной конформации атомы водорода находятся далеко друг от друга. В заслоненной форме атомы водорода находятся ближе, чем в заторможенной конформации. Молекула этана легко переходит из одной конформации в другую, поэтому этан представляет собой равновесную смесь конформеров, которые могут быть обнаружены только спектральными методами.
а

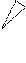











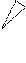

















 ) б)
) б)Н

С





Рис. 21. Стереохимическая модель молекулы этана: а) заторможенная конформация; б) заслоненная конформация
В более сложных, чем этан, молекулах могут существовать устойчивые конформеры. Например, молекула глюкозы С6Н12О6 в растворе принимает различные геометрические конфигурации (рис. 22).
Среди них наибольшая доля приходится на циклические формы, которые отличаются положением гидроксильных групп относительно плоскости кольца. Это связано с вращением альдегидной группы по связи С1С2.
Химические превращения включают одновременные процессы обмена энергией и изменения геометрической конфигурации молекул. Ключевым в определении химического превращения является термин процесс. Под процессом подразумевается разрыв химических связей (эндо-процесс), требующий энергии извне, и образования новых химических связей, сопровождающийся выделением энергии во внешнюю среду (экзо-процесс). В зависимости от соотношения эндо- и экзо- процессов реакция сопрово-
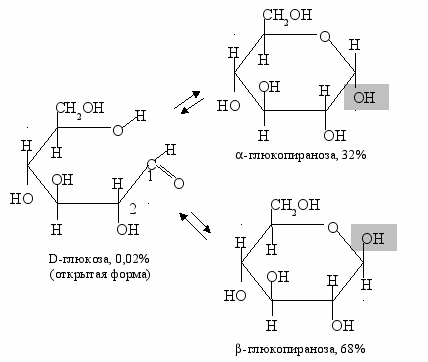
Рис. 22. Изомерные формы глюкозы: открытая и циклические формы
ждается разогреванием или охлаждением реакционной смеси.
Скрытая в химических связях потенциальная энергия притяжения и отталкивания заряженных частей молекулы (ядер и электронов) не проявляется до тех пор, пока не произойдет разрыв одних и образование других химических связей. В химическом превращении потенциальная энергия химических связей превращается в кинетическую энергию, т. е. энергию движения молекул.
Рассмотрим экзотермическую реакцию горения угля. В кристаллической решетке каждый атом углерода связан с четырьмя соседними атомами углерода ковалентными связями. Чтобы произошла химическая реакция, ковалентные химические связи между атомами в кристалле твердого углерода должны быть разорваны. Следовательно, требуется затратить энергию на разрушение кристаллической решетки до состояния отдельных атомов. Известно, что на превращение 1 моль кристаллического углерода в одноатомный газ требует +716,67 кДж (рис. 23). Источником энергии для поддержания эндотермического процесса может служить окружающая среда (нагревание).
С























 (т) С(г)
(т) С(г)+716,67 кДж
Рис. 23. Модель изменения геометрической конфигурации, агрегатного и энергетического состояния углерода
На разрыв ковалентных связей в молекулах кислорода О2 и превращение молекулярного газа в одноатомный газ также требуется энергия. Связи в молекулах кислорода необходимо разорвать, чтобы предоставить атомам кислорода возможность соединиться затем с атомами углерода (рис.24). На разрыв химических связей 1 моль кислорода требуется +498,4 кДж энергии, которая поступает из окружающей среды за счет нагревания.
Энергетические затраты на разрыв связей в углероде и кислороде составляют [(+716,67) + (498,4)] = +1215,07 кДж. Знак + указывает, что система (кристаллический углерод и молекулярный кислород) поглощает энергию извне.
О
 2(г) 2О(г)
2(г) 2О(г)




или








+498,4 кДж
























Рис. 24. Модель изменения геометрической конфигурации и энергетического состояния кислорода
Образование химических связей сопровождается высвобождением энергии, скрытой в химических связях молекул СО2. При этом следует иметь в виду, что сначала должна образоваться молекула СО (рис.25). Образование 1 моль СО сопровождается выделением энергии (1076,4 кДж).
С(г)+ О(г) СО(г)



































1076,4 кДж

Рис. 25. Модель изменения геометрической конфигурации и энергетического состояния углерода и кислорода
Присоединение еще одного атома кислорода к молекуле СО приведет к образованию СО2. Из СО и О образуется 1 моль СО2 с выделением 532,2 кДж (рис. 26).
Выделение энергии в окружающую среду при образовании 1 моль СО2 из атомов кислорода и углерода составляет [1076,4] + [532,2] = 1608,6 кДж. Знак «» указывает, что система [оксид углерода (IV)] выделяет энергию в окружающую среду.
С












































 О(г)+О(г) СО2(г)
О(г)+О(г) СО2(г)



532,2 кДж





Рис. 26. Модель изменения геометрической конфигурации и энергетического состояния СО (II) и кислорода при образовании СО2
В результате реакции горения твердого углерода в кислороде энергия выделяется в окружающую среду. Просуммируем энтальпии вышеуказанных четырех процессов:
С(т) + О2(г) = СО2(г)
[(+716,67)+(498,4)]+[1076,4]+[532,2]=+1215,071608,6 = 393,53кДж
Изменяются молекулярный состав, энергетическое и агрегатное состояние участников реакции. Модели химических превращений на рис. 2326 отражают лишь энергетические изменения, которые происходят в ходе реакции. Реальный химический процесс так не осуществляется, но энергетика реального процесса в моделях представлена правильно. Горение сопровождается выделением энергии в форме тепла и света. Следовательно, в реальном химическом процессе горения углерода эндо- и экзотермические процессы происходят одновременно (рис. 27).
1
 ) Сn(т) + О2(г) СnO(т) + О(г) Сn1(т) + CO(г) + О(г)
) Сn(т) + О2(г) СnO(т) + О(г) Сn1(т) + CO(г) + О(г)




















































2) СО(г) + О(г) СО2(г)
3) Сn(т) + О2(г) Сn1O(т) + О(г) Сn2(т) + CO(г) +О(г)
















































Рис. 27. Модель реакции горения углерода: 1) гетерогенная реакция на поверхности угля; 2) гомогенная реакция в газовой фазе; 3) выгорание поверхности углерода до полного исчезновения твердого вещества
Когда мы наблюдаем за горением кусочков раскаленного угля, то замечаем, что над его поверхностью мелькают языки пламени. Это срывающиеся с поверхности молекулы оксида углерода (II) сгорают в газовой фазе до оксида углерода (IV).
**3.5. Квантовые правила
Для описания химической связи рассмотрим метод валентных связей.
Метод валентных связей (ВС) был разработан немецкими физиками В. Гейтлером и Ф. Лондоном в 1927 г. Метод опирается на правила квантовой механики и может быть сформулирован в виде следующих положений:
- в образовании связи участвуют валентные электроны, т. е. электроны внешней электронной оболочки атома;
- химическая связь образуется при участии пары электронов с противоположными спинами;
- химическая связь образуется при перекрывании атомных орбиталей. Между ядрами появляется область повышенной электронной плотности, удерживающая ядра на расстоянии, соответствующем длине химической связи.
Исторически первым подходом к наглядному изображению химического связывания атомов были модели американского физико-химика Г. Льюиса, предложенные им еще в 1916 г. Эмпирические правила Льюиса точно отражали сущность химического связывания атомов:
- Химическая связь осуществляется с помощью двух электронов;
- В большинстве молекул вокруг каждого атома должно находиться четыре пары электронов (правило октета);
- Если атом химического элемента имеет меньше четырех валентных электронов, то октет вокруг него не образуется. Так происходит в атоме водорода, производных бора и т. д.
Наглядные изображения молекул, в которых электроны неподеленных и общих пар указываются точками, называются электронными формулами. Если ввести обозначение общей пары электронов валентной чертой, заменяющей две точки между атомами в электронной формуле, получим структурные формулы (рис. 28).
Н
О
Сl
Сl
Сl
Сl
С
































Н







Сl
Сl
Сl
В

























С
Сl
Сl
Сl
О
Н
Н
В
Сl
Сl
Сl
 а)
а)Сl

 б)
б) 





Рис. 28. Модели молекул, представленные: а) электронными и б) структурными формулами. Пустым квадратом в молекуле ВCl3 обозначена вакантная орбиталь
Таким образом, метод валентных связей явился результатом развития представлений Льюиса. Модели Льюиса были просты и понятны. Они используются до сих пор. Однако действительным приближением к объяснению количества химических связей является метод валентных связей, положения которого были обоснованы Гейтлером и Лондоном. Образование химической связи рассматривается как результат спаривания спинов свободных электронов атомов. Тем самым метод валентных связей дает обоснование одному из основных положений теории валентности: валентность нейтрального атома равна числу свободных электронов в его валентной оболочке.
Вопросы для проверки знаний
- Что называется молекулой?
- Что называют длиной химической связи?
- В чем сущность теории гибридизации?
- Почему ядра атомов в молекуле удерживаются на расстоянии длины химической связи, несмотря на электростатическое отталкивание?
- Почему ионы в кристаллической решетке не сближаются и остаются на расстоянии длины ионной связи, несмотря на электростатическое притяжение?
- В чем различие моделей структуры и состава молекул?
- Что понимают под насыщаемостью и направленностью ковалентной связи? Является ли направленность и насыщаемость характеристиками ионной связи?
- Какую роль играет электроотрицательность атомов в молекулах химических соединений?
- *Чем отличается индуктивный электронный эффект от мезомерного?
- Почему благородные газы в отличие от других газообразных простых веществ существуют в виде одноатомных молекул?
- Какое изменение состояния молекул называют химическим превращением?
- Почему система из двух связанных атомов (Н2) более устойчива по сравнению с системой из двух свободных атомов (2Н)?
- Перечислите возможные типы гибридизации s- и р-орбиталей, изобразите геометрические конфигурации молекул в случае каждого типа гибридизации
Упражнения
- Расположите карбоновые кислоты: СCl3COOH, СН3СООН, Сl2CHCOOH, ClCH2COOH в порядке увеличения кислотных свойств.
- Докажите, что реакция горения угля является сложной реакцией и включает много элементарных стадий.
- Возможны ли молекулы Н2+ Не2+ и Не2 с позиций метода валентных связей?
Задачи
- Л. Полинг предложил оценивать прочность химической связи по разности электроотрицательностей (ЭО) атомов. Определите по разности ЭО вид связи и расположите частицы каждого набора в порядке уменьшения прочности связи: а) ВеО, СаО, SrO, MgO; б) GeTe, GeO, GeSe, GeS.
- *Пользуясь молекулярными и структурными формулами, определите валентность и степень окисления Р и N в следующих частицах: PF3, PF5, PF4+, PF6–, NF3, NОF3, NF5, BeF2, BeF42–. Какие из них реальны, а какие гипотетические с точки зрения теории валентных связей?
- Составьте структурные формулы частиц: СН4, СН3ОН, Н2СО, Н2СО2, С2Н6. Определите валентность и степень окисления атомов в этих молекулах.
- Составьте формулы хлоридов элементов 3 периода, расположите их в порядке возрастания полярности связи, по разности ЭО укажите вид химической связи.
- С позиций теории валентной связи объясните изменение энергии связи (кДж/моль) в молекулах: F2 (155), О2 (498), N2 (945).
- *В состав молекулы водорода входят два атома водорода. Докажите, руководствуясь теорией валентных связей, что молекулы Н3 и Н4 не существуют.
- Изобразите структурные формулы молекул азота и ацетилена. Сравните химическую связь в молекулах этих веществ.
- *Чем объясняется свойство атомов некоторых химических элементов образовывать число связей, превышающее число неспаренных электронов в атомах? Приведите примеры.
- Укажите, какая из молекул: ВН3 или NH3 является электронодонором.
- Определите валентность и степень окисления атомов в молекулах этилена, пропилена.
