Н. В. Яблокова химия-11 Учебное пособие
| Вид материала | Учебное пособие |
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.
- Д. Д. Яблокова (1896-1993) Карпов, 153.37kb.
- Учебное пособие г. Йошкар Ола, 2007 Учебное пособие состоит из двух частей: «Книга, 56.21kb.
Задачи
- Плотность этилена по кислороду, D(O2) = 0,875. Определите молярную массу газа.
- Масса 200 мл ацетилена (н.у.) равна 0,232 г. Определите молярную массу газа. Ответ: 26 г/моль
- Определите объем 0,5 моль газа при 1000С, если известно, что при этой температуре его давление составляет 1,013105 Па.
- При 170С и давлении 104 кПа масса 624 мл газообразного вещества равна 1,56 г. Вычислите молярную массу газа и выскажите предположение, как называется этот газ. Ответ: 58 г/моль.
- При некоторой температуре плотность паров серы по азоту, D(N2) равна 9,14. Из скольких атомов состоит молекула серы при данной температуре?
- Масса 0,001 м3 газообразного вещества (н.у.) равна 0,00152 кг, а масса 0,001 м3 азота составляет 0,00125 кг. Вычислите молярную массу неизвестного газа, исходя из: а) его плотности по азоту; б) молярного объема. Выскажите предположение, как называется этот газ. Ответ: 34 г/моль.
4.6. Межмолекулярное взаимодействие
Представления о межмолекулярном взаимодействии впервые были введены нидерландским физиком Ван дер Ваальсом в 1873 г. Межмолекулярное взаимодействие свидетельствует о том, что электронейтральная молекула поляризована. В современной интерпретации составляющие макросистему частицы (атомы и молекулы) испытывают притяжение и отталкивание в силу того, что они состоят из заряженных частей (рис. 34).
На плоской модели молекулы воды (в действительности молекула воды не плоская, она имеет конфигурацию тетраэдра) видно разделение центров положительного и отрицательного зарядов (рис. 34 а). Молекула воды диполь. Дипольный момент равен произведению эффективного заряда на расстояние l (длина диполя) между положительным и отрицательным центрами





















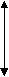
l
а)

























б)
Рис. 34. Плоские модели полярных молекул-диполей и неполярных молекул: а) молекула воды диполь, центры отрицательных и положительных зарядов молекулы не совпадают; б) молекула метана не диполь, центры отрицательных и положительных зарядов молекулы совпадают
В неполярной молекуле метана центры положительных и отрицательных зарядов совпадают, т.е. l = 0. (рис.34 б). Поэтому дипольный момент равен нулю. Молекула метана не диполь.
При сближении полярных молекул возникают силы притяжения и отталкивания заряженных частей молекул. Молекулы ориентируются так, чтобы развернуться положительно заряженной частью к отрицательно заряженной части другой молекулы. Такое взаимное расположение молекул называется ориентационным или диполь-дипольным взаимодействием (рис. 35 а).
При взаимодействии полярной и неполярной молекул возникает индукционное взаимодействие или взаимодействие диполь-не диполь. Полярная молекула оказывает на неполярную молекулу поляризующее действие. В неполярной молекуле происходит незначительное смещение электронной плотности и ядер таким образом, что центры тяжести положительно и отрицательно заряженных частей молекулы перестают совпадать. Возникает наведенный диполь (рис. 35 б). Такое положение сохраняется до тех пор, пока молекулы находятся в тесном контакте. Достаточно немного нагреть смесь веществ, чтобы движение молекул ускорилось, и межмолекулярное притяжение полярной и неполярной молекул разрушилось.











а)
 б)
б)в)
Рис. 35. Модель межмолекулярных взаимодействий: а) ориентационное (диполь диполь); б) индукционное (диполь наведенный диполь); в) дисперсионное (наведенный диполь наведенный диполь).
Взаимодействие двух неполярных молекул приводит к возникновению еще одного типа межмолекулярного взаимодействия. Благодаря непрерывному движению электронов и колебательному движению ядер в каждой из неполярных молекул возникает временное смещение некоторых электронных орбиталей относительно ядер и обусловленное этим временное возникновение наведенных диполей. Каждый из таких диполей влияет своими зарядами на ориентацию соседнего наведенного диполя. Возникает дисперсионное взаимодействие или взаимодействие наведенных диполей (рис. 35 в).
Межмолекулярное взаимодействие часто называют вандерваальсовым по имени ученого, изучившего природу этого вида связи между молекулами. Вандерваальсовы силы ответственны за существование при различных температурах трех состояний или фаз вещества: кристаллического, жидкого и газообразного.
4.7. Водородная связь
Водородная связь не является ни ковалентной, ни ионной связью. И, тем не менее, она называется связью, потому что удерживает молекулы рядом, не дает им легко разойтись, хотя и слабее ковалентной связи примерно в десять раз.
Водородная связь представляет собой межмолекулярное взаимодействие, в котором атом водорода одной молекулы притягивается к электроотрицательному атому (кислород, фтор, азот) другой молекулы
Модель водородной связи между молекулами воды представлена на рис. 36.








































-О
Н+ Н
Н
О-
Н+




а)
б)
Рис. 36. Модель водородной связи между молекулами воды: а) водород одной молекул воды смещается в направлении неподеленной пары кислорода другой молекулы; б) водородная связь между молекулами воды обозначена пунктирной линией
Вода это ассоциация молекул, объединенных водородными связями. Атом водорода одной молекулы слегка смещается в направлении неподеленной электронной пары кислорода другой молекулы (рис. 36 а). Как и в ковалентной связи, образование водородной связи обязано главным образом электростатическим силам. Водород располагается между электронными парами двух атомов кислорода, с одним из которых он непосредственно связан ковалентной полярной связью, а около другого удерживается силами электростатического притяжения: протон с зарядом (+) неподеленная электронная пара кислорода соседней молекулы с зарядом (-). «Полимерная» сеть межмолекулярных водородных связей ставит воду в ряд высококипящих жидкостей. Требуется затратить энергию (например, нагреть), чтобы оторвать молекулы воды с поверхности жидкости, удерживаемые не только диполь-дипольным взаимодействием, но и водородными связями.
Межмолекулярные силы, удерживающие вместе молекулы HF, H2O и NH3, заметно больше сил, действующих между другими гидридами, из-за наличия водородных связей. Молекулы органических кислот способны димеризоваться за счет водородных связей. Очень важны водородные связи в молекулах белков.
Вопросы для проверки знаний
- Какой физический эффект ответственен за возникновение вандерваальсовых сил?
- Бром может находиться в газообразном, жидком и твердом состоянии. Какую роль играют вандерваальсовы силы при переходе из одного состояния в другое?
- Какие физические взаимодействия проявляются при образовании льда из жидкой воды?
- Какие физические взаимодействия проявляются при смешении воды с этанолом?
Упражнения
- Среди водородных соединений элементов VIА группы вода теоретически должна иметь самую низкую температуру кипения и плавления (светлые точки на рисунке):
Температура плавления
0
90
70



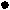
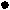
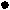
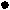
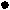
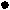
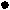
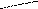
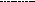
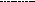
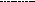
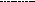
Температура
кипения
Т
+100
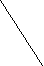

34
Н2Se
52
Н2Te
8
Н2О
16
Н2S
Атомная масса химического элемента в гидриде
Укажите причины необычайно высокой температуры кипения и плавления воды в сравнении с температурами кипения и плавления водородных соединений серы, селена и теллура.
2. Докажите, что при плавлении льда температура остается постоянной, равной 00С, несмотря на то, что внешний источник (нагреватель) непрерывно передает энергию в форме теплоты системе лед жидкость.
3. Докажите, что при кипении воды при атмосферном давлении температура остается постоянной, равной 1000С, несмотря на то, что внешний источник (нагреватель) непрерывно передает энергию в форме теплоты системе жидкость пар.
4. За счет каких связей образуется димер пропановой кислоты? Изобразите его структурную формулу.
Тема 5. Свойства макросистем
- Дисперсные системы
Воздух наполнен мельчайшими частицами пыли. Мутные ручьи после обильного дождя содержат взвешенные частицы. Молоко – водный раствор, содержащий капельки жира. Растения, животные и микробы представляют собой системы, состоящие одновременно из жидких, твердых и газообразных частей. Мир раздроблен на неоднородные части. Фактически нет ни чистой воды, ни чистого воздуха, ни твердых веществ без примесей. Нам предоставляется возможность понять мир раздробленного вещества.
Различают растворы и дисперсные системы. Уксус – раствор уксусной кислоты в воде, сахарный сироп – раствор сахарозы в воде. Растворы будут рассмотрены в следующем разделе главы.
В отличие от растворов – однородных систем,
дисперсные системы – это неоднородные (гетерогенные) системы, состоящие из большого числа фаз с сильно развитой поверхностью между ними.
Определение дисперсной системы может быть непонятным, если не раскрыть физический смысл понятия «фаза».
Фаза – однородная по химическому составу и физическим свойствам часть системы, отделенная от других частей (фаз) поверхностями раздела.
Например, вода может находиться в газообразном, жидком и твердом состоянии или в трех фазах (рис. 37).
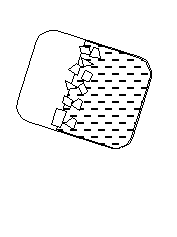
Рис. 37. Вода в трех фазовых состояниях: газообразном, жидком и твердом
Лед, жидкая вода и пар не различаются по химическому составу, но вода в разных агрегатных состояниях имеет различные физические свойства. Это предполагает существование поверхности раздела между разными фазами воды.
Если смешать жидкую воду с нерастворимым в воде органическим веществом, например, растительным маслом, и сильно встряхнуть, образуется эмульсия, – мелкие капельки масла распределятся по всему объему воды (рис. 38 б).
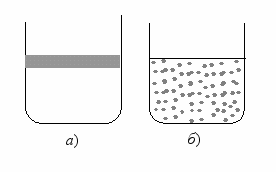
Рис. 38. Неоднородная двухфазная дисперсная система масло в воде:
а) масло на поверхности воды; б) эмульсия масла в воде
Эмульсия сохраняется некоторое время, затем капельки начинают слипаться в одну большую каплю, которая всплывает на поверхность воды (рис. 38 а).
Вода образует непрерывную дисперсионную среду (то, в чем распределены капли масла). Сами капельки масла представляют собой раздробленную органическую жидкость – дисперсную фазу (то, что распределено в воде). Дисперсионная среда – это непрерывная фаза, в объеме которой распределена другая (дисперсная) фаза в виде мелких твердых частичек, капелек жидкости или пузырьков газа.
Различают следующие дисперсные системы: эмульсии, суспензии, пены. Некоторые из них приведены на рис. 38-40.
Эмульсии – это дисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой (рис. 38 б). К ним относятся, например, молоко – эмульсия жира в воде, сырая нефть – эмульсия воды в смеси углеводородов. Среди искусственных эмульсий назовем маргарин, лекарственные и косметические мази и кремы.
Суспензии – это дисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой. К таким системам относятся масляные краски (рис. 39 а), эмали, цветные лаки. Обычно они готовятся на растительных или синтетических маслах (дисперсионная среда), дисперсной фазой является твердый краситель.
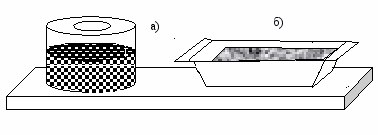
Рис. 39. Суспензии: а) краска; б) цементный раствор
К суспензиям также относятся свежеприготовленные цементные (рис. 39 б) и известковые растворы. Растворами эти суспензии называются условно, так принято в строительстве. Если цементный раствор хранить длительное время, то частички цемента (дисперсная фаза) оседают, и вверху появляется слой воды (дисперсионная среда). Поэтому цементный раствор перевозят в специальных цементовозах, где он непрерывно перемешивается для стабилизации суспензии.
Пена – это дисперсная система с газовой дисперсной фазой и жидкой или твердой дисперсионной средой (рис. 40). Например, мыльная пена – это дисперсная система, где воздух является дисперсной фазой, а вода – дисперсионной средой. Пены с жидкой дисперсионной средой, как правило, неустойчивы, а с твердой дисперсионной средой могут существовать длительное время (пористая резина, пенополиуретан).
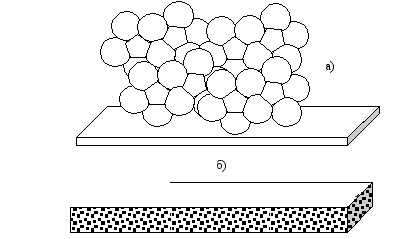
Рис. 40. Пена: а) образующаяся при работе пенного огнетушителя;
б) кусок пористой резины – пузырьки воздуха в резине
Дисперсные системы играют огромную роль в повседневной жизни человека.
Рассмотрим взаимодействия в жидких дисперсных системах вода – масло. Под маслом будем понимать любое жидкое органическое вещество, не растворимое в воде. Чем больше длина углеводородной цепи органического соединения, тем меньше его растворимость в воде. Полярные молекулы-диполи воды не могут удержать неполярные молекулы из-за слабого притяжения между ними. Органические вещества имеют меньшую удельную плотность по сравнению с водой. Поэтому они постепенно всплывают на поверхность водной среды. Пример: нефть из терпящего бедствие нефтяного танкера расплывается многокилометровым пятном на поверхности морской глади.
Чтобы повысить устойчивость дисперсных систем, используют поверхностно-активные вещества (ПАВ). Поверхностно-активные вещества – это органические соединения, состоящие из полярной группы и неполярного углеводородного радикала, которые концентрируются на поверхности раздела фаз в силу особенностей строения молекул. Свойства ПАВ проявляют белки, высокомолекулярные спирты, жирные карбоновые кислоты. Рассмотрим строение натриевой соли жирной карбоновой кислоты (рис. 41). Неполярная часть молекулы – углеводородный радикал – заканчивается полярной группой СООNa.

Рис. 41. Модель молекулы ПАВ – натриевой соли жирной карбоновой кислоты. Изображена диссоциация соли в воде
Молекулы ПАВ, имея в своем составе полярную и неполярную (углеводородную) группу, при растворении в воде взаимодействуют со средой (водой) и между собой таким образом, чтобы перейти в устойчивое состояние (рис. 42).
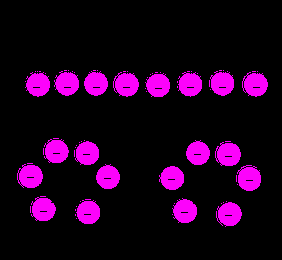
Рис. 42. Мыльный раствор. В воде молекулы мыла (ПАВ) группируются, располагаясь полярными группами наружу к полярным молекулам воды
Если смешать масло и воду и добавить ПАВ, то при взбалтывании образуется стабильная эмульсия либо масла в воде, либо воды в масле, в зависимости от концентрации компонентов смеси. Капли масла в водной эмульсии не слипаются, так как ПАВ, добавленное в эмульсию, стабилизирует капли масла, распределяясь на границе раздела фаз полярными группами наружу в воду, что вызывает электростатическое отталкивание образовавшихся в воде стабильных частичек масла. Если имеем эмульсию воды в масле, то капли воды стабилизируются ПАВ неполярными группами наружу в масло, что препятствует соприкосновению капель воды, распределенных в масле. Таким образом, ПАВ концентрируются на поверхности раздела органического вещества и воды и препятствуют слипанию частичек дисперсной фазы.
Это свойство ПАВ и дисперсных систем используется при очистке поверхностей, покрытых жиром или масляными пятнами, а также при очистке ткани от грязи при стирке белья. Ткань, помещенная в мыльную воду, очищается от грязи благодаря действию мыла (рис. 43).
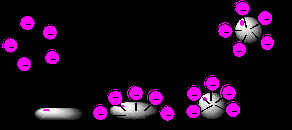
Рис. 43. Модель очистки ткани от жирных пятен
Молекулы соли жирной кислоты (мыла) обволакивают жирное пятно на поверхности ткани, причем неполярные концы ПАВ обращены в сторону жирного пятна. По мере интенсивного движения ткани в стиральной машине или при ручной стирке пятно окружается со всех сторон молекулами ПАВ и уходит с поверхности ткани в мыльный раствор. Без ПАВ этого бы не произошло, так как масло не растворимо в воде.
Практическая работа
Свойства мыла
- Приготовьте в пробирке раствор мыла в теплой воде, настрогав хозяйственное мыло тонкими стружками. Прилейте к 1-2 мл раствора мыла 1 мл серной или соляной кислоты. Объясните наблюдаемое явление. Напишите уравнение реакции.
- К 1-2 мл раствора мыла прибавьте 2 капли спиртового раствора фенолфталеина. Как изменился цвет раствора? Напишите уравнение реакции гидролиза мыла (стеарат натрия).
- К 1-2 мл раствора мыла прибавьте 1 мл раствора хлорида кальция. Что произошло с раствором мыла? Почему мыло плохо мылится в жесткой воде? Напишите уравнение реакции.
- Приготовьте эмульсию растительного масла в воде в двух пробирках. В одну из них добавьте равный объем мыльного раствора. Сильно взболтайте содержимое обеих пробирок. Объясните результаты опыта.
- В двух пробирках приготовьте суспензию сажи (толченый древесный уголь) в воде и мыльном растворе. Взболтайте содержимое обеих пробирок и поставьте их в штатив. В какой из пробирок суспензия быстро расслоится? Почему она не расслаивается во второй пробирке?
- Снова взболтайте содержимое пробирок из опыта 5 и профильтруйте через два разных фильтра. Какая суспензия разделяется фильтрованием? Почему содержимое другой пробирки не разделяется фильтрованием?
- Растворы. Растворимость
От химических соединений растворы отличаются переменным составом.
П
Растворами называют однородные (гомогенные) системы, состоящие из двух или большего числа веществ (компонентов).
одчеркнем, что в растворах вещества имеют молекулярную или ионную степень раздробленности.
Растворы бывают твердые, жидкие и газообразные. Ограничимся изучением жидких водных растворов. Раствор, содержащий наибольшее при данной температуре количество растворенного вещества, называется насыщенным.
Способы выражения состава растворов
Массовая доля растворенного вещества (Х) – это отношение массы компонента m(X) к массе всего раствора (m). Она может быть выражена в долях единицы или в процентах:
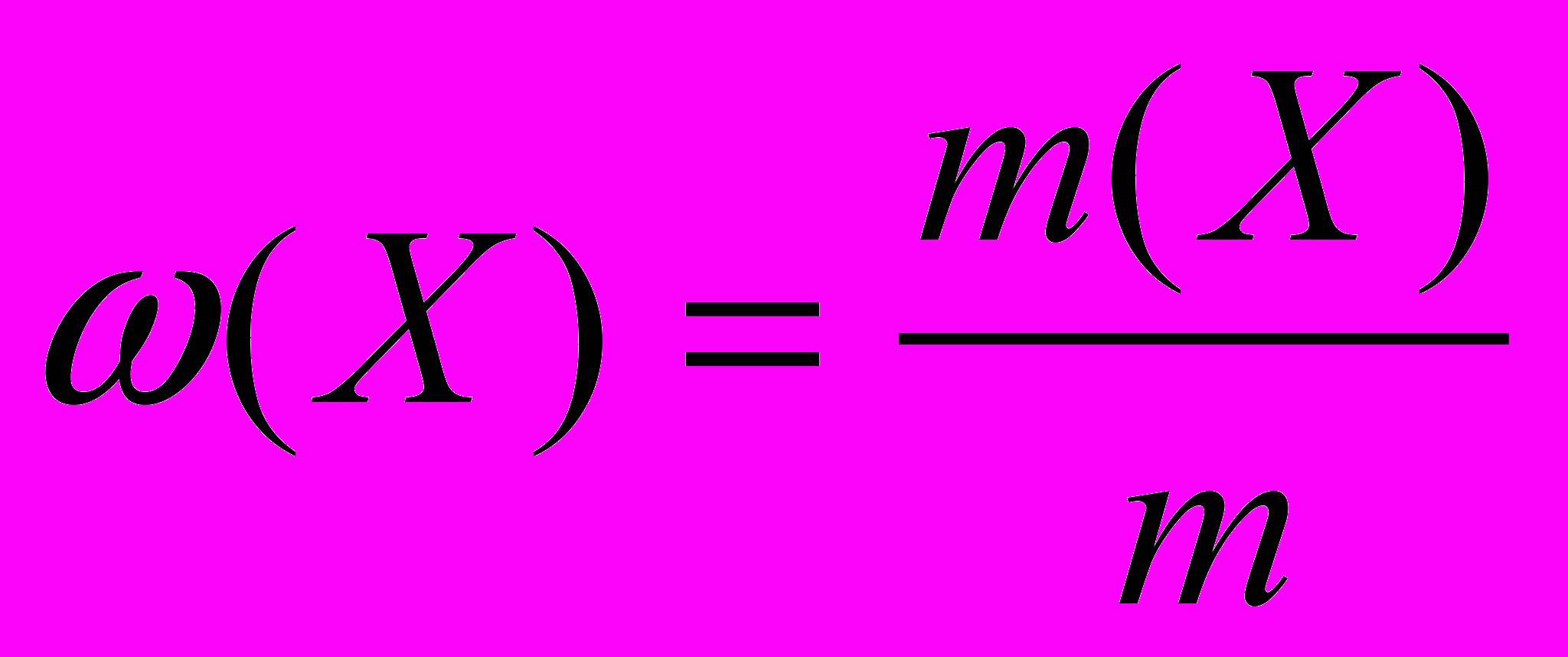 .
.Массовая доля – это также количество граммов растворенного вещества в 100 граммах раствора. Например, 15% раствор содержит 15 г растворенного вещества в 100 г раствора.
Пример. Сколько граммов медного купороса СuSO4 5Н2О следует добавить к раствору объемом 0,5 л, в котором (СuSO4) равна 4% ( = 1,04 г/мл), чтобы увеличить (СuSO4) до 16%?
