Н. В. Яблокова химия-11 Учебное пособие
| Вид материала | Учебное пособие |
СодержаниеСильные и слабые электролиты Деление электролитов на сильные и слабые |
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.
- Д. Д. Яблокова (1896-1993) Карпов, 153.37kb.
- Учебное пособие г. Йошкар Ола, 2007 Учебное пособие состоит из двух частей: «Книга, 56.21kb.
Сильные и слабые электролиты
Мерой проявляемого слабым электролитом свойства распадаться на ионы являются два параметра: степень диссоциации и константа диссоциации электролита Кд. Последний параметр используется для оценки силы слабых электролитов.
Степень диссоциации это отношение числа молекул электролита, распавшихся на ионы, к общему числу молекул растворенного электролита:
Число молекул электролита, распавшихся на ионы
 =
= Общее число молекул растворенного электролита
Для слабого электролита составляет десятые и сотые доли единицы (табл. 5). Поэтому в водном растворе существует равновесие между недиссоциированными молекулами электролита и ионами. Для сильного электролита = 1 или близка к 1. В этом случае в растворе существуют только ионы.
Т а б л и ц а 5
Деление электролитов на сильные и слабые
| Сильные электролиты | Слабые электролиты |
| Все соли. Кислоты, такие как H2SO4, HNO3, HCl, HClO4. Щелочи, такие как LiOH, KOH, NaOH, RbOH, CsOH, Ca(OH)2, Ba(OH)2, Sr(OH)2 | Кислоты, такие как HF, H2S, H2CO3, H2SO3, CH3COOH, C6H5COOH. Основания, такие как NH4OH, Pb(OH)2 |
Рассмотрим связь между константой диссоциации Кд и степенью диссоциации такого слабого электролита как бензойная кислота.
С6Н5СООН(р-р) ⇄ С6Н5СОО(р-р) + Н+(р-р)
Константа диссоциации определяется отношением произведения равновесных концентраций катионов и анионов к равновесной концентрации недиссоциированных молекул бензойной кислоты:
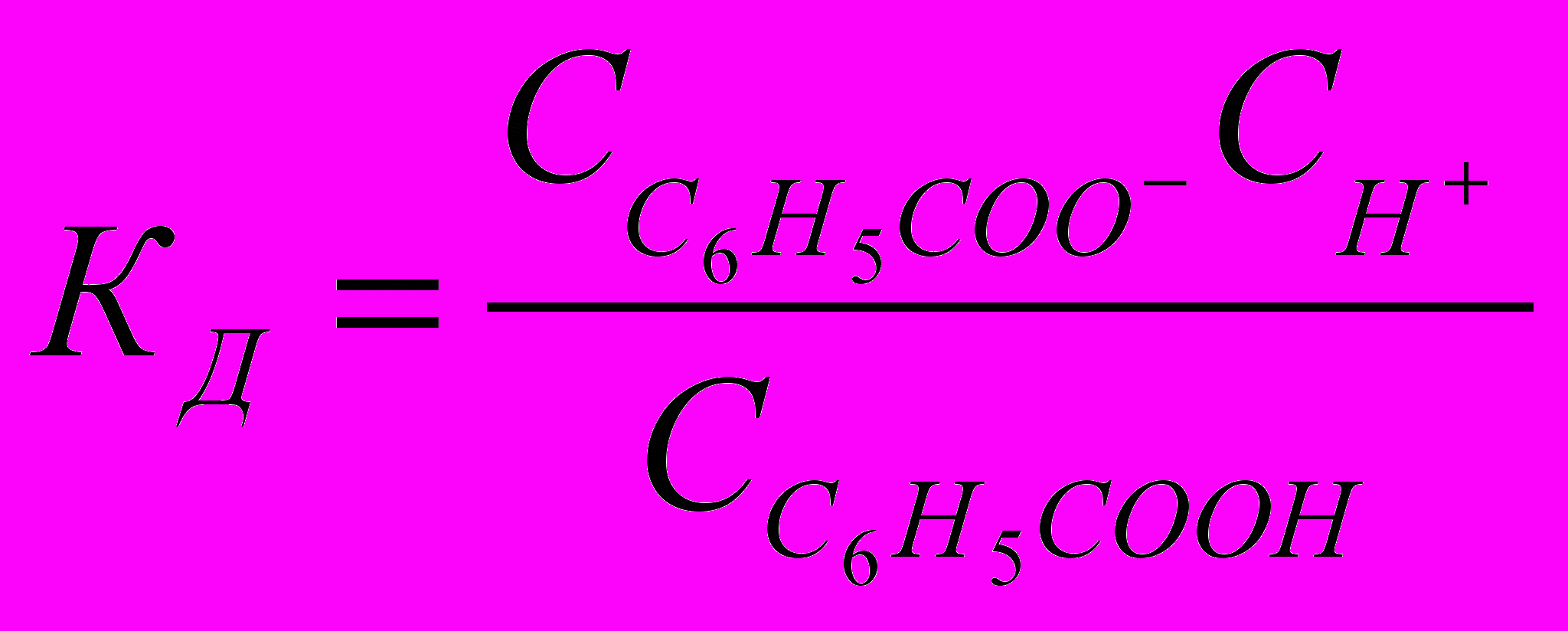
Начальная концентрация растворенной в воде бензойной кислоты С0. В результате электролитической диссоциации часть молекул бензойной кислоты распадается на ионы. Равновесные концентрации ионов бензойной кислоты и водорода одинаковы и равны С0. Равновесная концентрация недиссоциированной бензойной кислоты равна:
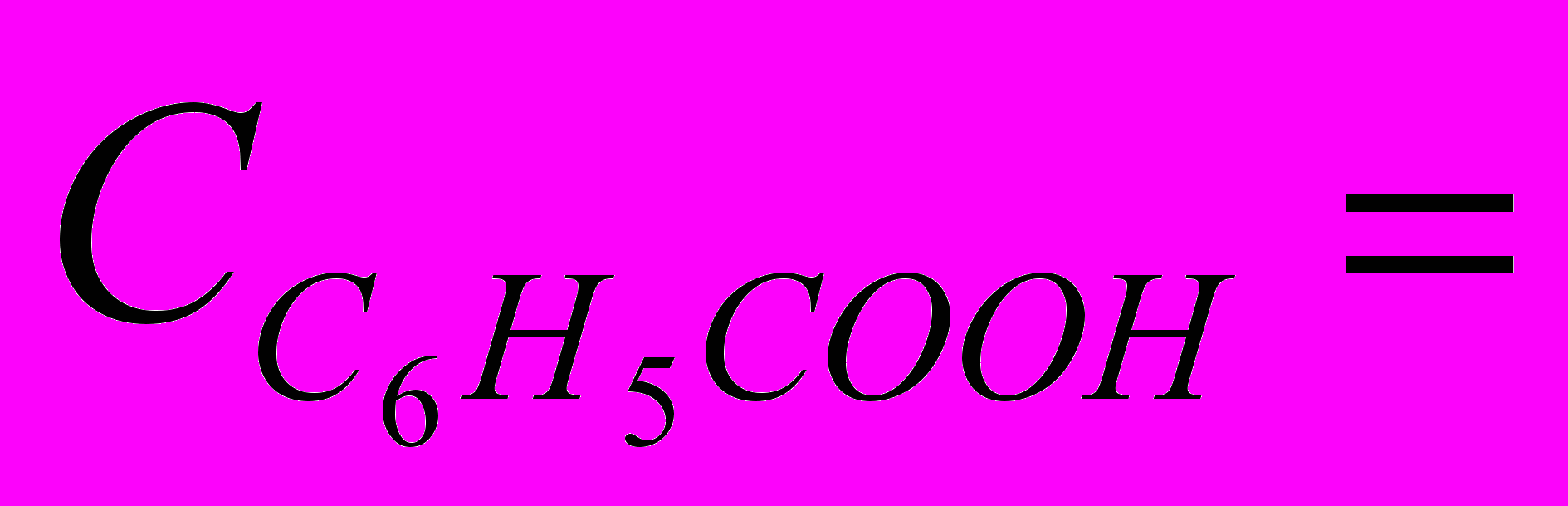 (С0С0) = С0(1)
(С0С0) = С0(1)Подставим значения равновесных концентраций в выражение константы диссоциации Кд:
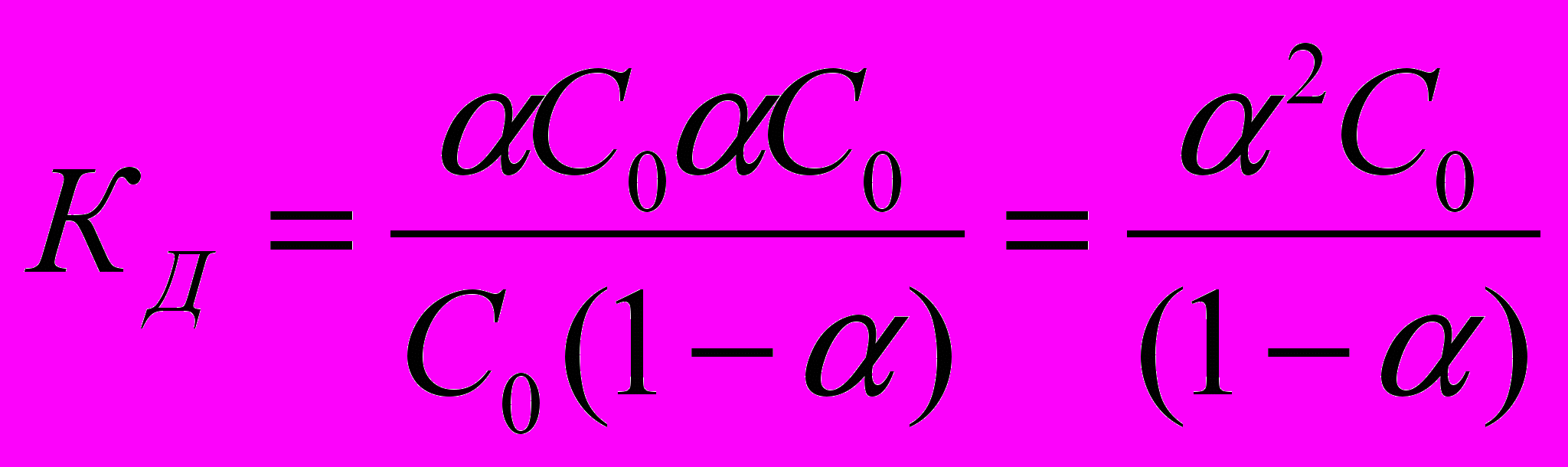
Для слабых кислот степень диссоциации существенно меньше единицы. При << 1 получаем, что (1-) 1 и выражение константы диссоциации слабой кислоты имеет следующий вид:
Кд = 2 С0
Константа диссоциации зависит только от температуры. Отметим важное свойство электролитов: чем больше начальная концентрация электролита С0, тем меньше степень его диссоциации:
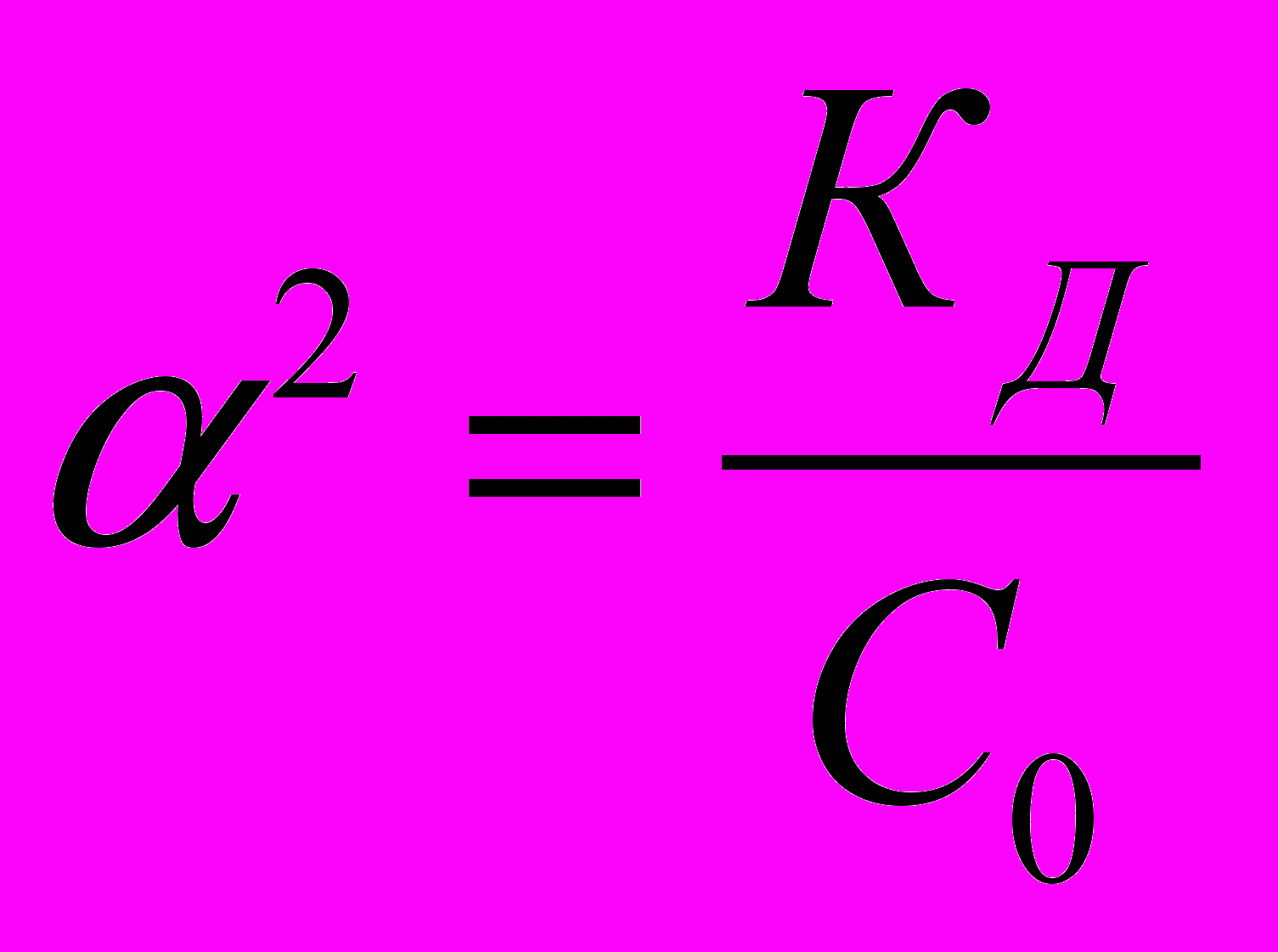
Пример. Определить степень диссоциации 0,1М водных растворов слабых уксусной и бензойной кислот. Константы диссоциации кислот соответственно равны
1,8 .10-5 и 6,3.10-5 при 250С.
Решение
Для вычисления воспользуемся уравнением
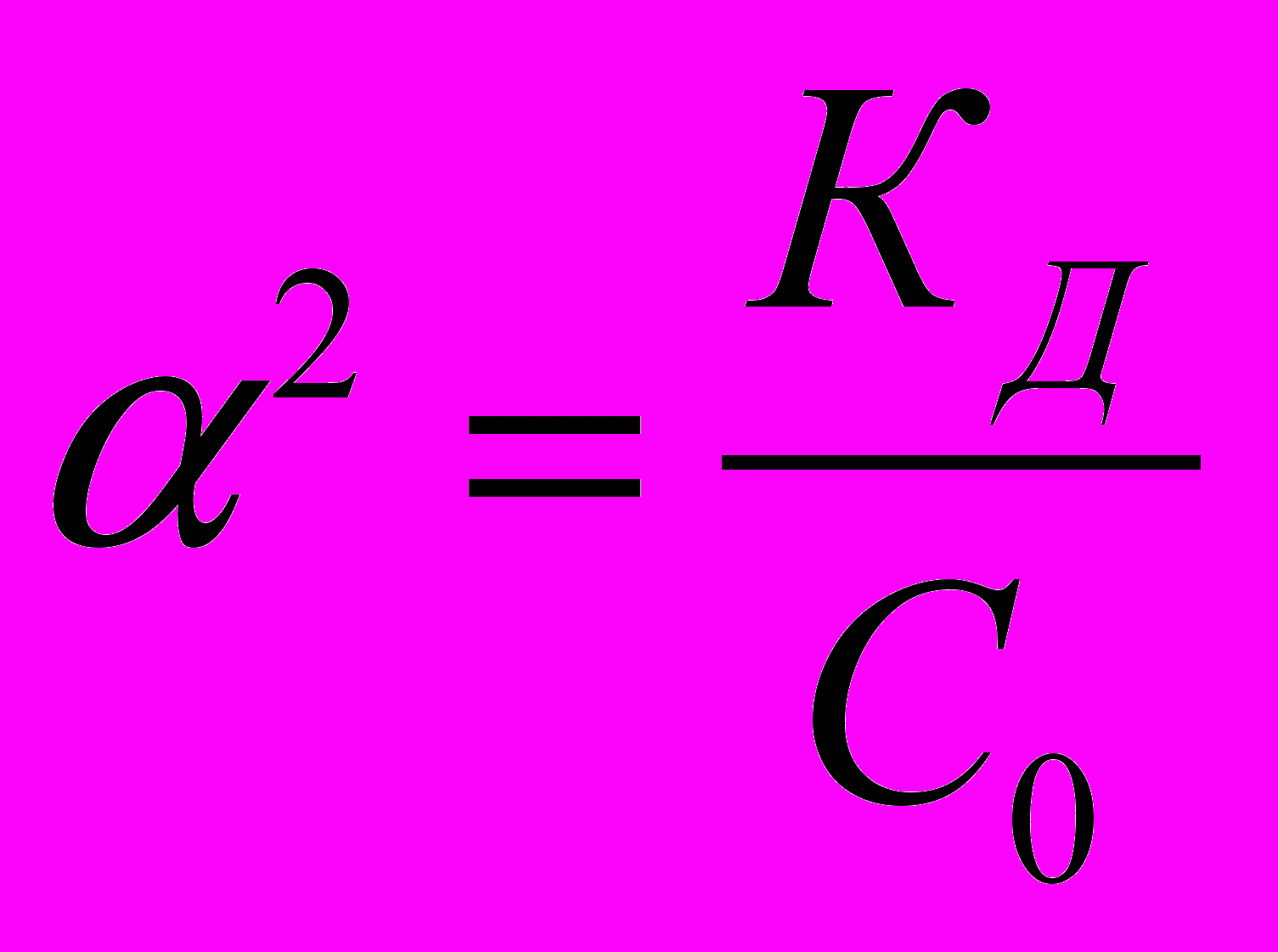
или
= (Кд/С0)1/2
Для 0,1М уксусной кислоты в воде:
= (1,8 105 / 101)1/2 = (0,00018)1/2 = 0,0134,
Для 0,1М бензойной кислоты в воде:
= (6,3 105 / 101)1/2 = (0,00063)1/2 = 0,025
Следовательно, при 250С уксусная кислота диссоциирует на 1,34%, а бензойная кислота на 2,5%.
Вопросы для проверки знаний
- Чем электролиты отличаются от неэлектролитов?
- Кто является основоположником теории электролитической диссоциации?
- Является ли электролитическая диссоциация химическим процессом?
- Что называют степенью диссоциации электролита?
- Чем отличаются сильные электролиты от слабых?
Упражнения
- Напишите несколько химических формул: а) сильных электролитов; б) слабых электролитов.
- Объясните, почему солей слабых электролитов не существует.
- Какие частицы находятся в растворе, если 1г поваренной соли растворить в 100г воды?
- Какие частицы находятся в растворе, если несколько см3 газообразного аммиака растворить в воде?
Задачи
1. Определить степень диссоциации 1М водного раствора уксусной кислоты. Константа диссоциации ее равна 1,8 .10-5 при 250С.
2. Определить степень диссоциации 0,5М водного раствора бензойной кислоты. Константа диссоциации ее равна 6,3.10-5 при 250С.
3. *Объясните с помощью электронных эффектов в молекулах различие констант диссоциации уксусной (1,8 10-5) и бензойной
(6,3 10-5 ) кислот.
