Н. В. Яблокова химия-11 Учебное пособие
| Вид материала | Учебное пособие |
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.
- Д. Д. Яблокова (1896-1993) Карпов, 153.37kb.
- Учебное пособие г. Йошкар Ола, 2007 Учебное пособие состоит из двух частей: «Книга, 56.21kb.
ТЕМА 3. МОЛЕКУЛА
3.1. Модели молекул
Молекулой называется микросистема, состоящая из двух или большего числа ядер и электронов, движущихся в поле ядер. Такое определение предполагает, что валентные электроны атомов перешли в общее владение.
Общее владение электронами соответствует образованию ковалентной химической связи между атомами.
Перекрывание атомных орбиталей создает между ядрами отрицательно заряженную область, которая удерживает положительно заряженные ядра (рис. 11).
Ковалентная химическая связь может быть полярной и неполярной. Неполярной называется ковалентная связь с участием пары электронов, в равной степени принадлежащей обоим атомам. Неполярные ковалентные связи существуют между одинаковыми атомами, обладающими одинаковой электроотрицательностью, например, Н2, Cl2 (рис. 11).
Соединение двух различающихся по электроотрицательности атомов в двухатомную молекулу осуществляется полярной ковалентной связью. В результате перекрывания атомных орбиталей между ядрами создается повышенная электронная плотность, которая удерживает ядра на расстоянии, соответствующем длине химической связи. Длиной химической связи называется расстояние между ядрами химически связанных атомов.
М
 одели:
одели:H2 состава
HН структуры
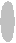

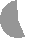

















+
+
+



H
 H с неполярной ковалентной связью
H с неполярной ковалентной связьюа)

перекрывания орбиталей
+
C
 l2 состава
l2 составаClCl структуры
 Cl Cl с неполярной ковалентной связью
Cl Cl с неполярной ковалентной связью

б)

Модель перекрывания орбиталей
Рис. 11. Модели молекул с неполярными ковалентными связями: а) водорода, б) хлора
В отличие от неполярной, в полярной ковалентной связи электронная плотность между ядрами смещается к более электроотрицательному атому (рис. 12).
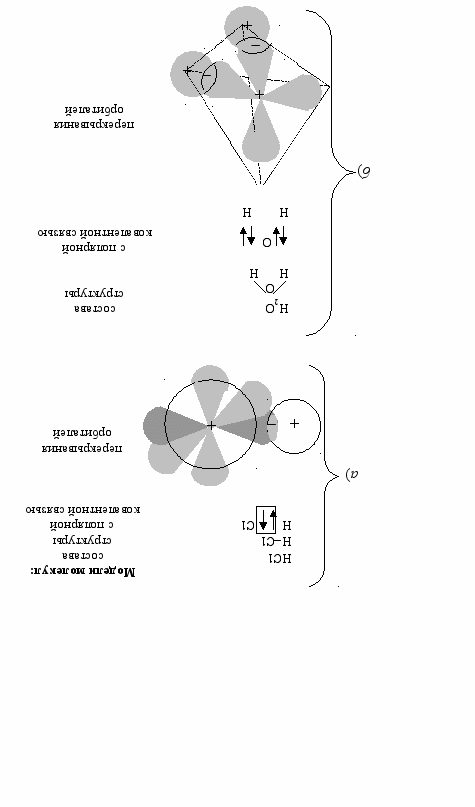
Рис. 12. Модели молекул с полярной ковалентной связью: а) хлороводорода; б) воды
Ковалентные связи имеют жесткие ограничения: во-первых, направленность в пространстве и, во-вторых, насыщаемость. Направленность определяется пространственным расположением орбиталей, участвующих в образовании химических связей. В молекуле воды химические связи НО расположены под углом 104,50. Это связано с тем, что атом кислорода находится в состоянии sp3-гибридизации.
Представления о гибридизации рассматривались в девятом и десятом классах, поэтому воспользуемся теми представлениями, которые нам уже известны. Напомним, что гибридизация представляет собой способ описания перестройки атомных орбиталей в молекуле по сравнению со свободным атомом. В молекуле орбитали атомов разворачиваются под действием электростатического отталкивания. Они представляют геометрическую конфигурацию, соответствующую наименьшему электростатическому отталкиванию. Например, атом углерода в одних соединениях (ацетилен) находится в sp-гибридном состоянии, когда две гибридные орбитали максимально удалены друг от друга и располагаются под углом 1800. В других соединениях (этилен) углерод находится в sp2- гибридном состоянии. Три гибридные орбитали располагаются в одной плоскости под углом 1200. Такое положение гибридных орбиталей соответствует их максимальному удалению друг от друга, обеспечивая наименьшее электростатическое отталкивание. В молекулах алканов углерод находится в sp3-гибридном состоянии. Наиболее благоприятной конфигурацией является положение ядра атома углерода в центре тетраэдра. К углам тетраэдра развернуты гибридные атомные орбитали, угол между которыми 109,280. Любое другое положение sp3-гибридных орбиталей энергетически невыгодно, т. к. потребует усилий для его сохранения.
Насыщаемость связана с тем, что каждый атом имеет ограниченные валентные возможности, если под валентностью понимать число химических связей, которые может образовать атом. Например, атом водорода образует одну химическую связь, атом кислорода две, атом углерода четыре или две в зависимости от партнеров, участвующих в образовании химических связей.
Перекрывание атомных орбиталей, на каждой из которых находится по одному электрону, не единственный путь образования ковалентной связи между атомами. Эта связь может образоваться и при перекрывании орбитали, содержащей пару электронов (донор электронов, лат. donare дарить), с вакантной атомной орбиталью (акцептор электронов, лат. acceptor принимающий).
Ковалентная связь, образующаяся за счет электронной пары одного атома и вакантной орбитали другого, называется донорно-акцепторной или координационной.
Такой тип связи реализуется при растворении, например, хлороводорода в воде. Образуется раствор соляной кислоты, в котором ионы водорода существуют в виде ионов гидроксония.
На рис. 13 представлено образование иона гидроксония по донорно-акцепторному механизму при участии пары электронов атома кислорода и вакантной орбитали иона водорода.
Н2О(ж) + Н+(ж) Н3О+(ж)
В растворе ионы водорода существуют в виде ионов гидроксония Н3О+, в которых ион водорода удерживается у молекулы воды донорно-акцепторной связью.
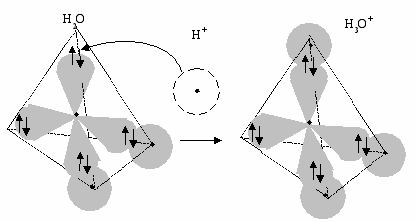
Рис. 13. Модель образования иона гидроксония по донорно-акцепторному механизму
Аналогичная картина наблюдается при образовании иона аммония, если взаимодействуют газообразный аммиак и хлороводород (рис.14).
NH3(г) + HСl(г) NH4Cl(т)
Донорно-акцепторные связи в молекулах встречаются довольно часто. Ниже будет рассмотрена молекула азотной кислоты, где одна из связей азота с кислородом образована по донорно-акцепторному механизму.
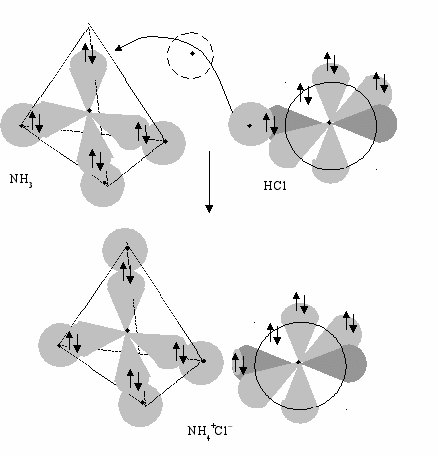
Рис 14. Модель образования иона аммония по донорно-акцепторному механизму
Обычно довольно трудно понять существование молекулы азотной кислоты HNO3. Если определить валентность по числу неспаренных электронов в атомах, то для водорода она равна 1, для кислорода – 2, а азота – 3.
Распаривание s-электронов в атоме азота невозможно – для этого у атома азота нет вакантных орбиталей. Поэтому в галогенидах азот образует только три ковалентные связи (NCl3, NBr3) и не существует таких соединений, как NCl5, или NBr5 в отличие от вполне стабильных производных фосфора PCl5 и PBr5. Фосфор для расширения валентных возможностей располагает вакантными 3d-орбиталями.
Представление о донорно-акцепторном механизме образования ковалентной связи позволяет дать вполне приемлемое объяснение реальному существованию молекул азотной кислоты. В соответствии с классической электронной теорией химических связей Льюиса в молекуле азота строго выполняется правило октета для всех атомов, при этом одна из связей между азотом и кислородом донорно-акцепторная:
Н







2р
О









2р
N


2s
2s
1s



О


Н
О
N
О


Донорно-акцепторная связь обозначена стрелкой
Такая молекулярная структура свидетельствует о том, что атом азота способен проявлять валентность, равную четырем. Одна из четырех ковалентных связей азота образована по донорно-акцепторному механизму, и азот в этом случае является донором неподеленной пары электронов. Но как могла возникнуть вакантная орбиталь в атоме кислорода, как он стал электроноакцептором? Атому кислорода пришлось «потеснить» свои электроны:
О
2р
2р
2s
2s


















О



В следующее мгновение образовалась донорно-акцепторная связь между атомом азота и кислорода:
2s
N


2р
2s
О


















Ионная связь представляет собой бесконечно чередующиеся ряды положительно и отрицательно заряженных ионов, удерживаемых электростатическими силами.
Ионная связь не имеет жестких ограничений (направленности, насыщаемости), присущих ковалентной связи. Она может быть представлена простой электростатической моделью притяжения и отталкивания ионов. Согласно модели, положительно и отрицательно заряженные ионы располагаются в кристаллических телах или в расплаве таким образом, что силы притяжения уравновешиваются силами отталкивания. Электростатическое притяжение и отталкивание регулирует равновесие сил, удерживающих ионы, но не ограничивает размеров кристаллической решетки. Поэтому химическая формула ионного соединения указывает лишь соотношение между катионами и анионами в составе кристалла или расплава. Под расплавом понимается жидкое ионное соединение, в котором отсутствует строгий порядок расположения ионов.
Формула хлорида натрия, NaCl(т), подразумевает ионную структуру Na+Cl(т) (рис. 15). Размеры ионов Na+ и Сl свидетельствуют о переходе валентного 3s-электрона атома натрия на 3р-орбиталь атома хлора. Подобный переход мы уже рассматривали при образовании ионной пары Li+F.























+
+
+
+
+
+
+
+
+
+
+

+
Рис. 15. Модель ионной кристаллической решетки NaCl
Строгого расположения ионов в расплавленном NaCl(ж) не существует, но силы притяжения ионов уравновешены силами отталкивания (рис. 16).
























+
+
+
+
+
+
+
+
+
+
+
+
Рис. 16. Модель расплава хлорида натрия, NaCl (ж)
** 3.2. Координационные или комплексные соединения
В конце XIX века была известна большая группа соединений, состав которых не находил объяснений с позиций классической теории валентности. Швейцарский химик Альфред Вернер (1866–1919) выдвинул идею о координации. Основные положения координационной теории, предложенные Альфредом Вернером, сохраняют свое значение и в настоящее время.
Комплексные соединения включают координационную, внутреннюю сферу, которая состоит из центрального иона или атома-комплексообразователя и окружающих его лигандов – ионов противоположного знака или нейтральных молекул. Внешнюю сферу комплекса образуют ионы, находящиеся на большем расстоянии от комплексообразователя (рис. 17, 18).
Количество лигандов, окружающих центральный ион или атом, называется координационным числом центрального атома или иона.
Природу химической связи в таких соединениях в настоящее время объясняют с позиций донорно-акцепторного взаимодействия. В координационном соединении хотя бы одна из связей – донорно-акцепторная, образуется в результате перекрывания заселенной электронами орбитали лиганда с вакантными орбиталями центрального атома или иона.
В реакции:
CoCl3 + 6NH3 [Co(NH3)6]Cl3
кобальт обладает вакантными 3d-орбиталями, азот – неподеленными электронными парами. Указанное обстоятельство обеспечивает образование донорно-акцепторных связей.
Первые аммиакаты кобальта были получены еще в 1798 г. (Тассерт). Разумеется, их структура не была в те времена известна. Это [Co(NH3)6]Cl3 – оранжевый, [Co(NH3)5 Cl]Сl2 – пурпурный, [Co(NH3)4 Cl2]Сl – зеленый (транс-) или фиолетовый (цис-), [Co(NH3)3 Cl3] – золотистый.
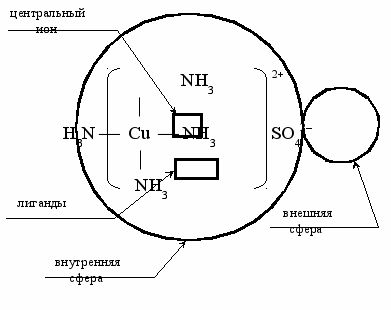
Рис. 17. Координационное соединение [Cu(NH3)4] SO4
При растворении внутренняя сфера координационных соединений устойчива и сохраняется в растворе, отщепляются ионы внешней сферы, что доказывает наличие ионной связи между внутренней и внешней сферой:
CuSO4 (p-p) + 4NH3 (p-p) [Cu(NH3)4]SO4 (p-p)
сульфат тетраамминмеди (II)
[Cu(NH3)4]SO4 (p-p) [Cu(NH3)4]2+ (р-р) + SO42– (p-p)
Если взять за основу заряд координационной сферы, то можно выделить три группы комплексов:
| катионные | анионные | нейтральные |
| [Cu(NH3)4]SO4 | K4[Fe(CN)6] | [Co(NH3)3Cl3]. |
Если элемент-комплексообразователь входит в состав катионного или нейтрального комплекса, то он получает русское название химического элемента с указанием его степени окисления, например: [Cu(NH3)4](OH)2 – гидроксид тетраамминмеди (II), [Cr(H2O)6]Cl3 – хлорид гексааквахрома (III), [Cu(H2O)4]SO4.H2O – гидрат сульфата тетрааквамеди (II)
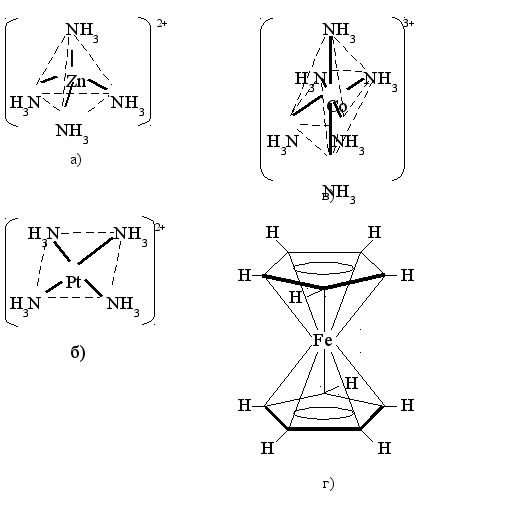
Рис. 18. Геометрическая структура комплексных соединений: а) тетраэдрическая; б) плоско-квадратная; в) октаэдрическая структура; г) ферроцен – сэндвичевая структура
Если элемент-комплексообразователь входит в состав анионного комплекса, то к корню латинского названия элемента добавляют суффикс -ат и степень окисления элемента, например: H2[SiF6] – гексафторосилицат водорода, Na[Al(OH)4(H2O)2] – тетрагидроксодиакваалюминат натрия, K4[Fe(CN)6] – гексацианоферрат (II) калия.
Во внутренней сфере сначала называют анионы, прибавляя к их латинскому названию окончание «о»: Cl– – хлоро, ОН– – гидроксо. Далее называют нейтральные лиганды, число которых указывают греческими числительными: (NH3)2 – диаммин, (H2O)6 – гексааква.
Для катионов металлов координационные числа зависят от размеров катиона и окружающих его лигандов и имеют некоторые постоянные значения, например: Ag+ – 2; Cu2+, Pt2+ – 4; Cr3+, Al3+, Co3+, Fe3+ – 6. Комплексы с координационным числом 2 – линейные, 4 – тетраэдрические или плоско-квадратные, 6 – октаэдрические (рис. 18).
Комплексные соединения присутствуют в живых организмах – это гемоглобин, хлорофилл (см. «Химия-10»), различные витаминные комплексы. Они находят применение как реактивы в аналитической химии, красители, селективные (высоко специфичные) катализаторы биохимических процессов.
