Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие
| Вид материала | Учебное пособие |
- Тема урока «Вода. Свойства воды. Как человек использует свойства воды», 39.35kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Урок. Тема. Вода. Качество питьевой воды. Очистка воды, 49.25kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Опыт применения мембранных технологий general electric и разработок компании «Гидротех», 39.56kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.

Министерство образования Российской Федерации
Томский политехнический университет
Л.Н. Шиян
Свойства и химия воды.
Водоподготовка
Учебное пособие
Издательство ТПУ
Томск 2004
УДК 546 (075.8)
М 22
Шиян Л.Н.
М22 Химия воды. Водоподготовка: Учебное пособие. – Томск: Изд во ТПУ, 2004. – 72 с.
На кафедре общей и неорганической химии ТПУ разработан курс лекций, включающий вопросы химии воды и технические проблемы ее подготовки для различных целей. Раздел «Химия воды» включает источники поступления различных ионов в скважинные воды, их миграцию и причины изменения химического состава воды при выходе на поверхность. В разделе «Водоподготовка» представлены нетрадиционные способы обработки воды. Поиск безреагентных наименее энергозатратных и дешевых технологий приводит к новому подходу при выборе способов обработки воды. В настоящее время такими безреагентными технологиями обработки воды являются: электрокоагуляция, озонирование, УФ-обработка, электроразрядная обработка, кавитация, радиационная обработка воды, а также технологии, включающие воздействие нескольких факторов одновременно, так называемые «адвансированные окислительные технологии» (АОТ), магнитная обработка. Перечисленные методы обработки воды, возможно, вполне перспективны, но требуют дополнительных исследований и научного подхода при описании физики и химии процессов. Учебное пособие содержит информацию о химическом составе скважинных вод г. Томска и Томской области и особенностях подготовки воды северных регионов Томской области.
Учебное пособие предназначено для студентов технических университетов.
УДК 546 (075.8)
Рекомендовано к печати Редакционно-издательским советом
Томского политехнического университета
Рецензенты
Профессор, доктор технических наук директор НИИ ВН
В. В. Лопатин
Кандидат технических наук заведующий лабораторией №12 НИИ ВН Томского политехнического университета
Н.А. Яворовский
© Томский политехнический университет, 2004
© Оформление. Издательство ТПУ, 2004
© Шиян Л.Н.
ВВЕДЕНИЕ
Запасы воды на Земле огромны. Большая часть всей воды сосредоточена в Мировом океане, который занимает почти ¾ поверхности планеты. Общие запасы воды на Земле, по последним подсчётам, составляют около 1,5 млрд. км3. Из общих учтённых на Земле запасов воды на долю вод, которые без особых энергетических затрат могут быть использованы человеком для удовлетворения своих потребностей, приходится только 2,5%. Из 35 млн. м3 пресных вод, потенциально пригодных для использования, почти 69 % заключено в ледниках, а более 30 % - в водоносных слоях глубоко под землей. На долю пресных вод, содержащихся в реках мира, приходится всего 0,006 %общих запасов пресной воды на земле. Эти цифры говорят о том, что воды пригодной человеку для обеспечения его жизнедеятельности на Земле мало.
В природе существует круговорот воды, связывающий воедино все водные ресурсы нашей планеты, где бы они ни находились: в атмосфере, гидросфере, биосфере. Круговорот воды на земле происходит за счет энергии солнца. Вода испаряется, под действием воздушных течений разносится по всему земному шару, конденсируется, выпадает на земную поверхность в виде дождя и снега и снова возвращается в океан. И так без конца. В процессе круговорота вода проходит сложный процесс самоочищения. Каждый год с поверхности Океана и с материков испаряется 520 тыс. км3 воды, вся она выпадает обратно в виде осадков. Причем, большая часть ее попадает сразу обратно в Океан – 410 тыс. км3, а остальное - 110 тыс. км3 орошают сушу, обеспечивая существование всего живого на всех континентах нашей планеты.
Вода важнейший элемент среды обитания человека, без которого само существование высокоорганизованных форм жизни невозможно. Не имея пищевой ценности, вода обеспечивает прохождение всех жизненных процессов в организме. Пищеварение, обмен веществ, синтез тканей и т.п. совершаются при активном участии воды. Она служит растворителем в организме для органических и неорганических веществ, необходимых для поддержания его функций. Вода удаляет из организма вредные продукты, остающиеся после усвоения необходимых веществ, регулирует температуру тела, содержание солей в тканях и жидкостях, участвует во множестве других процессов, без которых невозможно функционирование живых клеток.
Вода используется человеком для обеспечения жизнедеятельности, в технологических процессах, в системах охлаждения и теплоснабжения, в сельском хозяйстве и т. д. В зависимости от назначения используемой воды, качественный и количественный состав примесей, содержащихся в воде, может быть различным. Требования, предъявляемые к воде разного назначения, регламентируются специальными нормативными документами (ГОСТ, Санитарные правила и нормы (СанПиН), РД).
Для использования воды в конкретных целях, ее готовят по специальным технологиям. Для правильного выбора технологии очистки воды, необходимо знать химический состав примесей, растворенных в воде, их количество, в какой форме они существуют и нормативные требования, которым должна соответствовать очищенная вода.
- Свойства и химия воды
В естественных условиях вода никогда не встречается в чистом виде. В процессе своего круговорота вода, соприкасаясь с различными горными и осадочными породами и почвами, растворяет то или иное количество содержащихся в них веществ и превращается в раствор сложного состава. Этот сложный водный раствор веществ, встречающийся в естественных условиях, принято называть природной водой.
1.1Физические свойства воды
На земле нет другого такого соединения, которое обладало бы таким широким набором удивительных свойств, как вода.
1.1.1Аномальные свойства воды
- При замерзании вода расширяется, а не сжимается. Её объём увеличивается на 10%, а плотность соответственно уменьшается. Поэтому лед плавает и защищает зимой водоемы от промерзания.
- Вода единственное вещество на земле, которое существует одновременно в 3-х агрегатных состояниях: твердом, жидком и газообразном.
- У воды исключительно высокая величина поверхностного натяжения (σ), поэтому она способна подниматься по тонким капиллярам.
- При нагревании от 0 до 4С плотность воды увеличивается, а не уменьшается, как у других веществ. Максимальную плотность вода имеет при 4С а не при 0С. Плотность воды при 4С и давлении 1 атм. принята за единицу плотности твердых и жидких веществ.
- Диэлектрическая постоянная воды выше, чем у других жидкостей. Например, бензол – 2,3, хлороформ – 5,1, уксусная кислота – 21, вода – 81.
- Вода обладает высокой теплоемкостью, в 3000 раз большей, чем воздух. Это значит, что при охлаждении 1м3 воды на 1 на столько же нагревается 3000 м3 воздуха.
1.1.2Структура воды
Жидкая вода, соответствующая формуле Н2О в естественных условиях не существует. Полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. Много ученых работают над решением трудной проблемы получения абсолютно чистой воды. Но пока получить такую воду не удалось. Вода, близкая по составу формуле Н2О, находится только в нескольких лабораториях мира, как эталон.
Необычные (аномальные) свойства воды были загадкой для ученых. Выяснилось, что они обусловлены тремя причинами:
- полярным характером молекул;
- наличием неподеленных электронных пар у атомов кислорода;
- образованием водородных связей.
Итак, молекула воды (H2O) состоит из двух атомов водорода (H) и одного атома кислорода (O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его - сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, - по одному ядру водорода.
Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.1а. В соответствии с электронным строением атомов водорода и кислорода молекула воды cодержит пять электронных пар. Они образуют электронное облако. Облако неоднородно - в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром - ядром O2 - (рис. 1.1а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра – ядра O2. Каждый из оставшихся двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра – протоны, оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности. Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер).
Р
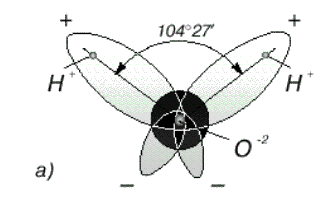
ис. 1.1а. Строение молекулы воды. Угол между связями О-Н
Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.1б).
Р
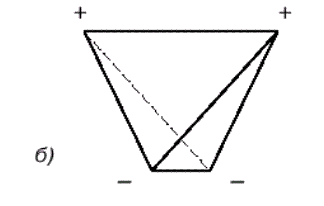
ис. 1.1б. Строение молекулы воды. Расположение полюсов заряда
Общий вид электронного облака молекулы воды показан на рис. 1.1в.
Р
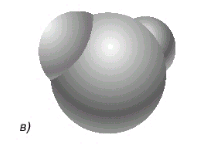
ис. 1.1в. Строение молекулы воды. Внешний вид электронного облака
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким дипольным моментом - 1,87 Дебая (Дебай - внесистемная единица электрического дипольного момента молекул).
Полярность молекул воды, наличие в них частично не скомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества» - ассоциаты.
В температурном интервале от 0 до 100С концентрация отдельных (мономерных молекул) жидкой воды не превышает1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (H2O)x.
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
x H2O = (H2O)x.
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдрическую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоциатов (рис. 1.2).
Р
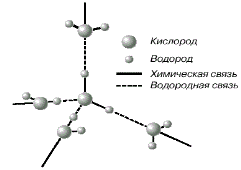
ис.1.2. Схема объединения молекул воды.
Возможны и другие модели водной структуры. Тетраэдрически связанные молекулы воды образуют своеобразные рои довольно стабильного состава. Пространства между роями заполняют мономерные молекулы воды. Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподобной структуры, жидкой воды и мономерных молекул, описан и третий элемент не тетраэдрической структуры. Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов. Изучение структуры жидкой воды еще незакончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире.
Развитие этих представлений помогает понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами
1.1.3Изотопный состав воды
Вода имеет молекулярный вес равный 18. Однако, не все молекулы воды являются одинаковыми. Часть молекул воды имеет вес 19, 20, 21 и даже 22. Это происходит потому, что некоторые молекулы воды составлены не из обычных атомов кислорода и водорода, имеющих атомный вес 16 и 1 соответственно, а из атомов более тяжелых. Кроме атомов кислорода, имеющих атомный вес 16, в воде обнаружены атомы кислорода с весом 17 и 18, которые обозначаются 17О и 18О. Количество «тяжелых» атомов в общей смеси атомов кислорода очень мало и определяется соотношением 16О : 17О : 18О = 3150 : 5 : 1. Для водорода найдены также тяжелые атомы с весом 2 и 3. Изотопы водорода распространены на Земле в соотношении: 1Н (протий) 99,9844%, 2Н (D-дейтерий) 0,0156%, 3Н (Т- тритий) 3х10-16 %. В гидросфере количество протия (1Н) примерно в 6000 раз больше, чем дейтерия.
Открытие изотопов вызвало большой интерес к возможности получения «тяжелой воды». Соединение дейтерия с кислородом D2O называется “тяжелой водой”. По своим физическим свойствам «тяжелая вода» отличается от «обычной воды».
Плотность D2O равна 1,1056 при +4С.
Температура плавления +3,81С.
Кипения +101,4C.
Температура максимальной плотности +11,3С.
«Тяжелая вода» токсична: она замедляет биохимические реакции, и живые организмы в ней погибают. Так как температура плавления «тяжелой воды» +3,81С, то талая вода содержит меньше «тяжелой воды», чем обычная. Было замечено, что люди, живущие в высокогорных районах и использующие для питья талую воду, живут в среднем значительно дольше. Влияние талой воды на продолжительность жизни было подтверждено опытами на животных.
Различие в содержании «тяжелой воды», наблюдающееся в природе, объясняется тем, что происходит частичное разделение изотопов. Одной из главных причин разделения изотопов является процесс испарения. Упругость паров «тяжелой воды» хотя и незначительно, но ниже обычной воды, а так как процесс испарения является основным фактором круговорота воды, то обогащение воды изотопами в местах испарения и обеднения ими в местах конденсации может вызвать заметную разницу в плотностях больших масс воды.
Изотопный состав подземных вод также в значительной степени зависит от атмосферных осадков, но закономерности его формирования значительно сложнее. Больше всего близок к составу атмосферных вод изотопный состав подземных вод зоны активного водообмена. По изменению изотопного состава воды возможно определение взаимосвязи подземных вод с поверхностными водоемами, определение источников питания подземных вод и оценка взаимосвязи водоносных горизонтов.
В глубоких водоносных горизонтах артезианских вод подземное испарение протекает очень слабо, и формирование изотопного состава подземных вод регулируется обменными процессами в системе вода - горная порода.
Так, в Западной Сибири пресные и соленые воды и рассолы выщелачивания каменной соли неглубоких горизонтов (до 500м) по концентрации дейтерия и кислорода-18 напоминают атмосферные воды.
1.2Химические свойства воды
Вода активное в химическом отношении вещество.
Na + 2H2O = H2 +2NaOH
2K + 2H2O = H2 +2KOH
Железо реагирует с водой при нагревании по реакции:
- Вода реагирует со многими металлами с выделением водорода.
3 Fe + 4H2O = 4H2 +Fe3O4
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях такого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
С + H2O = H2 + СО ( при сильном нагревании)
СН4 + 2H2O = 4H2 + СО2 ( при сильном нагревании)
- Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
2Н2О электрический ток 2Н2 + О2
- Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения.
SO2 + H2O = H2SO3 сернистая кислота
SO3 + H2O = H2SO4 серная кислота
СO2 + H2O = H2СO3 угольная кислота
- Некоторые оксиды металлов также могут вступать во взаимодействие с водой.
СаО + Н2О = Са(ОН)2 гидроксид кальция или гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически нерастворима в воде и поэтому с водой не реагирует. Это ZnO, TiO2, Cr2O3, из которых приготавливают стойкие к воде краски. Оксиды железа и алюминия также не растворимы в воде и не реагируют с ней.
- Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
CuSO4 + 5H2O = CuSO4 5H2O
H2SO4 + H2O = H2SO4 H2O гидрат серной кислоты
NaOH + H2O = NaOH H2O гидрат едкого натра
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С помощью их, например, удаляют водяные пары из влажного атмосферного воздуха.
- Особая реакция воды – синтез растениями крахмала (С6Н10О5)n и других подобных соединений (углеводов), происходящая с выделением кислорода.
6nСО2 + 5nН2О = (С6Р10О5)n + 6Н2О
- В комплексных соединениях вода является лигандом и координируется как катионами [Cr(H2O)6]Cl3, [Pt(H2O)2Cl4], так и анионами [A(H2O)m]n-.
- При взаимодействии с солями происходит гидролиз последних с образованием кислых, основных и средних солей:
Na2CO3 + H2O = NaHCO3 + NaOH
FeCl3 + H2O = FeOHCl2 + HCl
Al2S3 + H2O =Al(OH)3 + H2S
Процесс ступенчатого гидролиза солей используют при очистке воды с помощью коагулянтов. Например, при использовании в качестве коагулянта сернокислого алюминия, ступенчатый гидролиз соли протекает по схеме:
AI2(SO4)3 + H2O =AIOH SO4 +H2SO4
AIOH SO4 + H2O = [AI(OH)2]2 SO4 +H2SO4
[AI(OH)2]2 SO4 + H2O=AI(OH)3+H2SO4 +
1.3Химические свойства водных растворов
Благодаря полярному характеру молекул воды и способности ее молекул образовывать химические связи с другими молекулами, вода является самым распространенным растворителем. Поэтому в природе вода никогда не встречается в чистом виде. Природная вода находится в непрерывном взаимодействии с окружающей средой. Она реагирует с атмосферой, почвой, растительностью, минералами и различными породами. При этом вода растворяет органические и неорганические соединения. Природные воды – это растворы, содержащие сложный комплекс минеральных и органических веществ в ионно-молекулярном и дисперсном состоянии. Поэтому природная вода описывается общими закономерностями, присущими растворам.
