Н. В. Яблокова химия-11 Учебное пособие
| Вид материала | Учебное пособие |
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.
- Д. Д. Яблокова (1896-1993) Карпов, 153.37kb.
- Учебное пособие г. Йошкар Ола, 2007 Учебное пособие состоит из двух частей: «Книга, 56.21kb.
МИР МАКРОСИСТЕМ
ТВЕРДОЕ, ЖИДКОЕ И ГАЗООБРАЗНОЕ СОСТОЯНИЯ ВЕЩЕСТВА
Тема 4. Модели и взаимодействия
в макросистемах
4.1. Кристаллическое состояние вещества
В восьмом и девятом классах мы познакомились с ионными, ковалентными, металлическими и молекулярными кристаллическими решетками.
Ионная кристаллическая решетка. Главной отличительной особенностью твердых ионных соединений является наличие в узлах решетки разноименно заряженных ионов, располагающихся в чередующейся последовательности (рис. 29). Силы притяжения и отталкивания между ионами уравновешены.
Ионную кристаллическую решетку имеют все соли, например, галогениды щелочных металлов (рис. 29), оксиды металлов, основания, кислоты. Существуют кристаллы, содержащие в своем составе сложные многоатомные катионы и анионы, такие, как NH4+, РО43, SO42 в таких солях как Са3(РО4)2(т), К2SO4(т), NH4Сl(т).


























+
+
+
+
+
+
+
+
+
+
+
+
Рис. 29. Модель ионной кристаллической решетки хлорида натрия
Выделим основные свойства ионных кристаллических соединений.
1. Низкая электрическая проводимость в твердом состоянии. В твердом теле ионы закреплены в узлах кристаллической решетки и не могут перемещаться. Высокая проводимость в расплавленном состоянии обусловлена свободным перемещением ионов под действием электрического поля.
2. Высокая температура плавления. Такое свойство ионных соединений является следствием высокой прочности ионных связей. Каждый ион Na+ в хлориде натрия окружен шестью ионами Cl, а каждый ион Cl в свою очередь окружен шестью ионами Na+ (рис. 29). Чтобы разрушить кристаллическую решетку хлорида натрия, необходимо нагреть кристалл до 8010С.
3. Неограниченный рост кристалла из насыщенного раствора. Поверхность кристаллического вещества всегда открыта для присоединения из раствора или расплава катионов и анионов, что позволяет формировать кристалл любого размера. Из расплава хлорида калия выращены кристаллы массой до 100 кг. Обнаружены природные кристаллы каменной соли (NaCl) подобных размеров.
4. Хрупкость. Даже при относительно небольшом сдвиге слоев ионного кристалла возникает электростатическое отталкивание, превосходящее электростатическое притяжение. Последнее обстоятельство приводит к разрушению кристалла.
Ковалентная (атомная) кристаллическая решетка. Такую решетку образуют некоторые твердые вещества за счет ковалентных связей, удерживающих атомы в узлах кристаллической решетки. Примерами макромолекулярных структур могут служить алмаз и кремний (рис. 30). Атомы, образующие ковалентную кристаллическую решетку, как правило, либо не отличаются, либо мало отличаются электроотрицательностью. Такие решетки имеют кристаллы алмаза С(алмаз), кремния Si(т), графита С(графит), кварца SiO2(т).
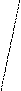
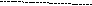
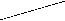

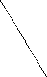
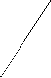





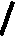




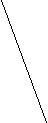
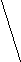
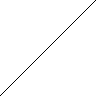
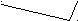



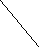
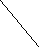
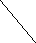

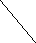
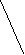
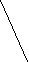

а) б)
Рис. 30. Модель кристалла алмаза и кремния: а) тетраэдрический фрагмент центральный атом окружен четырьмя равноудаленными атомами, находящимися в углах тетраэдра; б) кристалл, построенный из тетраэдрических фрагментов. Алмаз и кремний имеют одинаковую кристаллическую структуру, но различаются прочностью кристаллической решетки
В сущности, кристалл алмаза или кремния любого размера можно рассматривать как гигантскую макромолекулу, атомы которой связаны ковалентными связями, характеризующимися насыщаемостью и определенной направленностью. В кристалле алмаза и кремния атомы находятся в sp3-гибридном состоянии.
Кристаллы с ковалентной кристаллической решеткой, как правило, плохие проводники тепла и электрического тока, обладают высокой твердостью. Прочные ковалентные связи обусловливают высокую прочность таких кристаллов и их высокую температуру плавления. Например, алмаз из твердого состояния возгоняется, минуя жидкое состояние, при температуре выше 35000С. Кремний плавится при 14150С и кипит при 32490С.
Среди подобных кристаллов особое положение занимает графит. Графит имеет слоистую структуру. В пределах одного слоя каждый атом углерода использует три находящиеся в одной плоскости sp2-гибридные орбитали для образования связей с тремя другими атомами углерода. Образуется плоская сетка из шестиугольников, в которых длина -связи lс-с = 0,142 нм. Четвертая связь атома углерода слабая. С её помощью удерживаются углеродные слои, находящиеся на расстоянии l = 0,335 нм.
р-Электроны, принимающие участие в связывании слоев, достаточно подвижны и ведут себя подобно электронному газу в металлической кристаллической решетке. Поэтому графит обладает металлическим блеском и электропроводностью, уступающей металлам, но достаточно высокой, чтобы из него можно было изготавливать электроды. Слоистая структура позволяет графиту быть хорошим смазочным материалом.
Молекулярные кристаллы образуется в результате межмолекулярного взаимодействия как полярных, так и неполярных молекул.
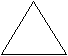
Молекулы-диполи в молекулярном кристалле ориентируются противоположно заряженными частями диполя, выстраиваясь в строгом порядке, например, молекулы воды в кристалле льда (рис. 31).
Металлическая кристаллическая решетка, как следует из названия, характерна для металлов. В узлах кристаллической решетки находятся ионы металла. Внешние (валентные) электроны атомов металла, участвующие в образовании металлической связи, распределяются по всему объему кристалла. В целом кристалл металла остается электронейтральным. Свободно перемещающиеся электроны не связаны с конкретным ионом, а принадлежат всем ионам металла, охватывая их в виде «электронного газа» (рис.32).


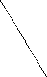
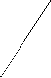



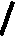



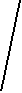


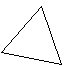
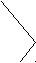

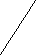







а)
б)

в)
Рис. 31. Модели молекул воды и кристалла льда: а) модель молекулы воды, центральный атом кислорода находится в sp3-гибридном состоянии; б) модель молекулы воды, где в вершинах тетраэдра указаны знаки зарядов; в) кристалл льда
+

+

+

+

+

+

+

+

+

+

+

+













Рис. 32. Модель металлической кристаллической решетки. Черными точками обозначены электроны («электронный газ»)
4.2. Аморфное состояние вещества
К аморфным веществам относятся соединения, которые в жидком состоянии были быстро охлаждены ниже температуры кристаллизации так, что соединение затвердело без кристаллизации. Следовательно, аморфные вещества это переохлажденные жидкости. К таким веществам относятся, например, стекла. Стекла образуются при охлаждении расплавленных оксидов SiO2, CaO, Na2O. В том, что это переохлажденные высоковязкие жидкости, исследователям удалось убедиться, изучая оконные стекла в старинных домах. Хотя стекла и являются твердыми телами, они способны к пластичной деформации (текучести), которую можно обнаружить через длительный срок наблюдений. Было замечено, что основания старинных стекол толще, чем их верхняя часть. Чтобы это обнаружить, понадобилось несколько сот лет.
4.3. Жидкие кристаллы
Хорошо известно, что кристаллические вещества плавятся при определенной температуре. Например, лед плавится при 00С, и температура остается постоянной до тех пор, пока не расплавится весь кристалл льда. Этим свойством отличаются кристаллические от аморфных веществ. Для аморфных веществ не существует определенной температуры плавления. Так происходит со стеклами и некоторыми полимерами. Аморфное вещество постепенно размягчается, появляются капельки жидкости, но температурной остановки не наблюдается.
Кроме того, существуют кристаллические вещества, которые при определенной, свойственной им температуре, сначала мутнеют, а затем окончательно плавятся, давая прозрачные жидкости. Мутная жидкость и есть жидкий кристалл. Область существования жидкого кристалла ограничена двумя температурами: плавления и просветления.
кристалл ⇄ жидкий кристалл ⇄ жидкость
Тпл. Тпросветления
Все жидкие кристаллы органические вещества. Число известных жидких кристаллов превышает десятки тысяч и непрерывно увеличивается. Одно из соединений этого типа приведено ниже:




CH3(CH2)4 CN
4-пентил-4`-цианодифенил
Совокупность множества таких молекул образует жидкий кристалл при комнатной температуре.
С обычными жидкостями жидкий кристалл сближает текучесть, а с кристаллическим веществом некоторые оптические свойства, обусловленные частично упорядоченным расположением молекул (рис. 33).
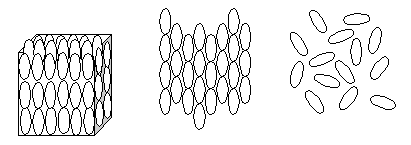
а) б) в)
Рис. 33. Модели упорядоченных структур в жидких кристаллах. Молекулы представлены в виде эллипсов, и их длинные оси параллельны: а) твердое кристаллическое вещество; б) жидкий кристалл текучая непрозрачная жидкость, структура упорядочена в одном направлении; в) текучая прозрачная жидкость, упорядоченная структура отсутствует
Комнатные термометры, цифровые экраны в часах и микрокалькуляторах содержат жидкие кристаллы. Структура жидкого кристалла, представленная на рис. 33 б, состоит из полярных, развернутых в одном направлении молекул. Для изменения ориентации молекул достаточно очень слабого электрического поля. Это вызывает изменение оптических свойств жидкого кристалла. Именно так происходит смена показаний на экране микрокалькулятора или на экране кварцевых часов.
4.4. Жидкое состояние вещества
В жидкости молекулы расположены довольно близко друг к другу, почти так же близко, как в кристалле. Однако жидкость отличается от кристаллического состояния беспорядочным (хаотическим) перемещением молекул (или ионов). Компактное размещение молекул при их подвижности обеспечивает высокую плотность и малую сжимаемость жидкости. Вода, например, имеет плотность выше, чем такие металлы, как натрий или калий, хотя плотность большей части металлов превосходит плотность воды и органических жидкостей. Свободное перемещение молекул жидкости позволяет молекулам совершать колебательное, вращательное, поступательное и деформационное движения, в то время как в кристалле движение частиц ограничено колебанием в узлах кристаллической решетки.
При атмосферном давлении и температуре 298К большинство природных веществ находится в твердом или газообразном состоянии. Относительно малая распространенность жидкостей в природе не сразу бросается в глаза из-за чрезвычайно большого количества одной-единственной жидкости морской и пресной воды. Но и её на поверхности планеты ничтожное количество по сравнению с земной твердью. Если представить, что Земля это футбольный мяч, то вся вода, покрывающая поверхность, равна трем слезинкам.
Жидкости таинственные вещества. До сих пор нет четкой теории, описывающей это состояние. Образование жидкости из твердого тела есть следствие разрушения кристаллической решетки и ослабления межмолекулярного взаимодействия. Для того чтобы расплавить кристалл, требуется энергия, которая может поступить из окружающей среды. Поскольку молекулы жидкости движутся непрерывно и беспорядочно, у некоторых из них энергии оказывается достаточно, чтобы оторваться с поверхности и перейти в газообразное состояние. Если существует равновесие между жидким и газообразным состояниями вещества, то его называют: равновесие жидкость пар. Если вся жидкость перешла в газообразное состояние, то о таком состоянии говорят, что это газ.
4.5. Газообразное состояние вещества
Газообразное состояние вещества характеризуется большими расстояниями между частицами (атомами и/или молекулами) по сравнению с расстояниями между частицами твердого тела или жидкости. Поэтому взаимодействие между частицами газа (притяжение и отталкивание) практически отсутствует. Хаотическое движение частиц позволяет газу занимать весь предоставленный ему объем. Для жидкостей и твердых веществ это не характерно.
Состояние идеального газа подчиняется уравнению:
PV = nRT
Уравнение состояния идеального газа позволяет рассчитать объем V [м3], давление Р [Па] и температуру Т [К] для любого количества вещества n [моль], используя значение газовой постоянной R = 8,314 [Дж/мольК].
Пример. В стеклянном сосуде объемом 1 л содержится газообразная вода при 1200С. Давление газа равно 190 мм рт. ст. Какое количество (моль) воды содержится в данном сосуде?
В соответствии с уравнением состояния идеального газа
n = PV/RT
известно, что 1 атм = 760 мм рт. ст. = 1,013105Па или 1 мм рт. ст. = 133,3 Па.
n =190133,3 [Па] 110 [м3]/ 8,314 [Дж/моль К] 393 [К] = 7,7510 моль.
Вопросы для проверки знаний
- Какие типы кристаллических решеток существуют в твердом йоде, броме, воде, алмазе, графите, железе, хлориде натрия?
- Почему кристаллы солей, а также кристаллы с молекулярными и ковалентными кристаллическими решетками под действием деформирующей силы дают трещины и раскалываются, а металлы лишь изменяют форму без разрушения кристалла?
- Приведите модели ионных, ковалентных, молекулярных и металлических кристаллических решеток. В какой из них частицы в узлах кристаллической решетки не связаны химическими связями?
- *Объясните, каким образом тип ионной связи в кристалле определяет его физические свойства?
- Объясните появление «свободных» электронов в металлической кристаллической решетке.
- В чем сходство и различие между аморфным веществом и жидкостью?
- Какие структурные особенности позволяют выделить среди макросистем группу жидких кристаллов?
- В жидкостях и газах молекулы движутся беспорядочно, однако жидкости практически несжимаемые вещества, в то время как газы легко сжимаются. Объясните это различие газов и жидкостей.
Упражнения
- Докажите, что кусок металла можно рассматривать как одну гигантскую молекулу.
- Алмаз используется в режущих инструментах, а графит нет. Докажите, что структура кристаллической решетки играет в этом определяющую роль.
- Область существования жидкого кристалла ограничена температурами плавления и просветления. Дайте модели структуры каждого из состояний органического вещества.
