Н. В. Яблокова химия-11 Учебное пособие
| Вид материала | Учебное пособие |
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
- Глинка Николай Леонидович. Общая химия: учебное пособие, 501.78kb.
- Учебное пособие Житомир 2001 удк 33: 007. Основы экономической кибернетики. Учебное, 3745.06kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 454.51kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 794.09kb.
- Учебное пособие, 2003 г. Учебное пособие разработано ведущим специалистом учебно-методического, 783.58kb.
- Е. Г. Непомнящий Учебное пособие Учебное пособие, 3590.49kb.
- Учебное пособие Сыктывкар 2002 Корпоративное управление Учебное пособие, 1940.74kb.
- Д. Д. Яблокова (1896-1993) Карпов, 153.37kb.
- Учебное пособие г. Йошкар Ола, 2007 Учебное пособие состоит из двух частей: «Книга, 56.21kb.
* Близкие значения k указывают на обоснованность предположений Канниццаро
Завершился выдающийся этап научных исследований в химии. Он начинался количественными измерениями массы, объема и давления газов, выполненными еще Бойлем. Количественные измерения (взвешивание) позволили Лавуазье установить закон сохранения массы в химических реакциях. Пруст доказал постоянство состава химических соединений, опираясь на количественные измерения процентного содержания элементов в соединениях, а Дальтон установил закон кратных отношений и по праву признается создателем атомистического учения. Он не сомневался в существовании атомов и предложил метод определения относительной атомной массы по водороду.
Перед химиками открылась возможность использования метода Канниццаро для точного вычисления относительных атомных масс элементов и химических формул газообразных химических соединений.
**Для n моль газов справедливы:
Закон Бойля-Мариотта: V~1/Р (при постоянных Т и n)
Закон Гей-Люссака: V~T (при постоянных Р и n)
Закон Авогадро: V~n (при постоянных Р и Т)
Следовательно, объем газа должен быть пропорционален произведению всех трех величин, от которых он зависит:
V~nT/P
Введем коэффициент пропорциональности R,тогда
PV=nRT
Получили хорошо известное уравнение состояния идеального газа, где R= 8,314 Дж/мольК. Уравнение позволяет вычислить молярную массу (М) соединения, если известны объем V [м3], давление P [Па], температура T [К] и масса газа m [кг] (все размерности приведены в системе СИ):
M =mRT /PV/, где n=m/M
1 моль это количество вещества, содержащее столько частиц, сколько атомов углерода содержится в 0,012 кг атома 12С, n = N/NA, где N – число частиц, NA – число Авогадро.
Зная молярную массу, нетрудно ввести понятие «моль», которое является единицей измерения количества вещества.
**Была также преодолена проблема определения относительных атомных масс нелетучих веществ, прежде всего, металлов, которые трудно получить в газообразном состоянии из-за их низкой летучести (высокой температуры кипения).
Дюлонг и Пти установили, что молярные теплоемкости ( С) твердых веществ, для которых были известны относительные атомные массы, имеют значения, близкие к 25 Дж/мольград. (СМ = 25 Дж/мольград). Вспомним, что теплоемкость – это количество теплоты, поглощаемой телом при нагревании на 1 градус; если 1 молем вещества – это молярная теплоемкость, если 1г вещества – удельная теплоемкость. Достаточно было определить удельную теплоемкость Cуд [Дж/гград], например, чистого металла, чтобы затем вычислить относительную атомную массу металла (Аr) по уравнению:
СМ = 25 [Дж/мольград] = Аr Cуд [Дж/гград]
Пример. Измерения удельной теплоемкости серебра показали, что эта величина равна 0,233 Дж/гград. Определить Аr серебра
Решение
Аr=25 [Дж/мольград] /0,233 [Дж/гград]= 107 [г/моль].
Надежный метод определения относительных атомных масс позволил подойти к открытию периодического закона и составить периодическую систему химических элементов.
1.7. Периодический закон химических элементов
Д. И. Менделеева
Открытие периодического закона химических элементов было подготовлено трудами предшественников и современников русского химика Д.И. Менделеева (18341907). Задачу классификации химических элементов Менделеев решил в 1869 г., открыв периодический закон. К тому времени были установлены близкие современным атомные массы многих химических элементов, развито учение о валентности химических элементов и открыто сходство кристаллических форм различных химических элементов (изоморфизм).
В период поиска Менделеевым принципов классификации химических элементов атомные массы многих элементов нуждались в серьезном уточнении. Из 60 элементов, известных в ту пору, почти у одной трети величины атомных масс имели разные значения по данным разных авторов.
Менделееву пришлось выйти за рамки привычных представлений о химических элементах. Основная трудность состояла в том, что не известны были причины периодического изменения свойств. Тот факт, что «Физические и химические свойства элементов…состоят в периодической зависимости…от их атомного веса», как писал Менделеев в 1869 г., скрывали истинные причины, на которые Менделеев указывал. По его мнению «…периодическая изменяемость простых и сложных тел подчиняется некоторому высшему закону, природу которого, а тем более причину ныне еще нет средств охватить. По всей вероятности, она кроется в основных началах внутренней механики атомов и частиц». Потребовалось почти 60 лет после открытия периодического закона, чтобы раскрыть фундаментальные причины периодической зависимости свойств химических элементов от заряда ядра атома. Современная формулировка периодического закона выглядит следующим образом: физические и химические свойства элементов находятся в периодической зависимости от заряда ядра атома.
Честь открытия периодического закона принадлежит Менделееву не только из-за приоритета публикации периодической системы элементов. Действительная причина состояла в том, как Менделеев построил периодическую систему. Чтобы выполнялось требование, согласно которому в вертикальных столбцах должны находиться элементы с одинаковой валентностью, Менделеев был вынужден в ряде случаев элементы с несколько большей массой поместить перед элементами с меньшей массой. Так, теллур (атомная масса 127,6, а валентность 2) был помещен перед йодом (атомная масса 126,9, валентность 1), чтобы теллур оказался в одном столбце с двухвалентными элементами, а йод в компании с одновалентными элементами.
Глубоко убежденный в том, что им открыт один из важнейших законов природы, Менделеев смело взял его за основу при оценке имеющихся экспериментальных данных. Он предложил не только расположить некоторые элементы вопреки известным в то время величинам атомных масс, но и изменил атомные массы многих элементов (In, La, Y, Er, Ce, Th,U).
Он допустил существование еще не открытых элементов и не только оставил для них в периодической таблице пустые места, но и на основе периодического закона дал их подробную химическую характеристику. Наиболее детально в 1871 г. были предсказаны свойства элементов с атомными массами 44, 68 и 72, названных Менделеевым экабором, экаалюминием и экасилицием. В 1975 г. француз Лекок де Буабодран открыл новый элемент с атомной массой 69,7; названный им галлием (Ga). Еще через 4 года Нильсон и Клеве выделили элемент с атомной массой 45,1 и назвали его скандием (Sc). Наконец, в1886г. немецкий химик Винклер открыл германий (Ge) и показал, что его атомная масса равна 72,6. Ближайшее изучение всех трех элементов и их соединений обнаружило прекрасное совпадение найденных на опыте свойств со свойствами, предсказанными еще в 1871 г. Менделеевым. Примером могут служить данные для германия (табл.2).
Т а б л и ц а 2
Сопоставление свойств экосилиция и германия
Свойства | Предсказаны Менделеевым для экасилиция в1871 г | Определены для германия Винклером в 1886 г |
Атомная масса | 72 | 72,6 |
Удельный вес | 5,5 | 5,35 |
Взаимодействие с кислотами | Металл не будет вытеснять водород из кислот | Не растворяется в НСl и разбавленной H2SO4 |
Формула окисла | ЭО2 | GeO2 |
Удельный вес окисла | 4.7 | 4,7 |
Способность окисла восстанавливаться | Окисел будет легко восстанавливаться до металла | GeO2 восстанавливается до металла в струе водорода |
Свойство гидроокиси | Основные свойства гидроокиси будут выражены слабо | Основные свойства для Ge(OH)4 не характерны |
Хлорид и его свойства | Хлорид ЭСl4 будет жидкостью с Ткип.=900С и удельным весом 1,9 | GeCl4 – жидкость с Ткип. =830С и удельным весом 1,887 |
«Нет никакого сомнения в том, что вновь найденный элемент есть ничто иное, как предсказанный 15 лет тому назад Д.И. Менделеевым экасилиций. Едва ли можно найти иное более поразительное доказательство справедливости учения о периодичности, как осуществление гипотетического экасилиция во вновь открытом элементе. Это не просто подтверждение смелой теории: здесь мы видим очевидное расширение химического кругозора, мощный шаг в область познания», писал Винклер в 1886 г.
Периодический закон дал толчок к накоплению экспериментального материала и обоснованию многих качественных и количественных свойств химических элементов.
Вопросы для проверки знаний
- Можно ли утверждать, что истина это то, что хотят узнать ученые?
- Какие основания заставляют людей заниматься научной деятельностью?
- Какие элементы-стихии положены в основу построения окружающего мира древними греками?
- Какой признак, по мнению Р. Бойля, отличает соединение от элемента?
- Как Лавуазье доказал, что элемент-«вода» не превращается в элемент-«землю»?
- Какими измерениями Ломоносов, а позже и Лавуазье доказали существование закона сохранения массы?
- Почему Дальтон заслуженно считается создателем химической атомистики?
- В чем состоит вклад в науку Канниццаро?
Упражнения
- Докажите или опровергните утверждение: «Среди людей, зарабатывающих на жизнь, ученых чрезвычайно мало».
- Докажите, что открытие Прустом закона постоянства состава химических соединений открывало дорогу к созданию химической атомистики.
- Можно ли утверждать, что заслуга Менделеева состоит только в том, что он установил закон периодического изменения свойств элементов?
Задачи
- Одно и то же количество металла соединяется с 4,8 г кислорода и 48 г одного из галогенов. Какой это галоген?
Ответ: бром.
- 2,71г хлорида трехвалентного металла взаимодействуют с 2г гидроксида натрия. Назовите металл. Ответ: железо.
- Приведены относительные молекулярные массы нескольких газообразных соединений АхВу и массовые доли элемента А в данных соединениях. Пользуясь методом Канниццаро, установите элементы и химические формулы газообразных соединений.
| Соединение | Молекулярная масса АхВу | Массовая доля В в соединении АхВу |
| 1 | 46,0 | 0,7 |
| 3 | 44,0 | 0,36 |
| 4 | 30,0 | 0,53 |
| 5 | 108,0 | 0,74 |
Ответ: элемент О, соединения NO2, N2O, NO, N2O5.
МИР МИКРОСИСТЕМ
АТОМЫ И МОЛЕКУЛЫ
ТЕМА 2. АТОМ
2.1. Атомное ядро
До сих пор изучение строения атома ограничивалось составом и структурой электронных орбиталей, т.к. именно электроны принимают участие в химических превращениях. В свою очередь, состав и структура орбиталей атома определяется зарядом ядра.
Ядро центральная массивная часть атома, состоящая из нуклонов (протонов и нейтронов).
Атом может находиться в электронейтральном состоянии или в виде отрицательно или положительно заряженного иона. В любом из этих состояний структура и состав электронной оболочки, а значит и химические свойства, определяются числом протонов в ядре.
Если изменяется заряд ядра, то изменяется природа химического элемента. Достаточно обратиться к элементам в периодической системе, чтобы убедиться в этом. Например, атомы водорода, гелия и лития различаются по своим химическим свойствам. Они разные, потому что у них разные ядра.
Любое атомное ядро – это нуклид (от лат. nucleus ядро) с заданным числом протонов (Z) и нейтронов (N). Различают стабильные нуклиды и радионуклиды. Радионуклиды неустойчивы, с течением времени они самопроизвольно распадаются, превращаясь, в конечном счете, в стабильные нуклиды. Говорят, что такие ядра проявляют радиоактивность.
Радиоактивность (от лат. radio излучаю и activus действенный) это самопроизвольный процесс превращения нестабильных ядер в другие ядра, сопровождающийся либо электромагнитным излучением (-излучение), либо выбросом электронов, нейтронов или -частиц (ядра атома гелия).
Например, у радиоактивного йода-131 неустойчивое ядро. За 8,1 суток половина атомов радиоактивного йода превращается в стабильные атомы инертного газа ксенона. Наблюдается разительное изменение природы элемента. Галоген превращается в благородный газ ксенон:
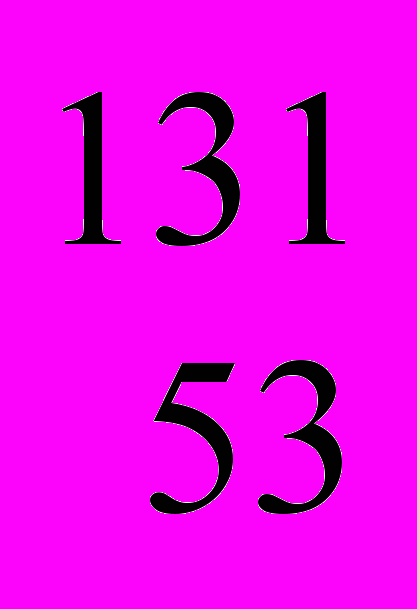 I
I 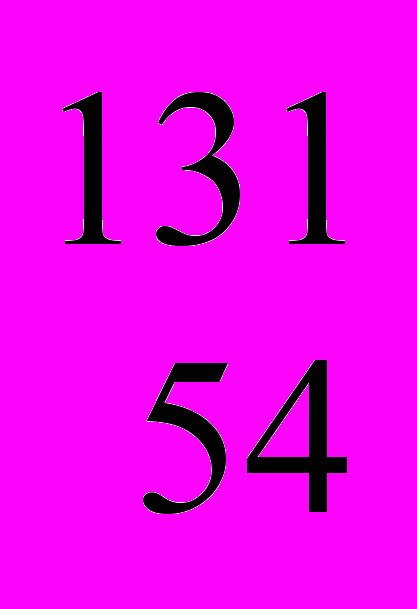 Xe + e (распад)
Xe + e (распад)При радиоактивном превращении не имеет значения состояние атома. Он может входить в состав сложного или простого вещества, его радиоактивные свойства от этого не изменяются. Верхний индекс слева от символа химического элемента обозначает массовое число А. A=Z+N, где, как уже указывалось, Z число протонов и N число нейтронов в ядре. Нижний индекс обозначает число протонов Z в ядре и, соответственно, заряд ядра атома (номер элемента в периодической системе).
Появление электронов е при радиоактивном распаде иода-131 обусловлено тем, что внутри ядра с неизбежно повторяющейся последовательностью происходит превращение нейтронов в протоны с выделением из ядра электронов:
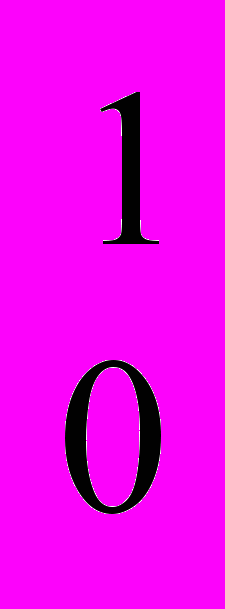 n
n 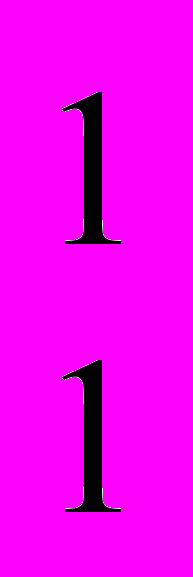 р + е
р + еПревращение нейтрона в протон увеличивает заряд ядра на единицу практически при неизменной массе ядра, т.к. электрон почти в 2000 раз легче протона.
Радиусы ядер (r) химических элементов вне зависимости от числа протонов и нейтронов имеют один и тот же порядок 10м.
Химический элемент может быть представлен несколькими нуклидами. Например, водород существует в виде трех природных нуклидов: протия
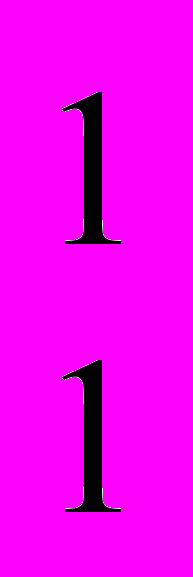 H, дейтерия
H, дейтерия 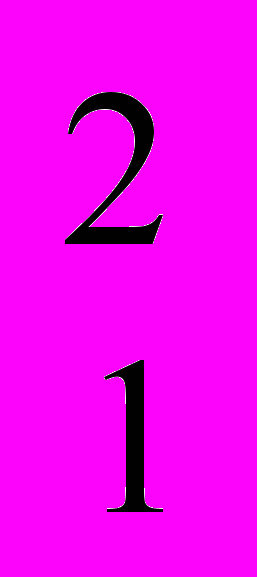 H и трития
H и трития  H. Первые два протий и дейтерий устойчивые, а тритий радиоактивный нуклид с периодом полураспада 12,3 лет. Общее число известных радионуклидов искусственного и естественного происхождения превышает 1800.
H. Первые два протий и дейтерий устойчивые, а тритий радиоактивный нуклид с периодом полураспада 12,3 лет. Общее число известных радионуклидов искусственного и естественного происхождения превышает 1800. Нуклиды, имеющие одинаковый заряд ядра Z, но различные массовые числа А, называются изотопами.
Термин «изотопы» правильно использовать во множественном числе. Например, можно сказать, что изотопы это нуклиды одного и того же элемента. В качестве эквивалентного термину «массовое число» допустимо использовать термин «нуклонное число», т.к. протоны и нейтроны имеют общее название «нуклоны».
2.2. Воздействие радиоактивного излучения
на живые организмы
Радиоактивное излучение представляет собой поток частиц электромагнитного поля (-излучение) и частиц вещества (нейтронов, электронов, ядер гелия). Излучение частиц вещества и поля обладает разной проникающей способностью. Оно способно ионизировать атомы вещества, встречающиеся на их пути, поэтому радиоактивное излучение называют ионизирующим излучением.
-Лучи и нейтроны пронизывают ткань человеческого организма и способны проникать сквозь полуметровую бетонную стену. Электроны (-лучи) проникают на глубину примерно 1 см в ткань человеческого тела. Ядра гелия (-лучи) задерживаются листком бумаги или кожным покровом человека (рис. 4).
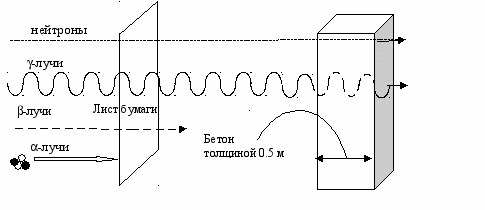
Рис. 4. Модель действия некоторых типов ионизирующего излучения
Когда ионизирующее излучение проходит через живой организм, оно передает свою энергию клеткам, из которых состоят ткани тела. Общее количество поглощенной тканями энергии излучения может быть небольшим, сопоставимым с энергией, получаемой после выпитой чашки горячего чая или после нескольких минут принятия солнечных ванн в теплый день. Но все дело в том, что энергия горячего чая или потока солнечной энергии при пребывании на солнце в течение нескольких минут поглощается тканями равномерно и на довольно большой поверхности тела.
В случае ионизирующего излучения «удар» ничтожной по своим размерам микрочастицы (электрона, нейтрона, ядра атома гелия или -частицы), обладающей высокой энергией, приходится на ничтожно малый участок, всего на одну молекулу в клетке и поэтому становится страшным по своей силе.
Представим, например, что брошенное копье ударяется о щит плашмя. Энергия удара приходится на большую поверхность и щит выдерживает такой удар. Другой вариант, когда та же энергия движения копья сосредоточена на острие. Копье разрушает щит и проходит сквозь него.
Ионизирующее излучение представляет собой очень большие порции энергии, сосредоточенные в ничтожно малом объеме. Какие изменения в клетке живого организма вызывает такой удар? Ионизирующее излучение может вызвать:
- возникновение раковых клеток (злокачественной опухоли);
- генетические мутации в половых клетках, оказывающие влияние на будущие поколения;
- смерть после интенсивного облучения.
Первые два изменения являются биологическими последствиями, наиболее часто связанными с ситуацией, когда люди подвергаются незначительным дозам облучения. Третье возможно лишь при получении больших доз облучения во время атомного взрыва (так это было, когда на японские города Хиросима и Нагасаки сбросили атомные бомбы) или аварии на атомном реакторе.
2.3. Источники радиации
Естественная радиация была и будет всегда. Она слагается из потока космических лучей, достигающих поверхности Земли и потока радиоактивного излучения элементов, содержащихся в земной коре и пище. Наши жилища тоже являются источником ионизирующего излучения, так как построены из силикатных строительных материалов. Уровень радиации из естественных источников остается относительно постоянным. В природе есть два очень важных радиоактивных элемента. Это уран-238 (
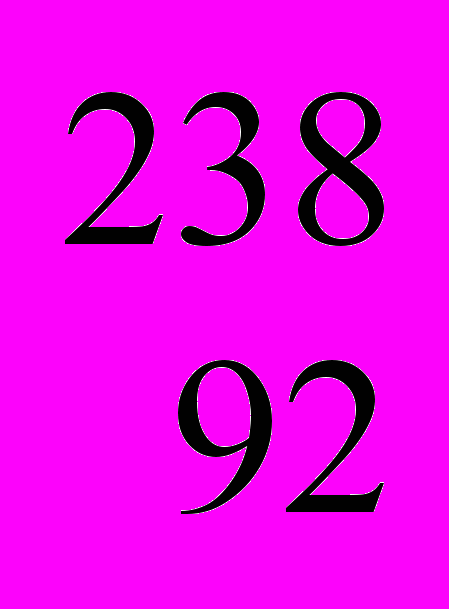 U) и торий-232 (
U) и торий-232 (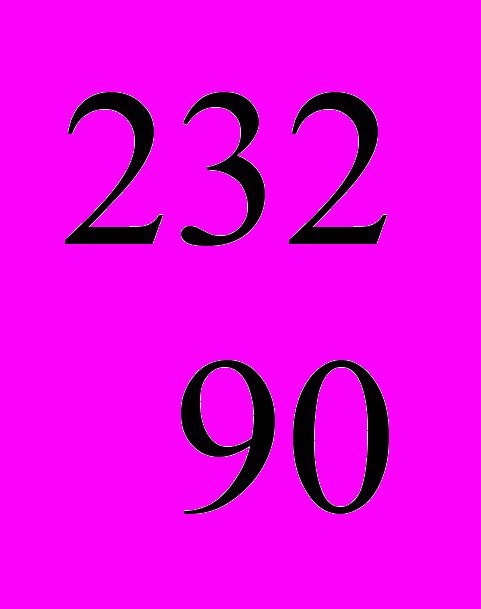 Th). Они распадаются медленно. Например, время, за которое подвергнется радиоактивному превращению половина исходного количества
Th). Они распадаются медленно. Например, время, за которое подвергнется радиоактивному превращению половина исходного количества 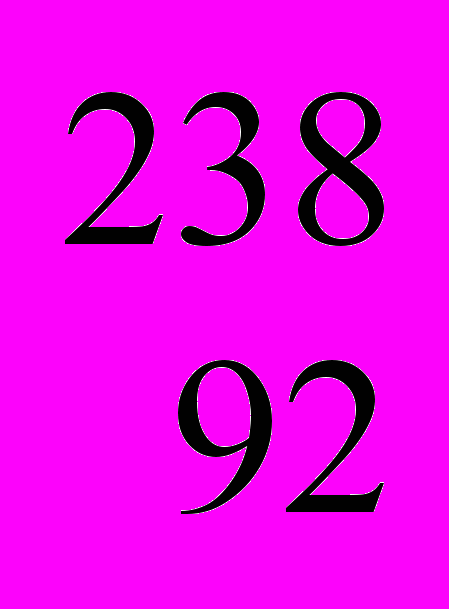 U, равно 4,51 млрд. лет (4,51109 лет период полураспада урана). По мере радиоактивного распада и исчезновения урана и тория излучение испускают их радиоактивные продукты, такие как радий и радон, имеющие более короткие периоды полураспада. Таким образом, стены наших жилищ «дышат» радиоактивным газом радоном, который попадает к нам в легкие с вдыхаемым воздухом.
U, равно 4,51 млрд. лет (4,51109 лет период полураспада урана). По мере радиоактивного распада и исчезновения урана и тория излучение испускают их радиоактивные продукты, такие как радий и радон, имеющие более короткие периоды полураспада. Таким образом, стены наших жилищ «дышат» радиоактивным газом радоном, который попадает к нам в легкие с вдыхаемым воздухом. Так как в почве содержатся незначительные количества радиоактивных элементов, то, вполне естественно, что они попадают к нам в пищу с плодами, зерном, овощами. Дозы естественного излучения, безусловно, оказывают вредное воздействие на живой организм. Этот неизбежный для человека и других живых организмов фон радиоактивного излучения «задевает» тех, кто к этому наиболее расположен. Поэтому превышение этого фона за счет искусственной радиоактивности, создаваемой в результате деятельности человека, не может не тревожить.
Источником искусственного радиоактивного загрязнения служат атомные электростанции. Ядерная «топка» представляет собой активную зону объемом с большую жилую комнату. В ней содержится годовой запас ядерного топлива более 100 т оксида урана в трубках из циркония, герметично закрытых для предотвращения утечки радиоактивных веществ. В трубках длиной 3,7 м аккуратно размещены таблетки оксида урана размером с наперсток. Таких таблеток набирается около 10 миллионов. В оксиде урана-238 содержится несколько процентов урана-235, который, служит «горючим» в ядерном реакторе. Герметично закрытые трубки с таблетками объединяют в пакеты. Это и есть топливные элементы, которые помещают в реактор, заполненный чистой водой или другим замедлителем нейтронов, образующихся при делении атомов урана-235. Выделяющаяся при делении ядер энергия, разогревает воду, выполняющую функцию не только замедлителя нейтронов, но и теплоносителя. Энергию образующегося пара в паровой турбине превращают в электрическую энергию.
По мере работы атомного реактора в топливных элементах накапливаются продукты деления, в том числе такие опасные радиоактивные вещества как йод
 I (-излучатель), цезий
I (-излучатель), цезий  Cs (- и -излучатель), стронций
Cs (- и -излучатель), стронций 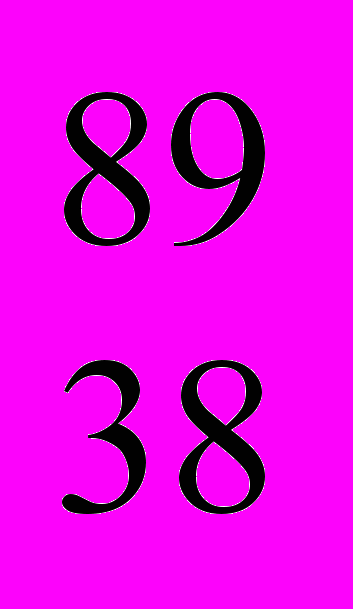 Sr,
Sr, 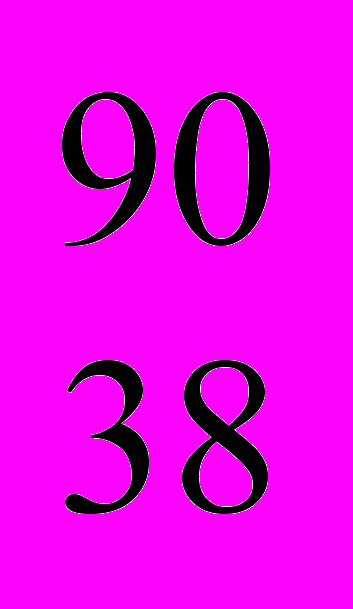 Sr (-излучатели), а также радиоактивные газы криптон
Sr (-излучатели), а также радиоактивные газы криптон 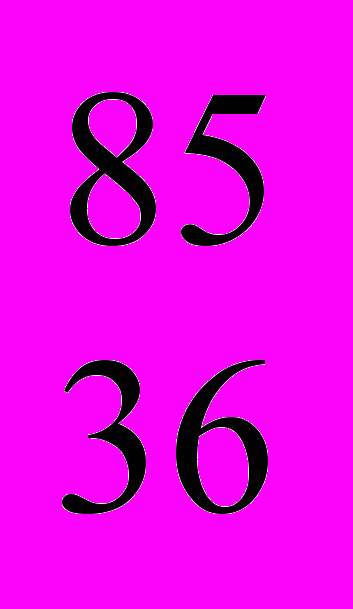 Kr и
Kr и 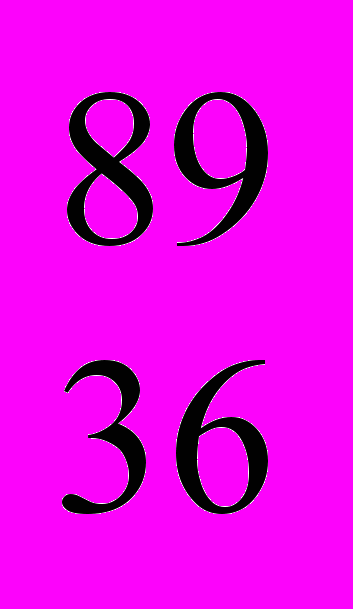 Kr (-излучатели).
Kr (-излучатели).Если посмотреть на атомную электростанцию со стороны, то можно заметить среди её корпусов высоко поднимающуюся трубу. Зачем атомной электростанции труба, ведь здесь ничего не сжигают в общепринятом смысле этого слова? На атомной электростанции может происходить утечка радиоактивности двумя путями. Первый путь выделение радиоактивных газов. Продукты деления просачиваются сквозь изоляционное покрытие топливных элементов. Прежде всего это криптон и йод. Йод переходит в газообразное состояние при высокой температуре топливного элемента. Йод задерживается в газоочистительной системе электростанции. Криптон-85 и криптон-89 невозможно удержать в газоочистительной системе. Это химически инертное вещество уходит в атмосферу. Образующийся в огромном количестве криптон-85 имеет период полураспада 11 лет. В силу химической инертности он не задерживается в легких при его вдыхании. Криптон-89 более опасен, поскольку распадается до радиоактивного стронция твердого вещества, сходного по химическим свойствам с кальцием и, следовательно, способного замещать кальций в скелете человека.
Второй путь, по которому радиоактивные вещества могут попасть в организм человека, водяная система охлаждения реактора, которая находится в контакте с топливными элементами. Попадание в воду даже ничтожных количеств радиоактивных стронция и цезия, а также следов радиоактивного кобальта, образующегося в результате активации металлических конструкций реактора, представляет серьезную опасность. Вода атомного реактора подвергается тщательной очистке и разбавляется, прежде чем поступает в водоемы общего пользования. Уровень радиоактивности в отработанной воде крайне мал. Однако здесь есть несколько более тонкие соображения. Рыба, моллюски, водоросли могут избирательно поглощать радиоактивные элементы и, следовательно, накапливать в своем теле их концентрацию во много раз более высокую, чем в воде, в которой они жили и росли. И тогда радиоактивные вещества возвращаются к нам на стол с рыбопродуктами
Наступает время замены 100 тонн ядерного «горючего» на новое. Отработавшие свой срок топливные элементы отправляются на переработку. В них накапливается большое количество самых разнообразных радиоактивных изотопов, причем одни из них имеют очень короткий период полураспада, всего несколько секунд, другие длинный, исчисляемый многими сотнями лет. Топливные элементы вскрывают и подвергают переработке для выделения неиспользованного урана и отделения плутония, образующегося в ходе работы реактора. Такие заводы по переработке ядерного топлива есть в США, России, Англии и Франции. На этих заводах топливные элементы разрушают и растворяют в сильных кислотах, что сопровождается выделением газов и летучих продуктов деления. Газы фильтруются и поглощаются водой, которая, в сущности, удаляет весь радиоактивный йод, но позволяет большой массе радиоактивного трития
 Н (-излучатель, период полураспада 12,3 года) и практически всему количеству Kr-85 уйти в атмосферу. Распространение трития и криптона-85 в атмосфере, конечно, вызывает определенную тревогу, т.к. эти вещества попадают внутрь человеческого организма с воздухом, водой и пищей.
Н (-излучатель, период полураспада 12,3 года) и практически всему количеству Kr-85 уйти в атмосферу. Распространение трития и криптона-85 в атмосфере, конечно, вызывает определенную тревогу, т.к. эти вещества попадают внутрь человеческого организма с воздухом, водой и пищей.Вопросы для проверки знаний
- Какие размеры имеют атомные ядра, из каких частиц они состоят?
- Почему некоторые атомные ядра неустойчивы?
- Какие виды радиоактивного распада известны?
- Какую опасность представляет радиоактивное излучение?
- Какие элементы являются естественными и искусственными источниками излучения? Приведите примеры.
Упражнения
- Радиоактивный йод-131 имеет период полураспада 8,1 суток. Сколько времени потребуется, чтобы исходная концентрация радиоактивного йода уменьшилась в 10 раз по сравнению с исходной концентрацией?
Задачи
- *Природный рубидий представляет собой смесь нуклидов
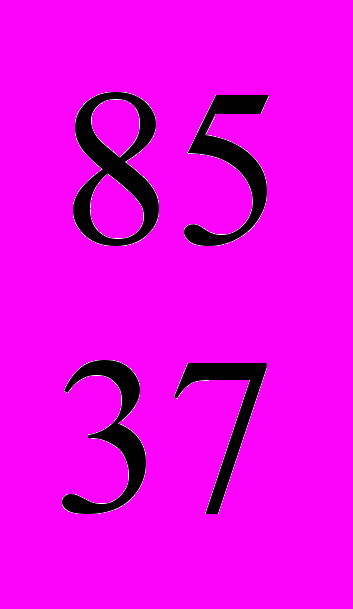 Rb и
Rb и 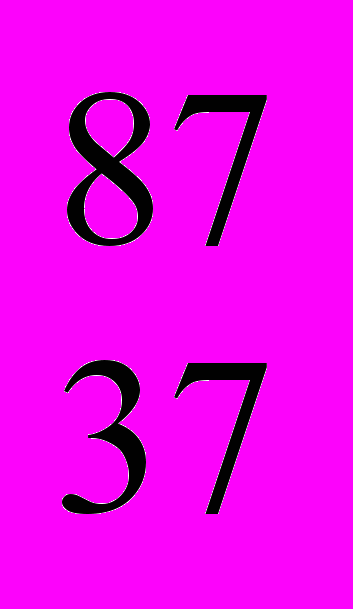 Rb и содержит 73% первого нуклида. Определите относительную атомную массу элемента рубидия.
Rb и содержит 73% первого нуклида. Определите относительную атомную массу элемента рубидия.
- Химический элемент представляет собой смесь двух нуклидов в соотношении 9:1. ядро первого нуклида содержит 10 протонов и 10 нейтронов. В ядре второго нуклида нейтронов на два больше. Вычислите среднюю атомную массу элемента.
- *Природный таллий – это смесь нуклидов
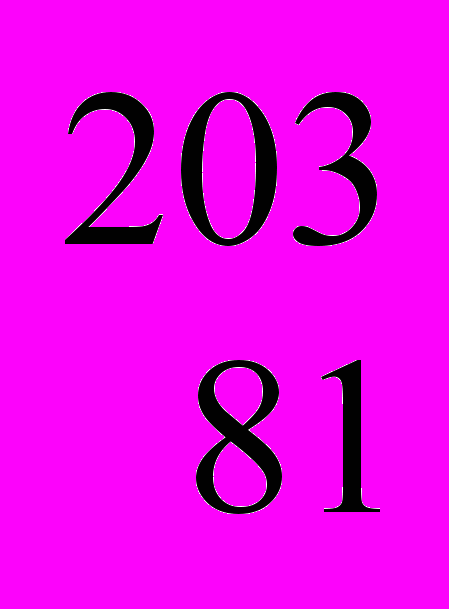 Tl и
Tl и 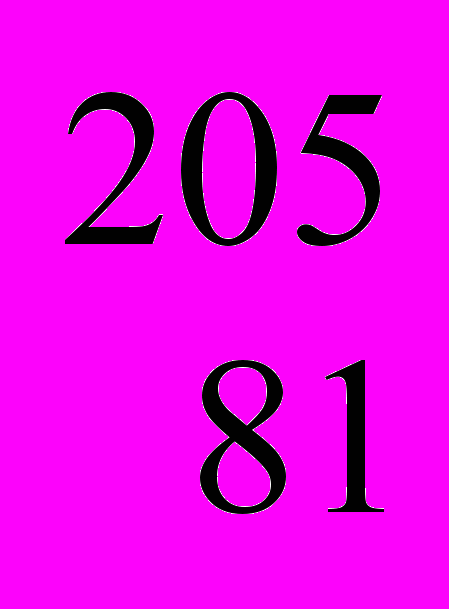 Tl. Зная относительную атомную массу природного таллия – 204,38, рассчитайте изотопный состав таллия (%).
Tl. Зная относительную атомную массу природного таллия – 204,38, рассчитайте изотопный состав таллия (%).
**2.4. Квантово-механическая модель атома
Мы уже много знаем об атоме. Положительно заряженное ядро окружено электронами, практически вся масса атома сосредоточена в ядре, а непрерывно движущиеся электроны охватывают громадную область пространства вокруг ядра. В электронейтральном состоянии количество протонов в ядре равно количеству электронов в электронной оболочке атома. Атом это микросистема, состоящая из ядра и электронов, движущихся в поле ядра.
Объяснение устойчивости атома в восьмом, девятом и десятом классах сводилось к формуле: «Так устроен мир». Если природа построена из атомов и молекул, если мир не разрушается, находясь в непрерывном движении, следовательно, атомы устойчивы. Но мы знаем, что существуют и неустойчивые атомы. Ядра таких атомов подвергаются радиоактивному распаду. К счастью, их концентрация на планете невелика.
Резерфорд, сформулировавший концепцию планетарного атома, в статье, опубликованной в 1911 г., писал: «вопрос об устойчивости предлагаемого атома на этой стадии не следует подвергать рассмотрению. … Устойчивость окажется, очевидно, зависящей от тонких деталей структуры атома и движения составляющих его заряженных частей». У Резерфорда были основания сомневаться в устойчивости планетарного атома. Что же его смущало? Экспериментальные исследования структуры и состава атомов ясно давали понять, что атом состоит из противоположно заряженных частей, которые находятся на некотором расстоянии друг от друга. По законам электростатики, чтобы сохранить устойчивость, электроны должны двигаться. Но это условие не спасает положение. По законам электродинамики, ускоренно двигаясь вокруг ядра, электроны должны излучать энергию и упасть на ядро. Получался замкнутый круг: движение электронов обеспечивает устойчивость, но оно же делает атом неустойчивым. Вот это и смущало Резерфорда.
Только по прошествии полутора десятков лет c момента появления планетарной модели атома стало понятно, что в микромире действуют законы движения, отличающиеся от законов движения тел, рассматриваемых классической механикой. В микромире действуют законы квантовой механики. Квантовую механику также называют волновой. Это раздел физики, изучающий законы движения и взаимодействия частиц очень маленькой массы, например, электронов, протонов, атомов. Оказалось, что микрочастицы проявляют свойства волн и частиц! О таком сочетании свойств говорят, что объекты проявляют корпускулярно-волновой дуализм.
Идея об устойчивых атомных орбиталях и волновых свойствах электрона натолкнула австрийского физика Э. Шредингера на мысль составить такое уравнение, решение которого позволило бы отразить все свойства атома. Такая математическая модель была создана в виде волнового уравнения. В честь создателя математической модели атома уравнение стали называть волновым уравнением Шредингера. Состояние движущегося в атоме электрона описывается уравнением электромагнитной стоячей волны. Было подобрано уравнение, справедливость которого доказывается его соответствием экспериментальным данным о строении, составе и свойствах атомов.
Математическая модель атома объединила совершенно несовместимые с точки зрения классической физики свойства микрочастицы, проявляемые ею в виде частицы-волны. Наличие строго фиксированных энергетических состояний электрона в атоме оказывается следствием присущих электрону волновых свойств и не требует введения особых постулатов (постулатов Бора). Волновое уравнение отражало фундаментальные законы природы, опираясь на которые можно утверждать, что: а) электроны в атоме находятся в непрерывном движении (совершаемом без потери энергии), б) энергетические уровни в атоме квантованы.
Положение электрона в атоме водорода (и в многоэлектронных атомах тоже) можно представить плотностью точек, указывающих место, где чаще или реже встречается электрон. В этом случае говорят о плотности вероятности обнаружить его в том или ином месте вблизи ядра. Для уяснения физического смысла сказанного рассмотрим рис. 5.
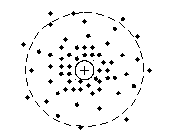
Рис. 5. Модель атома водорода. Пунктиром отмечена сферическая область орбиталь, охватывающая часть электронного облака
Плотность размещения точек вблизи ядра атома водорода тем больше, чем чаще обнаруживается электрон в соответствующей области пространства. Там, где точки расположены реже, плотность вероятности встретить электрон уменьшается. Видно, что по мере удаления от ядра плотность вероятности быстро падает до нуля. Пунктирной линией обозначена орбиталь сфера, охватывающая множество точек, соответствующих электронному облаку. Орбиталь указывает вероятное положение электрона в ограниченной ею области (движение без траектории), в то время как орбита предполагает движение по траектории. По орбитам движутся планеты солнечной системы, но не электроны в атоме.
Электронное облако это не наглядный образ самого электрона, «размытого» в пространстве, а наглядное изображение области его возможного местонахождения по отношению к ядру. Электронное облако характеризует состояние движения электрона. Такое состояние движения напоминает движение футбольного вратаря. Чаще всего он находится в штрафной площадке и чем дальше от ворот, тем меньше вероятность встретить его там. Но если движение вратаря во время матча все-таки можно изобразить некоторой траекторией, то для электрона такой возможности не существует в принципе.
Можно ограничится изображением электронной орбитали, охватывающей область вокруг ядра, где примерно 95% времени находится электрон. Тогда модель атома водорода выглядит так, как это представлено на рис. 6.


Рис. 6. Модель атома водорода. Отрицательно заряженная область, охватывающая ядро, имеет сферическую форму (s-орбиталь). Ядро и орбиталь показаны не в масштабе. При таком размере ядра электронное облако должно иметь радиус примерно 200 м
s-орбиталь
В многоэлектронных атомах появляются кроме s также р, d, f-орбитали. Отметим, что форма и пространственное расположение других орбиталей существенно отличается от сферических s-орбиталей. На рис 7. изображены р-орбитали.

Рис. 7. Модель электронных р-орбиталей (рх, ру, рz)
**2.5. Свойства атомов
Назовем основные свойства, проявляемые атомами:
- обмен энергией;
- обмен электронами;
- изменение геометрической конфигурации;
- участие в образовании химических связей.
Способность атомов участвовать в образовании химических связей включает в себя предыдущие три свойства: обмен энергией, способность отдавать или присоединять электроны, изменять геометрическую конфигурацию. Любое столкновение атомов предполагает, что они движутся, следовательно, обладают кинетической энергией. Соударение может быть упругим, тогда атомы разлетаются как бильярдные шары, обмениваясь энергией. Один атом приобретет большую скорость движения по сравнению с другим, хотя общее количество движения остается постоянным.
Столкновение может быть неупругим. Тогда происходит химическое взаимодействие. Изменяется состояние атомов. В качестве модели химического взаимодействия можно представить образование химической связи между атомами лития и фтора.
В газообразном состоянии между атомами образуется ковалентная полярная связь (рис. 8). Электронная плотность смешается от атома лития к атому фтора из-за того, что электроотрицательность атома фтора F = 4,0 превосходит электроотрицательность атома лития Li = 1,0. Молекулы фторида лития в газе находятся на больших расстояниях и не оказывают существенного влияния друг на друга.
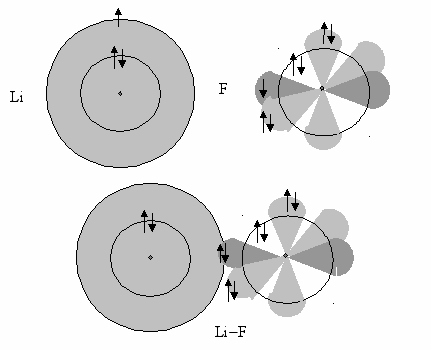
Рис. 8. Модель образования полярной молекулы фторида лития в результате перекрывания 2s-орбитали атома лития с р-орбиталью атома фтора. Электронная пара, участвующая в образовании химической связи, смещена к фтору
Иное состояние химически связанных лития и фтора наблюдается в кристалле при образовании ионной кристаллической решетки (рис. 9). Главной отличительной особенностью кристаллических ионных соединений является сильное и ненаправленное (распространяется во всех направлениях) электростатическое притяжение. Такое взаимодействие положительно и отрицательно заряженных ионов обеспечивает устойчивость ионных связей.
Ион лития оказывается окруженным сразу несколькими ионами фтора, так же, как ион фтора окружен несколькими ионами лития. Такое состояние энергетически более выгодно, чем связывание ковалентными связями.

Рис. 9. Модель образования ионной связи между литием и фтором: 2s-электрон атома лития переходит к атому фтора. Такой тип химического связывания возможен только в присутствии близко расположенных ионов лития и фтора в кристалле или расплаве
Ионная в кристалле фторида лития и ковалентная связь в молекуле фторида лития существуют не сами по себе, а в определенном окружении. Если такое окружение отсутствует или ничтожно по своему влиянию, как это наблюдается в газе, фторид лития существует в виде полярных ковалентных молекул. Если окружение стабилизирует ионное состояние, как это наблюдается в кристалле, фторид лития существует в виде ионного соединения. В любом из указанных случаев образования химической связи атомы изменяют энергетическое состояние, геометрическую конфигурацию и осуществляют обмен электронами.
Как видим, химическое связывание атомов осуществляется по-разному. В одних случаях образуется ионная связь, в других ковалентная полярная или неполярная связь. В любом случае химическая связь представлена притяжением и отталкиванием зарядов, носителями которых являются ядра и электроны.
**3.6. Квантовые правила
Волновое уравнение Шредингера представляет собой сложное математическое уравнение. Ограничимся конкретными результатами, полученными при его решении. Последовательность операций при решении волнового уравнения напоминает операции при решении квадратного уравнения.
Решением волнового уравнения является функция , подобно тому как решением квадратного уравнения является значение х1,2. Функция удовлетворяет волновому уравнению при условии, если некоторые числа (квантовые числа n, l, ml) принимают постоянные значения. Решение квадратного уравнения х1,2 удовлетворяет уравнению, если a, b, c остаются постоянными.
Квантовые числа n, l, ml входят в волновое уравнение и принимают определенные значения, о чем мы говорили при изучении химии в восьмом, девятом и десятом классах.
-
Волновое уравнение
H = E
Решением уравнения является
удовлетворяет волновому
уравнению
при постоянных значениях квантовых чисел
n, l, ml
Квадратное уравнение
aх2 + bх + с = 0
Решением уравнения является
х1,2
х1,2 удовлетворяет квадратному
уравнению
при постоянных значениях
a, b, c
Волновое уравнение описывает состояние электронов, движущихся в системе координат x, y, z. В начале этой системы находится атомное ядро. Электроны обладают собственным моментом количества движения, и это движение позволяет отличить электроны, находящиеся на одной орбитали. Собственный момент количества движения электрона называют спином. Характеристикой спина электрона является спиновое квантовое число ms, которое принимает значения +1/2 и 1/2.
Таким образом, четыре квантовые числа n, l, ml, ms определяют состояние атома:
-число энергетических уровней определяет главное квантовое число
n= 1, 2, 3,….;
-численное значение энергии уровня и подуровня определяют числа
n и l; l = 0, 1, 2,…( n1);
-форму, пространственное расположение и число орбиталей на подуровне определяют l и ml,, ml = l…2, 1, 0, +1, +2,….+ l;
-число электронов на одной орбитали определяет спиновое квантовое число ms. , равное +1/2 или 1/2.
Нужно умело использовать квантовые числа и квантовые правила, чтобы заполнять энергетические уровни в многоэлектронном атоме.
Квантовых правил три:
-принцип наименьшей энергии: электроны заполняют орбитали в порядке возрастания энергии от низших к высшим энергетическим уровням. Другими словами заполнение происходит от низших к высшим значениям суммы квантовых чисел (n + l); если сумма (n + l) имеет одинаковые значения, то сначала заполняется уровень, для которого n меньше;
-принцип запрета Паули: на одной орбитали не может быть больше двух электронов, различающихся спиновыми числами ms = +1/2 и 1/2;
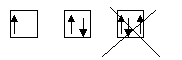
-правило Гунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором сумма спиновых чисел максимальна, т.е.
ms = max


ms +1/2 1 3/2 1 +1/2 0
В соответствии с квантовыми правилами заполняются энергетические уровни в многоэлектронных атомах.
Представленный на рис. 10 порядок заполнения электронами уровней в многоэлектронных атомах отражает одно из важнейших достижений квантовой механики в химии, а именно дает объяснение физического смысла периодического закона и структуры периодической системы химических элементов.
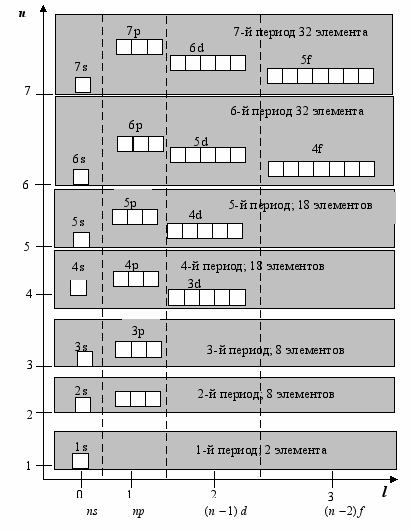
Рис. 10. Порядок заполнения электронами уровней в многоэлектронных атомах. Заполнение энергетических уровней идет от низших к высшим по мере увеличения суммы (n + l). Эта последовательность справедлива только для нейтральных атомов, находящихся в невозбужденном состоянии
Во-первых, каждый период открывается элементом, у которого начинает заполняться орбиталь с главным квантовым числом n, т.е. n-ый уровень, что всегда соответствует оболочке ns. Завершается первый период элементом, у которого заселена 1s-орбиталь (Не). Все остальные периоды завершаются элементами, у которых заселена np-орбиталь. Это соответствует конфигурации ns2…np6. Номер периода соответствует главному квантовому числу n (рис. 10).
Во-вторых, химические элементы, в зависимости от положения в периодической системе, делят на s-, p-, d- и f-элементы. К s-и p-элементам относят элементы главных подгрупп, к d-и f-элементам побочных подгрупп. Последние называют переходными элементами. Это название связано с тем, что в периодах они вклиниваются между s-и p-элементами, которые называют непереходными.
В-третьих, сходство физико-химических свойств атомов обусловлено сходством их электронных конфигураций, прежде всего сходством в распределении электронов внешних, валентных атомных орбиталей.
Таким образом, порядок заполнения электронами уровней в многоэлектронном атоме (рис. 10) есть иная, квантовомеханическая форма выражения периодического закона химических элементов.
Вернемся к высказыванию Д.И. Менделеева о периодическом законе. По его мнению «…периодическая изменяемость простых и сложных тел подчиняется некоторому высшему закону, природу которого, а тем более причину ныне еще нет средств охватить. По всей вероятности, она кроется в основных началах внутренней механики атомов и частиц». Это высказывание отражает сущность критического отношения выдающегося ученого к своему открытию, понимание того, что им сделан только шаг к поиску истинных причин химических свойств и состояний вещества.
Вспомним слова Э. Резерфорда, который считал, что устойчивость атома окажется зависящей от тонких деталей структуры атома и движения составляющих его заряженных частей. Оценку результатов достигнутого ученые давали в разное время, Менделеев в 1869 г., Резерфорд в 1911 г.
Удивительно, как поиск истины того, что ученые хотят узнать, объединяет и Менделеева, и Резерфорда в оценке своих собственных достижений. Они понимали, что познание непрерывный и бесконечный процесс постижения истины, и они выполнили лишь часть того, что предстоит узнать в будущем.
Вопросы для проверки знаний
- *Что подразумевают под корпускулярно-волновым дуализмом микрочастиц?
- *Какое свойство атома используется для доказательства его устойчивости?
- Какие свойства проявляют атомы при образовании химической связи?
- Можно ли утверждать, что периодический закон является законом квантовой механики?
Упражнения
- Почему все лантаноиды (элементы с порядковыми номерами 5871) располагаются в одной клетке периодической системы элементов?
Задачи
1. Составьте электронные и электронографические формулы внешнего энергетического уровня следующих атомов и ионов: S2–, Mn2+, Fe, Se.
- *Электронная конфигурация атома неона совпадает с электронными конфигурациями нескольких ионов. Приведите электронные формулы четырех таких ионов.
- *Напишите уравнения реакций образования двух соединений, в состав которых входят только ионы с конфигурацией внешних электронов 3s23р6.
- Сколько электронов и протонов содержат следующие частицы: а) нитрат-ион; б) молекула аммиака; в) Fe2+?
- Напишите электронные и электронографические формулы атомов элементов с порядковыми номерами 37, 43, 48, 52 (только валентные электроны).
- *Изобразите электронографическую формулу атома серы в состоянии, предшествующем образованию гексафторида серы SF6.
