Материалы российской научно-практической конференции с международным участием Ульяновск, 15-16 декабря 2010г. (сайт: ) Ульяновск 2010
| Вид материала | Диплом |
- Ульяновск, 17-19 декабря 2008 г. ( сайт: www uni ulsu ru ) Ульяновск 2008, 1972.01kb.
- Философия о знании и познании: актуальные проблемы Материалы Всероссийской научной, 23183.76kb.
- В X всероссийской научно-практической конференции с международным участием «Информационные, 85.51kb.
- Хх века о познании и его аксиологических аспектах Материалы Всероссийской научной конференции, 11387.01kb.
- Российские сми о мчс мониторинг за 10 декабря 2010, 979.5kb.
- Программа научно-практической конференции с международным, 847.82kb.
- И программа научно-практической конференции студентов и молодых ученых с международным, 233.52kb.
- Всероссийской научно-практической интернет-конференции с международным участием «спрос, 9.28kb.
- Всероссийская научно-практическая конференция с международным участием, 165.24kb.
- Положение о Всероссийской научно-практической конференции с международным участием, 58.64kb.
Иванов О.Л., Львов А.Н., Миченко А.В. Атопический дерматит: современные представления // Русский медицинский журнал. - 2007. - Т.15. - №19. - С.1362-1366.
НЕКОТОРЫЕ АСПЕКТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
ЭКСТРЕННЫХ ГИНЕКОЛОГИЧЕСКИХ БОЛЬНЫХ
Баулина Н.В., Смолькина А.В., Давидян Л.Ю.
Городская клиническая больница скорой медицинской помощи им. Захарьина г. Пензы,
Ульяновский государственный университет, Россия, Пенза, Ульяновск
Видеоэндохирургические методы диагностики и лечения, внедрение ряда классических подходов произвели значительные изменения в тактике оказания экстренной как хирургической, так и гинекологической помощи. С 1994 г. в работу хирургического и гинекологического отделений Городская клиническая больница скорой медицинской помощи им. Захарьина г. Пензы внедрено круглосуточное использование видеостойки, что фактически изменило технологию оказания экстренной помощи. В дежурной бригаде гинекологи владеют методикой лапароскопии, часто в составе эндо- гинеколог или хирург, есть дежурные на дому. Это позволило сократитть сроки установки диагноза и время с момента поступления до операции, особенно это коснулось больных с подозрением на перитонит, внематочную беременность, при которой достигли потолка в 97% оперированных эндоскопическими методиками. Только при геморрагическом шоке ставим сразу вопрос о лапаротомии из-за технической невозможности провести быструю реинфузию. У 12-18 пациенток в год подозревается, устанавливается диагноз перекрута придатков матки, и всех больных успешно оперировали эндоскопически. При развитии послеоперационных осложнений после классических или лапароскопических операций в первую очередь используем видеоэндоскопию, которая чаще бывает исчерпывающей в плане лечения. При гнойных процессах гениталий сократилось число лапаротомий. Изменилась технология с включением динамических санирующих лапароскопий, увеличилось количество органосохраняющих операций на гениталиях с восстановлением репродукции в перспективе. Диагностические лапаротомии перешли в разряд казуистики, также как и имевшие ранее место лапаротомии при болевых формах апоплексии яичников. Осложнения снизились в 4,2 раза.
При анализе лечения запущенных перитонитов (3 стадия) у 48 пациенток выявлены 77 хирургических осложнений (у 100% от 1 до 3): 58 – внутрибрюшные осложнения (продолженный перитонит, межпетельные абсцессы, непроходимость кишечника), 17 – гнойные раневые осложнения, в том числе в месте стояния дренажей, 2 – другие. В данной группе у 7 было повреждение желудочно-кишечного тракта. Среднее пребывание в отделении реанимации и интенсивной терапии составило 4,6 дня, причем, 10 пациенток находились дважды. Осложнения привели к вынужденным релапаротомиям у 39 женщин в сроки от 3 до 8 дней с момента первой операции. Девяти производились вскрытия абсцессов и флегмон брюшной стенки и накладывались вторичные швы. Крайне тяжёлых больных не было, осложнения выявлялись своевременно, повторные вмешательства были адекватными и современными, поэтому никто из больных не умер. Однако техническое выполнение проходило с большими хирургическими трудностями, как правило с привлечением хирургов. Среднее пребывание в больнице составило 32,3 дня. В позднем периоде послеоперационные грыжи отмечены у 19 женщин, 6 оперированы по поводу спаечной непроходимости и 4 - по поводу гнойников брюшной полости и брюшной стенки. Мы изменили технологию и стали применять программированную релапаротомию. Показания к программированным релапаротомиям с нашей точки зрения не могут быть строго математическими или привязанными, зависящими от одного признака. Это интегральное понятие, которое можно свести к простому выражению, что программированная релапаротомия показана тогда, когда невозможно произвести полноценную санацию брюшной полости за один этап или когда имеются явные условия для развития нежелательного осложнения, заметить и поправить последствия оного можно только с помощью следующего входа в брюшную полость в ближайшее безопасное время. Тем не менее, мы ориентируемся на возможную и допустимую неудаляемость первичного очага, деструкцию органов желудочно-кишечного тракта, характер и количество выпота, формирование осумкованных образований из неотделяемого фибрина на органах, наличие паралича кишечника. Во второй группе оперировано 26 женщин, программированные релапаротомии проводились через 21-30 часов. Во время программированной релапаротомии у всех отмечалась положительная динамика, но у 23 - в тазу сохранялись остатки некротических тканей, у 12 -обнаружены формирующиеся межпетельные абсцессы, у 6 - имелись гнойные наложения вокруг лигатур, у 18 - кишечные петли создавали ангуляцию, у 11 - в пространстве между брюшной стенкой, кишечными петлями и дренажами найдены большие скопления гнойно-фибринозной массы, а у 1 больной обнаружены 2 некротизированные жировые подвески. Две программированные релапаротомии выполнены 2 женщинам, три – четырем, после которых рану зашивали классически наглухо с оставлением дренажей в контрапертурах. В отделении реанимации пациентки были в среднем 3,5 дня однократно. Никому не производились вынужденные релапаротомии. Осложнения возникли у 7 женщин: 4 – плевропневмонии и одна бронхопневмония, а внутрибрюшных и раневых осложнений не было. Умерли две пациентки, смерти связаны с крайне запущенными заболеваниями. Среднее пребывание в больнице составило 22,8 дня. В позднем периоде у 2 больных возникла послеоперационная грыжа.
Таким образом, необходимо шире применять видиоскопические методы хирургического лечения гинекологической патологии.
ЭТИОЛОГИЧЕСКАЯ РОЛЬ БАКТЕРИЙ РОДА KLEBSIELLA В РАЗВИТИИ ДИСБАКТЕРИОЗА
Бурганова Р.Ф.
Областная клиническая больница
Россия, Ульяновск
В последние годы наблюдается значительный рост заболеваний, сопровождающихся развитием дисбактериоза. Все большую этиологическую значимость приобретают условно-патогенными микроорганизмы, среди которых одно из ведущих мест занимают бактерии рода Klebsiella [1]. Многие исследователи признают их значительную роль в развитии госпитальных инфекций, бронхитов, пневмоний, воспалительных процессов желудочно-кишечного и урогенитального тракта [3].
Клебсиеллы привлекают внимание недостаточной изученностью биологических свойств и способностью проявлять патогенность, особенно при снижении иммунитета, устойчивостью к широкому спектру химиопрепаратов и дезинфектантов [2].
Целью работы явилось изучение роли бактерий рода Klebsiella в формировании микрофлоры кишечника в условиях дисбактериоза.
Материалы и методы. В период с 09.2009 г. по 11.2009 г. было обследовано 105 человек в возрасте от 18 до 56 лет с целью выявления дисбактериоза кишечника. Исследования проводились в бактериологическом отделе КДЛ ГУЗ УОКБ в соответствии с Приказом №231 от 9 июня 2003 г. «Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника». Дифференциацию клебсиелл осуществляли при помощи 15 биохимических тестов, дающих полную характеристику ферментативной активности данного возбудителя.
Результаты и обсуждение. Проведенные исследования выявили наличие изменений микрофлоры кишечника у 91% пациентов.
У обследованных отмечалось снижение содержания бифидобактерий до 9,54
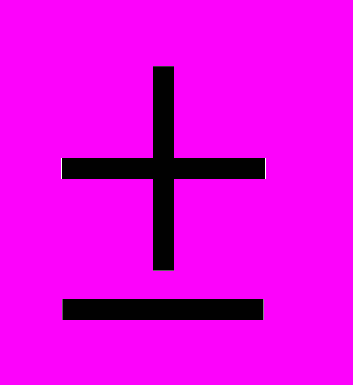 0,15 lg КОЕ/г, лактобактерий - до 7,87
0,15 lg КОЕ/г, лактобактерий - до 7,87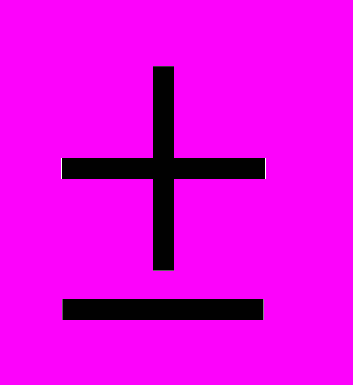 0,11 lg КОЕ/г.
0,11 lg КОЕ/г. Количественные показатели эшерихий с нормальной ферментативной активностью и лактозонегативных кишечных палочек составило 7,96
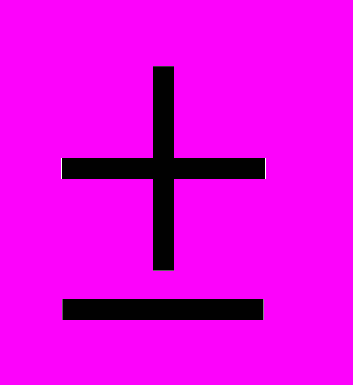 0,12 lg КОЕ/г и 2,61±0,34 lg КОЕ/г соответственно. Наряду с этим, у 26,7% обследованных больных была выявлена кишечная палочка с гемолитическими свойствами. Уровень содержания данных бактерий составил 2,32±0,35 lg КОЕ/г.
0,12 lg КОЕ/г и 2,61±0,34 lg КОЕ/г соответственно. Наряду с этим, у 26,7% обследованных больных была выявлена кишечная палочка с гемолитическими свойствами. Уровень содержания данных бактерий составил 2,32±0,35 lg КОЕ/г. Частота встречаемости золотистого и эпидермального стафилококка составила 24,2% и 28,3% больных. Уровень их содержания был равен 1,47±0,24 lg KOE/г и 1,86±0,28 lg KOE/г соответственно. Помимо этого, в значительных количествах высевались энтерококки, они были выявлены у 100% больных. Количественное содержание данных микроорганизмов составило 7,88±0,12 lg KOE/г.
Дрожжеподобные грибы рода Candida обнаружены в 35% случаев при количественном содержании 2,26±0,29 lg KOE/г.
У 33,3% обследованных выявлены клебсиеллы, их количественные показатели составили 2,37±0,32 lg KOE/г. Структура видового состава клебсиелл была представлена K. pneumoniae (64,2%), K. oxytoca (21,4%) и K. mobilis (14,4%).
Выводы
- У 91% обследованных пациентов выявлены дисбиотические изменения микрофлоры кишечника, проявлявшиеся снижением содержания облигатных компонентов на фоне увеличения микробного числа условно-патогенных и появлением патогенных видов.
- В 33,3% случаях дисбактериоза в составе микрофлоры кишечника обнаружены клебсиеллы, представленные тремя видами: K. pneumoniaе, K. oxytoca и K. mobilis.
Литература:
- Малкоч А.В., Белмер С.В. Микроэкология кишечника и основные направления корреция ее нарушений// Педиатрия. – 2009. - №2.- С.21-24.
- Конев Ю.В. Дисбактериозы и их коррекция// Консилиум. – 2005. – Т.7. - №6. – С.14-17.
- Захаров А.С. Условно-патогенные энтеробактерии во внешней среде, кишечнике людей и их антибиотикорезистентность// Функциональные исследования. – 2004. - №1. – С.28-30.
РОЛЬ СРЕДНИХ МЕДИЦИНСКИХ РАБОТНИКОВ В ФОРМИРОВАНИИ ПРИНЦИПОВ ЗДОРОВОГО ОБРАЗА ЖИЗНИ У ПАЦИЕНТОК С ПРИВЫЧНОЙ ПОТЕРЕЙ БЕРЕМЕННОСТИ
Груздев С.А., Канаева Ю.И., Давидян Л.Ю., Кирикова Е.В.,
Хайруллин Р.М
Ульяновский Государственный Университет
Россия, Ульяновск
В настоящее время для многих супружеских пар репродуктивного возраста актуальной проблемой является не только период вынашивания и родов, но и зачатие. Существующие современные технологии в силу дороговизны, удаленности центров репродукции зачастую недоступны для рядовых семейных пар. Вопросы выяснения причин и факторов, способствующих привычному невынашиванию беременности, и, главное, их предупреждению, являются актуальной проблемой современности. Одно из главных мест в профилактике раннего невынашивания отводится женским консультациям и средним медицинским работникам, осуществляющим пропаганду здорового образа жизни среди беременных.
По данным официальной статистики Минздравсоцразвития РФ частота невынашивания беременности на сегодняшний день составляет 15-27%, причем половина всех случаев приходится на срок до 12 недель.
Статистика такова, что если у пациентки было два выкидыша, вероятность неудачного развития третьей беременности составляет 55%. Возможных причин невынашивания беременности множество. Это и гормональные расстройства и заболевания матери, генетические нарушения и воздействие факторов внешней среды и другие. Печальный опыт самопроизвольного прерывания беременности – является однозначным поводом визита к гинекологу на прием по невынашиванию. Решиться на такой шаг женщине бывает нелегко, но еще тяжелее осознавать, что подобной ситуации можно было бы избежать. Своевременная коррекция патологических состояний до и во время беременности могла бы во многих случаях предотвратить её прерывание.
Среди гинекологической патологии особое место по своей медико-социальной значимости занимают спонтанные аборты. Они являются одним из составных элементов нарушений детородной функции женщин, характерных для многих регионов современной России. В 1995 году в стране зарегистрировано 186277 самопроизвольных абортов, что составило 13% желанных беременностей. В последние годы их частота немного уменьшилась, но остается на достаточно высоком уровне. За последние 5 лет в 1,5 раза возросла частота осложнений беременности - на 8,6% воспалительных заболеваний придатков матки, на 27% расстройств менструального цикла. В 2005 году в Ульяновской области зафиксировано 11174 случаев спонтанного аборта, что составляет 30,9‰ на 1000 женщин фертильного возраста. В 2007 году по данным аналитической справки Минздрава Ульяновской области зафиксировано 11152 случая спонтанного аборта, что составляет 30,8‰ на 1000 женщин фертильного возраста, а с учетом данных частных и ведомственных клиник этот показатель ещё более увеличивается.
Причины самопроизвольных абортов разнообразны. Однако, по данным разных авторов, в 25-66% случаев причину самопроизвольных абортов установить не удаётся [1]. Самопроизвольные выкидыши включают в себя все случаи спонтанного нарушения беременности при сроке до 22 недель гестации [2]. Среди клинически диагностированных беременностей их частота достигает 10-30%, причем на долю первого триместра приходится от 50-80% потерь [2]. Однако, по настоящее время, патология первого триместра беременности – наименее изученная глава антенатальной медицины. Известно, что в процессе клинической диагностики этиологии ранних самопроизвольных выкидышей существенная роль отводится патоморфологическому исследованию элементов плодного пузыря и эндометрия [2]. Возможности патоморфологического анализа соскобов из полости матки пока ограничены, так как не разработаны четкие критерии диагностики цитогенетических, эндокринных, иммунологических и других причин ранних спонтанных абортов [3]. Таким образом, особая социальная значимость проблемы самопроизвольных абортов, высокая частота их развития, отсутствие четких диагностических критериев выявления их этиологических факторов и определяют актуальность комплексного морфологическом исследовании соскобов эндометрия и оболочек при спонтанном аборте с параллельным анализом клинических данных.
Среди основных причин прерывания беременности в первом триместре называют генетический, эндокринный, инфекционный и иммунологический факторы; меньшее распространение имеют тромбофилитические факторы и патология матки. Единого мнения о лидирующей роли того или иного фактора не существует. Многие авторы исследовавшие проблему невынашивания указывают крайне противоречивые цифры. Одни считают, что в настоящее время одной из ведущих причин невынашивания беременности ранних сроков принято считать генетический фактор [4]. Среди ранних абортусов их встречаемость достигает 60-75%. У человека более 95% всех мутаций заканчивается прерыванием беременности. Хромосомные аберрации у зародышей могут возникать под действием разнообразных внешних и внутренних факторов. Воздействие химических, физических, биологических (вирусные инфекции) агентов, нарушение метаболизма (например, при аутоиммунном тиреоидите или сахарном диабете), нарушение функции генов дезактивации токсичных метаболитов, возраст матери, гетерозиготное носительство транслокаций одним из родителей могут провоцировать образование неполноценных и несбалансированных гамет и зигот у человека [7]. Летальный эффект мутации, возникший после имплантации, приводит к прекращению развития эмбриона, следствием чего является выкидыш.
При цитогенетическом исследовании самопроизвольных абортов выявляют различные варианты хромосомных аберраций: 44,5-56% составляют полные трисомии (утроение) по аутосомам, у 15,1-18% встречаются полиплоидии (обычно возникают при оплодотворении двумя и более сперматозоидами или при нарушении экструзии, выбрасывания полярных телец в мейозе), моносомия X является следствием не расхождения хромосом при гаметогенезе - 15% [2]. По данным многочисленных исследований, трисомии составляют основную долю хромосомной патологии. Трисомия хромосомы 16 встречается в 31% случаев, хромосомы 22 - в 10,4%, хромосомы 21- в 9,5%, хромосомы 15 - в 7,2%, хромосомы 13 - в 5,1%. [7]. Возраст женщин, эмбрион которых имеет трисомию, обычно старше 30 лет.
Другими авторами утверждается, что прогестероновая недостаточность в 64-89% случаев является основным патогенетическим механизмом невынашивания беременности [2]. По разным данным среди факторов невынашивания от 30 до 78,2% приходится на эндокринные нарушения у матери. Эндокринная патология, независимо от своей этиологии, в конечном счете реализуется из-за структурно-функциональной недостаточности желтого тела яичников, которое служит основным продуцентом прогестерона в первом триместре беременности [2]. Однако, решающее значение имеет не абсолютное содержание стероидных гормонов и морфологическая структура эндометрия, а количество функционально полноценных рецепторов стероидных гормонов в ткани эндометрия. Гормональная неполноценность желтого тела может быть выражена в различной степени. В случае прогестероновой недостаточности эндометрий выступает в качестве органа-мишени, достоверно отражающего гуморальные способности желтого тела яичника. Неполноценная лютеиновая фаза может быть обусловлена гиперпролактинемией, дефицитом массы тела, ожирением, поликистозными яичниками, гопотиреозом, эндометриозом, хроническим сальпингоофоритом, эндометритом, наличием внутриматочных синехий, пороков развития матки и генитальным инфантилизмом, а также наблюдается при нормогонадотропной недостаточной функции яичников [8]. Остается слабо изученной степень влияния данных патологических состояний на морфологическую картину при эстроген-гестагенной недостаточности, которую они вызывают. По данным многочисленных исследований [7] в 21-32% случаев невынашивание беременности в той или иной степени обусловлено гиперандрогенией. Характерной особенностью больных с гиперандрогенией является прерывание беременности по типу неразвивающейся в первом триместре[6].
По данным третей группы исследователей, инфекция - одна из значимых причин как спорадической, так и привычной потери беременности. По данным О.А. Пустотиной и соавт., у матерей с хроническими инфекционными заболеваниями более чем у половины (56,4%) эмбрионов были воспалительные изменения; в своей работе В.Л. Тютюнник и соавт. [9] указывает, что основная причина в развитии первичной плацентарной недостаточности принадлежит инфекциям. Особого внимания, по мнению авторов, заслуживают вирусные инфекции (герпес, цитомегаловирусная, аденовирусная инфекции краснуха, вирус паротита, грипп), возбудители которых гематогенно проникают через плацентарный барьер и активно размножаются в плаценте, повреждая ее и вызывая внутриутробное инфицирование плода [7]. Среди этиологических факторов самопроизвольных абортов большую группу составляют острые и хронические инфекционные заболевания матери. Исследования последних лет показали, что у большинства женщин с повторными самопроизвольными абортами имеется смешанная персистирующая вирусная инфекция (вирусы Коксаки А и Б, некоторые другие энтеровирусы, цитомегаловирус, вирус простого герпеса). В прерывании беременности, помимо вирусной, существенную роль играет бактериальная инфекция-поражение полового аппарата микоплазмой, уреаплазмой, хламидией, гонококком, стрептококком группы Б; имеют значение поражение токсоплазмой, листериями, грибами, наличие бактериального вагиноза. Хламидийная инфекция, по данным литературы [5], найдена у 51-55% женщин с невынашиванием беременности. Особенностью урогенитальных инфекций в современных условиях являются вирсуно-микробные ассоциации [7]. Персистируя длительное время, вирусная и бактериальная инфекции могут приводить к изменению антигенной структуры инфицированных клеток как за счет собственно инфекционных антигенов, включаемых в структуру поверхностных мембран так и за счет образования новых клеточных антигенов, детерминированных клеточным геномом. При этом развивается иммунный ответ на гетерогенизированные аутоантигены, приводящий к появлению аутоантител и вызывающий развитие хронической формы ДВС-синдрома [10]. Таким образом, при длительной бессимптомной персистенции вирусно-бактериальной инфекции у пациенток с повторными самопроизвольными абортами происходит активация на локальном уровне системы гемостаза и иммунитета, непосредственно участвующих в процессах гибели и отторжения плодного яйца [7]. Дифференциальная диагностика первичного или повторного характера воспаления, возникшего в репродуктивных органах беременной женщины, имеет важное прогностическое и лечебно-тактическое значение.
Определение путей инфицирования эндометрия в первом триместре беременности является сложной диагностической задачей. Это связано с экспансивным ростом плаценты и сохранением прямого сообщения между влагалищем, полостью матки и маточными трубами на фоне выраженной анатомо-гистологической реконструкции детородных органов. Отмеченное обстоятельство несет в себе возможность одновременной инфекционной агрессии по различным каналам распространения - восходящему, гематогенному, контактному и нисходящему [2]. Примером могут служить нередкие случаи одновременно вирусного и бактериального инфицирования эндометрия, обусловленные гематогенным и нисходящим распространением инфекционных агентов при сочетании кольпита и тяжелого гриппа. В качестве основного источника воспалительного процесса, развивающегося в первом триместре беременности, чаще всего выступают очаги инфекции, гнездящиеся в различных органах урогенитальной системы. При этом ведущую роль некоторые авторы отводят инфекционным процессам в шейке матки, проявляющимся острым катарально-гнойным эндоцервицитом или хроническим воспалением с развитием истинных или ложных эрозий [2]. Инфекция может непосредственно поражать плод или действовать путем активизации воспалительных цитокинов, обладающих цитотоксическим эффектом [7].
Диагностика различных путей инфицирования, гематогенного и восходящего (контактного) возможна по разграничению зоны воспалительной реакции в базальной децидуальной оболочке и ворсинчатом хорионе. Но, при лечебно-диагностических выскабливаний полости матки при спонтанных и абортах в первом триместре беременности патологоанатому представлена лишь базальная часть децидуальной оболочки [3], поэтому путь инфицирования определить порой не удается.
Иммунологические аспекты невынашивания беременности обозначены только в последние десятилетия, в связи с новыми методологическими возможностями. Среди иммунологических аспектов различают аутоиммунные (направленные против собственных тканей матери) и аллоиммуные. Примером таких аутоиммунных взаимодействий являются транзиторная тромбоцитопения у новорожденных, диффузно-токсический зоб, миастения, системная красная волчанка и другие аутоиммунные заболевания, при которых неблагопрятный акушерский анамнез на много лет предшествует развитию клиники аутоиммунного заболевания. Так антифосфолипидный синдром, часто является маркёром возможных аутоиммунных заболеваний впоследствии. Примером аллоиммунных взаиомодействий являются гемолитическая болезнь новорожденных в связи с Rh- или AB0-сенсибилизацией, или сенсибилизацией к другим эритроцитарным факторам типа Kell, Daffy, Pp и др. [7].
В современной литературе нет данных о влиянии сопутствующей гинекологической и соматической патологии, количества беременностей, медицинских абортов, данных дополнительных методов исследований, что могло бы оказать значительную помощь в профилактике самопроизвольных абортов. Установлено, что в первые 6 недель беременности происходит 70% спонтанных абортов, а в первые 10 недель возникают 50% абортов [6]. Существует значительное количество факторов влияющих на прерывание беременности: курение, прием алкоголя и наркотиков, химические и физические вредности, тяжелый физический труд, возраст матери, характер питания, уклад в семье и даже психологические взаимоотношения между супругами, стресс-реакции индуцирующие патофизиологические и психоцитокиновые реакции.
Роль медицинской сестры и акушерки в профилактике привычной потери беременности заключается в постоянном обновлении знаний об этиопатогенетических факторах невынашивания, динамическом наблюдении данной категории пациенток и прививанию, пропаганде им принципов, направленных на здоровый образ жизни. Они заключаются в отказе от курения, алкоголя и наркотиков, случайных половых связей во время беременности, совместной с акушером-гинекологом помощи в подготовке к беременности и её ведении.
В формировании здорового образа жизни немаловажную роль играет осведомленность об особенностях состояния психики во время беременности и готовность женщины следовать рекомендациям специалистов. На отношение женщины к беременности оказывают влияние социальные факторы, внутрисемейные взаимоотношения, преморбидные особенности личности и т.д. Экономические трудности, переход к новым, сформированным СМИ, критериям качества жизни и болезненное переживание собственного несоответствия этим критериям, имеют своим следствием неуверенность в завтрашнем дне, которая оборачивается для женщины длительным психоэмоциональным стрессом.
У многих, особенно юных женщин, с наступлением беременности возникают тревожные опасения не только по поводу здоровья будущего ребенка, но и страх, сомнения в возможности сохранить «женственность», «сексуальную привлекательность», прежний образ жизни и внешность, а также прежний уровень отношений с отцом ребенка, в том числе и сексуальных. На этой почве возникающая реактивная депрессия как форма проявления постабортного синдрома попадает в поле зрения акушерок на этапе возникновения соматических осложнений. Большинство женщин с постабортным синдромом отмечают снижение чувства самооценки личности, принижения достоинства и полноценности личности, чувства вины, угрызений совести, их состояние характеризуется утратой надежды стать матерью, которые могут нарастать с течением времени и стать причиной внутрисемейных конфликтов и даже разводов. С течением времени перманентная симптоматика склонна к потенцированию негативных эмоций, что в свою очередь может негативно откликнуться на течении новой беременности, формируя так называемый порочный круг. Приём таких пациенток должен вестись в спокойной доброжелательной обстановке, с живым, не формальным участием в обозначаемых беременной проблемах личной жизни и состояниях здоровья, с советами, помогающими в выработке и принятии ответственных решений.
Литература:
1. Кеворков, Н.Н. Гормоны репродукции в регуляции процессов иммунитета /Н.Н. Кеворков, Ю.И. Шилов, С.В. Ширшев.- Екатеринбург.-1993.- 54с.
2. Глуховец, Б.И. Патоморфологическая диагностика ранних самопроизвольных выкидышей /Б.И. Глуховец, Н.Г. Глуховец.- Санкт-Петербург, 1999.- 96с.
3. Милованов, А.П. Патология системы мать-плацента-плод /А.П. Милованов.- М.: Медицина, 1999.- 440с.
4. Кулаков, В.И. Руководство по безопасному материнству / В.И. Кулаков, В.Н. Серов, Ю.И. Барашнев.- М.- 1998.- С. 52.
5. Пустотина, О.А. Клинические, морфологические и цитологические критерии диагностики врожденной инфекции /О.А. Пустотина, Н.И. Бубнова, Б.Л. Гуртова //Акушерство и гинекология.- 2002.- № 1.- С. 13-16.
6. Салов И.А. Неразвивающаяся беременность/И.А. Салов.- Саратов.-2009.- 280с.
7. Сидельникова, В.М. Привычная потеря беременности /В.М. Сидельникова.- М.- 2002.- 102с.
8. Топчиева, О.И. Биопсии эндометрия. /О.И. Топчиева, В.А. Прянишников, З.П. Жемкова.- М.: Медицина, 1978.- 231с.
9. Тютюнник, В.Л. Морфофункциональное состояние системы мать-плацента-плод при плацентарной недостаточности и инфекции /В.Л. Тютюнник, В.А. Бурлев, З.С. Зайдиева // Акушерство и гинекология.- 2003.- № 6.- С. 11-16.
10. Ройт, А. Основы иммунологии: Пер. с англ.- М.- 1991.- 246с.
Комплексный подход к обследованию женщин с розацеа, включающий исследование эндокринной регуляции менструальной функции
Качурина Е.В.
Ульяновский государственный университет, Россия, Ульяновск
К числу наиболее распространенных хронических дерматозов относятся
розовые угри (розацеа), частота заболеваемости которыми по данным различных авторов достигает 5-10%. В косметическом отношении это тяжелое заболевание, поскольку данный дерматоз локализуется главным образом на лице, а страдают ими преимущественно женщины в наиболее социально активном возрасте - 25 - 50 лет. Розацеа отличается хронически прогредиентным течением и рефрактерностью к проводимой терапии, что значительно ухудшает качество жизни больных.
Известно, что важную роль в развитии розацеа играет функциональная связь гипоталамуса, гипофиза и коры надпочечников — так называемая гипоталамо-гипофизарно-надпочечниковая система, что связано с недостаточностью адаптационных механизмов. Гормональный дисбаланс выделяют как один из провоцирующих факторов в развитии розацеа.
Проведённые исследования нейроэндокринных факторов в патогенезе розацеа показали, что в отдельных случаях имеет место гипофизарно-овариальная недостаточность, описано возникновение и экзацербация заболевания как во время беременности или климакса, так и перед менструацией.
Таким образом, определение особенностей нейроэндокринного контроля менструальной функции и вегетативных состояний, связанных с ней и их коррекция может значительно повлиять на характер течения розацеа.
Основные методы обследования женщин с розацеа должны включать в себя:
1. Осмотр кожи, оценка тяжести и характера клинических проявлений розацеа.
2. Тесты функциональной диагностики (контроль базальной температуры, УЗИ контроль овуляции).
2. Микробиологические и акарологические методы обследования
3. Определение содержания гормонов (ФСГ, ЛГ, эстрадиола, тестостерона) в сыворотке крови
Оценка полученных данных в комплексе, выбор сроков и методов гормональной коррекции позволит оптимизировать методы лечения и профилактики розацеа и значительно улучшить показатели качества жизни больных.
Медико-социальные факторы риска развития розацеа у женщин в г. Ульяновск
Качурина Е.В.
Ульяновский государственный университет, Россия, Ульяновск
К числу наиболее распространенных хронических дерматозов относятся розовые угри (розацеа), частота заболеваемости которыми по данным различных авторов достигает 5-10%.
Цель исследования - изучить состояние здоровья пациенток с розацеа, выделив при этом региональные медико-социальные факторы риска развития заболевания.
Материалы и методы: Под нашим наблюдением находилось 153 женщин с розацеа, в возрасте от 20 до 50 лет, обследованные и пролеченные в поликлинике ГУЗ «ОККВД» и 30 практически здоровых женщин.
Исследования показали, что достоверных различий по социальному положению, уровню образования выявлено не было: большинство обследованных составили служащие. Уровень образования у пациенток, в основном был средним.
Анализ семейного статуса обследованных женщин показал, что женщин с розацеа, состоявших во втором браке, было больше в основной, чем в контрольной группе: 19 (12,4±2,6%) и 1 соответственно.
Изучение сексуальной жизни показало, что практически все женщины обеих групп в период обследования жили половой жизнью. Отметим, что до 17 лет половую жизнь начали женщин- 23 (15,0±2,8%) в основной и значительно реже 1 (3,3±3,3%) в контрольной группе. В период обследования нерегулярную половую жизнь (реже одного раза в неделю) отмечали 58 (37,9±3,9%) пациенток основной группы и 5 (16,6±6,9%) женщин контрольной группы, 19 (12,4±2,6%) в основной и 1 (3,3±3,3%) женщина в контрольной группе не имели половых контактов.
Анализ структуры соматической патологии у пациенток основной и контрольной групп показал, что у пациенток с розацеа достоверно чаще встречались заболевания системы пищеварения, эндокринной, дыхательной системы: 135 (88,2±2,6%), 65 (42,2±4,0%) и 45 (29,4±3,6%) у женщин основной и 19 (63,3±8,9%), 6 (20±7,4%) и 4 (13,3±6,3%) в контрольной группе. Заболеваний мочевыделительной системы и почек было больше у практически здоровых пациенток 7 (23,3±7,8%) по сравнению с основной группой 23 (15,0±2,8%). По остальным заболеваниям достоверных различий в сравниваемых группах выявлено не было.
Изучение структуры перенесенных гинекологических заболеваний у женщин с розацеа, что наибольшую группу составили воспалительные заболевания гениталий, в анамнезе на них указывали 69 (45,0±4,0%) пациенток основной и только 8 (26,6±8,2%) в контрольной группе. На втором месте по частоте встречаемости была миома матки 57 (37,2±3,9%) в основной, в контрольной группе частота этого заболевания была 6 (20±7,4%). Высоко достоверные различия выявлены при сочетании розацеа с кольпитом 42 (27,4±3,6% ) у пациенток основной и у 3 (10±5,5% ) в контрольной группе (р<0,01); так же при их сочетании с дисфункцией яичников у 28 (18,3±3,1% ) пациентки основной группы и у 2 (6,6±4,6% ) практически здоровых женщин. По остальным нозологическим группам достоверно значимых различий выявлено не было.
Анализируя нейроэндокринные синдромы в анамнезе у обследуемых женщин, мы определили, что предменструальный синдром встречался у пациенток с розацеа высоко достоверно чаще 71(46,4±4,0%), чем у относительно здоровых женщин 7 (23,3±7,8% ).
Анализ менструальной функции показал, что значительных различий в характере менструальной функции у женщин сравниваемых групп выявлено не было. Вместе с тем, отметим, что болезненные менструации чаще встречались в группе женщин с розацеа 64(41,8±4,0%), чем у практически здоровых 6 (20±7,4%) женщин. Антепонирующий менструальный цикл чаще отмечался у 36 (23,5±3,4%) обследованных основной и меньше у 3 (10±5,5%) в контрольной группе (р<0,05). Продолжительностью от 32 до 35 дней – только у женщин с розацеа у 6 (3,9±1,5%).
Провоцирующими факторами розацеа чаще всего являлись погрешности в диете 42 (27,4±3,6%). У 27 (17,6±3,0%) женщин с розацеа на возникновение высыпаний влияли предменопаузальные и менопаузальные расстройства. На связь со стрессом указывали 35 (22,8±3,4%) пациенток, с метеорологическими факторами – 12 (7,8±2,1%). 37 (17,6±3,0%) женщин с розацеа ни с чем не связывали возникновение высыпаний.
Таким образом, мы достоверно выделили две репрезентативные группы женщин на основании тщательного отбора основной и контрольной групп, сопоставляя такие параметры, как: возраст, социальное положение, образовательный ценз и т.д. Вместе с тем выявлены достоверные различия, по таким параметрам, как: возраст начала половой жизни, семейное положение, особенности сексуальных отношений, в структуре соматической патологии, перенесенных гинекологических заболеваний, что подчеркивает достоверно значимые различия между пациентками с розацеа и практически здоровыми женщинами.
Эффективность лечения розацеа у женщин с применением гормональной коррекции менструальной функции
Качурина Е.В., Давидян Л.Ю.
Ульяновский государственный университет, Россия, Ульяновск
Розацеа относится к числу наиболее распространенных хронических дерматозов, частота заболеваемости по данным различных авторов достигает 5-10%.
Цель работы: изучение эффективности применения гормональных препаратов в комплексной терапии розацеа у женщин.
Материалы и методы: под нашим наблюдением находилось 153 женщины с розацеа с различными клиническими формами: эритематозно-телеангиэктатической -71, папуло-пустулёзной- 79 и офтальморозацеа – 3, обследованные и пролеченные в поликлинике ГУЗ «ОККВД». Женщин делили на 2 группы: в 1 группе лечение проводилось по традиционной схеме- 76 человек, во 2 группе пациентам рекомендовалась гормонотерапия- 77 женщин, результаты лечения оцениваем через 6 месяцев.
В своей работе перед назначением лечения проводили микроскопическое исследование на демодекс. В случаях обнаружения клеща, назначали соответствующую терапию. Следует отметить, что у 104 пациенток был диагностирован демодекоз.
При лечении розацеа мы учитывали возраст пациенток, клиническую форму заболевания и гормональный фон, на котором развились клинические симптомы. Эффективность проведенной терапии оценивалась по динамике исчезновения клинических симптомов.
При папуло-пустулёзной форме назначали трихопол внутрь во время еды по 0,75 мг в сутки, три 10-дневных цикла. При пиококковой инфекции рекомендовали антибиотики тетрациклинового ряда. При эритематозно- телеангиэктатической форме местно использовали холодные примочки с 2% раствором таннина или 1% раствором резорцина. Наружно при всех формах использовали 1% гель Розамет или крем Розекс 1-2 раза в день в течение 1-1,5 месяцев. При офтальморозацеа дополнительно применялась обработка края век блефарогелем 2 раза в сутки, 1,5 месяца.
У женщин во второй группе параллельно используем препараты заместительной гормональной терапии.
Следует отметить, что при лечении по предложенной методике, ни у одной из 153 исследованных женщин второй группы отсутствия динамики не отмечалось.
В 1 группе улучшение наступало в среднем через 3 недели. Значительное улучшение - через 6 недель. Во второй группе улучшение наступало раньше: в среднем на 7-10 дни лечения. Значительное улучшение было отмечено в среднем на 18-20 день лечении.
В 1 группе клиническое выздоровление наступало у 37(48,6±5,7%) женщин, у 31(40,7±5,6%) было значительное улучшение, улучшение было у 8(10,5±3,5%) пациентов. Во 2 группе клиническое выздоровление наступило в 56 (72,7±5,1%) случаев, у 17(22,0±4,7%) было значительное улучшение, и только у 4(5,1±2,5%) пациентов было улучшение.
Побочного действия назначаемых медикаментозных средств, которые требовали бы изменения или прекращения терапии, не отмечалось. Demodex folliculorum после лечения не обнаружен ни у одного пациента. Наилучший результат и отсутствие рецидивов в течение полугода отмечен у больных во 2 группе с начальной, эритематозно-телеангиэктатической формой заболевания.
Таким образом, при комплексной терапии розацеа, включающей применение заместительных гормональных препаратов, достигнут быстрый и стойкий клинический эффект, что говорит о высокой эффективности и возможности использования гормональных препаратов при лечении женщин с розацеа.
СОЦИАЛЬНЫЕ ПРЕДИКТОРЫ В ПРОФИЛАКТИКЕ И РАННЕЙ ДИАГНОСТИКЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Кометова В.В., Родионов В.В., Хайруллин Р.М., Филиппова Е.Н.,
Зеркалова Ю.Ф.
Ульяновский Государственный Университет
Россия, Ульяновск
Рак молочной железы – не только важная медицинская, но и социальная проблема. Обусловлено это быстрым, неуклонным и повсеместным ростом заболеваемости данной формой рака, вышедшей на первое место в структуре заболеваемости женщин злокачественными новообразованиями. Сложность этой, по сути социальной проблемы, требует более внимательного анализа ряда аспектов современного репродуктивного поведения женщин, которые способствуют росту заболеваемости. Об острой актуальности проблемы для специалистов свидетельствует наличие проблемы рака молочной железы в перечне приоритетов индексирования национальной медицинской библиотекой США, практически монопольно контролирующей весь поток текущих научных публикаций в области биомедицинских наук. В настоящей публикации авторы обращают внимание к проблеме наличия ряда социальных и психологических предикторов, имеющих существенное значение для ранней диагностики и профилактики рака молочной железы, особенно в студенческой молодёжной среде. По статистике МЗ и СР РФ более 40% российских женщин страдают теми или иными онкологическими заболеваниями молочной железы. Последние два десятилетия они характеризуются значительным ростом, как в нашей стране, так и за рубежом. По данным ВОЗ (2009г.) в мире наблюдаются и проходят лечение порядка 12 миллионов женщин с диагнозом «рак молочной железы». Мировая заболеваемость растет на 3% ежегодно. Смертность женщин от рака молочной железы стоит на третьем месте после болезней системы кровообращения и несчастных случаев, травм и отравлений [1].
Причина такой высокой заболеваемости и смертности от рака молочной железы чаще всего обусловлена запущенностью заболевания. Более 90% выявляемого рака молочной железы приходится на долю поздних стадий болезни. В России очень низкий процент выявляемости рака на первой стадии. В то же время современные биомедицинские технологии позволяют диагностировать злокачественную опухоль на очень ранних стадиях, когда она может быть успешно излечена – в 9 из 10 случаев. Современные российские девушки и молодые женщины считают более важным заботу о своей спортивной форме и правильном питании, забывая порой об условиях, которые могут помочь сохранить им гораздо более важное с социальной точки зрения репродуктивное здоровье, молочную железу, и, главное, предстоящую жизнь. Каждой современной девушке и женщине важно усвоить три простых, но вполне доступных и эффективных действия, которые позволят выявить самостоятельно патологию молочных желез до появления клинических симптомов: 1 - ежемесячное самостоятельное обследование молочных желез; 2 - регулярное посещение врача-маммолога; 3 - периодическое выполнение маммографии [2]. Опыт показывает, что многие российские женщины не имеют привычки с профилактической целью регулярно посещать врача-маммолога, следуют советам некомпетентных специалистов и посторонних людей, средствам массовой информации, возлагают надежды на парамедицинские методы лечения и приём биодобавок. Именно такое поведение женщин и приводит к запущенным случаям, когда необходимо комплексное лечение (хирургическое, лучевое, химиотерапевтическое, гормональное), и, как следствие - к неблагоприятному исходу. У каждой второй женщины, из числа заболевших раком молочной железы, есть риск умереть от этого патологии.
На сегодняшний день существуют лишь два способа надежной борьбы со злокачественными опухолями, апробированные в мировой практике: профилактика и диагностика на ранних стадиях. Актуальной и во многом нерешенной проблемой, как в онкологии, так и в здравоохранении в целом является активное выявление рака молочной железы на ранних стадиях. Следует различать ранний рак и минимальный рак. Ранний рак – это неинфильтрирующий рак, или рак in situ. Минимальный рак – рак с микроинвазией (до 5 мм). Обе эти формы не определяются при пальпации, то есть клинически. По статистике, в группах женщин, подвергающихся регулярной маммографии, рак молочной железы в I стадии выявляется в 50-70% случаев. 5-летняя выживаемость таких больных приближается к 100% [3].
Риск развития опухоли индивидуален и зависит от сочетания предрасполагающих к его развитию факторов. Они делятся на эндогенные и экзогенные. Среди эндогенных факторов основным является возраст женщины. Чем старше женщина, тем выше риск у нее заболеть раком молочной железы. Резкий рост заболеваемости отмечается после 40 лет, достигая максимума к 60 годам. Поэтому женщинам старше 40-45 лет рекомендуется ежегодно проводить осмотр у врача-маммолога и делать маммографию. Однако в настоящее время данная патология ещё более молодеет. В Ульяновской области за последние два года выявлено около десятка случаев рака молочной железы у женщин 20-30-летнего возраста. В молодом возрасте опухоль обладает более агрессивными признаками: высокой степенью анаплазии, более высокими значениями Ki-67-индекса, более выраженной инвазией сосудов, некрозом опухолевой паренхимы и меньшей экспрессией рецепторов половых гормонов. По данным некоторых исследований установлено, что раки молочной железы в возрасте 35-40 лет и моложе на момент постановки диагноза имеют худшие показатели прогноза и чаще рецидивируют [4]. Поэтому девушкам и молодым женщинам с целью выявления раннего рака также необходимо ежегодно проходить осмотр у врача-маммолога и ультразвуковое исследование молочных желез. Делать маммографию женщинам до 30 лет не рекомендуется из-за высокой плотности молочной железы в этом возрасте и низкой эффективности выявления объемного образования на снимке.
Генетические факторы играют огромную роль в развитии не только рака молочной железы, но и в его сочетании с другими опухолями – так называемый интегральный специфический наследственный синдром рака молочной железы. Например, рак молочной железы может выявляться совместно с карциномой яичника (молочно-яичниковый опухолевый синдром) или может возникнуть в сложном комплексе с саркомой. Также у кровных родственников могут возникать сочетания опухолей: рак молочной железы, рак легкого, рак гортани и лейкоз; рак молочной железы и опухоль головного мозга; болезнь BLOOM – аутосомный наследственный генодерматоз и рак молочной железы, и некоторые другие сочетания. Некоторые женщины являются носителями недавно открытых патологических генов BRCA1 и BRCA2 (breast cancer associated genes), с которыми связан высокий риск развития рака молочной железы и составляет 44-80% и 55-85% соответственно. Кроме того, выявлена группа мутаций гена р53, также связанных с предрасположенностью к раку молочной железы [5].
На основании анализа данных литературы можно рассматривать в качестве фактора риска развития рака молочной железы состояние репродуктивной системы организма женщины. В современном мире отмечается снижение рождаемости, увеличивается возраст первой беременности и родов. Многие женщины отказываются от грудного вскармливания. Увеличивается количество абортов, особенно при первой беременности. Отмечается рост инфекционно-воспалительных заболеваний половой системы. Все эти факторы негативно влияют на гормональное состояние женщины и, соответственно, на состояние молочных желез. Так, более высокий риск заболеть имеют нерожавшие женщины или те, у которых первые роды были после 30 лет. Женщины, у которых начало менструаций приходилось на период до 12 лет, а наступление менопаузы после 55 лет, имеют в 2-2,5 раза выше риск заболеть раком молочной железы. Нарушенная функция яичников и гиперпластические процессы в матке увеличивают заболеваемость карциномой молочной железы.
Среди экзогенных факторов, существенно увеличивающих риск развития рака молочной железы, в литературе чаще встречаются упоминания о нерациональном питании с преобладанием животных жиров, о некачественной питьевой воде, о гиподинамии, физической травме груди, о психических травмах и т.п. Так, в работах некоторых исследователей сообщается об увеличении более чем на 20% риска развития рака молочной железы у тучных женщин. По данным голландских ученых, у высоких женщин (более 165 см) повышен риск развития рака молочной железы, и после наступления менопаузы вероятность возникновения опухоли молочной железы возрастает на 7% с увеличением роста на каждые пять сантиметров. В последнее десятилетие участие женщин в «чисто» мужском труде (физическая работа), занятия такими видами спорта, как футбол, хоккей, бокс, некоторые виды борьбы привели к росту числа травм молочных желез. Об этом необходимо знать, прежде всего, студенткам, являющимся будущими профессиональными спортсменками. Процент «посттравматического» рака молочной железы колеблется от 4,2 до 44,6 [3]. Необходимо оберегать молочные железы от травм и при возникновении уплотнения на месте травмы не заниматься самолечением, а обращаться к врачу-маммологу. В литературе встречаются данные о том, что яркий свет приводит к увеличению выработки мелатонина, а затем эстрогенов и пролактина, что приводит к повышенному риску развития рака молочной железы. Не исключено, что косметические кабинеты и студии искусственного загара – источник не только рака кожи, но и косвенно – рака молочной железы. Таким образом, блокируя тот или иной фактор или несколько, можно уменьшить число случаев рака молочной железы. Однако это лишь теория. Практически невозможно сделать всех женщин низкого роста, худых, употребляющих в пищу только сою и ржаной хлеб, рожающих до 30 лет и т.д. Зная предрасполагающие экзогенные и эндогенные факторы риска развития рака молочной железы, можно уменьшить их влияние и определить группу риска женщин, за которыми необходимо динамическое наблюдение в качестве профилактики развития заболевания.
На настоящем этапе развития современного общества в основе снижения смертности среди женщин от рака молочной железы лежит раннее выявление минимальных форм рака. Важно знать, что, к счастью, большинство выявляемых на приеме у врача-маммолога опухолей молочной железы (около 80% случаев) являются доброкачественными: узловая мастопатия, киста, фиброаденома, внутрипротоковая папиллома и другие образования. Но они также представляют серьезную медицинскую проблему, так как некоторые из них являются предраковыми патологическими изменениями. По данным статистики, только у 1 из 9 таких женщин разовьется злокачественное образование. Так, при непролиферативной форме мастопатии малигнизация наступает в 0,87% случаев, а при пролиферативном фиброаденоматозе в зависимости от степени пролиферации риск развития рака молочной железы возрастает с 2,34% до 31,4% [3]. Следовательно, пролиферативные изменения в молочной железе нужно расценивать как раннюю онкологическую патологию, которая требует правильной тактики лечения и динамического наблюдения со стороны врача-маммолога. Чаще всего при обнаружении какого-либо объемного образования в молочной железе врач-маммолог проводит минимальное хирургическое вмешательство с целью получения кусочка образования для гистологического исследования – биопсийного материала. Только гистологическое исследование удаленного препарата позволяет диагностировать рак in situ и/или минимальный рак молочной железы.
Актуальной и во многом нерешенной проблемой представляется активное выявление рака молочной железы на стадиях неинвазивного и микроинвазивного рака молочной железы. Обучение женщин методам самообследования молочных желез и внедрение его в практику как метода ранней диагностики не даёт значительного улучшения не только в выявлении ранних форм рака, но и в общей выживаемости больных. Это связано с тем, что пальпируемая женщиной опухоль уже имеет клиническое проявление, а значит, относится к поздней стадии (инвазивному раку) заболевания. Наиболее приемлемой для ранней диагностики рака молочной железы остается по-прежнему маммография, которая лежит в основе скрининга - массового периодического обследование здорового населения с целью выявления скрыто протекающего заболевания, в частности рака молочной железы. Главной целью скрининга является сокращение смертности от заболевания. При максимальном времени опережения диагностики опухоли перед клиническими проявлениями, равном 1,5 года, сокращение смертности от рака молочной железы достигает 30% [5]. Таким образом, маммография, выполняемая раз в 2-3 года, не обеспечивает эффективную диагностику рака молочной железы, так как более половины случаев заболевания приходится на интервалы между скрининговыми исследованиями. Поэтому женщинам необходимо знать, что маммографию нужно проходить ежегодно, и нерегулярные посещения врача-маммолога не гарантируют защиты от заболеваемости раком молочной железы. При обращении женщин к врачу любой специальности, если она не осматривалась в текущем году у маммолога, врач обязан напомнить женщине о необходимости самообследования молочных желез и своевременном обращении к специалисту. При появлении жалоб и/или выявлении очаговых изменений в молочных железах врачом любой специальности больная должна быть направлена на консультацию к врачу-онкологу.
В связи с тем, что рак молочной железы в последнее десятилетие «помолодел», возрастает роль педагогов вузов и учителей школ в разъяснении студенткам и девочкам старших классов причин развития заболеваний молочных желез. Необходимо периодически проводить лекции по риску развития рака молочной железы, объяснять, что такие факторы, как курение и приём алкоголя, неконтролируемый специалистом и неправильный прием гормональных противозачаточных препаратов, наличие в анамнезе абортов, воспалительные и дисфункциональные заболевания женских половых органов, несбалансированное питание могут быть потенциальными факторами развития опухолей молочных желез. В медицинских вузах и средних специальных учебных заведениях необходимо уделять достаточное внимание изучению рака молочной железы, начиная со строения и функции органа на кафедре анатомии и заканчивая диагностикой и лечением на кафедрах гинекологии и онкологии. В задачи педагога входит объяснение студенткам и студентам анатомических особенностей строения молочной железы, путей оттока лимфы в регионарные лимфоузлы, путей возможного метастазирования рака молочной железы. Для массовой информированности женщин о профилактике рака молочной железы необходимо издание специальной литературы (памяток, буклетов, рекламных листовок) для размещения в поликлиниках, вузах, транспорте и т.д.
Таким образом, профилактическая работа, направленная на раннюю диагностику рака молочной железы, должна складываться из многих составляющих: экономической, социальной, клинической, экспериментальной, эпидемиологической. Еще около 20 лет назад рак situ диагностировали в 3-5% случаев от всех вновь выявляемых раков молочной железы. По данным мировой литературы в настоящее время минимальный рак составляет около 20% от всех случаев рака молочной железы. Есть определенные надежды, что все больше случаев заболевания будут выявляться на стадии, когда лечение дает хорошие результаты. Изучение основных причин возникновения рака молочной железы, совершенствование диагностической базы, появление новых методов исследования, а также совместные усилия онкологов, врачей всех специальностей и самих женщин – вот основные составляющие улучшения ситуации в своевременной диагностике рака молочной железы.
Литература:
- Аксель Е.М. Злокачественные образования молочных желез: состояние онкологической помощи, заболеваемость и смертность // Маммология. – 2006.- Вып.1. – С. 9-13.
- Беккер Д. Раннее обнаружение рака молочной железы; важность самодиагностики // Тез. докл. международн. женского форума «Чистый и безопасный мир». - Мн. - 2000. – С.15.
- Доброкачественные и злокачественные заболевания молочной железы: Пособие для студентов и врачей / Под редакцией Л.А. Путырского, Ю.Л. Путырского. – Москва. – 2008. – С. 37.
- Крючков А.Н., Фрейнд Г.Г. Возрастные особенности инвазивной протоковой карциномы молочной железы // Архив патологии. – 2007. – вып. 6. – С. 15-16.
- Иванов В.Г. Эпидемиологические факторы риска, ранняя диагностика рака молочной железы // Практическая онкология. – 2002. – Т.3, №1. – С. 15-19.
