Десятые академические чтения раасн, 2006 г
| Вид материала | Документы |
СодержаниеОсобенности изготовления керамических изделий Об изменении фазового состава гидросиликатов кальция |
- Десятые академические чтения раасн, 2006, 1092.49kb.
- Десятые академические чтения раасн, 2006, 1266.3kb.
- Концепция устойчивого развития в стратегии градостроительства франции 05. 23. 22 Градостроительство,, 332.07kb.
- Резолюция районной детской экологической конференции Десятые Басарукинские чтения, 39.32kb.
- План организационно-педагогической деятельности с детьми, имеющими ярко-выраженные, 77.33kb.
- Новосибирский государственный педагогический университет, 43.06kb.
- Академические программы и экзаменационные курсы в австралии международные центры Embassy, 146.35kb.
- Экология человек общество, 371.15kb.
- Министерство образования и науки российской федерации московский государственный областной, 2810.15kb.
- Рассказывайте детям о ценности чтения. Показывайте связь чтения с их успехами в учебе, 97.26kb.
Для оценки кислотостойкости образцы погружались в 10 %-ный раствор H2SO4; щелочестойкости –
1 %-ный NaOH. После определенного количества суток образцы испытывались на сжатие, и рассчитывалось изменение их объема (по отношению к исходному объему обожженных сухих образцов). Полученные данные представлены в табл. 4.
Таблица 4.
Оценка стойкости образцов в агрессивных средах
| Период наблюдения, сутки | Кислотная среда | Щелочная среда | ||
| Коэффициент химической стойкости | Изменение объема, % | Коэффициент химической стойкости | Изменение объема, % | |
| 4 | 1,05 1,51 | 0 0,16 | 0,91 0,91 | 0,50 0,17 |
| 8 | 0,94 1,51 | 1,65 -0,51 | 0,94 0,95 | -0,5 -0,68 |
| 12 | 1,02 1,05 | 0,01 0,004 | 0,98 1,05 | -0,82 -0,34 |
| 16 | 1,05 1,28 | 0,83 0,019 | 0,86 1,12 | -0,65 -0,36 |
| 20 | 1,11 1,42 | 0,67 0,002 | 0,83 1,23 | 1,32 -1,03 |
| 24 | 1,01 1,34 | 1,32 1,51 | 0,83 0,83 | 0,66 0,04 |
Примечание: в числителе приведены данные для образцов суглинка Анзебинского месторождения, в знаменателе - для золокерамики; коэффициент химической стойкости рассчитан как соотношение прочности образцов после нахождения в агрессивной среде (без высушивания) к прочности обожженного материала.
Установлено, что в щелочной среде образцы мало изменяют свои свойства. После 24 суток пребывания в растворе щелочи прочность материала из природного и техногенного сырья снизилась на 17% (Кх.с.=0,83). Изменение объема образцов незначительно: 0,66 – для глиняной керамики, 0,04 – для золокерамики.
Напротив, хранение в растворе кислоты резко меняет прочностные характеристики золокерамики. После 4 суток происходит упрочнение образцов в 1,5 раза, а по истечении 24 суток прирост прочности составляет 34 %.
Изменение объема при этом составляет 1,5 %. Для глиняных образцов отмечено слабое упрочнение (1 – 11 %) при хранении в растворе кислоты.
Для анализа механизма упрочнения золокерамики в агрессивных средах проведен РФА образцов, обожженных при температурах от 600 до 10000С (Рис. 1).
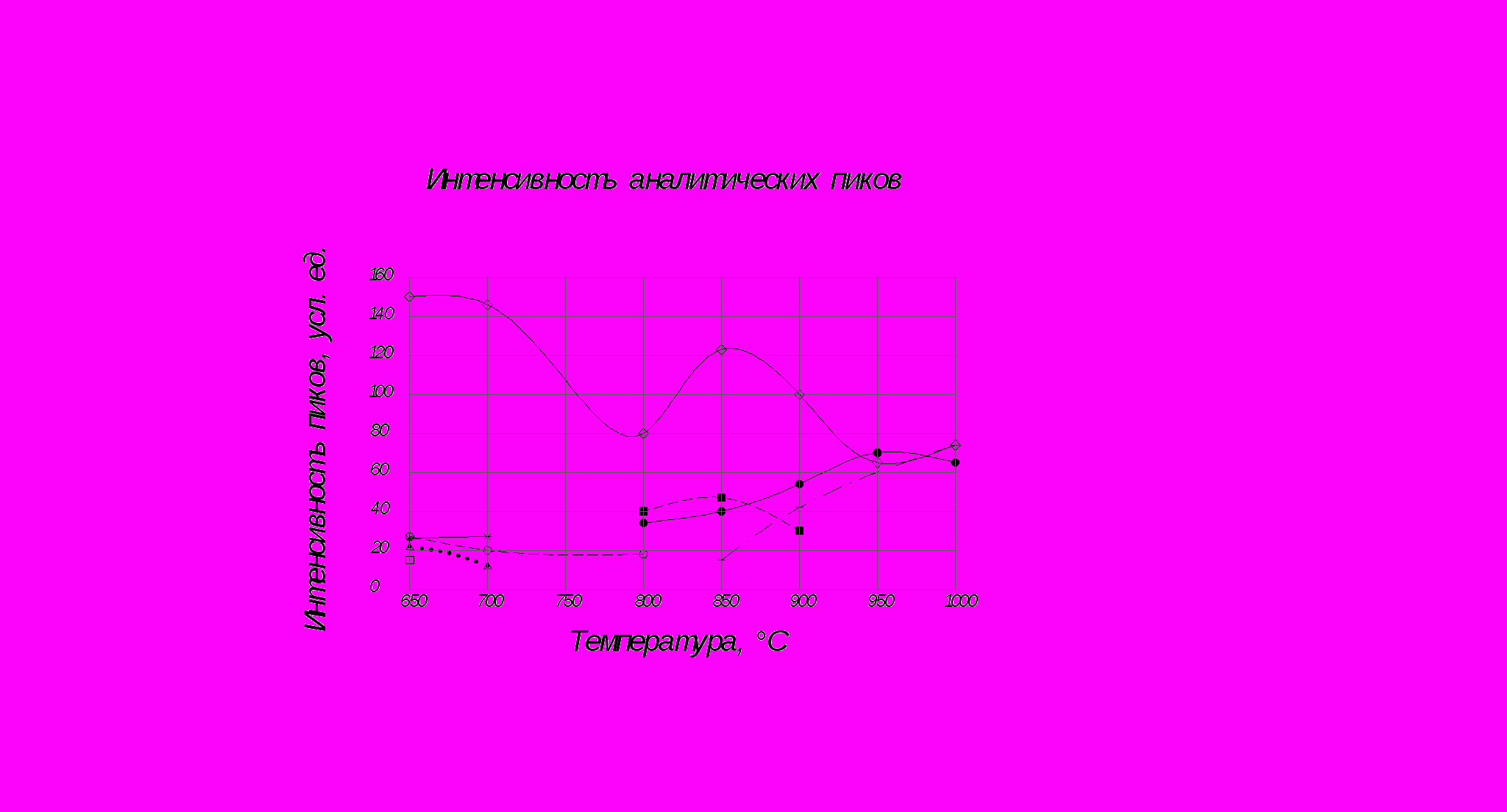

Рис. 1
Результаты РФА показывают, что при нагревании до 10000С содержание кварца в системе снижается, кальцит и гематит присутствуют до 7000С. Наличие оксида магния сохраняется до 8000С. Синтез диопсида и геленита отмечен при 8000С. При повышении температуры до 9500С наблюдается интенсивный рост диопсида в системе, содержание которого стабилизируется при 10000С. Полевые шпаты кристаллизуются при 8500С. Повышение температуры до 10000С интенсифицирует кристаллизацию полевых шпатов в композиции. Наличие геленита фиксируется в диапазоне температур от 8000С до 9000С.
Таким образом, упрочнение золокерамики в сернкислом растворе может быть вязано с присутствием геленита, который в условиях сульфатной активации гидратируется уплотняя структуру и повышая прочность материала. Щелочная активация для золокерамики менее эффективна и носит волнообразный характер.
УДК 666.70
Макарова И.А., канд. техн. наук, доцент, Гура З.И., доцент
Братский государственный университет
ОСОБЕННОСТИ ИЗГОТОВЛЕНИЯ КЕРАМИЧЕСКИХ ИЗДЕЛИЙ
КОМБИНИРОВАННОГО СОСТАВА
Возможность получения гидратированной керамики с применением лессовых пород выявлена рядом исследований [1,2]. Особенностью предлагаемых технических решений является низкотемпературный при 700…850С обжиг и последующее увлажнение материала. Рекомендованы разные способы увлажнения: погружение в воду («естественная гидратация»), пропаривание, водотепловая обратка под давлением. Причиной проявления гидравлической активности является синтез активных соединений кальция, обладающих способностью к гидратации. Позитивное влияние процесса гидратации на эксплуатационные свойства изделий (прочность, морозостойкость) проявляется в том случае, если большая часть оксида кальция связывается в процессе обжига в активные соединения.
Применительно к закарбонизованному сырью установлена целесообразность получения методом полусухого прессования стеновой керамики, упрочняющейся при дополнительном увлажнении после обжига [3]. По мнению авторов прием увлажнения приводит к образованию гидроксида кальция, активному размыванию включений и отсосу размытых и растворенных частичек по порам и капиллярам, поскольку к включениям в кирпиче полусухого прессования поступает большее количество воды.
Наличие несвязанного оксида кальция в керамических изделиях на основе барханных песков (оптимальный состав шихты «песок 70% + глина 30%) обусловлено развитием деструктивных процессов в связи с медленным гашением свободной извести парами воды, содержащимися в воздухе [4]. Авторы рекомендуют применение быстрого способа гашения оксида кальция водной обработкой изделий, что позволяет избежать разрушений. Опытно-промышленными испытаниями подтверждена принципиальная возможность изготовления стенового материала — «барханокерама» марки «125» с морозостойкостью 35 циклов.
Исследованиями, выполненными в Братском государственном университете выявлен эффект упрочнения после увлажнения керамических материалов на основе микрокремнезема (МК) — высокодисперсного отхода производства кристаллического кремния Братского алюминиевого завода (БрАЗа). В составе МК преобладает высокодисперсный аморфный кремнезем.
Изучено сочетание МК с термообработанным суглинком (СГЛ) Анзебинского месторождения, содержащим 20…23% карбонатных примесей. Использование приема предварительной термообработки суглинка основано на высокой эффективности применения сырьевой смеси, включающей МК и глиежи, являющиеся продуктом самообжига глинистых пород [5]. Применительно к производству кирпича в г. Братске глиежи являются привозным сырьем и поэтому целесообразна их замена на аналогичный компонент. Немаловажно, что на действующем кирпичном заводе принят порошково-пластический способ подготовки суглинка, включающий его предварительное измельчение и термическую подготовку в тангенциальной молотковой мельнице. Предварительный анализ показал, что температура термообработки суглинка 500°С является оптимальной.
Для активизации процессов спекания предусмотрено дополнительное введение в серьевую смесь пыли электрофильтров (ПЭФ) — дисперсного отхода основного алюминиевого производства БрАЗа. Выбор этой добавки обусловлен наличием в его составе как ценных минерализующих составляющих — фторсодержащих соединений (хиолита, криолита), гематита и глинозема, так и органических примесей.
Оптимизация рецептуры и параметров обжига экспериментальных шихт проводилась с применением метода математического планирования эксперимента. Установлены составы смесей, позволяющие получить при 875°С обжиговый материал, характеризующийся коэффициентами размягчения 1,1…1,3; что соответствует приросту прочности после дополнительного увлажнения на 10…30%. При этом содержание термообработанного суглинка в основной шихте составляет 15…30 мас.%, а расход ПЭФ – 10% от массы базовой шихты «МК+СГЛ».
Примечательно, что для керамических образцов из экспериментальной смеси 77,5%МК+22,5%СГЛ с добавкой 10%ПЭФ эффект упрочнения сохраняется после испытания на морозостойкость. При этом прирост прочности составляет 36 и 25% соответственно для образцов, обожженных при 875 и 950°С. Очевидно, это связано с образованием при обжиге низкоосновных гидравлически активных фаз, гидратация которых приводит к упрочнению материала, несмотря на жесткие условия испытания на морозостойкость. Образцы, обожженные при 875 и 950°С, соответственно характеризуются морозостойкостью 100 и 125 циклов.
Характерной особенностью образцов из рекомендуемой трехкомпонентной шихты является малая воздушная усадка, не превышающая 0,3%. Это предоопределяет меньшую деформативность сырца при сушке. Для материала, обожженного при 875°С, огневая усадка составляет 0,56%, а прочность при сжатии 18МПа. Обжиг при повышенной температуре 950°С способствует росту огневой усадки (2,16%) и прочности (24МПа). При этом водопоглощение не зависит от температуры обжига и составляет 32%.
Низкие значения средней плотности 1150…1200кг/м3 предопределяют получение лицевой стеновой керамики с лучшими теплотехническими свойствами в сравнении с керамической продукцией из анзебинского суглинка, для которой этот показатель выше на 33…36%.
Таким образом, применение рекомендуемой композиции позволяет синтезировать при обжиге наряду с традиционными керамическими минералами (кристобалит, кварц, полевые шпаты) гидравлически активные фазы.
Формирование комбинированного минерального состава и сбалансированная пористость обеспечивают высокие эксплуатационные свойства керамических изделий на основе МК, термообработанного СГЛ и ПЭФ.
СПИСОК литературЫ
- Нудельман Б. И. Хлорирующий обжиг извести. - Ташкент: Мехнат, 1989. -С. 414-415.
- Боженов П. И., Глибина И. В., Григорьев Б. А. Строительная керамика из побочных продуктов промышленности. - М.: Стройиздат, 1986. - С.79-99.
- Соловьева О. В., Смирнова И. В. Использование в кирпичном производстве глин с выключением карбонатных пород. Под ред. Р. Я. Попицкого. - М.: Госуд. изд-во лит. по стр-ву. – 1957. - С.64.
- Умарова М. Ш., Нудельман Б. И., Валищев Р. Л, Гашанова О. Г. Кирпич на основе барханного песка// Строительные материалы. – 1988. - № 7 - С.4-5.
- Лохова Н. А., Макарова И. А., Патраманская С. В. Обжиговые материалы на основе микрокремнезена. - Братск: БрГТУ, 2002. - 163с.
УДК 691.32:678.06
Макридин Н.И., д-р техн. наук, профессор, Вернигорова В.Н., д-р хим. наук, профессор,
Максимова И.Н., канд. техн. наук, доцент, Мамедов М.Т., инженер, Овсюкова Ю.В., магистр
Пензенский государственный университет архитектуры и строительства
ОБ ИЗМЕНЕНИИ ФАЗОВОГО СОСТАВА ГИДРОСИЛИКАТОВ КАЛЬЦИЯ
С ДОБАВКАМИ СУПЕРПЛАСТИФИКАТОРОВ
Трехкальциевый силикат ЗСаО-SiO2(С3S) и -двухкальциевый силикат -2СаО-SiO2(-C2S) являются основными минералами портландцементного клинкера и определяют его важнейшие технические свойства. Было исследовано влияние СП С-3 и НФ на фазовый состав образующихся гидросиликатов кальция (ГСК) в процессе гидратации минералов -С2S и С3S. Гидратацию минералов проводили в суспензии с водотвердым отношением В/Т=300. Добавки СП С-3 и НФ вводили в суспензию в количестве 60 мг/дм3, что составляло 2% от массы минералов. Гидратация минералов проводилась при комнатной температуре в течение 80 сут. Как показано во многих работах, кинетика гидратации в суспензиях практически не отличается от кинетики гидратации в пастах, несмотря на различие в водо-силикатных отношениях (В/С). В работе показано, что начиная с отношения В/С=0,45, скорость гидратации силикатов почти не зависит от величины В/С. Через 80 сут синтеза ГСК отфильтровывали и промывали эфиром, а затем высушивали при 105°С.
Полученные порошкообразные ГСК прессовали в таблетки. Были получены ионизационные рентгенограммы образцов ГСК на дифрактометре ДРОН-2. В таблице представлены основные линии (Å) негидратированных минералов и гидратированных минералов -С2S и С3S как без добавок СП, так и в их присутствии.
Из данных таблицы следует, что на ионизационных рентгенограммах всех образцов наблюдается исчезновение некоторых линий, характерных для негидратированных образцов -С2S и С3S и появление новых линий. На ионизационных рентгенограммах гидратированных образцов -С2S наблюдается смещение одной части линий в сторону меньших углов, другая часть линий смещена в сторону больших углов. Это указывает на изменение периодов идентичности кристаллической решетки -С2S как в сторону увеличения, так и в сторону уменьшения.
Анализ ионизационных рентгенограмм показал, что в образцах -С2S, гидратированных без добавок СП, присутствуют 2 фазы:
- фаза C2SH (А): линии (Å) - 3,29 (20%); 3,04 (100%); 2,70 (70%); 2,61 (50%); 2,33 (сл.); 2,19 (25%); 2,10 (сл.); 2,06 (сл.); 1,94 (сл.); 1,65 (cл.); 1,54 (cл);
- фаза C2SH (В): линии (Å) - 3,39 (25%); 2,98 (10%); 2,78 (60%); 2,75 (60%); 2,49 (сл.); 2,37 (сл.); 2,29 (сл.); 1,98 (10%); 1,87 (сл.); 1,82 (сл.); 1,77 (30%); 1,63 (25%).
Фазы формируются приблизительно в равных количествах.
В образцах -С2S, гидратированных в присутствии СП С-3, наблюдаются также 2 фазы.
Фаза C2SH (А): линии (Å) - 3,28 (20%); 3,05 (100%); 2,79 (60%); 2,70 (20%); 2,62 (60%); 2,29 (сл.); 2,19 (30%); 2,10 (сл.); 2,06 (сл.); 1,91 (сл.); 1,76 (30%); 1,55 (сл.).
Фаза C2SH (В): линии (Å) - 3,57 (сл.); 3,39 (20%); 2,98 (10%); 2,75 (50%); 2,50 (30%); 2,39 (сл.); 1,98 (10%); 1,94 (сл.); 1,87 (сл.); 1,82 (сл.); 1,63 (сл.).
СП С-3 препятствует кристаллизации этих фаз, так как относительная интенсивность линий этих фаз в присутствии СП С-3 меньше. Фаза C2SH (А) преобладает.
В образцах -С2S, гидратированных в присутствии СП НФ, наблюдаются 3 фазы.
Фаза C2SH (А): линии (Å) - 3,29 (10%); 3,03 (100%); 2,79 (20%); 2,70 (10%); 2,61 (25%); 2,29 (10%); 2,19 (20%); 2,09 (<10%); 2,06 (сл.); 1,91 (сл.); 1,76 (20%); 1,60 (сл.); 1,55 (сл.).
Фаза C2SH (В): линии (Å) - 3,57 (сл.); 3,39 (сл.); 2,98 (<10%); 2,75 (40%); 2,50 (10%); 2,37 (сл.); 1,98 (сл.); 1,94 (сл.); 1,82 (50%); 1,63 (сл.).
Фаза C2SH (С): линии (Å) - 3,85 (сл.); 3,03 (100%); 2,70 (10%); 1,88 (10%).
Суперпластификатор НФ, внедряясь в кристаллическую решетку -С2S, создает большие стерические затруднения, чем С-3, поэтому формируется больше фаз. Преобладает фаза C2SH (А).
В образцах минерала С3S, гидратированных без добавок СП, присутствуют 3 фазы.
Фаза C2SH (А): линии (Å) - 3,28 (20%); 3,03 (100%); 2,79 (50%); 2,70 (40%); 2,61 (50%); 2,29 (сл.); 2,19 (30%); 2,09 (сл.); 1,91 (сл.); 1,64 (сл.); 1,55 (сл.).
Фаза C2SH (В): линии (Å) - 3,39 (45%.); 2,97 (30%); 2,76 (45%); 2,50 (сл.); 2,37 (сл.); 1,98 (20%); 1,82 (сл.); 1,77 (20%).
Фаза C2SH (С): линии (Å) - 3,86 (сл.); 3,03 (100%); 2.50 (сл.); 2,33 (сл.); 1,88 (15%).
Преобладает фаза C2SH (А).
Нестехиометричность и дефектность структуры С3S являются причиной формирования в кристаллической решетке минерала нескольких фаз под действием воды.
Таблица
| -С2S | С3S | ||||||
| негид-ратиро-ванный | гидра-тирован-ный без добавок | гидра-тирован-ный с С-3 | гидра-тированный с НФ | негид-ратиро-ванный | гидра-тированный без добавок | гидратированный с С-3 | гидра-тирован-ный с НФ |
| | 3,39 25% | 3,57 cл. | 3,85 cл. | | 3,86 cл. | 3,85 cл. | 3,85 cл. |
| 3,20 cл. | 3,29 20% | 3,39 20% | 3,57 cл. | | 3,39 45% | 3,56 cл. | |
| 3,02 cл. | 3,04 100% | 3,28 20% | 3,39 cл. | 3,03 80% | 3,28 20% | 3,39 40% | 3,39 40% |
| 2,84 cл. cл.ел. | 2,98 10% | 3,05 100% | 3,29 ~10% | 2,97 cл. | 3,03 100% | 3,28 25% | 3,28 30% |
| 2,77 100% | 2,78 50% | 2,98 ~10% | 3,03 100% | 2,78 100% | 2,97 30% | 3,03 100% | 3,03 100% |
| | 2,75 60% | 2,79 60% | 2,98 <10% | 2,75 90% | 2,79 50% | 2,97 30% | 2,98 cл. |
| 2,72 90% | 2,70 10% | 2,75 50% | 2,79 ~20% | 2,60 90% | 2,76 45% | 2,78 35% | 2,79 40% |
| 2,60 40% | 2,61 50% | 2,70 20% | 2,75 ~40% | | 2,70 40% | 2,75 30% | 2,76 40% |
| 2,45 20% | 2,49 cл. | 2,62 60% | 2,70 ~10% | | 2,61 50% | 2,70 25% | 2,71 20% |
| 2,38 ~20% | 2,37 cл. | 2,50 30% | 2,61 ~25% | | | 2,61 35% | 2,61 ~40% |
| | 2,33 cл. | 2,39 cл. | 2,50 <10% | | 2,50 cл. | 2,50 10% | 2,49 <10% |
| 2,27 ~20% | 2,29 cл. | 2,33 ~10% | 2,37 cл. | 2,32 cл. | 2,37 cл. | 2,37 ~10% | 2,37 cл. |
| 2,18 40% | 2,19 25% | 2,29 cл. | 2,29 ~10% | | 2,33 cл. | | 2.33 cл. |
| 2,14 cл. | 2,10 cл. | 2,19 30% | 2,19 ~20% | 2,19 60% | 2,29 cл. | 2,29 ~10% | 2,25 ~40% |
| 2,04 cл. | 2,06 cл. | 2,10 cл. | 2,09 <10% | | 2,19 30% | 2,19 15% | 2,19 ~10% |
| 2,01 cл. | 1,98 10% | 2,06 cл. | 2,06 cл. | | 2,09 cл. | 2,09 ~10% | 2,09 <10% |
| 1,97 20% | 1,94 cл. | 1,98 10% | 1,98 cл. | 1,97 cл. | 1,98 20% | 1,98 15% | 1,98 ~10% |
| | 1,91 cл. | 1,94 cл. | 1,94 cл. | 1,94 10% | 1,91 cл. | 1,94 cл. | 1,91 cл. |
| 1,88 ~15% | 1,87 cл. | 1,91 cл. | 1,91 cл. | | 1,88 15% | 1,91 cл. | 1,88 ~10% |
| | 1,82 cл. | 1,87 cл. | 1,88 ~10% | | 1,82 cл. | 1,88 ~10% | |
| 1,78 ~15% | 1,77 30% | 1,82 cл. | 1,82 50% | 1,82 cл. | | 1,82 cл. | 1,82 cл. |
| 1,70 ~10% | 11,74 cл. | 1,76 ~30% | 1,76 20% | 1,77 50% | 1,77 20% | 1,77 ~10% | 1,76 cл. |
| | 1,65 cл. | 1,63 cл. | 1,63 cл. | 1,68 35% | 1,64 cл. | 1,74 cл. | |
| 1,62 30% | 1,63 25% | | 1,60 cл. | 1,54 20% | 1,55 cл. | 1,72 cл. | 1,63 cл. |
| 1,54 cл. | 1,54 cл. | 1,55 cл. | 1,55 cл. | | | 1,63 cл. | |
| 1,52 cл. | 1,50 25% | 1,49 ~10% | 1,49 cл. | | 1,49 cл. | 1,55 cл. | 1,55 cл. |
| 1,47 cл. | 1,46 cл. | 1,48 cл. | | 1,48 40% | | 1,49 cл. | 1,49 cл. |
В образцах С3S, гидратированных в присутствии CП С-3, наблюдаются фазы:
- фаза C2SH (А): линии (Å) - 3,28 (25%); 3,03 (100%); 2,70 (25%); 2,61 (35%); 2,29 (10%); 2,19 (15%); 2,09 (10%); 1,91 (сл.); 1,77 (10%); 1,74 (сл.); 1,72 (сл.); 1,55 (сл.);
- фаза C2SH (В): линии (Å) - 3,56 (сл.); 3,39 (40%); 2,97 (30%); 2,78 (35%); 2,75 (30%); 2,50 (10%); 2,37 (10%); 1,98 (15%); 1,94 (сл.); 1,82 (сл.); 1,63 (сл).
- фаза C2SH (С): линии (Å) - 3,85 (сл.); 3,03 (100%); 2,50 (10%); 1,88 (10%).
В присутствии СП С-3 формируются те же фазы, но относительная интенсивность их линий меньше вследствие меньшей степени закристаллизованности образовавшихся фаз. Преобладает фаза C2SH (А).
В образцах С3S, гидратированных в присутствии СП НФ, присутствуют 3 фазы:
Фаза C2SH (А): линии (Å) - 3,28 (30%); 3,03 (100%); 2,71 (20%); 2,61 (40%); 2,25 (40%); 2,19 (10%); 2,09 (<10%); 1,91 (сл.); 1,76 (сл.); 1,55(сл.).
Фаза C2SH (В): линии (Å) - 3,39 (40%.); 2,98 (сл.); 2,79 (40%); 2,76 (40%); 2,49 (<10%); 2,37 (сл.); 1,98 (10%); 1,82 (сл.); 1,63 (сл.).
Фаза C2SH (С): линии (Å) - 3,85 (сл.); 3,03 (100%); 2,49 (<10%); 2,33 (сл.); 1,88 (-10%).
Относительная интенсивность линий выделившихся фаз меньше в присутствии СП НФ, чем без этого СП.
С добавкой СП НФ фазы C2SH(А) и C2SH (В) формируются в равной степени. Во всех случаях фаза C2SH (С): формируется хуже.
По Калоусеку, фазы, выделяющиеся при гидратации -С2S и С3S, имеют состав:
C2SH (А): 1,82,4 СаО-SiO2 11,25 Н2O;
C2SH (В): 1,752,4 СаО-SiO2 1,11,5 Н2O;
C2SH (С): 1,752,25 СаО-SiO2 0,30,4 Н2O.
Как видно, взаимодействие минералов -С2S и С3S с водой при данных условиях синтеза происходит непрерывно и приводит к образованию нескольких бертоллидных фаз, твердых растворов внедрения с различными областями гомогенности по СаО и Н2O.
В кристаллической решетке -С2S атомы Са находятся в двух валентных состояниях. Поэтому при гидратации -С2S образуются 2 фазы и только в присутствии СП НФ появляется третья фаза. При гидратации С3S образуются 3 фазы как в отсутствии добавок СП, так и в их присутствии. При соприкосновении -С2S с водой молекулы воды адсорбируются как на атомах кальция, кремния, так и на атомах кислорода. Расстояние между атомами СаII и кислорода больше, чем СаI-О и еще больше, чем Si-O. Поэтому рвутся связи СаII-O и сразу же нарушается координационная насыщаемость атомов кальция.
Атомы СаII, находящиеся в пустотах структуры между тетраэдрами, начинают диффундировать в кристаллической решетке с тем, чтобы занять в ней такое положение, которое привело бы к валентной (координационной) насыщенности. Диффузия в твердом кристаллическом веществе, несмотря на дефекты, протекает медленно. Поэтому катионы кальция при наличии связанной воды в структуре не успевают сформировать колонки из СаII-O, а просто статистически распределяются в кристаллической решетке, образуя области гомогенности, состоящей из большого числа химических соединений, отличающихся друг от друга разным числом атомов в элементарной ячейке. Эти соединения как бы продолжают друг друга, простираясь от 1,8 СаО до 2,4 СаО. Разрушение колонок из СаII-O приводит к разрушению колонок и из СаI-О, их перестройке и миграции атомов СаI. Поэтому при гидратации -С2S образуются только две фазы переменного состава, два бертоллида. Громоздкие молекулы СП С-3 адсорбируются только на катионах кальция и кремния и способствуют более быстрому разрыву связи Са-О, диспергируют структуру и создают стерические затруднения при формировании новых фаз в недрах старой кристаллической решетки -С2S. Такое же действие оказывает и СП НФ, но стерические затруднения СП НФ больше, поэтому формируются 3 фазы переменного состава, хотя преобладают две: C2SH (А) и C2SH (В).
В кристаллической решетке С3S атомы кальция находятся в трех валентных состояниях: в островном кремнекислородном мотиве, в первой полусфере остатка решетки СаО и во второй полусфере остатка решетки СаО. Расстояния Са-О в этой части структуры С3S меняются. Значит, меняется и валентность (координационное число) Са. Разность длин Si-O-связей в SiO4-тетраэдрах колеблется в пределах 0,1-0,15 Å. Значительная часть ионов Са2+ в С3S имеет несимметричное окружение. При соприкосновении С3S с водой молекулы воды адсорбируются как на катионах кальция и кремния, так и атомах кислорода. Связь Са-О рвется там, где она длиннее, а значит и слабее. Нарушается координация катионов кальция, молекулы воды, внедрившиеся в кристаллическую решетку С3S, также нарушают координацию кальция. Это является причиной перестройки кристаллической решетки С3S. Катионы кальция перемещаются на такие расстояния, чтобы было реализовано валентное насыщение. Перемещаясь, катионы кальция попадают в новое окружение, в связи с чем координационное число атомов меняется. Так как катионы кальция перемещаются в кристаллической решетке, то этот процесс протекает медленно. При этом состав непрерывно меняется, что приводит к образованию областей гомогенности (однородности) по СаО и Н2О. Области гомогенности включают в себя множество химических соединений с разным числом атомов в элементарной ячейке. Так как в С3S кальций находится в трех валентных состояниях, то и формируются три фазы переменного состава. Роль СП С-3 и НФ сводится к диспергированию частиц С3S и к созданию стерических затруднений при формировании фаз переменного состава.
Структуры кристаллических решеток -С2S и С3S дефектны. В основном это точечные дефекты-вакансии, одномерные дефекты-дислокации. Вводя молекулы СП С-3 в кристаллические решетки -С2S и С3S, мы делаем их более активными, реакционноспособными. Однако в присутствии данных СП и большом водотвердом отношении формируется только ближний порядок в структуре ГС К.
УДК 691.316:541.13
