О. Й. Любич, В. О. Пчелінцев Фізичні основи металургії кольорових І рідкоземельних металів
| Вид материала | Документы |
- З дисципліни «Теоретичні основи ливарного виробництва» для студентів заочного факультету, 390.98kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни " виробництво виливків, 797.9kb.
- Нова технологія утилізації гальваношламів машинобудівних підприємств з одержанням комплексних, 26.76kb.
- І містять у собі чорні або кольорові метали чи їх сплави, а також вироби з металу,, 462.13kb.
- Наказом Державного комітету України з питань регуляторної політики та підприємництва,, 341.66kb.
- Розробка базових теплотехнічних І конструктивних рішень, а також технологічних схем, 24.73kb.
- Назва реферату: Зварювання кольорових металів Розділ, 29.07kb.
- Робоча програма загальні методичні вказівки та індивідуальні завдання до вивчення дисципліни, 156.9kb.
- Типова програма кандидатського іспиту із спеціальності, 95.6kb.
- Державна митна служба україни, 19.16kb.
ТЕСТОВІ питання
1. У якому вигляді знаходяться мідь в рудах?
2. З чого складається порожня порода?
3. Якими способами витягують мідь з руди?
4. Яким методом збагачують мідні руди?
5. Яким чином проводять випалення мідного концентратора?
6. Що забезпечує випалення мідних концентраторів?
7. З чого складається мідний штейн?
8. Які процеси проходять у нижній частині печі при виплавленні мідного штейну?
9. Які процеси проходять при проходженні газів через стовп шихти при виплавленні мідного штейну?
10. Які сполуки плавляться при температурі 1000°С?
11. Які основні хімічні реакції проходять у пористій масі мідного штейну?
12. Що входить до складу штейну?
13. Що необхідно зробити, щоб підвищити кількість міді в штейні?
14. З чого складається відбивний штейн міді?
15. Яким чином одержують чорнову мідь?
16. На які періоди поділяють процес виплавки чорнової міді і чому?
17. Які реакції проходять у конверторі при першому періоді отримання чорнової міді?
18. Які реакції проходять у другому періоді отримання чорнової міді?
19. Які процеси проходять при основному рафінуванні міді?
20. У чому сутність електролітичного рафінування міді?
21. Які використовують нові методи добування міді?
22. Які руди застосовують для отримання нікелю?
23. Яким чином готують руду перед плавленням нікелю?
24. Як проводити переробку сульфідних мідно-нікелевих руд?
25. У чому сутність переробки окиснювальних нікелевих руд?
26. За якою схемою проводять виплавку нікелю з окислених руд?
27. У чому сутність виплавки нікелевого штейну?
28. Які реакції проходять при виплавці штейну?
29. Навіщо необхідне дуття при плавленні нікелевого штейну?
30. Яким чином із штейну отримують нікель?
31. У чому необхідність другого періоду продування при переділі штейну?
32. Що таке файнштейн і як його отримують.
33. Які шлаки утворюються при плавленні в конверторах?
34. Які є можливості для отримання чорнового нікелю в конверторі?
35. Яким чином видаляють сірку з нікелевого файнштейну?
36. Навіщо необхідне випалення білого нікелевого штейну в киплячому шарі?
37. Яким чином проводять відновні плавлення нікелю?
38. Які реакції проходять при відновленні нікелю?
39. Яку роль виконує вуглець при плавленні нікелю?
40. Навіщо необхідно застосовувати електролітичне рафінування чорнового нікелю?
41. Які найважливіші мінерали містить свинець?
42. Яким чином отримують свинець?
43. Які етапи отримання свинцю?
44. Які властивості має оксид свинцю?
45. З якими кислотами реагує свинець при кімнатній температурі?
46. Як застосовується свинець?
47. Які методи використовують для добування цинку із руд?
48. Які елементи містять цинкові концентрати?
49. За якою реакцією відновлюється цинк у реторті?
50. З яких інгредієнтів складається шихта для отримання цинку еклектротермічним способом?
51. За якою реакцією цинк відновлюється у шахтній печі?
52. Скільки міститься свинцю і цинку у шлаках шахтної плавки?
53. Яким чином проводять рафінування чорнового цинку?
54. Що залишається у нерозчиненому залишку після вилуговування, розбавленого кислотою?
55. За якою схемою проходить реакція електролізу?
56. Яка основна реакція випалення сульфіду цинку?
57. За якою реакцією окисел цинку взаємодіє з Fe2O3?
58. Якими печами користуються при виплавленні цинкових концентратів?
59. Яка температура киплячого шару при виплавленні цинкового концентрату?
60. У скільки стадій проводять вилуговування цинку з обпалених концентратів?
61. Для чого необхідно очищення нейтрального розчину сульфату цинку?
62. Чим визначається рівноважний потенціал напруги при електролітичному осадженні цинку?
63. Де відкладається окисел свинцю при електролітичному осадженні цинку?
64. Яким чином проводять збагачення руд, що містять молібден?
65. Охарактеризуйте аміачний спосіб переробки концентратів молібдену?
66. Яким чином проходить вилуговування триокису молібдену розчинами аміаку?
67. Яка реакція утворення молібдену амонію?
68. Яким чином відбувається очищення аміачних розчинів?
69. Яким чином утворюється парамолібдат амонію?
70. Як отримати триокис молібдену?
71. Яким чином відбувається осадження тетрамолібдату?
72. Як отримати молібдат натрію?
73. За якою схемою відбувається взаємодія молібденатів міді, кальцію і заліза з содою?
74. Яка реакція осадження молібдату кальцію?
75. За якою технологією одержують триокис молібдену?
76. Якими реагентами можна перевести металевий ніобій у хімічну сполуку?
77. Які фізичні властивості ніобію?
78. Яка реакція взаємодії ніобію і хлору.
79. Які якості ніобію допомагають чинити опір дії окиснювачів?
80. Яким чином використовують ніобій для випрямляння струму?
81. Які способи переробки руд, що містять ніобій?
82. Які стадії отримання ніобію?
83. Які основні методи отримання ніобію?
84. З якою метою вводять ніобій до складу сталей?
4 БЛАГОРОДНІ МЕТАЛИ
4.1 Xіміко-фізичні властивості золота
4.1.1 Поширення золота у природі
Середній вміст золота в літосфері становить 4,3-10-7% за масою. Належить до розсіяних елементів. Відомо більше 20 мінералів, з яких головний – самородне золото (електрум, мідисте, паладієве, вісмутове золото). Самородки великого розміру зустрічаються надто рідко і, як правило, мають іменні назви. Хімічні сполуки золота у природі рідкісні, в основному це телуриди – калаверит АuТе2, кренерит (Аu, Аg) Те2 та ін. Золото може бути наявним у вигляді домішки у різних сульфідних мінералах: піриті, халькопіриті, сфалериті та ін. Сучасні методи хімічного аналізу дозволяють знайти наявність нехтовно малих кількостей Аu в організмах рослин і тварин, у винах і коньяках, у мінеральних водах і в морській воді.
У магмі і магматичних породах золото розсіяне, але з гарячих вод у земній корі утворюються гідротермальні родовища золота, що мають важливе промислове значення (кварцові золотоносні жили та ін.). У рудах золото в основному знаходиться у вільному (самородному) стані і лише дуже рідко утворює мінерали з селеном, телуром, сурмою, вісмутом. Пірит та інші сульфіди часто містять домішку золота, яку добувають при переробці мідних, поліметалічних та інших руд.
У біосфері золото мігрує в комплексі з органічними сполуками і механічним шляхом у річкових суспензіях. Один літр морської і річкової води містить близько 4-10 г золота. На ділянках золоторудних родовищ підземні води містять золото приблизно 6-10 г/л. Воно мігрує в ґрунтах і звідти потрапляє до рослин; деякі з них концентрують золото, наприклад, хвощі, кукурудза. Руйнування ендогенних родовищ золота приводить до утворення розсипів золота, що мають промислове значення. Золото добувається в 41 країні.
4.1.2 Фізичні та хімічні властивості золота
Золото – жовтий метал із кубічними гранецентрованими гратками (а = 0,40786 нм). Температура плавлення 1064,4°С, температура кипіння 2880°С. Має виняткову пластичність, теплопровідність і електропровідність. Кульку золота діаметром в 1 мм можна розкатати у найтонший лист, що просвічує голубувато-зеленим кольором площею 50 м2. Товщина найтонших листочків золота 0,1 мкм. Із золота можна зробити найтонші нитки.
Золото стійке на повітрі і у воді. Із киснем, азотом, воднем, фосфором, сурмою і вуглецем безпосередньо не взаємодіє. Антимонід АuSb2 і фосфід золота Аu2P2 одержують непрямими шляхами.
Золото – м'який, дуже пластичний, тягучий метал (може проковувати в листки завтовшки до 8·10-5 мм, протягнуто у дріт, 2 км якого важить 1 г), добре проводить тепло і електрику, дуже стійке проти хімічної дії. Атомний радіус 1,44 Е, іонний радіус Аul + 1,37 Е. Щільність (при 20°С) 19,32 г/см3, tпл 1064,43°С, tкип 2947°С; термічний коефіцієнт лінійного розширення 14,2-10-6 (0-100°С); питома теплопровідність 311,48 вт/(м·К) [0,744 кал/(см·с·°С)]; питома теплоємність 132,3 Дж/(кг·К) [0,0316 кал/(г·°С)] (при 0°-100°С); питомий електроопір 2,25-10-8Ом·м (2,25·10-6 Ом·см) (при 20°С); температурний коефіцієнт електроопору 0,00396 (0-100°С). Модуль пружності 79·103 Мн/м2 (79·102 кгс/мм2), для відпаленого золота межа міцності при розтягуванні 100-140 Мн/м2 (10-14 кгс/мм2), відносне подовження 30-50%, звуження площі поперечного перетину 90%. Після пластичної деформації на холоді межа міцності підвищується до 270-340 Мн/м2 (27-34 кгс/мм2). Твердість за Бринелем 180 Мн/м2 (18 кгс/мм2) (для золота відпаленого близько 4000С).
У ряді стандартних потенціалів золото розміщене правіше за водень, тому із неокисними кислотами в реакцію не вступає. Розчиняється у гарячій селеновій кислоті:
2Аu + 6Н2SеО4 = Аu2(SеО4)3 + ЗН2SеО3 + ЗН2О, (4.1)
у концентрованій соляній кислоті при пропусканні через розчин хлору:
2Аu + ЗСl2 + 2НС1 = 2Н[АuС14]. (4.2)
При акуратному упарюванні отримуваного розчину можна отримати жовті кристали золотохлористоводневої кислоти НАuС14 ∙ ЗН2О.
Із галогенами без нагрівання за відсутності вологи золото не реагує. При нагріванні порошку золота з галогенами або з дифторидом ксенону утворюються галогеніди золота:
2Au + 3Cl2 = 2AuCl3, (4.3)
2Аu + ЗХеF2 = 2АuF3 + ЗХе. (4.4)
У воді розчинні тільки АuС13 і АuВr3, що складаються з димерних молекул.
Моногалогеніди золота АuС1, АuВr і АuI утворюються при нагріванні у вакуумі відповідних вищих галогенідів. При нагріванні вони або розкладаються:
2АuС1 = 2Аu + Cl2, (4.5)
або диспропорціонують:
3АuВr = АuВr3 + 2Аu. (4.6)
Сполуки золота нестійкі і у водних розчинах гідролізуються, легко відновлюючись до металу.
Сполуки оксиду золота (Ш) з аміаком Аu2ОЗ·4NН3- «гримуче золото» вибухає при нагріванні.
При відновленні золота з розбавлених розчинів його солей, а також при електричному розпилюванні золота у воді утворюється стійкий колоїдний розчин золота
2АuС13 + 3SnСl2 = 3SnС14 +2Аu. (4.7)
Забарвлення колоїдних розчинів золота залежить від ступеня дисперсності частинок золота, а інтенсивність від їх концентрацій. Частинки золота у розчині завжди негативно заряджені.
Конфігурація зовнішніх електронів атома золота 5d10бsl. У сполуках золото має валентності 1 і 3 (відомі комплексні сполуки, в яких золото 2-валентне). З неметалами (крім галогенів) золото не взаємодіє. З галогенами золото утворює галогеніди, наприклад 2Аu+ЗСl2 = 2АuСlЗ.
У суміші соляної і азотної кислот золото розчиняється, утворюючи золотохлористоводневу кислоту Н[АuСl4]. У розчинах ціаніду натрію NаСN (або калію КСN) при одночасному доступі кисню золото перетворюється в ціанозурат натрію 2Nа[Аu(СN)2]. Ця реакція, відкрита у 1843 році П.Р.Багратіоном, одержала практичне застосування тільки в кінці 19-го століття (ціанування). Для золота характерне легке відновлення його із сполук до металу і здатність до комплексоутворенню. Існування оксиду золота Аu2O сумнівне. Хлорид золота AuCl отримуємо при нагріванні хлориду золота
АuС13 = АuС1 + С12. (4.8)
Хлорид золота AuCl3 одержують дією хлору на порошок або тонкі листи золота при 2000С. Червоні голки AuCl3 створюють з водою коричнево-червоний розчин комплексної кислоти
AuCl3 + H2O = H2[AuOCl3]. (4.9)
При осадженні розчину АuСl3 їдким лугом випадає амфотерний жовто-коричневий гідрооксид золота Аu(ОН)3, тому його називають золотою кислотою, а його солі - ауратами. При нагріванні гідрооксид золота перетворюється на оксид золота Аu2О3, який вище 220° розкладається за реакцією
2Аu2О3= 4Аu + СО2. (4.10)
При відновленні солей золота хлоридом олова утворюється дуже стійкий пурпуровий колоїдний розчин золота (касиїв пурпур)
АuСl3 + 3SnС12 = 3SnС14 + 2Аu, (4.11) це використовується в аналізі при виявленні золота. Кількісне визначення золота базується на його осадженні Із водних розчинів відновниками (FеSO4, Н2SO3, H2С2О4 та ін.) або на застосуванні пробіркового аналізу.
Радіоактивне золото (частіше 198Аu) вводять у тканину у вигляді штифтів, гранул і тому подібне – для гамма-терапії і у вигляді колоїдних розчинів – для бета-терапії. Його застосовують при лікуванні пухлин, звичайно у поєднанні з хірургічним і медикаментозним лікуванням, а також з діагностичною метою - у вигляді колоїдних розчинів при дослідженні ретикуло-ендотеліальної системи, печінки, селезінки та інших органів.
4.1.3 Отримання золота і його афінаж
З розсипних родовищ золото можна добувати відмочуванням, що ґрунтується на великій різниці щільності золота і пустої породи. Цей спосіб, що застосовувався вже в глибокій старовині, пов'язаний з великими втратами. Він поступився місцем амальгамуванню (відомою вже у 1-му столітті до н.е. і застосовуваного в Америці починаючи з 16-го століття) і ціануванню, що набуло значного поширення в Америці, Африці і Австралії в 1890-х роках. У кінці 19 – початку 20-го століття основним джерелом золота стали корінні родовища. Золотоносну породу спочатку піддають дробленню і збагаченню. З отриманого концентрату добувають золото розчином ціаніду калію або натрію. З розчину комплексного ціаніду осаджують золото цинком; при цьому випадають і домішки. Для очищення (афінажу) золота електролізом (спосіб Е.Вольвіла, 1896 рік) аноди, відлиті з нечистого золота, підвішують у ванні, що містить солянокислий розчин АuС13 катодом служить листом чистого золота. При проходженні струму домішки випадають в осад (анодний мул, шлам), а на катоді відкладається золото чистотою не менше 99,99%.
Джерела золота при його промисловому отриманні – руди і піски золотих розсипних і корінних родовищ, вміст золота в яких становить 5-15 г на тонну вихідного матеріалу, а також проміжні продукти (0,5-3 г/т) свинцево-цинкового, мідного, уранового і деяких інших виробництв.
Процес отримання золота з розсипів ґрунтується на різниці щільності золота і піску. За допомогою могутніх струменів води подрібнену золотоносну породу переводять у зважений у воді стан. Одержана пульпа стікає у дразі по похилій площині. При цьому важкі частинки золота осідають, а піщинки несуться водою.
Іншим способом золото добувають з руди, обробляючи її рідкою ртуттю і одержуючи рідкий сплав – амальгаму. Далі амальгаму нагрівають, ртуть випаровується, а золото залишається. Застосовують і ціанідний спосіб добування золота з руд. У цьому випадку золотоносну руду обробляють розчином ціаніду натрію NаСN. За наявності кисню повітря золото переходить в розчин:
4Аu + О2 + 8NаСN + 2Н2O = 4Nа[Аu(СN2)2]+ 4NaOH. (4.12)
Далі отриманий розчин комплексу золота обробляють цинковим пилом:
2Na [Аu(CN)2] + Zn = Na2[Zn(CN)4]+ 2Au (4.13)
Очищають золото розчиненням у царській горілці:
Аu + НNO3 + 4HС1 = Н[АuС14]+ NO + H2O (4.14)
з подальшим виборчим осадженням золота з розчину, наприклад, за допомогою FeSO4.
4.1.4 Сорбційне вилуговування золота
Ціанування перемішуванням золотовмісних руд є найефективнішим процесом отримання золота. Вилуговування пульп перемішуванням проходить швидше і дає краще добування золота і срібла внаслідок того, що при подрібненні руди забезпечується добре виявлення золота. Тому при швидкості вилуговування і повноті добування золота ціанування переміщенням значно краще за перколяційний процес і купчасте вилуговування.
За наявності в руді великого золота його перед ціануванням добувають у циклі подрібнення методами гравітаційного збагачення, тому в процес ціанування перемішуванням з рудою надходить тільки дрібне золото, розчинення якого відбувається досить швидко.
Рудні пульпи, що надходять на ціанування перемішуванням, мають підвищену в'язкість, що утруднює дифузію ціаністих іонів і молекул розчиненого кисню до поверхні частинок золота. Крім того, сульфідні мінерали, часто наявні в руді, досить легко окиснюються розчиненим киснем, внаслідок чого його концентрація в рідкій фазі може стати значно нижчою необхідної для розчинення золота. Тому при ціануванні пульп особливе значення має енергійне перемішування і безперервне насичення її киснем повітря.
Процес ціанування руд перемішуванням проводять при концентрації NаСN, що становить 0,05-0,1%, і концентрації СаО, яка дорівнює 0,01-0,03% (рН = 9-11).
Для забезпечення найкращих умов добування золота із сульфідних руд і руд з високим вмістом оксидів заліза або глини потрібне більше розрідження пульпи.
Процес ціаністого вилуговування золота здійснюють в періодичному або безперервному режимі.
При ціануванні в періодичному режимі пульпи періодично окремими порціями закачують в паралельно працюючі апарати для вилуговування. Після інтенсивного перемішування з ціаністим розчином і захисним лугом протягом певного проміжку часу, необхідного для розчинення золота, пульпу випускають і перекачують в чани-збірники, а в апарати вилуговування закачують нову порцію пульпи. У чанах-збірниках вилуджена пульпа накопичується і підтримується у зваженому стані до надходження у наступну стадію обробки, наприклад, на відділення золотовмісних розчинів від твердої фази методом фільтрації.
Періодичний режим ціанування руди використовується на фабриках невеликої продуктивності із застосуванням фільтрації пульпи і подальшим осадженням золота з ціаністих розчинів цинковим пилом або стружкою. Як правило, в періодичному режимі ціанують невеликі кількості гравітаційних концентратів та інших золотовмісних продуктів.
При безперервному вилуговуванні пульпа надходить у каскад з послідовно з’єднаних апаратів ціанування. Число апаратів в каскаді звичайно вибирають не більш 4-6 з сумарним робочим об’ємом, що забезпечує при проходженні пульпи через них необхідний час для розчинення золота.
Технологічні параметри процесу сорбційного вилуговування.
Сорбцію золота і срібла з пульпи із застосуванням сорбентів на даний час здійснюють двома способами.
1 Після операції попереднього ціанування.
2 Поєднанням процесів ціанування і сорбції.
І в тому, і іншому випадку за наявності сорбенту відбуваються два поєднані в часі процеси – розчинення благородних металів і сорбція їх на іоніт або активне вугілля, тобто процес сорбційного вилуговування (рис. 4.1). Тільки після попереднього ціанування у процесі сорбції за наявності сорбенту відбувається процес дорозчинення золота. Перед виведенням насиченого сорбенту з процесу він повинен контактувати з ціанистою пульпою, у розчині якої є досить висока концентрація золота.
Це досягається тим, що руду або концентрат перед сорбційним вилуговуванням піддають операції попереднього ціанування. У цьому випадку частина або більше половини золота з твердої фази переходить у розчин з максимальною концентрацією його в рідкій фазі. Проціанована таким чином пульпа надходить у процес сорбційного вилуговування, де відбуваються дорозчинення золота і його сорбція на активне вугілля.
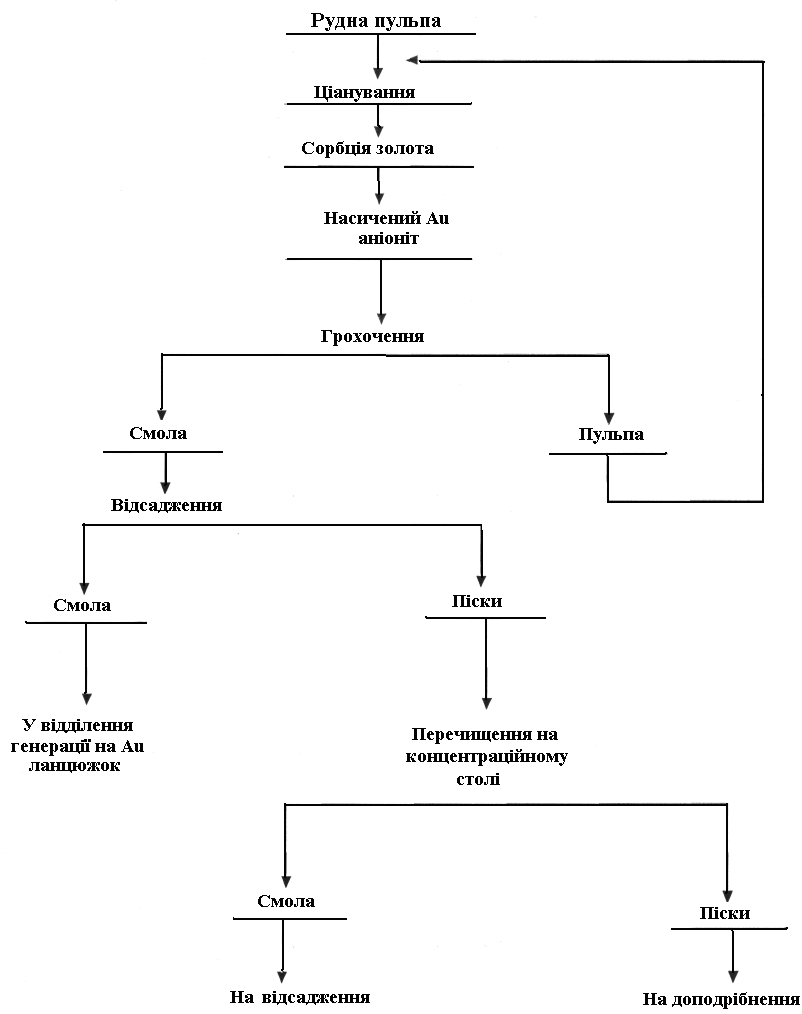
Рисунок 4.1 – Технологічна схема процесу сорбційного
вилуговування золота
Процес розчинення золота відбувається у дифузійній ділянці, тобто швидкість процесу розчинення залежить від швидкості дифузії розчинників і продуктів реакції. Якщо швидкість дифузії розчинників – учасників реакції обміну – більша, ніж швидкість дифузії продуктів реакції, то введений у систему сорбент сприяє прискореному відведенню з реакційної зони ціаністих аніонів золота.
До основних технологічних параметрів процесу сорбційного ціанування відносять такі:
1 Тривалість процесу.
2 Одноразове завантаження сорбенту в процес.
3 Час перебування сорбенту в процесі сорбції.
4 Кількість ступенів сорбції.
5 Величини потоків пульпи і сорбенту.
4.2 Фізичні і хімічні властивості срібла
4.2.1 Хімічні властивості срібла
Срібло – метал білого кольору. Він має гранецентровані кубічні гратки, відрізняється винятковою ковкістю і тягучістю. Із срібла можна зробити дріт діаметром в 0,001 мм. Тепло- і електропровідність металу дуже високі: срібло у цьому відношенні перевершує всі інші метали.
Летючість срібла при високих температурах досить суттєва і вище в окиснювальній атмосфері, ніж у відновній.
Будучи (d-елементом І групи періодичної системи, срібло також, як їх електронний аналог - мідь, має в s-стані зовнішнього шару по одному, а в передостанньому шарі по 18 електронів (s2p6d10). За певних умов цей передостанній 18-електронний шар здатний до часткової втрати електронів, тому мідь, срібло і золото можуть мати у своїх сполуках ступінь окиснення не тільки +1, відповідний втраті з-електрона зовнішнього шару, але також +2 і +3. При цьому для срібла найбільш характерні ступені окиснення +1.
Відмітною особливістю цього елемента є здатність до комплексоутворення і легкості відновлення більшості його сполук до металу. За своєю хімічною активністю срібло займає проміжне положення між золотом і міддю.
З киснем, воднем, азотом і вуглецем срібло безпосередньо не взаємодіє. Фосфор діє на срібло лише при температурі червоного розжарення з утворенням фосфідів. При нагріванні з сіркою срібло легко утворює сульфід Аg2S. Ця сама сполука одержується при дії на срібло газоподібної сірки, що виділяється при термічній дисоціації деяких сульфідів (піриту, піротину, халькопіриту), і при нагріві металу у контакті з цими сульфідами. При дії сірководню поверхня срібла покривається чорною плівкою Аg2S. Срібло взаємодіє також з вільними хлором, бромом і йодом з утворенням відповідних галогенідів. Ці процеси проходять поволі навіть при звичайних температурах і швидшають за наявності вологи при нагріванні і під дією світла. Подібно до золота, срібло легко взаємодіє з царською горілкою і насиченою хлором соляною кислотою, але при цьому воно залишається у нерозчинному залишку унаслідок утворення малорозчинного хлориду АgС1. Такі відмінності в поведінці золота і срібла часто використовують для розділення цих металів. Тонкодисперсне срібло у контакті з киснем повітря розчиняється у розбавленій сірчаній кислоті. Подібно до золота срібло розчиняється також у насичених повітрям водних розчинах ціанідів лужних і лужноземельних металів, у водному розчині тіосечовини за наявності солей заліза.
Оксид срібла Аg2О чорно-коричневого кольору може бути одержаний введенням лугу в розчин, що містить іони Аg+. Спочатку, очевидно, утворюється гідроксид, що негайно переходить в оксид:
Аg+ + ОН- = АgОН; (4.15)
2А2ОН = А2О + Н2О. (4.16)
Хоча оксид срібла – малорозчинна у воді сполука, його водна суспензія має чітко виражену основну реакцію, тому солі срібла у водних розчинах не гідролізуються і дають нейтральну реакцію.
У водному розчині аміаку Аg2О розчиняється з утворенням комплексної сполуки:
4NН4ОН + 2Аg(NН3)2ОН + ЗН2О. (4.17)
При стоянні з розчину осідає надзвичайно вибуховий навіть у вологому стані осад нітриду срібла Аg3N (гримуче срібло).
Галогеніди срібла – малорозчинні сполуки. Виняток становить лише легкорозчинний фторид АgF. Хлорид АgС1, бромід АgВr і іодид Аg1 випадають в осад при введенні в розчин, що містить іони Аg+.
Електронегативними металами (цинком, залізом) хлорид срібла, узятий у вигляді суспензії в розбавленій сірчаній кислоті, легко відновлюється до металу. Цей простий прийом отримання металевого срібла з його хлориду широко застосовують в афінажному виробництві. Бромід срібла АgВr схожий за своїми властивостями на АgС1. Він розчинний в аміачних, тіосульфатних, сульфітних і ціаністих розчинах, легко відновлюється до металу.
Йодид Аg1 - найменш розчинний з галогенідів срібла, тому на відміну від АgС1 і АgВr він не розчинний в аміачних розчинах, але розчинний за наявності іонів СN- і
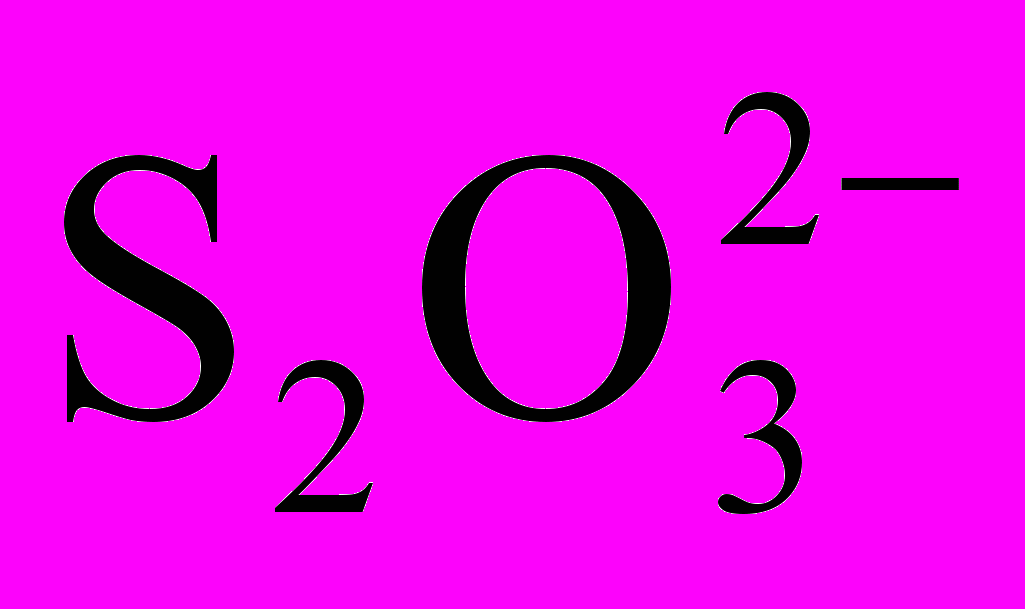 , з якими срібло утворює міцніші, ніж з аміаком, комплекси. Помітну розчинність аgl має також у концентрованих розчинах йодидів лужних металів, що пояснюється утворенням комплексних іонів Аgl2-.
, з якими срібло утворює міцніші, ніж з аміаком, комплекси. Помітну розчинність аgl має також у концентрованих розчинах йодидів лужних металів, що пояснюється утворенням комплексних іонів Аgl2-.Дуже характерною і важливою особливістю важкорозчинних галогенідів срібла є їх світлочутливість, що полягає у тому, що під дією світла вони розкладаються на металеве срібло і вільний галоїд: 2АgI = 2Аg+I2.
Ця властивість галоїдних солей срібла лежить в основі їх застосування для виробництва фотоматеріалів – світлочутливих плівок, пластинок і паперу. Світлочутливість галідів срібла зростає у ряді АgI<АgС1<АgВr, тому найчастіше для виробництва фотоматеріалів використовують бромід срібла.
До галогенідів срібла дуже близький за своїми властивостями ціанід АgСN. Він випадає у вигляді білого осаду при додаванні до розчину, що містить іони Аg+, розчину ціаніду лужного металу (без надлишку). Подібно до галогенідів срібла практично нерозчинний у воді і розбавлених кислотах, але розчинний в аміачних, тіосульфатних і ціаністих розчинах, внаслідок утворення відповідних комплексних сполук. На відміну від галогенідів ціанід срібла під дією світла не розкладається.
З інших сполук срібла велике практичне значення мають нітрат і сульфат срібла.
Нітрат срібла АgNO3 одержують дією азотної кислоти на металеве срібло:
3Аg + 4НNO3 = 3АgNO3 + NO + 2Н2О. (4.18)
Нітрат срібла є безбарвними негігроскопічними кристалами, плавкими при 208,5°С; при температурі вище 3500С термічно розкладається. АgNO3 дуже легко розчиняється у воді. При 20°С його розчинність становить 222 г на 100 г води, при 100°С вона зростає до 952 г на 100 г.
За наявності органічних речовин нітрат срібла чорніє внаслідок часткового відновлення до металу.
Нітрат срібла – технічно найважливіша сполука цього металу. Ця сіль служить вихідним продуктом для приготування решти сполук срібла. Водний розчин АgNО3 використовують як електроліт при електролітичному рафінуванні срібла.
Сульфат срібла Аg2SО+ може бути одержаний розчиненням металевого срібла у гарячій концентрованій сірчаній кислоті:
2Аg + 2Н2SО4 = АgSО4 + SО2 + 2Н2О. (4.19)
Сульфат срібла утворює безбарвні кристали, плавкі при 660°С. При температурі вище 1000°С термічно розкладається. Розчинність Аg2SО4 у воді невелика, при 25°С вона становить 0,80 г на 100 г води. У концентрованій сірчаній кислоті розчинність значно вища внаслідок утворення більш розчинного бісульфату АgНSО4.
