О. Й. Любич, В. О. Пчелінцев Фізичні основи металургії кольорових І рідкоземельних металів
| Вид материала | Документы |
- З дисципліни «Теоретичні основи ливарного виробництва» для студентів заочного факультету, 390.98kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни " виробництво виливків, 797.9kb.
- Нова технологія утилізації гальваношламів машинобудівних підприємств з одержанням комплексних, 26.76kb.
- І містять у собі чорні або кольорові метали чи їх сплави, а також вироби з металу,, 462.13kb.
- Наказом Державного комітету України з питань регуляторної політики та підприємництва,, 341.66kb.
- Розробка базових теплотехнічних І конструктивних рішень, а також технологічних схем, 24.73kb.
- Назва реферату: Зварювання кольорових металів Розділ, 29.07kb.
- Робоча програма загальні методичні вказівки та індивідуальні завдання до вивчення дисципліни, 156.9kb.
- Типова програма кандидатського іспиту із спеціальності, 95.6kb.
- Державна митна служба україни, 19.16kb.
Рисунок 1.2 - Найпростіші кристалічні структури металів:
а – мідь (аналогічні Au, Ag, Al, Pt та інші); б – залізо (аналогічні К, Ва та інші); в – магній
На атоми і іони у вузлах кристалічної гратки діють сили взаємного тяжіння і відштовхування. Амплітуди коливання іонів і атомів залежать від температури і зростають з нею. При температурі плавлення амплітуди коливань такі великі, що ґратки руйнуються: атоми й іони втрачають свої постійні місця і переходять в безладний рух, властивий рідкому стану. Зв'язок між іонами і електронами називають металевим, а між атомами – ковалентним. Від співвідношення цих видів хімічного зв'язку залежить кількість блукаючих електронів. Чим більша ця кількість, тим яскравіше виражені металеві властивості елементів.
Міцністю металевого зв'язку пояснюються багато фізичних і механічних властивостей металів, показники яких наведені у табл. 1.1.
Зовнішні механічні дії на метал викликають зрушення шарів кристалічної ґратки, проте зв'язок між іонами і електронами при цьому не порушується через вільну рухливість електронів. З цієї причини метали міцні і пластичні, вони змінюють форму, не втрачають міцності. У міді і золоті багато вільних електронів, металевий зв'язок значно переважає над ковалентним – ці метали пластичні, ковкі, в'язкі. У сурми і вісмуту вільних електронів порівняно мало, тому вони крихкі.
Свобода переміщення електронів у просторі між вузлами кристалічної гратки пояснює високу електропровідність металів, при накладенні потенціалу рух електронів легко переходить з безладного у направлений. З підвищенням температури амплітуди коливання іонів і атомів наростають, рухливості електронів від цього важко, і електропровідність металів знижується. При температурах, близьких до абсолютного нуля, коливання у вузлах ґраток майже згасають, і електропровідність різко збільшується. Електроопір деяких металів при температурах, близьких до 00 К, зникаюче мало (надпровідність). Домішки, навіть у малих кількостях, порушують будову кристалічної гратки, утрудняють переміщення електронів і цим знижують електропровідність.
Теплопровідність металів – результат руху електронів, а також коливань іонів і атомів. Із цього зрозуміло, чому електропровідність і теплопровідність металів – властивості, що паралельно змінюються. У більшості випадків найбільш електропровідні метали характеризуються і високою теплопровідністю.
Таблиця 1.1 - Фізичні та механічні властивості найважливіших металів
| Метали | Атомна маса | Густина при 200С, кг/м3 | Температура, 0С | Коефіцієнт теплопровідності (при 200С) | Питомий опір при 200С, Ом ∙ м | Механічні властивості | |||||
| плавлення | кипін-ня | вт (м ∙ град) | кал (см ∙ град) | межа міцності при розтяганні | міцність за Бринелем | ||||||
| н/м2 | кг/мм2 | н/м2 | кг/мм2 | ||||||||
| Важкі | | ||||||||||
| Мідь | 63,54 | 8,960 | 1083 | 2600 | 393,56 | 0,94 | 0,018 | 215,8 | 22 | 343,4 | 35 |
| Нікель | 58,69 | 8,900 | 1455 | 2730 | 92,11 | 0,22 | 0,068 | 441,5 | 45 | 686,7 | 70 |
| Свинець | 207,21 | 11,340 | 327,4 | 1840 | 35,17 | 0,084 | 0,206 | 14,7 | 1,5 | 49,1 | 5 |
| Цинк | 65,38 | 7,140 | 419,5 | 907 | 112,23 | 0,268 | 0,059 | 127,5 | 13 | 372,8 | 38 |
| Легкі | | ||||||||||
| Алюміній | 26,98 | 2,680 | 660,2 | 2060 | 221,9 | 0,53 | 0,026 | 98,1 | 10 | 264,9 | 27 |
| Магній | 24,32 | 1,740 | 650 | 1107 | 159,1 | 0,38 | 0.047 | 176,6 | 18 | 245,3 | 25 |
| Титан | 47,90 | 4,540 | 1800 | 3400 | 15,9 | 0,036 | 0,47 | 313,9 | 32 | 833,9 | 85 |
| Тугоплавкі | | ||||||||||
| Вольфрам | 183,92 | 19,350 | 3377 | 6000 | 167,47 | 0,4 | 5,03 | 343,4 | 35 | 2943 | 300 |
| Молібден | 95,95 | 10,200 | 2625 | 4800 | 146,54 | 0,35 | 0,0517 | 686,7 | 70 | 1226,3 | 125 |
При нагріванні металів може початися викидання електронів. Цей термоелектричний ефект залежить від температури і особливостей будови ґраток. У деяких металів він особливо великий і тому використовується в електроніці.
Рідкі метали відрізняються від твердих порівняно малим зв'язком між атомами і іонами. Але свобода руху електронів і тут збережена, тому рідкі метали також електропровідні і теплопровідні.
Іноді один і той самий метал при різних температурах має різні кристалічні ґратки. Перехід з однієї кристалічної системи в іншу (поліморфне перетворення) змінює відстань між вузлами ґраток і їх розташування, він істотно відбивається і на властивостях поліморфних модифікацій. Наприклад олово, відоме при звичайних температурах як пластичний блискучий метал з щільністю 7,29 г/см3 (β - модифікація), при температурах нижче 13,2° З, а особливо швидко – при переохолодженні перетворюється на сірий порошок з щільністю 5,85 г/см3 (α - модифікація).
Багато металів взаємно розчинні в рідкому і твердому станах, деякі з них утворюють між собою хімічні сполуки (інтерметалеві з'єднання). Все це приводить до утворення інших кристалічних систем і широкої зміни властивостей. Мова йде про утворення сплавів, які відкривають широкий простір отримання нових цінних матеріалів з потрібними властивостями. У сучасній техніці застосовуються тисячі подвійних, потрійних і складніших металевих сплавів.
У періодичній системі елементів Д.І.Менделєєва метали розміщені у всіх групах, окрім нульової і сьомої. У кожній із головних підгруп металеві властивості елементів посилюються зверху вниз, а в кожному із семи горизонтальних рядів вони слабшають зліва направо. Всі ці зміни властивостей закономірно пов’язані з електронною будовою атомів.
Хімічну активність металів можна характеризувати положенням в електрохімічному ряді напруги, де метали розміщені в порядку наростання нормальних електрохімічних або електродних потенціалів. Нагадаємо, що величина нормального електрохімічного потенціалу, що виникає між металом і однополярным розчином його іонів, характеризує здатність металу віддавати електрон (окиснюватися), тобто бути відновником. Чим більша величина нормального електродного потенціалу, тим менша відновна здатність і хімічна активність металу. У ряді напруги кожен метал здатний витісняти правіші за нього метали з водних розчинів і сольових розплавів.
Метали з негативними електрохімічними потенціалами легко схильні до окиснення, тому вони трапляються в природі тільки у вигляді хімічних сполук: оксидів, галогенідів, а також сульфідів, силікатів та інших солей. У міру підвищення потенціалу, а отже, і зниження хімічної активності вільний стан металів стає все більш стійким. Наприклад, мідь, срібло і ртуть знаходяться в природі не тільки у вигляді солей, але і у вільному стані, а золото і платина – переважно у вільному стані. Зв'язок між електродними потенціалами і деякими властивостями металів показаний в табл. 1.2.
Періодична система елементів Д.І.Менделєєва дає чітку класифікацію металів за їх хімічними властивостями, але вона, природно, не відображає важливих для металургії особливостей виробництва і застосування металів. З цієї причини склалася промислова або технічна класифікація металів, що не має наукової основи, але традиційно прийнята в технічній літературі і практиці.
Залізо далеко випереджає всі інші метали за масштабами виробництва і застосування. Тому розрізняють «залізні метали» (залізо і його багатообразні сплави – чавуни і сталі) та інші «незалізні метали». У російській мові цьому відповідають прийняті назви «чорні» і «кольорові» метали.
Кольорові метали, у свою чергу, поділяються за деякими умовними ознаками на ряд груп і підгруп (табл. 1.3).
Таблиця 1.2 - Ряд напружень і деякі властивості металів
| Властивості металів | Са/Са2+ | Nа/Nа+ | Mg/Mg2+ | Al/Al3+ | Ti/Ti2+ | Zn/Zn2+ | Fe/Fe2+ | Cd/Cd2+ | Co/Co2+ | Ni/Ni2+ | Sn/Sn2+ | Pb/Pb2+ | H/2H+ | Cu/Cu2+ | Ag/Ag+ | Pt/Pt2+ | Au/Au3+ |
| 2,87 | 2,71 | 2,37 | 1,66 | 1,63 | 0,76 | 0,44 | 0,40 | 0,28 | 0.24 | 0,14 | 0,13 | 0,0 | 0,34 | 0,88 | 1,20 | 1,50 | |
| Окиснюються киснем повітря при звичайній температурі | Швидко | Повільно, з різною швидкістю | | | Не окиснюються | ||||||||||||
| Відновлюються із окислів вуглецю | При температурах вище 10000С | При температурах нижче 10000С | | | | ||||||||||||
| Витісняють водень із кислот (сірчаної, соляної) | Бурхливо | З різною швидкістю | | Не витісняють | |||||||||||||
| Знаходяться в природі у вигляді | Галогенідів та сполук окислів | Сполуки окислів | Сульфідів і сполук окислів | | | Переважно в елементарному стані | |||||||||||
| Способи отримання | Електроліз розплавів і металотермія (силікокарботермія) | Відновлення вуглецем. Електроліз водних розчинів | | | Одночасно з цинком, свинцем, нікелем | ||||||||||||
Таблиця 1.3 – Промислова класифікація металів
| Група | Підгрупа | Метали |
| Чорні метали | | Fe - залізо та його сплави – чугуни та сталі |
| | Важкі | Cu – мідь, Ni – нікель, Pb – свинець, Zn – цинк, Sn – олово |
| Кольорові метали | Легкі | Al – алюміній, Mg – магній, Ti – титан, Be – берилій, Ca – кальцій, Sr – стронцій, Ba – барій, Li – літій, Na – натрій, K – калій, Rb – рубідій, Cs – цезій |
| Малі (молодщі) | Co – кобальт, Cd – кадмій, Sb – сурма, Bi – вісмут, Hg – ртуть, As – миш’як | |
| Благородні | Au – золото, Ag – срібло, Pt – платина, Os – осмій, Ru – рутеній, Rh – родій, Pd – паладій | |
| Тугоплавкі | W – вольфрам, Mo – молібден, V – ванадій, Ta – тантал, Nb – ніобій, Cr – хром, Mn – марганець, Zr - цирконій | |
| Рідкоземельні | Sc – скандій, Y – ітрій, La – лантан, Ce – церій, Pr – празеодим, Nd – неодим, Sm – самарій, Eu – європій, Gd – гадоліній, Tb – тербій, Yb – ітербій, Dy – диспрозій, Ho – гольмій, Er – ербій, Tu – тулій, Lu – лютецій | |
| Розсіяні | Ge – германій,Ga – галій, Tl – талій,Re – реній, Hf – гафній, Se – селен, Te - телур | |
| Радіоактивні | U – уран, Th – торій, Pa – протактиній, Ra - радій |
1.2 Способи отримання металів
Більшість металів знаходяться в природі у вигляді сполук, головним чином оксидів, сульфідів, хлоридів і силікатів. Завдання металургії полягає в отриманні вільних металів – в їх відновленні з природних сполук. З багатьох придатних для цього хімічних реакцій нижче розглядаються тільки економічно доцільні, застосовувані в практиці металургії.
1.2.1 Відновлення металів вуглецем або воднем
Найбільш доступний і дешевий відновник – вуглець становить основну масу кам'яного вугілля. Реакцію відновлення оксиду металу вуглецем, наприклад окисли свинцю, можна записати таким рівнянням:
РbО + С = Рb + СО. (1.1)
Подібні реакції відбуваються вправо – у бік відновлення металу, якщо міцність хімічного зв'язку кисню з вуглецем в окислі вуглецю більше міцності зв'язку кисню з металом. Міцність хімічних зв'язків називають спорідненістю і характеризують в хімічній термодинаміці величиною ізобарно-ізотермічного потенціалу, що позначається символом ∆Z. Ізобарний потенціал вимірюють у джоулях або калоріях. Його фізичний сенс – максимальна робота, яку може зробити реакція. Цю роботу умовно вважають негативною, тому негативна величина ∆Z свідчить про працездатність реакції – можливість мимовільного її проходження.
Спорідненість якого-небудь елемента до кисню або сірки (ізобарний потенціал утворення оксиду або сульфіду) залежить від температури. Ця залежність виражається рівнянням вигляду
∆Z = А + BT lg Т + СT + … , (1.2)
де А, В, С – коефіцієнти, визначувані з досвіду;
Т – абсолютна температура °К.
Залежність спорідненості від температури за цими рівняннями можна представити графічно, як це зроблено на рис. 1.3, де величина
 Z дана на 1 моль кисню, що бере участь в реакції утворення оксиду. Скориставшись графіком, обчислимо ізобарний потенціал реакції відновлення окислу свинцю вуглецем при 800° С.
Z дана на 1 моль кисню, що бере участь в реакції утворення оксиду. Скориставшись графіком, обчислимо ізобарний потенціал реакції відновлення окислу свинцю вуглецем при 800° С.Відновлення РbО можна представити різницею двох реакцій – II і I:
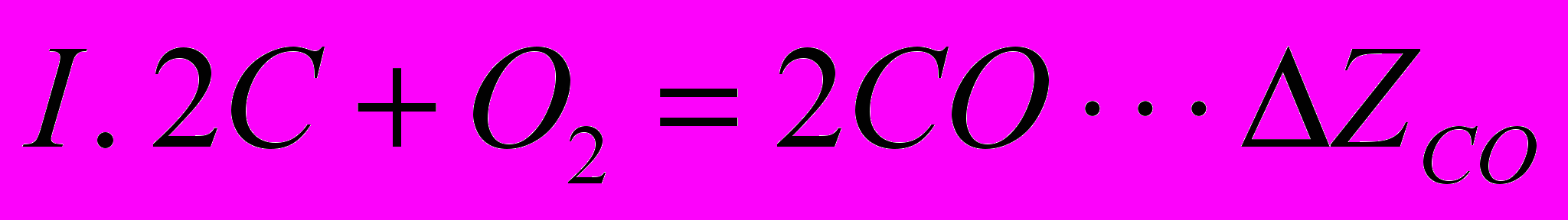
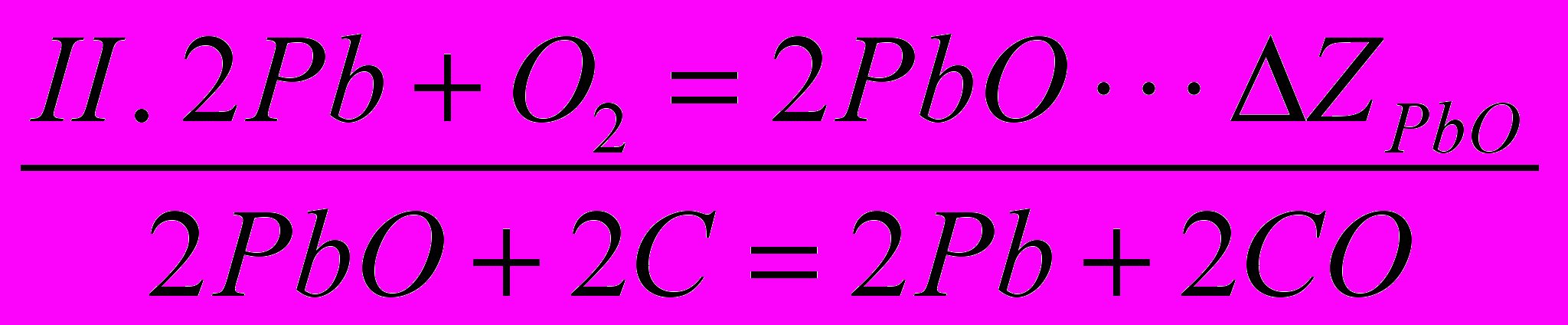
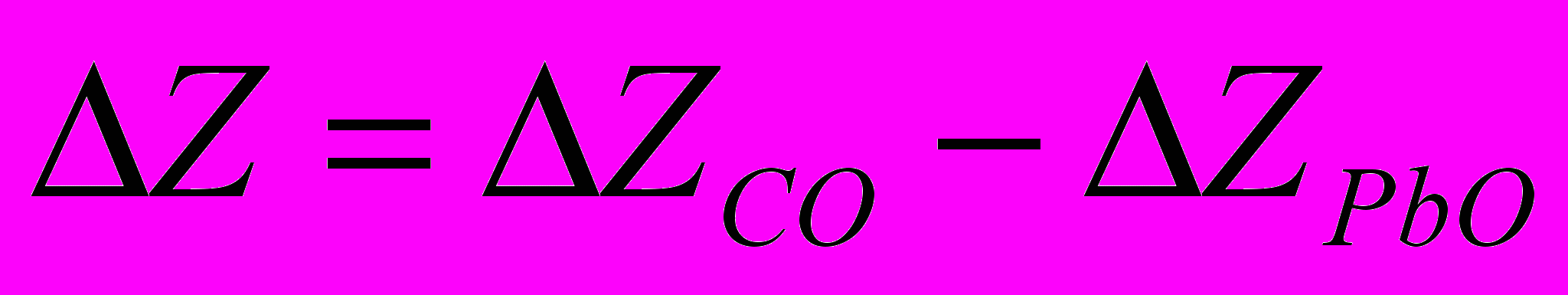 .
.За графіком рис. 1.3 знаходимо
 Zpbo = - 250 кДж;
Zpbo = - 250 кДж;  Zco = - 400 кДж;
Zco = - 400 кДж; Z = - 400 + 250 = -150 кДж.
Z = - 400 + 250 = -150 кДж.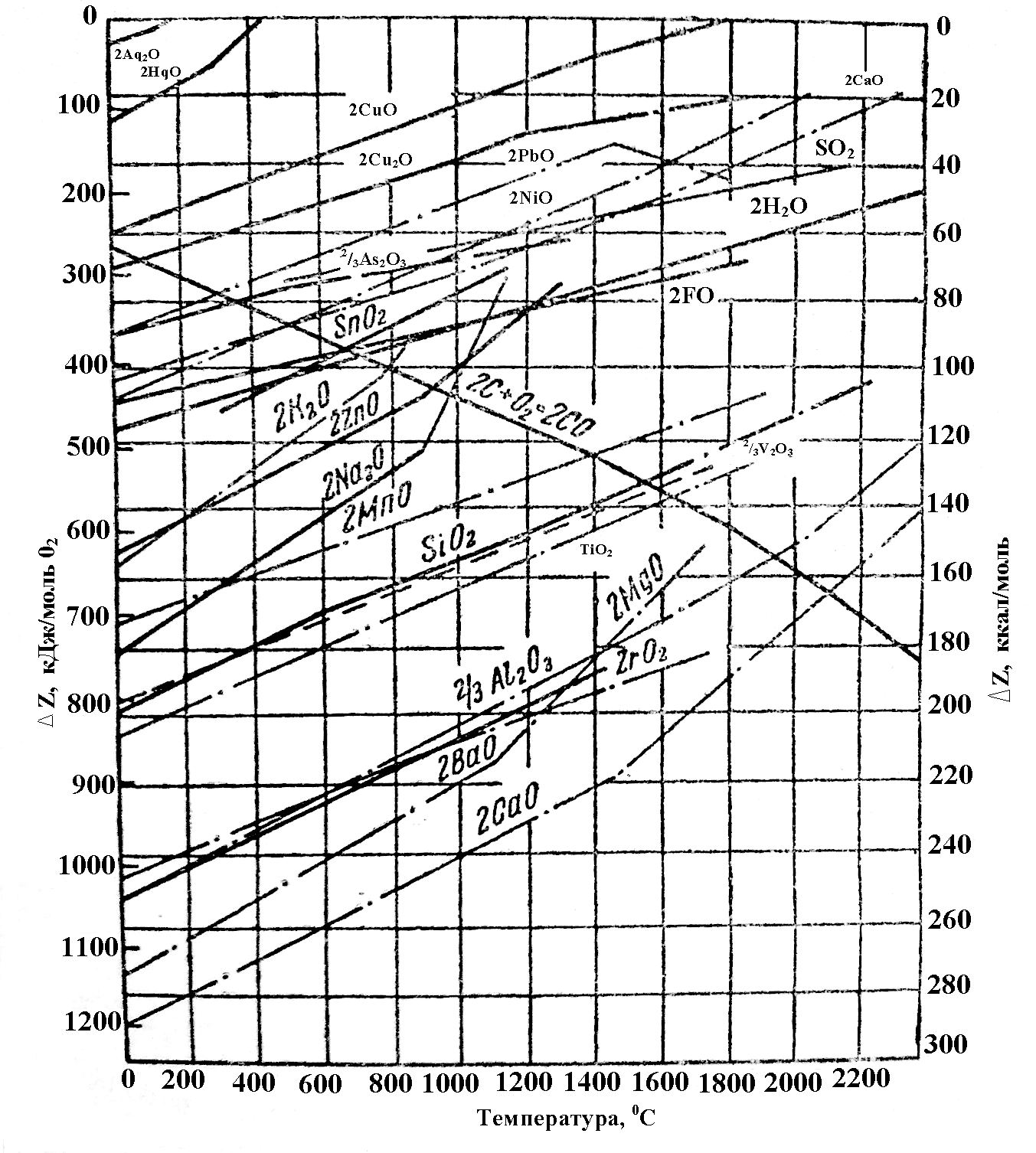
Рисунок 1.3 - Стандартні ізобарні потенціали утворення окислів
Різниця – негативна, отже, реакція буде відбуватися вправо, свинець відновлюватиметься. Відмітимо, що лінії РbО і С на рис. 1.3 перетинаються при температурі близько 320°С. За точкою перетину вліво різниця спорідненості виявиться позитивною, ця точка визначає температуру початку відновлення свинцю вуглецем.
Так само за точками перетину відповідних лінії можна визначити температури початку відновлення вуглецем інших оксидів. Для SiO2 ,Al2O3, CaO,MgO вони вище15000С.
Отже, можна вибрати такі температури, при яких одні оксиди відновлюються до металу, а інші залишаються незмінними. На цьому грунтується, наприклад, виплавлення свинцю з руд, що містять FeO, SiO2, CaO, Al2O3.
Дуже важлива швидкість відновлення: металургійні переділи повинні бути продуктивними, а для цього необхідно, щоб реакції, що в них входять, мали швидкий перебіг.
Відновлення твердих оксидів твердим вуглецем відбувається поволі через малу поверхню контакту реагуючих речовин. Навіть при тонкому подрібненні частинки оксиду і вуглецю стикаються нещільно. До того ж продукт реакції – метал, що виходить в місцях зіткнення, припиняє реакцію у даній точці (рис. 1.4). Твердий вуглець може бути енергійним відновником тільки в тому випадку, якщо зерна його омиваються рідким або пароподібним оксидом.
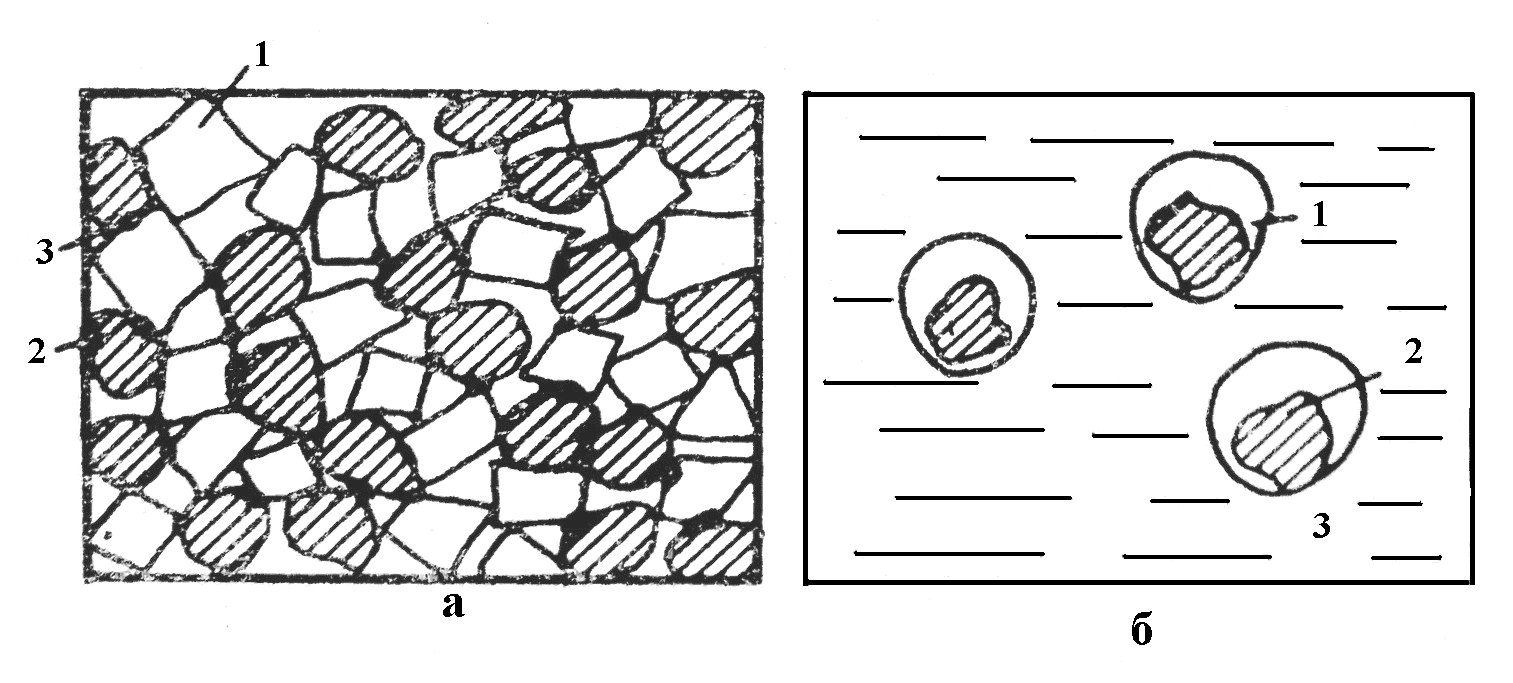
Рисунок 1.4 - Схема відновлення окислів вуглецем: а – відновлення твердого окислу: 1 – частинки окислу; 2 – частинки вуглецю; 3 – метал, утворений при відновленні; б – відновлення окислу в розплаві: 1 – газові плівки із СО та СО2 навколо вуглецю; 2 – частинки вуглецю; 3 – розплав окислів
Якщо ж оксиди знаходяться в твердому стані, вони швидко відновлюються газоподібним окислом вуглецю:
МеО + СО = Me + СО2. (1.3)
Окисел вуглецю отримують за реакцією
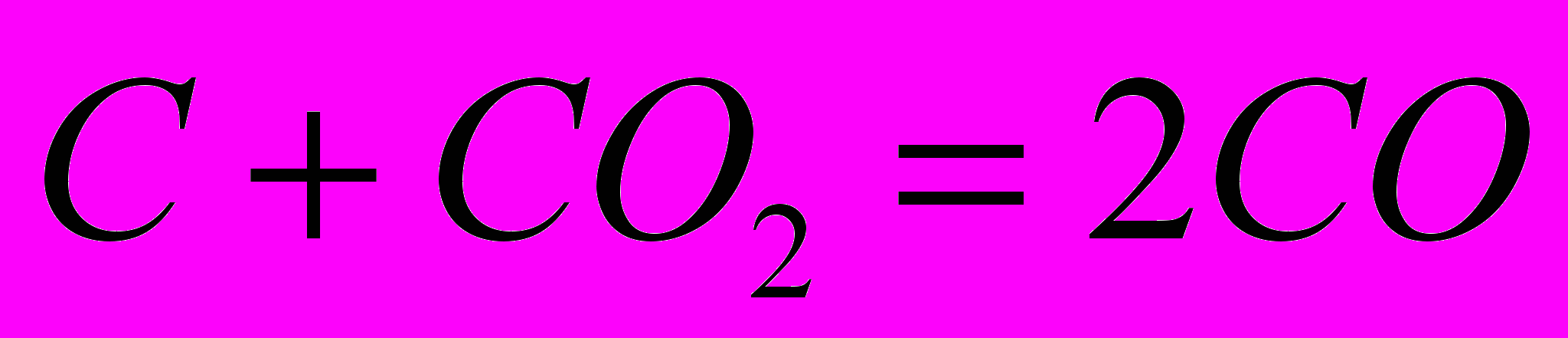 . (1.4)
. (1.4)У розплавах, що погано змочують вуглець, а такі трапляються часто, частинки вуглецю оточені газовою плівкою, що складається із C і СO2. Відновлення тут відбувається також у результаті взаємодії між C і СO2.
Водень для відновлення оксидів застосовують рідше, він дорожче і вибухонебезпечний. Водень буває необхідним у тих випадках, коли вуглець може утворити з металами небажані карбіди, наприклад при відновленні вольфраму і молібдену з оксидів за реакціями:
WO3 + ЗС = W + ЗСО, (1.5)
МоО3 + ЗС = Мо + ЗСО. (1.6)
Одночасно з відновленням утворюються карбіди WC і Мо2С.
Багато металів представлено в природі сульфідами. Для оцінки можливості відновлення сульфідів вуглецем за реакцією розглянемо рис. 1.5, що характеризує спорідненість елементів до сірки. У більшості випадків вуглець не придатний для безпосереднього відновлення металів із сульфідів.
2MeS + С == 2Ме + CS2 . (1.7)
Також мало придатний для цього і водень: лінія H2S розміщена високо, що свідчить про неможливість реакції типу
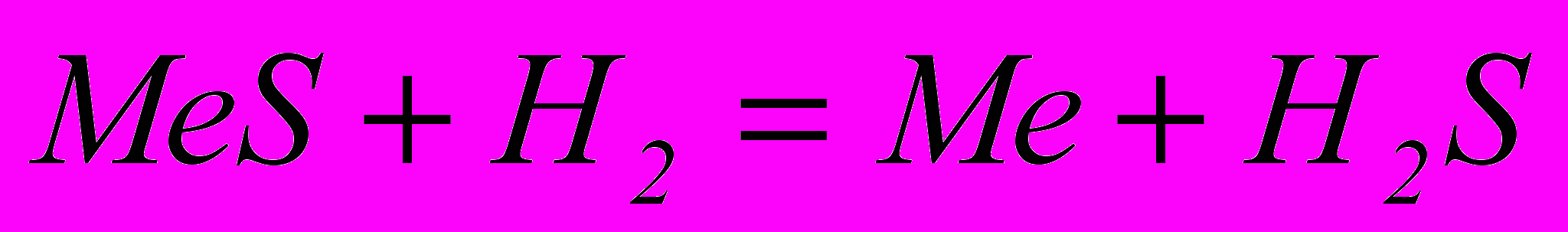 . (1.8)
. (1.8)У металургійній практиці природні сульфіди металів спочатку переводять в оксиди, які потім відновлюють вуглецем. Наприклад, сульфід свинцю – галеніт – окиснюють киснем повітря при температурі близько 1000°С:
2PbS + ЗО2 = 2РbО + 2SO2. (1.9)
Окисел свинцю, що утворився при цьому, відновлюють вуглецем.
За подібними реакціями отримують з сульфіду цинк. Треба відзначити, що на рис. 1.3 лінія ZnO має злам, відповідний точці кипіння металу при 907°С. Відновлюючись при температурі близько 1200°С, цинк виходить у вигляді пари, яка відводить з печі, охолоджує і таким чином конденсує у вигляді рідкого або твердого металу (залежно від температури в конденсаторі).
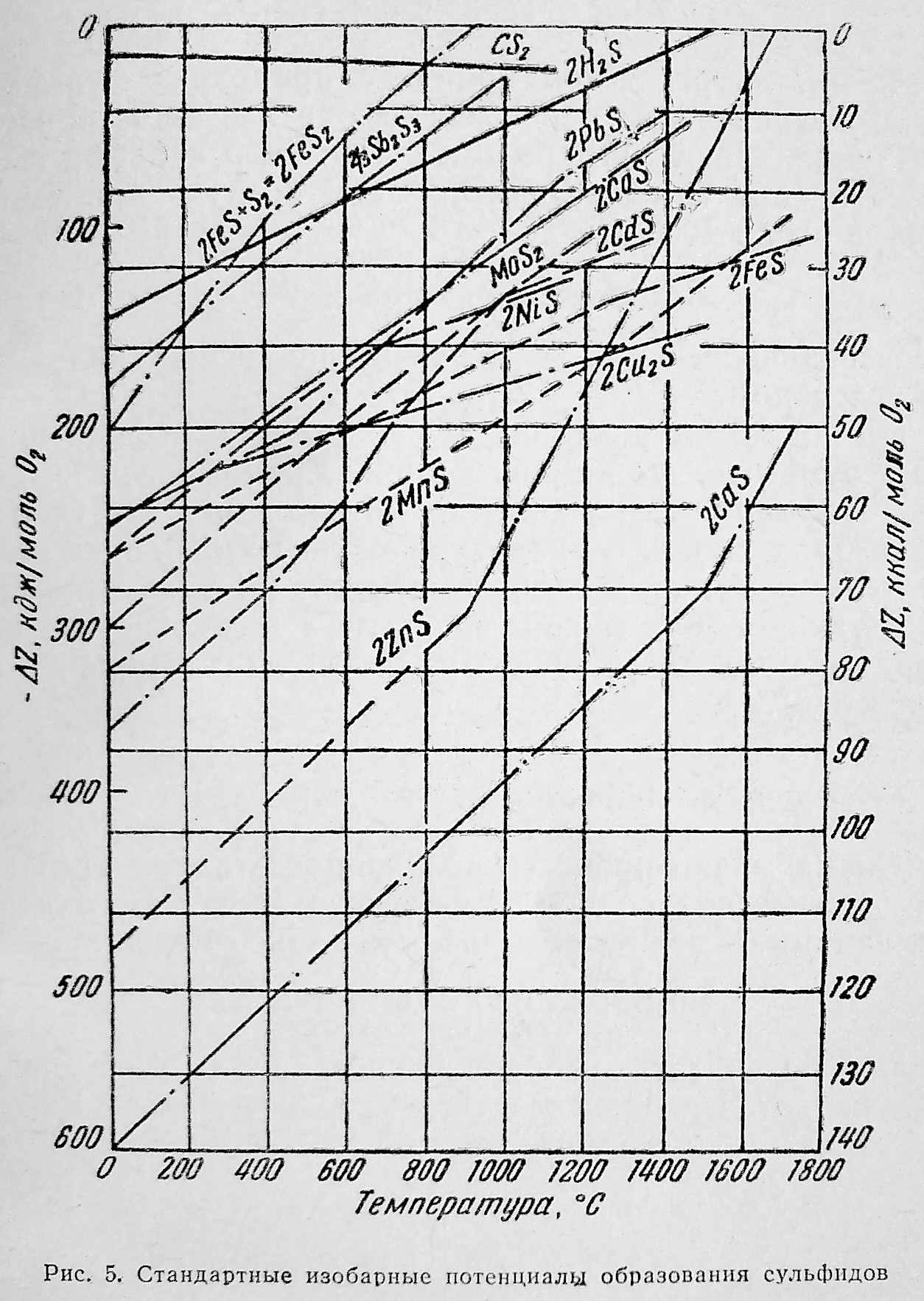
Рисунок 1.5 - Стандартні ізобарні потенціали утворення
сульфідів
1.2.2 Реакційні плавки
Так називають процеси отримання металів у результаті хімічних реакцій між сульфідами і оксидами, наприклад, між сульфідом і закисом міді:
Cu2S + 2Cu2O = 6Cu + SO2. (1.10)
Щоб підрахувати ізобарний потенціал цієї реакції, доведеться скористатися рис. 1.3 і 1.5. Для 1200°С знайдемо
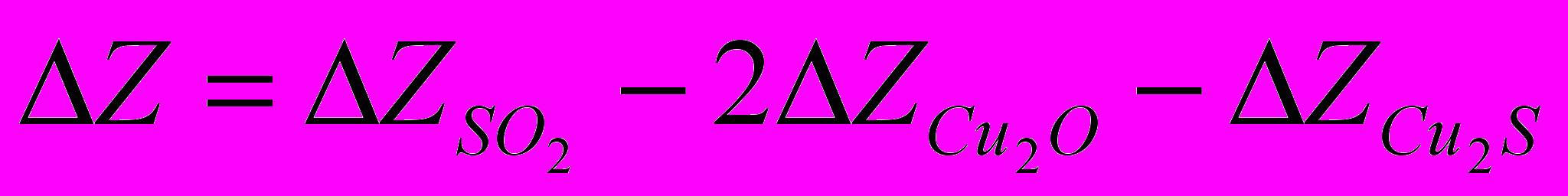 ; (1.11)
; (1.11)  .
.Подібним способом іноді відновлюють з оксидів свинець при температурі близько 800°С. Умовою реакційних плавок є порівняно мала спорідненість металів і до кисню, і до сірки.
1.2.3 Електроліз розплавлених солей
Метали, для відновлення оксидів яких вуглецем потрібні дуже високі температури або оксиди яких реагують з вуглецем, утворюючи карбіди, отримують електролізом розплавлених солей.
Лужні і лужноземельні метали і алюміній мають дуже велику спорідненість до кисню, а при високих температурах вони інтенсивно випаровуються або утворюють карбіди. Ці метали відновлюють електричним струмом з розплавлених солей, переважно з галогенідів. Найбільш зручні хлориди і фториди: вони порівняно дешеві і дають легкоплавкі суміші (з температурами плавлення нижче 1000°С). Для електролізу використовують природні хлориди металів або оксиди переводять в хлориди дією хлору і вуглецю. Наприклад, мінерал магнію – магнезит – спочатку обпалюють для видалення вуглекислоти:
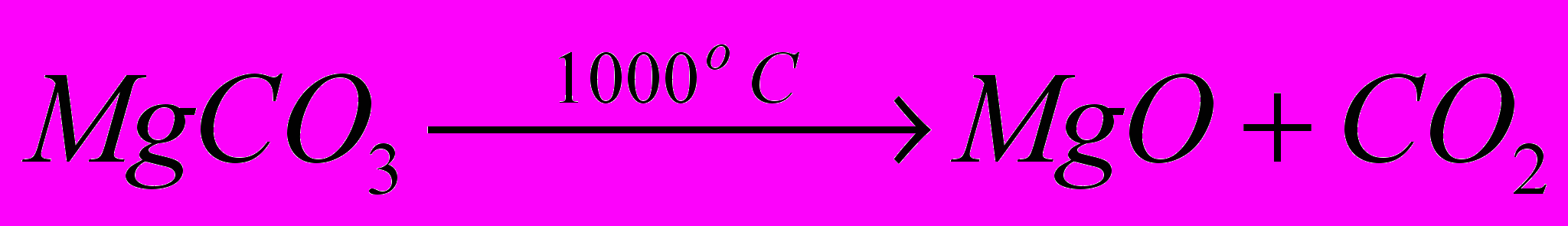 , (1.12)
, (1.12)потім окисел магнію хлорують:
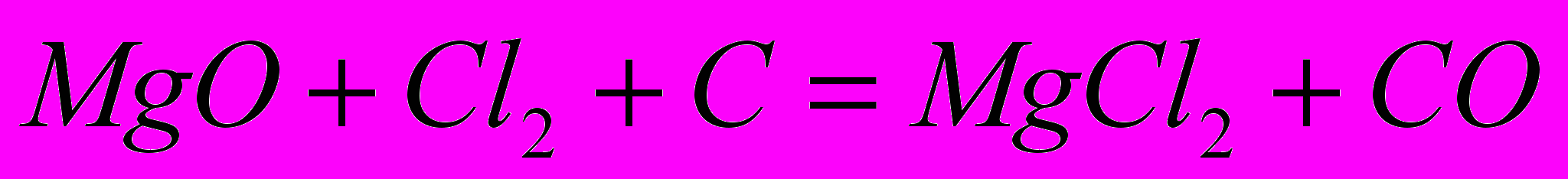 (1.13)
(1.13)Розплавлений хлористий магній при температурі близько 700°С піддають електролізу. У розплаві ця сіль складається з іонів Mg2+ і Cl-. На негативному електроді – катоди іонів магнію набувають два електрони і відновлюються до металу. Температура плавлення магнію 651° С, тому він виходить в рідкому стані і внаслідок меншої щільності, ніж електроліт, спливає над ним:
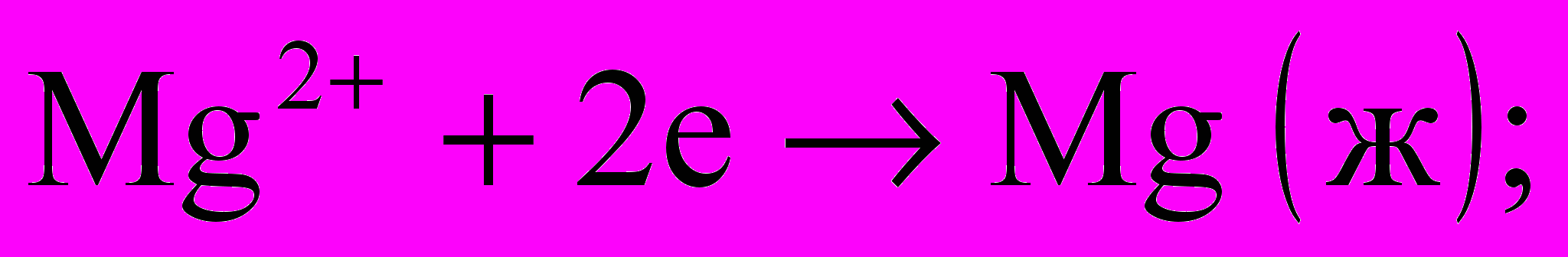 (1.14)
(1.14) На позитивному електроді – аноді – іони хлору віддають два електрони, перетворюючись на молекули газоподібного хлору:
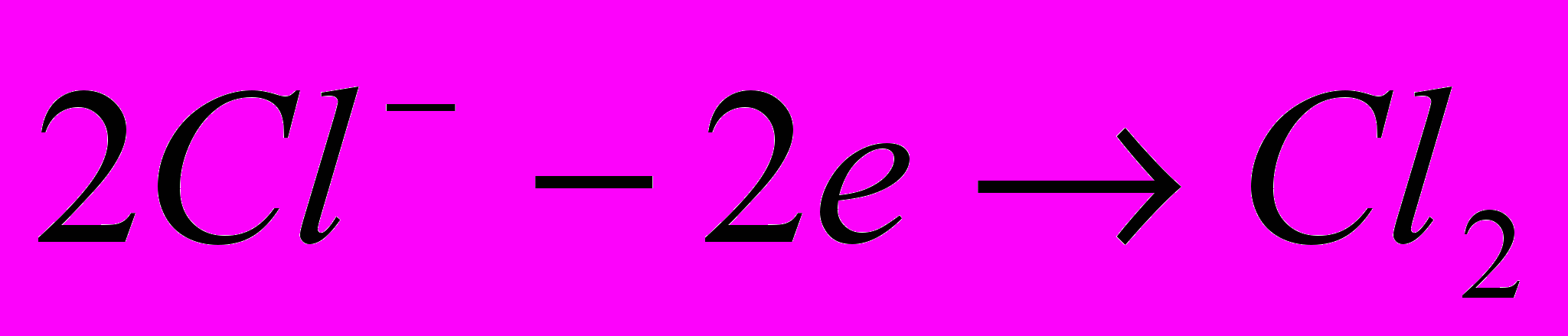 . (1.15)
. (1.15)Подібно до магнію, з хлористих і фтористих розплавів отримують лужні метали, кальцій і барій. Відмітимо, що для відновлення цих металів вуглецем були б потрібні дуже високі температури, вище 1800°С (див. рис. 1.3).
1.2.4 Металотермія
Деякі оксиди металів не вдається перетворити на зручні для електролізу легкоплавкі солі або розчинити в розплавах інших солей. Разом з тим вони міцні і не відновлюються вуглецем при технічно зручних температурах. До таких сполук відносять, наприклад, тетрахлорид титану TiCl4 і тетрафторид урану UF4, а також деякі оксиди тугоплавких металів: V2O5, Сr2О3 і ін. Метали з них відновлюють іншими, дешевшими металами, що мають більшу спорідненість до галогену або кисню, ніж відновлюваний метал. Титан відновлюють магнієм за реакцією
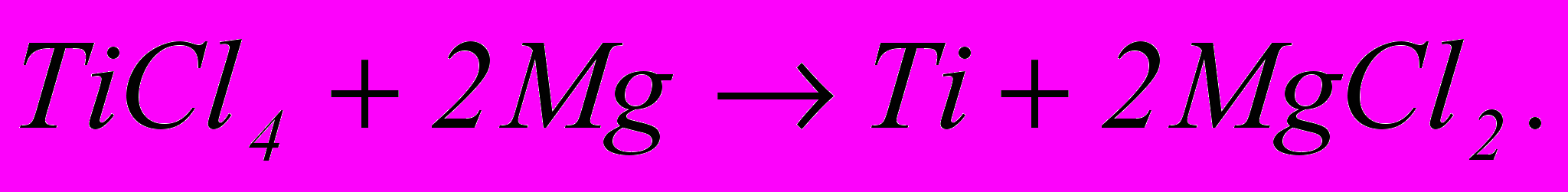 (1.16)
(1.16)Уран відновлюють магнієм або кальцієм:
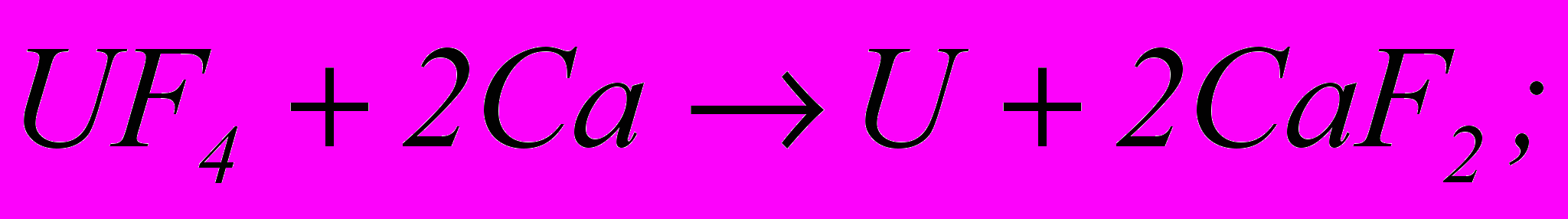 (1.17)
(1.17)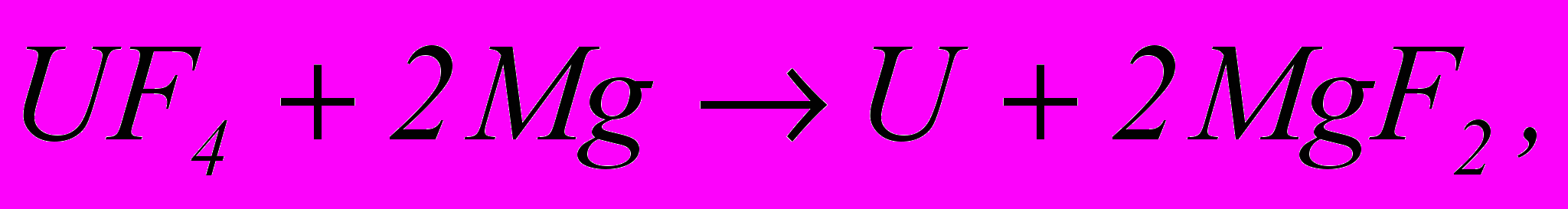 (1.18)
(1.18) а ванадій – алюмінієм:
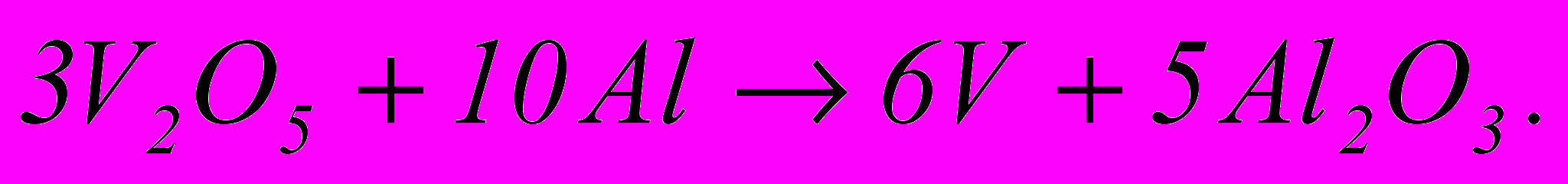 (1.19)
(1.19)Багато з подібних реакцій проходить з виділенням великої кількості тепла, якого буває достатньо для розплавлення навіть таких тугоплавких металів, як ванадій, хром або марганець. Звідси і назва способу – металотермія. Для проведення металотермічної реакції досить приготувати суміш порошків реагуючих речовин і підпалити її особливим запалом, наприклад, з порошку магнію і КСlО3. Реакційна суміш розгорається, а потім плавиться від тепла, що виділяється реакцією. Це – позапічна металотермія, що не вимагає зовнішнього підігріву. В інших випадках, коли тепла, що виділяється реакцією, недостатньо для плавлення, доводиться застосовувати зовнішній підігрів у печах. Це – пічна металотермія.
Металотермічні способи дорогі: для відновлення одного металу доводиться спалювати інший метал; вони застосовуються тільки при непридатності інших способів відновлення.
Для здійснення усіх описаних вище способів отримання металів потрібні високі температури, тому їх називають пірометалургічними (від грецького – вогонь).
При виплавленні металу пірометалургійними способами необхідні витрати на паливо, електроенергію і вогнетривкі матеріали. Якщо в руді металу мало, а домішок багато, ці способи невигідні: попутно доводиться нагрівати або плавити переважну масу порожньої породи.
У деяких випадках пірометалургічними способами не досягають мети через особливі властивості сировини або витягуваних металів. З цих причин у металургії застосовуються також гідрометалургійні способи (від грецького hydor – вода).
1.2.5 Вилуговування металів водними розчинами
Обробляючи руди водними розчинами кислот або інших реагентів, вилуговують метали з сировини – переводять їх у розчин у вигляді солей. Порожня порода залишається в нерозчинному залишку, її фільтрують, а з фільтрату різними способами отримують метали або їх сполуки.
1.2.6 Електроліз водних розчинів
При електролізі на катоді в першу чергу розряджаються найбільш позитивні катіони, послідовність розряду їх відповідає ряду напруги справа наліво. Поки в електроліті є достатня кількість катіона, що розряджається в даний момент, наступний, більш негативний, як правило, розряджатися не може. У водних розчинах завжди є водневі іони від дисоціації води, а запас їх невичерпний, поки є вода. Здавалося б, з цієї причини виділення електролізом металів, що стоять у ряді напруги лівіше водню, неможливе. Насправді, це не так через малу швидкість розряду Н+. Якби нашим завданням було виділення водню з швидкістю, властивою металам, катоду довелося б повідомити потенціал, значно більш негативний, ніж рівноважний потенціал водню. Необхідність для розряду іонів водню цього додаткового потенціалу - перенапруження – дозволяє відновлювати електролізом водних розчинів багато електронегативних металів: цинк, залізо, кадмій, кобальт, нікель та деякі інші. Електрохімічні потенціали титану і металів, що стоять у ряді напруг ще лівіше, негативніші перенапруження водню. Вони не відновлюються на катоді з водних розчинів. У розплавлених солях водневих іонів немає, тому з розплавів можна відновлювати електролізом усі метали.
1.2.7 Цементація
Так називають реакції відновлення іонів одного металу іншим металом з водних розчинів. Наприклад
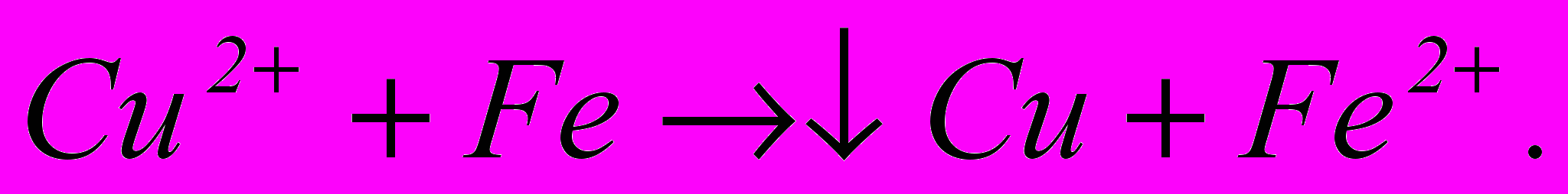 (1.20)
(1.20)Металоосаджувач повинен бути електронегативніше металу, що осаджується, як у даному випадку: Е°си = +0,34 в; E°Fе = 0,44 в.
