О. Й. Любич, В. О. Пчелінцев Фізичні основи металургії кольорових І рідкоземельних металів
| Вид материала | Документы |
- З дисципліни «Теоретичні основи ливарного виробництва» для студентів заочного факультету, 390.98kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни " виробництво виливків, 797.9kb.
- Нова технологія утилізації гальваношламів машинобудівних підприємств з одержанням комплексних, 26.76kb.
- І містять у собі чорні або кольорові метали чи їх сплави, а також вироби з металу,, 462.13kb.
- Наказом Державного комітету України з питань регуляторної політики та підприємництва,, 341.66kb.
- Розробка базових теплотехнічних І конструктивних рішень, а також технологічних схем, 24.73kb.
- Назва реферату: Зварювання кольорових металів Розділ, 29.07kb.
- Робоча програма загальні методичні вказівки та індивідуальні завдання до вивчення дисципліни, 156.9kb.
- Типова програма кандидатського іспиту із спеціальності, 95.6kb.
- Державна митна служба україни, 19.16kb.
3.5.4 Вилуговування МоО 3 розчинами аміаку
На виробництві вилуговування проводять при температурі не вище 50-60°С; у сталевих чанах з пропелерними мішалками або в барабанних вилуговувавчах в три або чотири стадії. У міцний луг витягується 80-95% молібдену при концентрації його 140 г/л. У розчині залишається до 30 г/л (≈ 2 міль/л) NH3.
Реакція утворення молібдату амонію
MoO3 + 2NH4OH = 2NH4+ + MoO42- + 2H2O. (3.64)
Молібдати міді, цинку, заліза, свинцю і кальцію реагують з аміаком по-різному. Перші три дають аміачні комплекси і при розрахунку рівноваги тут необхідно враховувати руйнування комплексного іона NH+5:
NH4+ = NH3 + H+; (3.65)
pK=9,2.
Для молібдатів міді, цинку і заліза у загальному вигляді
MeMoO4 + 4NH4OH =
 + MoO42- + 4H2O; (3.66)
+ MoO42- + 4H2O; (3.66) - для кальцію і свинцю
МеМоO4 + 2NH4OH = Me(OH)2 + 2NH4+ + MoO42; (3.67)
- мідь і залізо осаджують сірчистим амонієм з розчину, у якому близько 2 моль/л надлишкового NH3 і близько 3 моль/л NH4. Сульфіди міді і заліза осаджуються з суміші аміачних комплексів, серед яких переважають тетрамінні:
Сu (NH3)2+ + S2- = CuS + 4 NH3, (3.68)
Fe(NH3)2+ + S2- = FeS + 4NH3, K = 4·1013. (3.69)
Повнота осадження домішок повинна бути високою, проте слід уникати забруднень сіркою, надлишок (NH4)2S зв'язують, додаючи свіжий розчин, від чого залишкові концентрації міді, заліза і цинку збільшуються. Очищення проводять у сталевих гумованих чанах з мішалками.
Для кристалізації парамолібдату амонію
(NH4)6
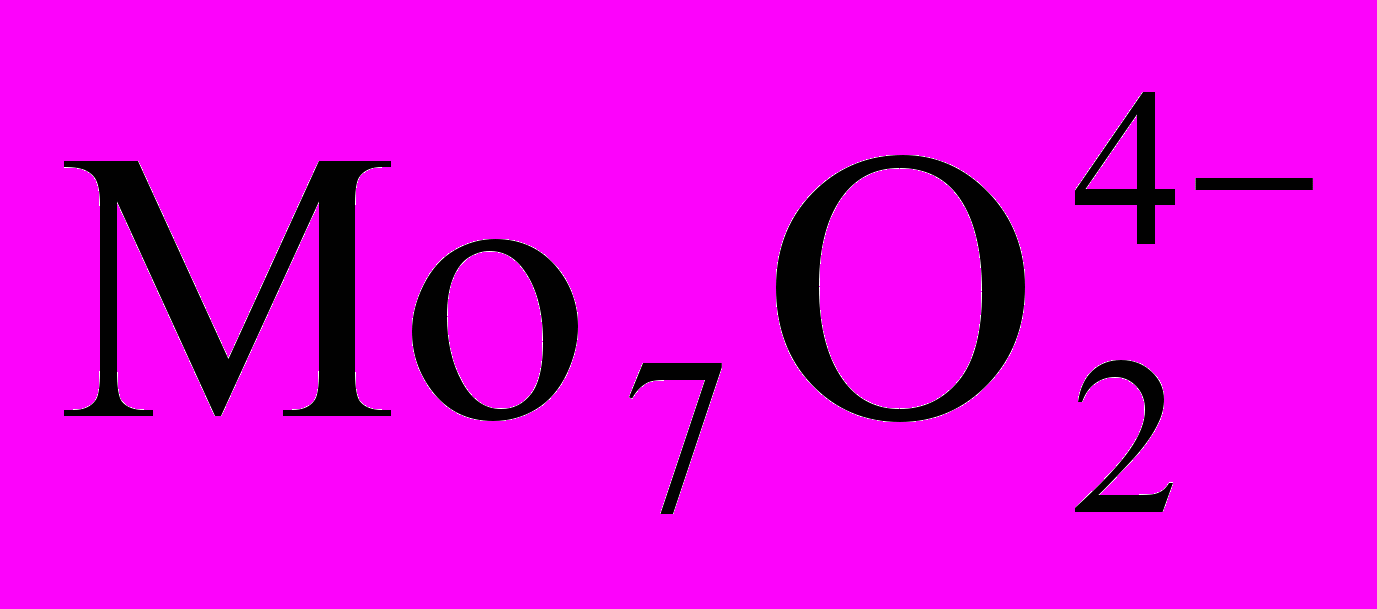 · 4H2O) потрібне молярне відношення NH3 : МоО4 = 6 : 7, а в очищеному розчині воно більше 2:1 при концентрації МоО близько 1 моль/л.
· 4H2O) потрібне молярне відношення NH3 : МоО4 = 6 : 7, а в очищеному розчині воно більше 2:1 при концентрації МоО близько 1 моль/л.Нейтралізація частини аміаку соляною кислотою дає краще витягання, ніж пряме випаровування, і досить чистий продукт, в якому заліза менше 0,05%, а інших домішок сумарно не більше 0,015%.
Паромолібдат прожарюють у човниках з нержавіючої сталі в електричних печах з коробчастим муфелем при температурі 500°С. Човники поступово просувають в зони високих температур.
Застосовують також трубчасті печі, що обертаються, з трубою з нержавіючої сталі, що обігріваються електрикою.
Техніко-економічні показники аміачного способу, включаючи переробку відходів, в основному залежать від ціни сировини, яка становить більше 90% собівартості. Витягання з концентрату в парамолібдат амонію 93-96% залежить від якості концентратів і культури виробництва. Найбільші втрати (2-6%) припадають на очищення розчинів і кристалізацію. Втрати при відновленні близько 1%.
3.5.5 Виробництво триокису молібдену сублімацією
Низька температура кипіння МоО3 (1150°С) дозволяє переганяти його з недогарка відразу після випалення, минувши гідрометалургійні переділи. Для цього розроблені круглі печі з кільцевим черенем. На під, що обертається і покритий кварцовим піском для полегшення вивантаження залишку, безперервно завантажують огарок. Триокис молібдену плавиться, вбирається у пісок і сублімується. Його уловлюють з газів рукавними фільтрами. Подовий залишок періодично вивантажують і переробляють гідрометалургійними способами або плавлять на феромолібден. Для переробки придатні тільки багаті і чисті концентрати, в яких, наприклад, 56% молібдену і менше 0,05% свинцю, молібдат якого також сублімується. Сублімований триокис має дуже тонкі частинки і малу насипну масу, цим вона незручна для відновлення. Інколи перегін доводиться розчиняти в аміаку і виділяти парамолібдат, прогартовуванням якого вдається отримати більше порошку. Витягання у перегони не перевищує 70%, відходи вимагають додаткової переробки. Надлишок аміаку видаляють нагріванням з одночасним випаровуванням частини води. Застосовують випарні апарати з нержавіючої сталі з тепловою циркуляцією розчинів в паралельному пучку труб, що обігріваються парою.
Після підвищення щільності від 1100 до 1210 кг/м3 коагулюються осади домішок, які перед подальшим випаровуванням до 1390 кг/м3 фільтрують. Досить випарений розчин знову фільтрують і зливають у кристалізатори з нержавіючої сталі з мішалками і водним охолоджуванням. Маточний розчин випаровують і повторно піддають кристалізації, виділяючи після двох стадій до 60% солі високої чистоти. Залишок розчину випаровують насухо, нагрівають до 400°С для перетворення в оксиди, які повертають на вилуговування. Осадження тетрамолібдату (NH4)
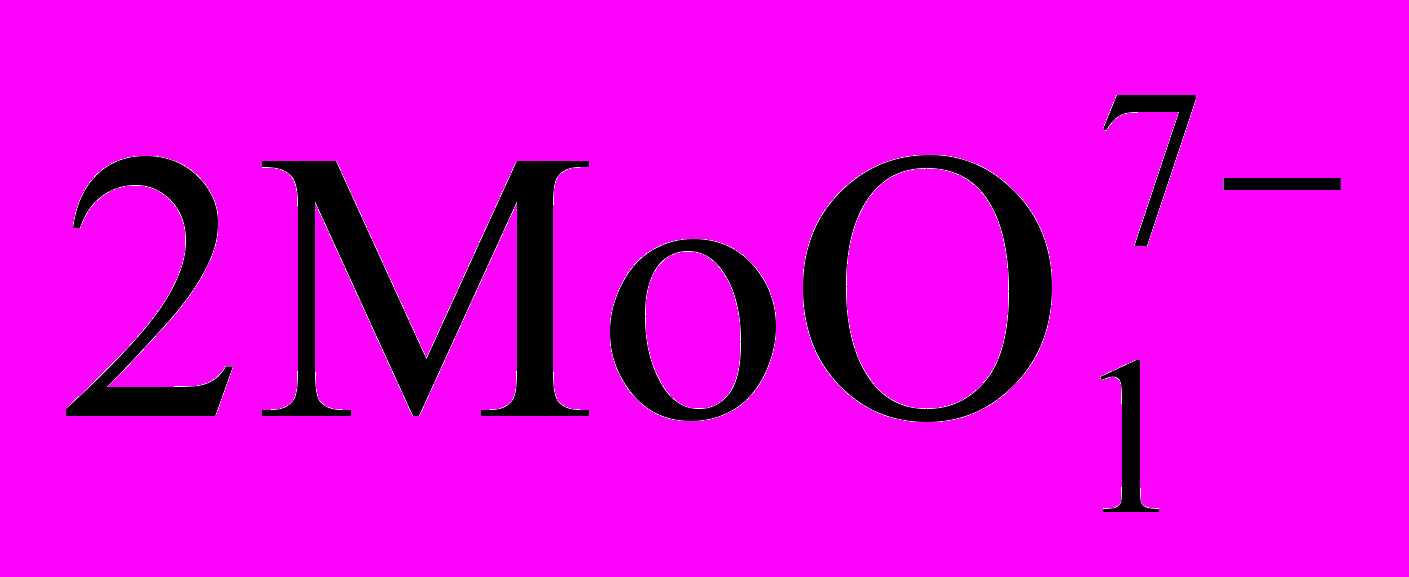 2H2O досягається скріпленням вільного аміаку добавками соляної кислоти при температурі 60°С і перемішуванні. У вихідному розчині повинно бути не менше 280 г/л МоО3 і його, якщо потрібно, концентрують випаровуванням.
2H2O досягається скріпленням вільного аміаку добавками соляної кислоти при температурі 60°С і перемішуванні. У вихідному розчині повинно бути не менше 280 г/л МоО3 і його, якщо потрібно, концентрують випаровуванням. Після центрифугування і промивання водою одержують досить чистий продукт, проте часто забруднений хлором (>0,2%). Повторною кристалізацією, після розчинення в гарячому 5% NH4ОН доводять до щільності 1420 кг/м3.
Маточний розчин після десятиразового обертання спрямовують на очищення. Цей спосіб дає ще вище добування і достатньо чистий продукт, в якому заліза менше 0,05%, а інших домішок сумарно до 0,015%.
3.5.6 Переробка збідненої сировини і відходів
Хвости аміачного вилуговування, що містять сумарно до 25% молібдену, знаходилися спіканням із содою, вилуговуванням розчинами її в автоклавах або розкладалися кислотами.
Спікання шихти з вологих відходів і соди проводять в череневих печах при температурі близько 750°С, отримуючи у пекові молібдат натрію. Після вилуговування водою осаджує молібдат заліза:
3Na2MoO4 + 2FeCl3 = 6NaCl + Fe2(МоО4)3. (3.70)
Осад обробляють аміаком
Fes (МоО4)3 + 6NH4OH = 3Fe(ВІН)3 + 3(NH4)2MoO4. (3.71)
Розчини молібдату амонію, в які добувається до 94% молібдену, повертають в основне виробництво; у відвальних хвостах його залишається до 1,5%. Вилуговування хвостів содою в автоклавах можливе, якщо значно переважає окиснений молібден, а сульфідного мало. Вилуговування соляною кислотою застосовують, якщо, крім молібдену, наявний вольфрам.
Маточні розчини після осадження тетрамолібдату амонію (1 г/л Мо, 40 г/л С1, 7 г/л SO4, домішки заліза і кольорових металів) переробляють сорбцією на аніонітах. Слабоосновний аніоніт AH-1 у хлор-формі має динамічну обмінну місткість (ДОМ) за молібденом близько 300 кг/т. Сорбцію проводять при рН-3, пропускаючи розчин через колону із смолою. Домішки хлору і катіонів не сорбують. Після промивання водою молібден елюїрують 5-10% аміаком і розчин (100 г/л Мо) повертають в основне виробництво.
Промислові продукти збагачені комплексними, переважно мідно-молібденовими рудами, що містять сульфіди заліза, міді, молібдену, а також повеліт і молібдит, піддають окиснювальному випаленню, а потім вилуговують розчинами соди. За відсутності або при малій кількості сульфідів випалення не потрібне.
Вільний триокис молібдену переходить при вилуговуванні в добре розчинний Na2MoO4, а молібдати – мідь, кальцій і залізо - взаємодіють із содою за загальною схемою
Me MoO4 + Na2CO3 = Na2MoO4 + MeCO3 (3.72)
Карбонати міді і заліза далі гідролізуються, переходячи в гідроокиси і основні солі.
Вилуговування проводять з протитечією в 4-5 стадій 10% розчином соди в залізних чанах з механічним перемішуванням при підігріванні паровими змійовиками. Після кожної стадії розчину дають відстоятися і пускають в оборот. Кінцеві хвости фільтрують, промивають і скидають у відвал, а перший міцний розчин також після фільтрації надходить на переробку. З концентрованого розчину (60% Мо) осаджується молібдат кальцію:
Na2MoO4 + СаС12 = СаМоО4 + 2NaCl. (3.73)
Практично після осадження при 80°С, щоб уникнути великого надлишку CaCl2 і не забруднити осад гіпсом, залишають в маточному розчині до 1 г/л молібдену.
Молібдат кальцію марок МКД і МКД4, в якому не менше 44 або 40% молібденів, а домішок сірки і фосфору відповідно не більше 0,20-0,23 і 0,1-0,2%, йде в чорну металургію, на присадки в сталі і виплавку феромолібдену.
Відновлення триокису молібдену відбувається в дві стадії при 800°С і відповідає реакціям:
MoO3 + H2 = MoO2 + H2O; (3.74)
MoO2 + 2H2 = Mo +2H2O. (3.75)
При протитечійному пропусканні водню реакція завершується в інтервалі температур 400-550°С; проте вимагає повільного нагрівання через можливість утворення легкоплавкої евтектики MoO3 – МоО2, що уповільнює відновлення.
На виробництві застосовують такі самі печі, як для вольфраму. Відновлення проводять в дві стадії: спочатку в межах температур до 650, а потім до 950°С. Повільне просування човників в кінці другої стадії сприяє зниженню вмісту залишкового кисню до 0,1-0,2%. Порошок усереднюють, просівають і зберігають в герметичній тарі, заповненій аргоном.
3.6 Фізико-металургійні основи отримання ніобію
3.6.1 Історія відкриття ніобію
Ніобій (лат. Niobium), Nb, хімічний елемент V групи періодичної системи Менделєєва; атомний номер 41, атомна маса 92,9064; метал сіро-стального кольору. Елемент має один природний ізотоп 93 Nb.
Елемент, що займає у таблиці Менделєєва клітинку 41, людство знає давно. Назва ніобій була винайдена на півстоліття пізніше. Трапилося так, що елемент N41 був відкритий двічі. Перший раз у 1801 р. англійський вчений Чарльз Хатчет досліджував зразок мінералу, надісланий у Британський музей з Америки. З цього мінералу він виділив оксид невідомого раніше елемента. Новий елемент Хатчет назвав колумбієм, відзначаючи тим самим його заокеанське походження. А чорний мінерал отримав назву колумбіт.
Через рік шведський хімік Екеберг виділив з колумбіту оксид ще одного нового елемента, названого тантал. Схожість сполук колумбію і танталу була така велика, що протягом 40 років більшість хіміків вважали, що тантал і колумбій - один і той самий елемент.
У 1844 р. німецький хімік Генріх Розі досліджував зразки колумбію, знайдені в Баварії. Він знову виявив оксиди двох металів. Один з них був оксидом відомого вже танталу. Оксиди були схожі, і, підкреслюючи їх схожість, Розі назвав елемент, що створює другий оксид, ніобієм на ім'я Ніобі, дочки міфологічного мученика Тантала. Втім, Розі, як і Хатчет, не зумів отримати цей елемент у вільному стані.
Металевий ніобій був вперше отриманий лише у 1866 р. шведським ученим Бломстрандом при відновленні хлориду ніобію воднем. У кінці ХІ ст. були знайдені ще два способи отримання цього елемента. Спочатку Муассан отримав його в електропечі, відновлюючи окисел ніобію вуглецем, а потім Гольдшмідт зумів відновити той же елемент алюмінієм.
Середній вміст ніобію у земній корі (кларк) 2-10-3% за масою. Тільки у лужних вивержених породах – ніфелінових сієнитах та інших – вміст ніобію підвищений до 10-2 -10-1%. У цих породах і пов'язаних з ними пегматитах, карбонатитах, а також у гранітних пегматитах виявлено 23 мінерали ніобію і близько 130 інших мінералів, що містять підвищені кількості ніобію. Це в основному складні і прості оксиди. У мінералах Nb пов'язаний з рідкоземельними елементами та з Та, Ті, Са, Nа, Тh, Fе, Ва (тантало-ніобати, титанати та ін.). З 6 промислових мінералів найбільш важливі пірохлор і колумбіт. Промислові родовища ніобію пов'язані з масивами лужних порід (наприклад, на Кольському півострові), їх корою вивітрювання, а також з гранітними пегматитами. Важливе значення мають і розсипи танталоніобатів.
3.6.2 Хімічні властивості ніобію
За хімічними властивостями ніобій близький до танталу. Обидва вони надзвичайно стійкі (тантал більш стійкий, ніж ніобій) на холоді і при невеликому нагріванні до дії багатьох агресивних середовищ. Компактний ніобій помітно окиснюється на повітрі тільки вище 200°С. На ніобій діють: хлор вище 200°С, водень при 250°С (інтенсивно при 360°С), азот при 400°С. Практично не діють на ніобій очищені від домішок кисню рідкі Nа, Kо і їх сплави, Li, Ві, Рb, Нg, Sn, застосовувані як рідкометалеві теплоносії в атомних реакторах.
Елементарний ніобій - надзвичайно тугоплавкий (2468°С) і висококиплячий (4927°С) метал, дуже стійкий у багатьох агресивних середовищах. Усі кислоти, за винятком плавикової, не діють на нього. Кислоти-окиснювачі «пасивують» ніобій, покриваючи його захисною окисною плівкою (К 205). Але при високих температурах хімічна активність ніобію підвищується. Якщо при 150-200°С окиснюється лише невеликий поверхневий шар металу, то при 900-1200°С товщина окисної плівки значно збільшується.
Ніобій активно реагує з багатьма неметалами. З ним утворюють сполуки галогену, азоту, водню, вуглецю, сірки. При цьому ніобій може проявляти різні валентності - від двох до п'яти. Але головна валентність цього елемента 5+. П'ятивалентний ніобій може входити до складу солі і як катіон, і як один з елементів аніона, що свідчить про амфотерний характер елемента N41.
Солі ніобієвих кислот називають ніобатами. Їх отримують у результаті обмінних реакцій після сплаву п'ятиокису ніобію з содою:
Nb2O5 + 3Na2CO3 > 2Na3NbO4 + 3CO2. (3.76)
Досить добре вивчені солі декількох ніобієвих кислот, в першу чергу метаніобієвої НNbO3, а також диніобати і пентаніобати (К4Nb2О7, K7Nb5О16). А солі, в яких елемент N41 виступає як катіон, як правило, отримують прямою взаємодією простих речовин, наприклад,
2Nb + 5С12 >2NbСl5. (3.77)
Яскраво забарвлені голчасті кристали пентагалогенідів ніобію (NbС1 - жовтого кольору, NbВr5 – пурпурно-червоного) легко розчиняються в органічних розчинниках - хлороформі, ефірі, спирті. Але при розчиненні у воді ці сполуки повністю розкладаються, гідролізуються з утворенням ніобатів:
NbCl5 + 4Н2O > 5НСl + Н3NbО4. (3.78)
Гідролізу можна запобігти, якщо у водний розчин додати яку-небудь сильну кислоту. У таких розчинах пентагалогеніди ніобію розчиняються, не гідролізуючись.
Ніобій утворює подвійні солі і комплексні сполуки, найлегше – фтористі. Фторніобати - так називаються ці подвійні солі. Вони виходять, якщо у розчин ніобієвої і плавикової кислот додати фторид якого-небудь металу.
Склад комплексної сполуки залежить від співвідношення реагуючих в розчині компонентів. Рентгенометричний аналіз однієї з цих сполук показав будову, що відповідає формулі К2NbF7. Можуть утворитися і оксосполуки ніобію, наприклад, оксофторніобат калію К2NbOF5nН2O.
Ніобій особливо цінується за його стійкість до дії неорганічних і органічних речовин.
Є різниця в хімічній поведінці порошкоподібного і кускового металу. Останній стійкіший. Метали на нього не діють, навіть якщо нагрівати їх до високих температур. Рідкі лужні метали і їх сплави – вісмут, свинець, ртуть, олово можуть знаходитися у контакті з ніобієм довго, не змінюючи його властивостей. Він не змінюється навіть при дії таких сильних окиснювачів, як хлорна кислота, «царська горілка», не кажучи вже про азотну, сірчану, соляну і всі інші. Розчини лугів на ніобій теж не діють.
Існують, проте, три реагенти, які можуть переводити металевий ніобій в хімічні сполуки. Одним з них є розплав гідроксиду якого-небудь лужного металу:
4Nb + 4NaОН + 5О2 > 4NaNbОЗ + 2Н2О. (3.79)
Двома іншими є плавикова кислота (НF) або її суміш з азотною (НF + НNО). При цьому утворюються фторидні комплекси, склад яких у значній мірі залежить від умов проведення реакції. Елемент у будь-якому випадку входить до складу аніона типу [NbOF5]2 або [Nb(ОН)2F5]2-.
Якщо ж узяти порошкоподібний ніобій, то він дещо активніший. Наприклад, у розплавленому нітраті натрію він навіть западав, перетворюючись на оксид. Компактний ніобій починає окиснюватися при нагріванні вище 200°С, а порошок покривається окисною плівкою вже при 150°С. При цьому виявляється одна з чудових властивостей цього металу – він зберігає пластичність.
У вигляді тирси при нагріванні вище 900°С ніобій повністю згорає до Nb2O5. Енергійно згорає в струмі хлору
2Nb + 5Сl2 → 2NbCl5. (3.80)
При нагріванні реагує із сіркою. З більшістю металів він ледь сплавляється. Виняток, мабуть, становлять лише два: залізо, з яким утворюються тверді розчини різного відношення, та алюміній, що має з ніобієм сполуку Al2Nb.
При зіткненні з окиснювачами на поверхні металу виникає найтонший (тому він і непомітний), але дуже щільний шар оксидів. Цей шар стає непереборною перешкодою на шляху окиснювача до чистої металевої поверхні. Проникнути крізь нього можуть тільки деякі хімічні реагенти, зокрема аніон фтору.
Отже, по суті, метал окиснюється, але практично результатів окиснення непомітно через наявність тонкої захисної плівки. Пасивність по відношенню до розбавленої сірчаної кислоти використовують для створення випрямляча змінного струму. Влаштований він просто: платинова і ніобієва пластинки занурені в розчин сірчаної кислоти. Ніобій в пасивуючому, стані, може проводити струм, якщо є негативним електродом – катодом, тобто електрони можуть проходити крізь шар оксидів тільки з боку металу. З розчину шлях електронам закритий. Тому коли через такий прилад пропускають змінний струм, то проходить лише одна фаза, для якої платина – анод, а ніобій – катод.
3.6.3 Металургія ніобію
Руди ніобію – як правило, комплексні і збіднені Nb, хоча їх запаси набагато перевершують запаси руд Та. Рудні концентрати містять Nb2О5: пірохлорові - не менше 37%, лопаритові - 8%, колумбітові - 30-60%. Велику їх частину переробляють алюміно- або силікотермічним відновленням на фероніобій (40-60% Nb) й феротанталоніобій. Металевий ніобій отримують з рудних концентратів за складною технологією у три стадії: 1) розкриття концентрату, 2) розділення Nb і Та і отримання їх чистих хімічних сполук; 3) відновлення і рафінування металевого ніобію і його сплавів. Основні промислові методи виробництва ніобію і сплавів алюмінотермічний, натрієтермічний, карботермічний: з суміші Nb2О5 і сажі спочатку одержують при 1800°С в атмосфері водню карбід, потім з суміші карбіду і оксид при 1800-1900°С у вакуумі - метал; для отримання сплавів ніобію у цю суміш додають оксиди легуючих металів; за іншим варіантом ніобій відновлюють при високій температурі у вакуумі безпосередньо з Nb2О5 сажею. Натрієтермічним способом ніобій відновлюють натрієм з К2NbF7, алюмінотермічним - алюмінієм з Nb2О5. Компактний метал (сплав) виробляють методами порошкової металургії, спікаючи спресовані з порошків штабки у вакуумі при 2300°С, або електронно-променевим і вакуумним дуговим плавленням; монокристали ніобію високої чистоти – безтигельним електронно-променевим зонним плавленням.
Металевий ніобій можна отримати відновленням його сполук, наприклад хлориду ніобію або фтор-ніобату калію, при високій температурі:
К2 NbF7 + 5Na → Nb + 2КF + 5NaF. (3.81)
Але перш ніж досягти цієї, по суті, останньої стадії виробництва, ніобієва руда проходить безліч етапів переробки. Перший з них – збагачення руди, отримання концентратів. Концентрат сплавляють з різними інгредієнтами: їдким натром або содою. Отриманий сплав вилуговують. Але розчиняється він не повністю. Нерозчинним осадом і є ніобій. Правда, він тут ще у складі гідроокису, не роздільний зі своїм аналогом за підгрупою - танталом - і не очищений від деяких домішок.
До 1866 р. не було відомо жодного придатного для виробничих умов способу розділення танталу і ніобію. Перший метод розділення цих надзвичайно схожих елементів запропонував Жан Шарль Галіссар де Маріньяк. Метод базується на різній розчинності комплексних сполук цих металів і називається фторидним. Комплексний фторид танталу нерозчинний у воді, а аналогічна сполука ніобію розчинна.
Фторидний метод складний і не дозволяє повністю розділити ніобій і тантал. Тому в наші дні він майже не застосовується. На зміну йому прийшли методи виборчої екстракції, іонного обміну, ректифікації галогенідів та ін. Цими методами отримують оксид і хлорид п'ятивалентного ніобію. Після розділення ніобію і танталу йде основна операція – відновлення. П'ятиокис ніобію Nb2O5 відновлюють алюмінієм, натрієм, сажею або карбідом ніобію, отриманим при взаємодії Nb2O5 з вуглецем; пентахлорид ніобію відновлюють металевим натрієм або амальгамою натрію. Так отримують порошкоподібний ніобій, який потрібно потім перетворити на моноліт, зробити пластичним, компактним, придатним для обробки. Як і інші тугоплавкі метали, ніобій-моноліт отримують методами порошкової металургії, суть якої полягає у такому.
З отриманого металевого порошку під великим тиском (1 т/см2) пресують так звані штабки прямокутної або квадратної форми. У вакуумі при 2300°С ці штабки спікають, сполучають у прутки, які плавлять у вакуумних дугових печах, причому прутки у цих печах виконують роль електрода. Такий процес називається плавкою з електродом, що витрачається. Багатокристалічний пластичний ніобій отримують методом безтигельного зонного електронно-променевого плавлення. Суть його в тому, що на порошкоподібний ніобій (операції пресування і спікання виключені) спрямовують могутній пучок електронів, який плавить порошок. Краплі металу стікають на ніобієвий злиток, який поступово росте і виводиться з робочої камери.
3.6.4 Застосування ніобію
У металургії ніобій знайшов найбільш широке застосування, як у кольоровій металургії, так і у чорній. Сталь, легована ніобієм, має гарну корозійну стійкість. Хром теж підвищує корозійну стійкість сталі, і він набагато дешевший за ніобій, але в хромонікелевій сталі, як і у всякій іншій, завжди є вуглець. Але вуглець з'єднується з хромом, утворюючи карбід, який робить сталь крихкішою. Ніобій має більшу спорідненість до вуглецю, ніж хром. Тому при додаванні у сталь ніобію обов'язково утворюється карбід ніобію. Легована ніобієм сталь набуває високих антикорозійних властивостей і не втрачає своєї пластичності. Потрібний ефект досягається, коли до тонни сталі додано всього 200 г металевого ніобію. А хромо-марганцевій сталі ніобій додає високої зносостійкості.
Ніобієм легують і багато кольорових металів. Так, алюміній, що легко розчиняється в лугах, не реагує з ними, якщо в нього додано всього 0,05% ніобію. А мідь, відому своєю м'якістю, і багато її сплавів ніобій немов загартовує. Він збільшує міцність таких металів, як титан, молібден, цирконій, і одночасно підвищує їх жаростійкість і жароміцність.
Зараз властивості і можливості ніобію гідно оцінені авіацією, машинобудуванням, радіотехнікою, хімічною промисловістю, ядерною енергетикою. Всі вони застосовують ніобій.
Унікальна властивість – відсутність помітної взаємодії ніобію з ураном при температурі до 1100°С і, крім того, хороша теплопровідність, невеликий ефективний переріз поглинання теплових нейтронів зробили ніобій серйозним конкурентом визнаних в атомній промисловості металів –алюмінію, берилію і цирконію. До того ж штучна (наведена) радіоактивність ніобію невелика. Тому з нього можна робити контейнери для зберігання радіоактивних відходів або установки щодо їх використання.
Хімічна промисловість споживає порівняно трохи ніобію, але це пояснюється тільки його дефіцитністю. З ніобійутримуючих сплавів і рідше з листового ніобію іноді роблять апаратуру для виробництва високочистих кислот. Здатність ніобію впливати на швидкість деяких хімічних реакцій використовується, наприклад, при синтезі спирту з бутадієну. Споживачами елемента N 41 стали також ракетна і космічна техніка. Не секрет, що на навколоземних орбітах вже обертаються якісь кількості цього елемента. З ніобійутримуючих сплавів і чистого ніобію зроблені деякі деталі ракет і бортової апаратури штучних супутників землі.
Монокарбід ніобію NвС – пластична речовина з характерним рожевим блиском. Ця важлива сполука дуже легко утворюється при взаємодії металевого ніобію з вуглеводами. Поєднання доброї ковкості і високої термостійкості з приємними «зовнішніми даними» зробило монокарбід ніобію цінним матеріалом для виготовлення покриттів. Шар цієї речовини товщиною всього 0,5 мм надійно захищає від корозії при високих температурах багато матеріалів, зокрема графіт, який іншими покриттями фактично не захищений. NвС використовується і як конструкційний матеріал в ракетобудуванні і виробництві турбін.
Висока корозійна стійкість ніобію дозволила використовувати його в медицині. Ніобієві нитки не викликають подразнення живої тканини і добре зрощуються з нею. Відновна хірургія успішно використовує такі нитки для зшивання порваних сухожиль, кровоносних судин і навіть нервів.
Ніобій не тільки має комплекс потрібних техніці властивостей, але і має досить гарний вигляд. Цей білий блискучий метал ювелір намагалися використовувати для виготовлення корпусів ручного годинника. Сплави ніобію з вольфрамом або ренієм іноді замінюють благородні метали: золото, платину, іридій. Останнє особливо важливо, оскільки сплав ніобію з ренієм не тільки зовні схожий на металевий іридій, але майже так само стійкий проти зношування. Це дозволило деяким країнам обходитися без дорогого іридію у виробництві напайок для пер авторучок.
В кінці 20-х років нашого століття електро- і газозварювання підвищили якість виробів, прискорили і здешевили процеси їх збирання. Особливо перспективне зварювання при монтажі великих установок, що працюють в корозійно-активних середовищах або під великим тиском. Але тут з'ясувалося, що при зварюванні неіржавіючої сталі зварний шов має набагато меншу міцність, ніж сама сталь. Щоб поліпшити властивості шва, в нержавіючу сталь почали вводити різні домішки. Кращим з них виявився ніобій.
