Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена 15. 00. 02 Фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат |
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Исследование по стандартизации и разработке лекарственных средств на основе листьев, 475.51kb.
- Исследования по разработке и стандартизации комбинированного антимикробного и регенерирующего, 405.42kb.
- «Фармацевтическая химия» специальность – 111201 Ветеринарный врач специализация Ветеринарная, 77.44kb.
Схема 24.
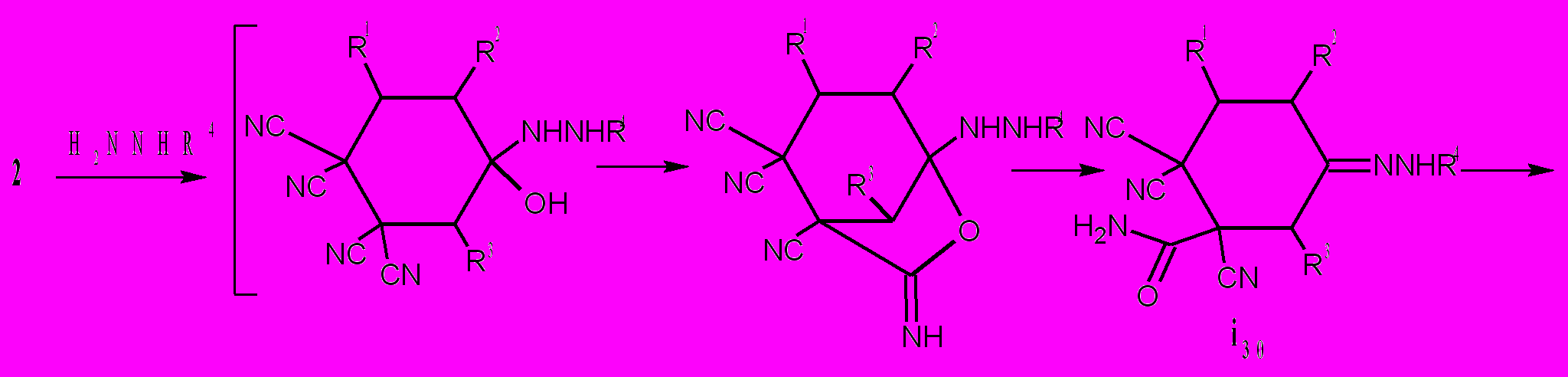
R1 = Ph, R2 = C3H7, R3 = H, R4 = CONH2(а); R1 = R4 = Ph, R2 = H, R3 = CH3(б);
R1= 4-MeOC6H4, R2 = C3H7, R3 = H, R4 = H (в); R1 = R4 = Ph, R2 = C3H7, R3= Н, (г); R1 = 4-MeOC6H4, R2 = C3H7, R3 = H, R4 = CONH2 (д); R1 = Ph, R2 = R4 = Н, R3 = CH3 (е); R1= 4-MeOC6H4, R2 = Н, R3 = i-C3H7, R4 = CONH2(ж)*;
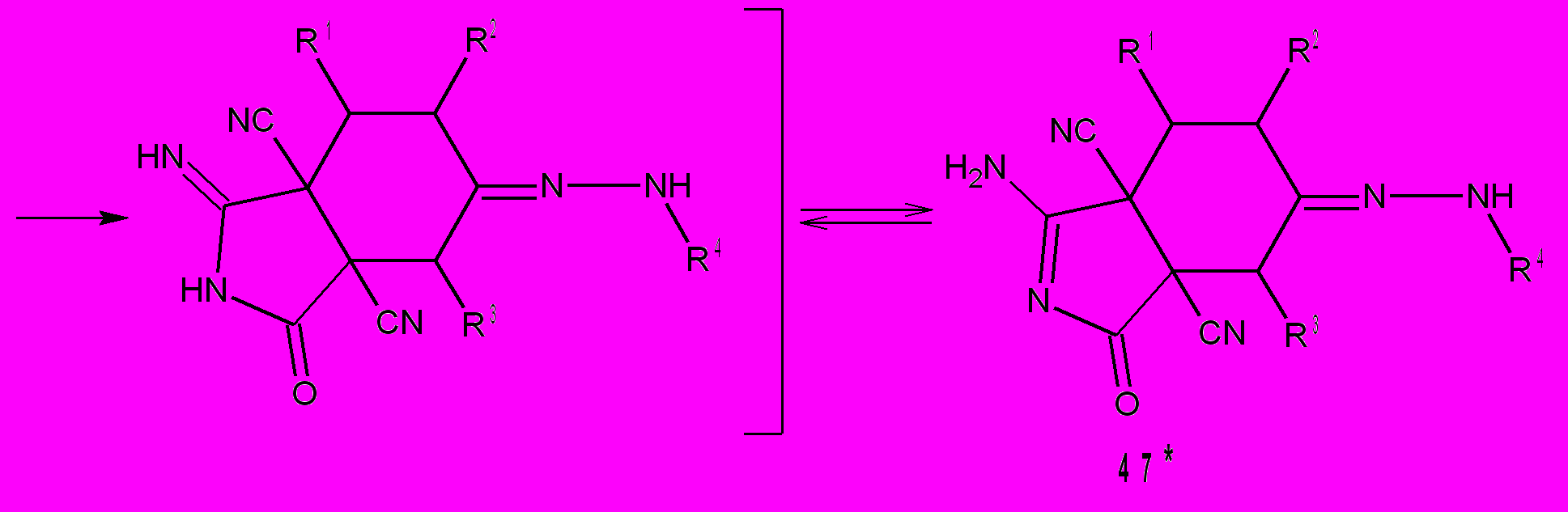
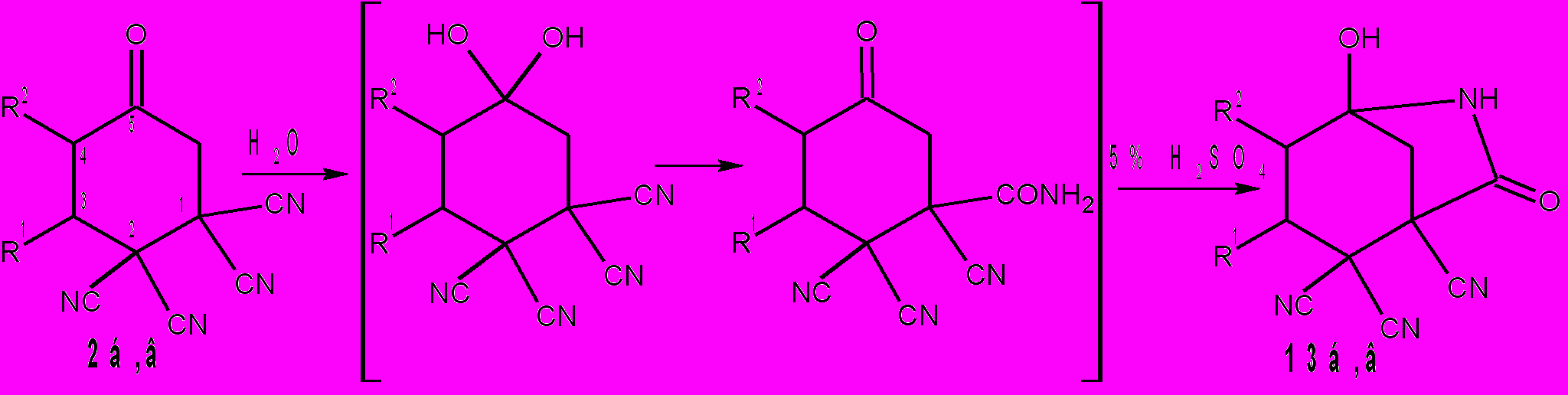
Расстояния между азотом CONH2 и цианогруппой для i29(а) и i30(а) равны соответственно: 4,15 и 2,82Å. Очевидно, что наиболее вероятные взаимодействия между этими фрагментами осуществляется при наименьших значениях межатомных расстояний. Взаимодействие групп CONH2 и C=NH в интермедиате i29 приводит к бициклам 46. В интермедиате i30 группы CONH2 и CN, в сравнении с CONH2 и C=N-NHR, более сближены и поэтому реализуется другой путь реакции – образуются соединения 47. Мы обнаружили, что циклогексаноны 2, с выходами 80-98% превращаются в бициклы 13 под действием воды не только в присутствии HCl, но и H2SO4, которая катализирует этот процесс. Однако в этом случае необходимо нагревание реакционной смеси до 30-50°С в течение 10 мин. Более глубокие превращения протекают в том случае, если циклогексаноны 2 нагревать в диоксане с 30% раствором H2SO4. При этом идет децианирование тетрацианоциклогексанонов 2 до трицианоциклогексанонов 48, причем только одной CN-группы в положении 1 цикла, что, вероятно, обусловлено внутримолекулярным взаимодействием ее с гидратированной карбонильной группой. Процесс гидролиза одной цианогруппы у циклогексанонов 2 до амидов 12 уже известен и описан нами в разделе 1.1.2. поэтому мы считаем, что следующие стадии, протекающие при нагревании циклогексанонов 2 с 30% H2SO4 – это гидролиз амидов 12 до трицианокарбоксциклогексанонов i31 и декарбоксилирование их в трицианоциклогексаноны 48.
Схема 25.
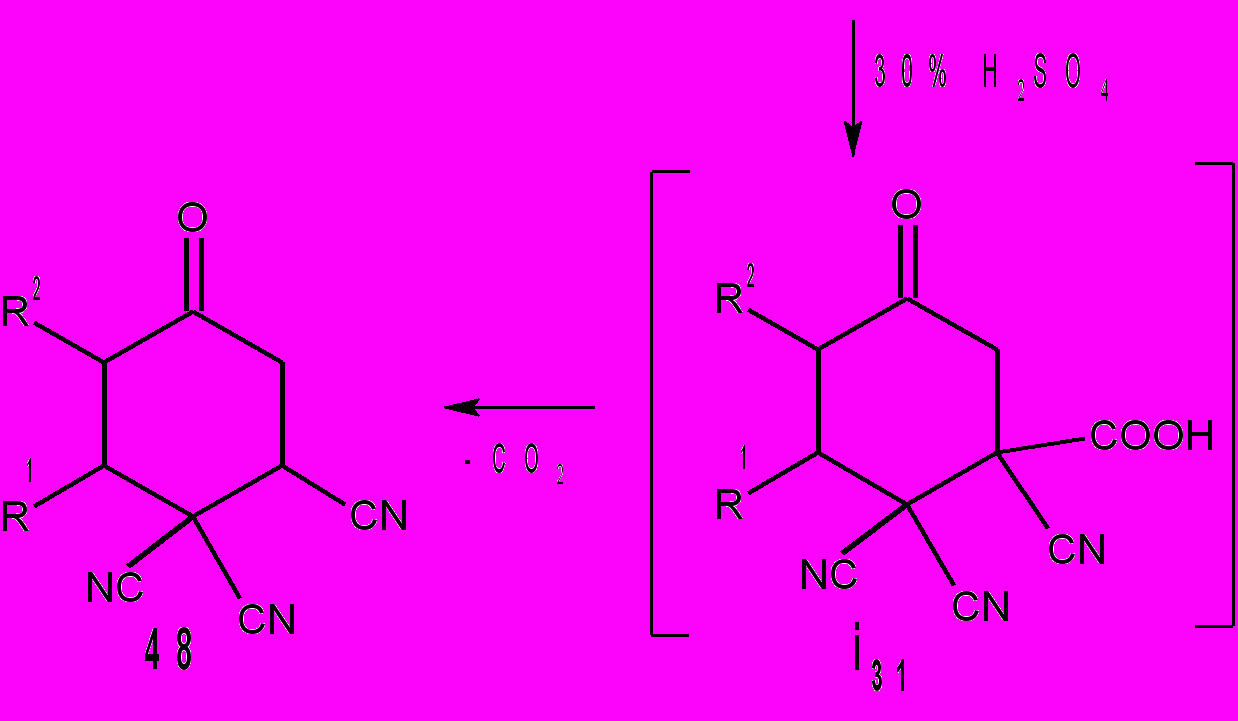
R1 = C6H5, R2 = C3H7 (а); R1 = 4-CH3OC6H4, R2 = C3H7 (б).
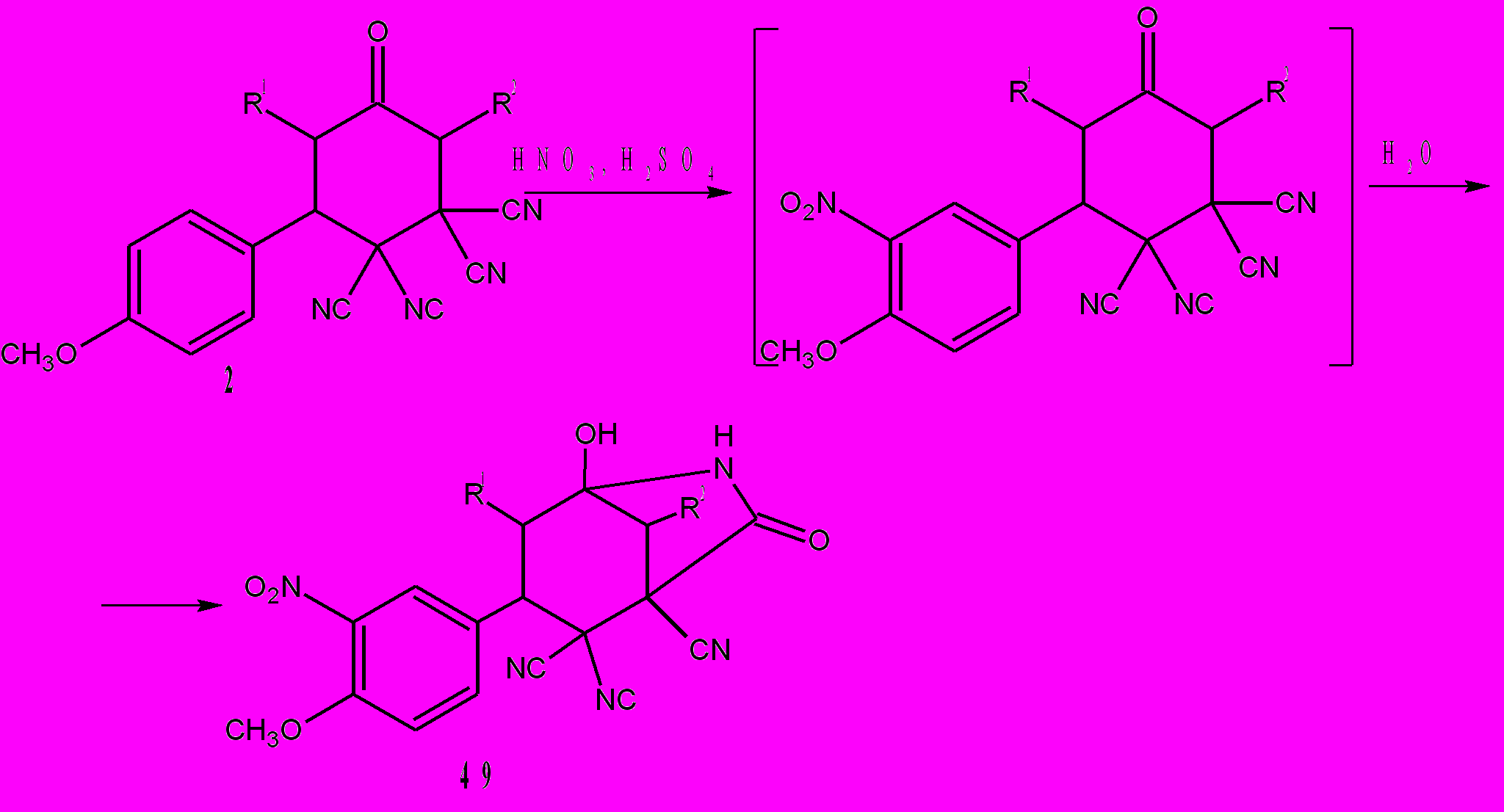
Способность трицианоциклогексанонов 48 к дальнейшим процессам гидролиза CN - групп и последующих различных внутримолекулярных взаимодействий в рамках открытых нами процессов 2→13 отсутствует. Расчеты показывают, что это маловероятно, поскольку расстояние НО···CN для гидратированной формы циклогексанона 48а равно 4,62Å. Выходы соединений 48 71-81%. Необычное свойство циклогексанонов 2, содержащих метоксифенильный заместитель, обнаружено нами при их нитровании. При действии на циклогексаноны 2 нитрующей смеси с выходами 85-95% образуются 4-метокси-3-нитрофенилазабициклы 49.
Схема 26.
R1 = R2 = CH3 (а); R1 = C3H7, R2 = Н (б); R1 = H, R2 = i-C3H7 (в).
Нитрование происходит легко и быстро (30-40˚С, 1мин). По-видимому, при нитровании циклогексанонов 2 на первой стадии происходит нитрование фенильного кольца в орто положение по отношению к ориентанту первого рода – метоксигруппе. На второй стадии при разбавлении реакционной смеси водой, гидролизуется одна цианогруппа и образуются азабициклы 49. Соединения 49 оказались устойчивыми к действию сильных кислот (серной и азотной) и даже при высоких температурах не происходит гидролиз других трех цианогрупп. Таким образом, сопоставляя процессы гидролиза и гетероциклизации циклогексанонов 2 в азабициклы 13 (сх. 6 и 25) протекающие за 5-10 мин с гораздо более быстрыми превращениями (1 мин) 2→49 (сх. 26), можно сделать вывод о том, что в последнем случае происходит их активация за счет нитрования 4-метоксифенильного фрагмента.
3. Биологическая активность синтезированных соединений
В настоящее время в поиске и создании новых лекарств химические соединения тестируются лишь на небольшое число требуемых видов биологической активности, поскольку практически нереально исследовать экспериментально на все виды биологической активности ни одно химическое соединение. Реальную возможность наиболее эффективного исследования биологической активности веществ может обеспечить развитие новых технологий компьютерного прогнозирования с последующим тестированием изучаемых веществ в соответствии с результатами прогноза. Программа PASS (Prediction of Activity Spectra Substances – прогноз спектров биологической активности органических соединений) основана на анализе взаимосвязей ″структура-активность″ c использованием обучающей выборки, содержащей большое количество разнородных химических соединений с различными видами биологической активности. Главное назначение системы PASS состоит в прогнозе спектров активности новых, еще не изученных веществ. Результат прогноза представляется в виде упорядоченного списка названий соответствующих активностей и вероятности Pa ″быть активным″ (″to be active″) и Pi ″быть неактивным″ (″to be inactive″). В него включаются активности, для которых Pa > Pi , Pa > 0,3. Использование системы PASS учеными из Национального института рака США позволило повысить вероятность успеха первичных испытаний в 17 раз. Прогноз спектров биологической активности синтезированных нами соединений показал, что все они должны проявить противоопухолевую активность. Среди спектров предсказанных биологических эффектов наиболее часто, с вероятностью до 91%, программа PASS выдает термин ″антинеопластик″, то есть, из расчетов по этой программе можно сделать вывод о том, что наиболее перспективным направлением изучения возможных воздействий синтезированных нами цианосодержащих карбо- и гетероциклов на биологические объекты является исследование их противоопухолевой активности. Испытания биологической активности синтезированных соединений выполнены в NCI (США) и в Чувашском государственном университете.
3.1. Противоопухолевая активность
Проблема создания новых, более эффективных и менее токсичных препаратов для лечения онкологических процессов остается актуальной. Онкозаболевания поражают все слои населения, нанося огромный ущерб обществу. Ежегодно в промышленно развитых странах количество смертельных исходов от злокачественных новообразований достигает 23-29% от всех случаев гибели людей, вызванной болезнями. Один из основных недостатков многих противоопухолевых препаратов состоит в их высокой токсичности. Например, у сарколизина, применяемого при лечении рака яичников ЛД50=23мг/кг, а колхицин проявляет притивомитотические свойства при злокачественных заболеваниях кожи и кишечника и имеет летальную дозу для человека 1мг/кг (Георге Могош, 1984). В настоящее время в поисках новых противораковых препаратов особое внимание стали уделять исследованию циансодержащих соединений. Цианогруппа, в ряде случаев может способствовать проявлению противоопухолевой активности. Выделенные из семян и косточек некоторых растений семейства розоцветных, подсемейства сливовых, цианогенные глюкозиды – линамарин, лотаустралин, гетеродентрин, дуррин, амигдалин, тетрафилин А (Племенков В.В., 2001) используются в экспериментальной онкологии. Вероятно, их действие основано на том, что опухолевые клетки обладают способностью расщеплять цианогенные глюкозиды значительно активнее, чем здоровые, превращаясь при этом в своеобразные концентраторы синильной кислоты. Избирательно концентрируясь в опухолевых клетках, синильная кислота замедляет рост и даже приводит к гибели, практически не повреждая здоровые клетки. В медицинской практике (Машковский М.Д., 2007) в химиотерапии онкологических заболеваний используются цианосодержащие препараты анастразол, летрозол (рак молочной железы), бикалутамид (рак предстательной железы), тойокамицин (лейкемия). Перспективность синтеза новых цианосодержащих соединений и исследования их противоопухолевой активности показана, например, в работе Моргана и соавт. (J. Med. Chem., 1991). На основе винилпорфиринов ими были синтезированы аддукты Дильса-Альдера с диметилацетилендикарбоксилатом и c ТЦЭ. Последние оказались намного более эффективными в фотодинамической терапии опухолей мочевого пузыря крыс, инициированных N-[4-(5-нитро-2-фурил)-2-тиазолил]формамидом. Тетрацианоэтиленовый аддукт, введенный в дозе 1 мг/кг после облучения опухолей в течение 30 мин светом длиной волны 590 нм вызвал их полное уничтожение. Сами порфирины и его другие нецианосодержащие аддукты Дильса-Альдера вызывали в лучшем случае 50% поражение опухолей.
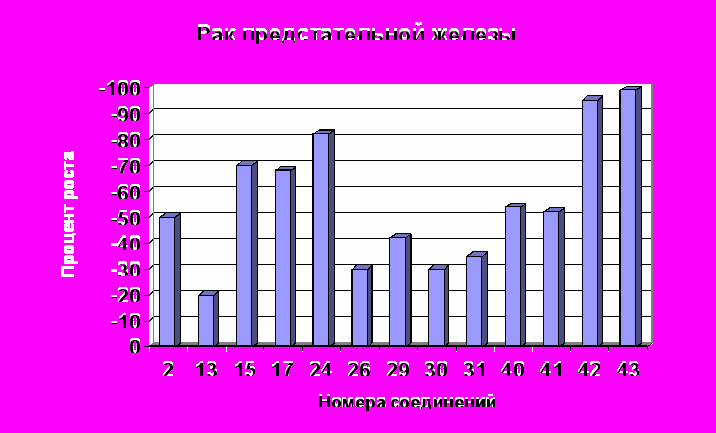
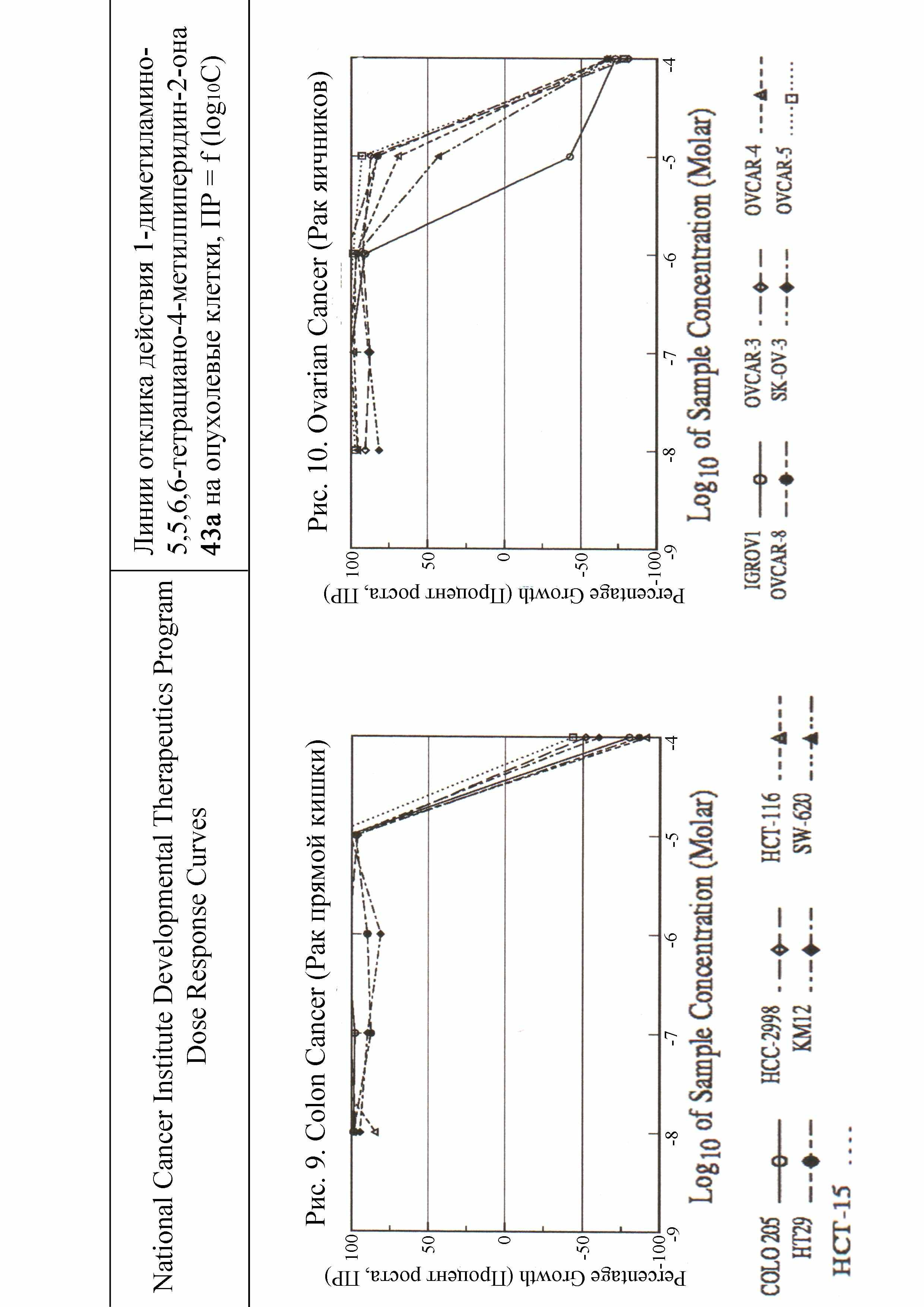
При испытании в NCI синтезированных нами соединений на противоопухолевую активность использовалась модель in vitro позволяющая стандартизировать условия эксперимента для повторяющихся серий. Исследования проведены на 60 клеточных линиях, полученных из твердых опухолей легких, прямой кишки, мозга, яичников, почек, предстательной железы, молочной железы, а также лейкемии и меланомы человека. Определяли процент роста (ПР) опухолевых клеток и критерии GI50, TGI, LC50 (GI50 – концентрации исследуемых веществ, при которых подавление развития опухолевых клеток составляет 50%; TGI – концентрации полностью подавляющие рост опухолевых клеток; LC50 – концентрации, вызывающие гибель 50% опухолевых клеток). Опухолевые клетки выдерживали на пластинках с микрочашечками в присутствии исследуемых веществ и без них. Антиопухолевая активность выявлялась по подавлению роста (гибели) опухолевых клеток, определяемой спектрофотометрически. В качестве реагента для определения конечной точки клеточного роста в исследованиях использовали розовый анионный краситель сульфородамин В (SRB), который присоединяется только к живым клеткам. После промывки присоединившийся краситель определяли спектрофотометрически. Анализ основан на цитотоксическом действии исследуемых веществ на опухолевые клетки. Число живых клеток в культуре определяли по интенсивности флуоресценции сульфородамина В в промывной жидкости. Чем выше интенсивность флуоресценции, тем меньше живых клеток, захвативших краситель из раствора. Результаты скрининга показали, что все исследованные полицианосодержащие карбо- и гетероциклы 2, 4, 6, 8, 12, 13, 15, 17, 20-22, 24, 26, 29, 30, 31, 33, 34, 36, 37, 40-49 проявляют противоопухолевую активность. Для соединений 2, 4, 6, 8, 15, 17, 24, 37, 42, 43 она более высокая: на уровне известных препаратов и выше. Значения LC50 этих соединений в основном расположены в интервале 1,0·10-4М ÷ 6,0·10-6М. Их активность связана с наличием в структурах 1,1,2,2-тетрацианоэтильного фрагмента и почти не зависит от других заместителей R1, R2, R3 – Alk или Ar. Основной структурный фактор ответственный за сравнительно более высокую противоопухолевую активность соединений 2, 4, 6, 8, 15, 17, 24, 37, 42, 43 среди цианосодержащих карбо- и гетероциклов – это 1,1,2,2-тетрацианоэтильный фрагмент. Наиболее чувствительны к этим веществам опухолевые клетки рака предстательной железы (Prostate Cancer - PC), рака почек (Renal Cancer - RC), рака кишечника (Colon Cancer - CC), рака яичников (Ovarian Cancer - OC). В таблице 5 приведены данные о наиболее активных соединениях 2, 15, 17, 24, 42, 43 и некоторых их производных 36, 40, 45, 48. В рядах полицианозамещенных карбо- и гетероциклов противоопухолевая активность в наибольшей степени зависит от нитрильных групп и более всего от их расположения, наибольший эффект которых проявляется, когда четыре нитрильные группы сосредоточены в положениях 1,1,2,2. У тетрацианозамещенных карбо- и гетероциклов 2, 15, 17, 24, 42, 43 противоопухолевая активность, определенная на опухолевых клетках рака почек, рака предстательной железы, рака кишечника, рака яичников по сравнению с известными препаратами, такими как фторурацил, бусульфан, тиогуанин, меркаптопурин, пироксантрон, зорубицин и др., как правило, выше в несколько раз (табл. 5). По действию на опухолевые клетки рака почек клеточной линии CAKI-1 пиперидин-2-он 43а (LC50 = 0,854·10-5М) и гидразон 42а (LC50 = 0,607·10-5М) активнее фторурацила соответственно в 11 и 16 раз. Полученные из тетрацианозамещенных карбо- и гетероциклов 2, 15, 43 соединения 36, 45, 48 1,1,2,2-тетрацианоэтильный фрагмент не имеют и как следствие этого их противоопухолевые свойства незначительны. Все критерии LC50 и даже GI50, TGI 60 клеточных линий опухолей легких, кишечника, мозга, яичников, почек, предстательной железы, молочной железы, лейкемии, меланомы соединений 36, 45, 48 больше 10·10-5М. Средние значения ПР опухолевых клеток рака почек и предстательной железы при концентрации исследуемых веществ 2, 13, 15, 17, 24, 26, 29, 30, 31, 40, 41, 42, 43 1,0·10-4М приведены на рис. 5,6. Величина ПР = -50 означает LC50 = 1,0·10-4М и соответствует, например, фторурацилу, тиогуанину, меркаптопурину. Наивысшую противоопухолевую активность имеют соединения 42, 43, ПР для которых достигает -100, то есть опухолевые клетки полностью гибнут. Вероятно это можно объяснить тем, что фрагменты сформированные из N,N-диалкилгидразина, так же как и 1,1,2,2-тетрацианоэтильный фрагмент придают соединениям противоопухолевые свойства.
Для синтеза соединений 42, 43 мы использовали ЭТК, α,β-непредельные альдегиды и диалкилгидразины, как известно, являющимися канцерогенами. Практика создания противоопухолевых препаратов, содержащих в своих структурах алкилгидразинные фрагменты уже известна. Такие препараты как дакарбазин и прокарбазин используются при лечении меланом, лимфатических тканей, опухолей мозга, легких и различных других злокачественных новообразований. Наличие в этих препаратах гидразинных фрагментов способствует накоплению их в опухолевых клетках, их самоокислению и внутриклеточному образованию перикисных и гидроперекисных радикалов, что по существу имитирует эффект ионизирующей радиации. В итоге, по противоопухолевой активности всех синтезированных нами карбо- и гетероциклов можно выделить три основных момента: 1) самую высокую активность со значениями LC50 доходящими до 10-6М имеют соединения содержащие в своих структурах фрагменты ЭТК и N,N-диалкилгидразина; 2) активность соединений почти не зависит от алкильных и арильных заместителей; 3) тетрацианозамещенные карбо- и гетероциклы наиболее эффективны по отношению к опухолевым клеткам рака почек, предстательной железы, кишечника и яичников.
Эффективное ингибирование роста опухолевых клеток и их гибель под действием 1,1,2,2-тетрацианозамещенных карбо- и гетероциклов основано, вероятно, на взаимодействии 1,1,2,2-тетрацианоэтильного фрагмента с нуклеофильными центрами клеточных мишеней, в первую очередь с ДНК. Это приводит к неправильному считыванию информации с ДНК и опухолевые клетки погибают из-за вмешательства в репликацию ДНК и митоза. Данная версия подтверждается тем, что 1-диметиламино-5,5,6,6-тетрациано-4-метилпиперидин-2-он 43а, обладающий высокими противоопухолевыми свойствами, легко присоединяет по цианогруппам нуклеофилы – воду или метанол с образованием 5-амино-1-(диметиламино)-4-метил-3,4-дигидро-1Н-пирроло[3,4-b]пиридин-4а,7а(2Н,7Н)-дикарбонит-рилов 44, 45 не имеющих значительной противоопухолевой активности. Для этих соединений на всех клеточных линиях LC50 и TGI больше 1,0·10-4 М. Противоопухолевая активность соединений, содержащих менее четырех нитрильных групп (ди- и тризамещенные), в основном, значительно ниже чем у тетрацианозамещенных. Лишь по отношению к некоторым опухолевым культурам и не на всех клеточных линиях противоопухолевая активность трицианозамещенных карбо- и гетероциклов 29, 31, 40, 41 близка к известным препаратам: диоксабициклы 29 (рак почек, рак предстательной железы, LC50 = 1,0·10-4 ÷ 3,77·10-5М), азапентален 31 (рак почек, рак предстательной железы, рак молочной железы LC50 = 1,0·10-4 ÷ 5,1·10-5 М), циклопентены 40 (рак почек, рак предстательной железы, LC50 = 1,0·10-4 ÷ 2,68·10-5М), пирролидины 41 (рак почек, рак предстательной
Табл.5. Данные по противоопухолевой активности, острой токсичности 1,1,2,2-тетрацианозамещенных карбо- и гетероциклов 2, 15, 17, 24, 42, 43 и их производных 36, 40, 45, 48.
| № соединений | Структурная формула | LC50, минимальная концентрация (10-5М) | Токсичность ЛД50 (мг/кг) | |||
| PC | RC | CC | OC | |||
| 15а-и |  | 5,77 | 5,31 | 4,50 | 6,56 | 850-950 |
| 36а,б |  | >10 | >10 | >10 | >10 | 750 |
| 17а-в |  | 7,11 | 6,68 | 5,61 | 7,88 | 1000-1100 |
| 42а-в |  | 5,93 | 0,607 | 4,12 | 5,16 | 1500-1600 |
| 40а-в |  | 7,27 | 2,68 | 4,01 | 9,4 | 350-400 |
| 24 |  | 2,85 | 2,80 | 2,80 | 2,80 | 350 |
| 2а-к |  | 10 | 9,05 | 10 | 8,13 | 500-550 |
| 48а,б |  | >10 | >10 | >10 | >10 | 750-780 |
| 43а-в |  | 5,73 | 0,854 | 1,73 | 6,08 | 1600-1700 |
| 45 |  | >10 | >10 | >10 | >10 | 1100 |
| Фторурацил | 10 | 10 | 10 | 10 | 230 | |
| Бусульфан | 25,1 | 25,1 | 25,1 | 25,1 | 120 | |
Рис. 5. Результаты, полученные после 48 ч воздействия исследуемых веществ при концентрации 1∙10-4 М на опухолевые клетки рака почек (средние значения).
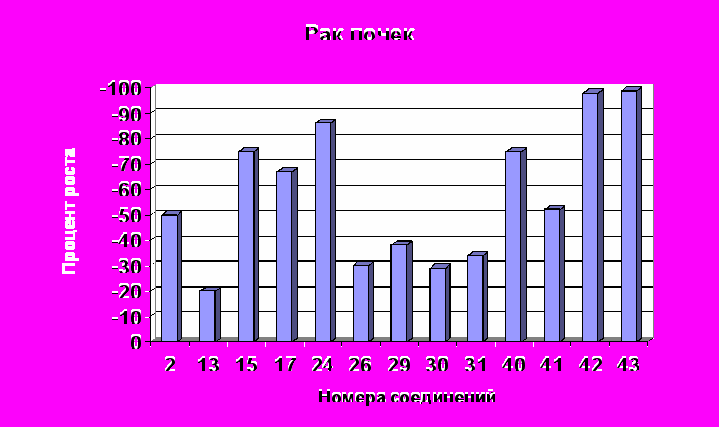
Рис. 6. Результаты, полученные после 48 ч воздействия исследуемых веществ при концентрации 1∙10-4 М на опухолевые клетки рака предстательной железы (средние значения).
железы, LC50 = 1,0·10-4 ÷ 5,15·10-5М). Токсичность изучали на белых беспородных самцах крыс массой 250 г при внутрибрюшном введении. Сравнивали острую токсичность испытанных соединений с ЛД50 известных препаратов. Соединения вводили в виде взвеси 2% крахмальной слизи из расчета 0,1мл на 10 г. Показателем токсичности служила доза, вызывающая гибель 50% животных (ЛД50). Судя по ЛД50 испытанных соединений, они согласно классификации Сидорова К.К. относятся к классу малотоксичных или практически нетоксичных веществ. Токсичность синтезированных соединений зависит от их устойчивости. Наименее токсичны гидразоны 42 и пиперидин-2-оны 43 (ЛД50 = 1500 ÷ 1700 мг/кг; табл. 5). Хранить их можно при комнатной температуре в течение нескольких лет (десять и более) без каких-либо признаков разложения (масс-, ЯМР-спектроскопия, хроматография). Самую высокую токсичность имеют соединения 24, 40 (ЛД50 = 350 ÷ 400 мг/кг; табл. 5). После их получения, уже через 2-3 дня, при комнатной температуре они начинают разлагаться – происходит изменение цвета и температуры плавления.
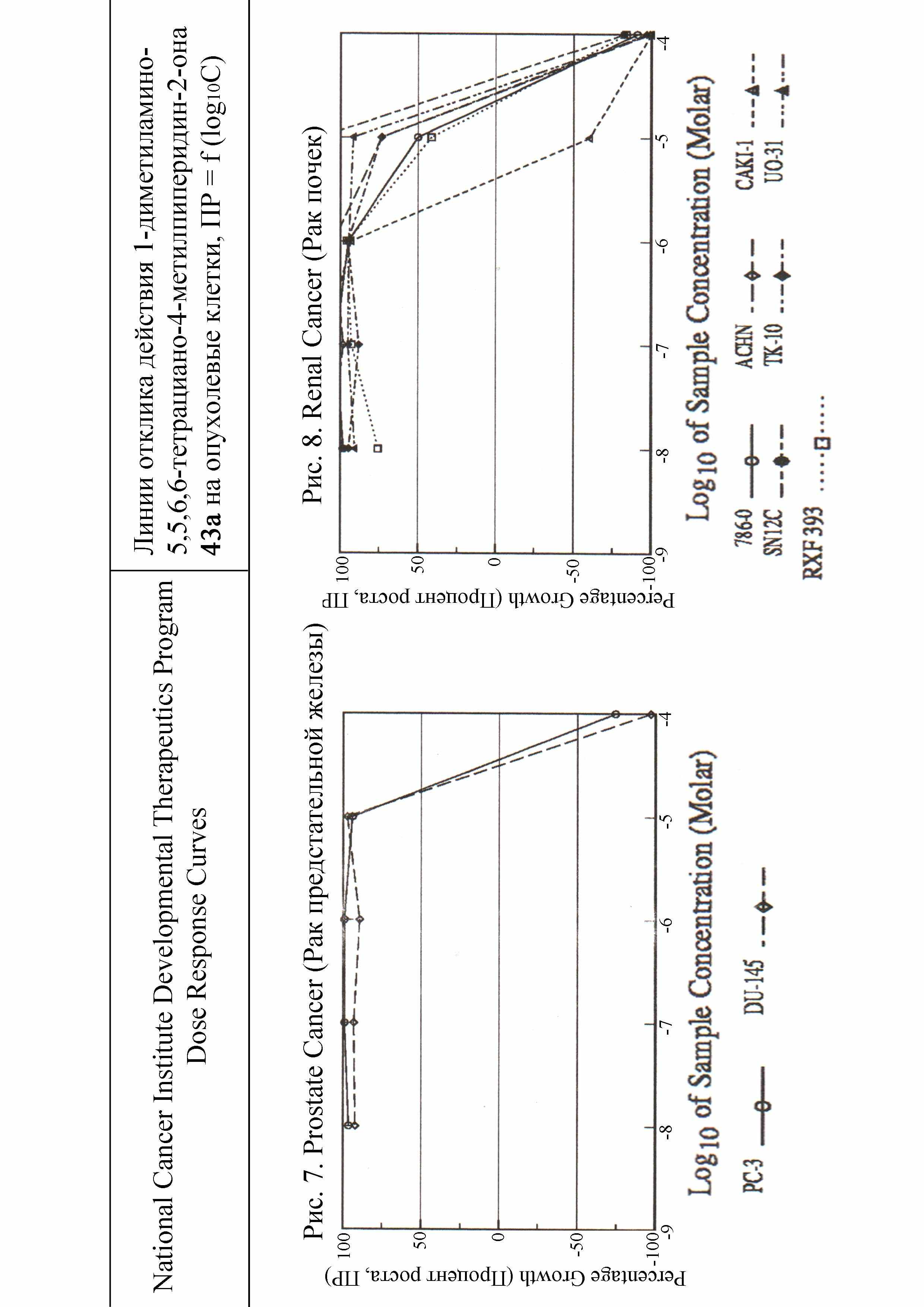
Терапевтический индекс, то есть промежуток между возможными лечебными и летальными дозами наиболее высок у 1-(2,2-диалкилгидразоно)-4-R-2,2,3,3-тетрацианоциклопентанов 42 и 1-диметиламино-5,5,6,6-тетрациано-4-R-пиперидин-2-онов 43. Соединения 42, 43 имеют наименьшие значения LC50 и в тоже время их ЛД50 наиболее высоки (табл.5) и по классификации Сидорова К.К. относятся к практически нетоксичным. Противоопухолевый эффект гидразонов 42 и пиперидин-2-онов 43 при изменении концентрации от 10-6М до 10-4М имеет четкую динамику подавления развития и полной гибели опухолевых клеток рака предстательной железы (рис.7), рака почек (рис.8), рака прямой кишки (рис.9), рака яичников (рис.10). Эти соединения по условной широте фармакологического действия превосходят используемые в медицинской практике противоопухолевые препараты. Для углубленных фармакологических исследований рекомендуются 1-(2,2-диметилгидразоно)-4-метил-2,2,3,3-тетрацианоцик-лопентан и 1-диметиламино-5,5,6,6-тетрациано-4-метилпиперидин-2-он.
3.2. Активность синтезированных соединений по отношению к ВИЧ-1
В 1964 г. в рамках поиска противораковых средств в США был синтезирован 1-(3´-азидо-2´-дезоксирибозил)тимидин (зидовудин). Однако, наиболее широкое применение он нашел для лечения от ВИЧ-1. В США его промышленное производство в 1997 г. составило 40 т (в России в 1997 г. – 0,3 т). Кроме этого препарата при лечении от ВИЧ-1 используют много других аналогичных антиметаболитов (идоксуридин, пенцикловир, эпервудин, диданозин, ставудин и т.д.). Они также, как и ряд противоопухолевых препаратов (фторурацил, фторафур, цитарабин, меркаптопурин, тиогуанин и др.), являются производными урацила и пурина. Вероятно, еще и поэтому в NCI (США), наряду с испытаниями новых синтезированных веществ на рак, проводятся широкие исследования на ВИЧ-1. Параллельно с
Табл. 6. Данные по активности на ВИЧ-1 соединений 41, 44, 45
| № соед. | Структура | Концентрация (моль) | Процент защиты | Острая токсичность ЛД50 (мг/кг) |
| 41а |  | 6,35·10-8 | -3,54 | 1500 |
| 2,00·10-7 | 1,24 | |||
| 2,00·10-5 | 1,32 | |||
| 6,32·10-5 | 13,76 | |||
| 2,00·10-4 | 50,06 | |||
| 41б |  | 6,35·10-8 | -3,61 | 1300 |
| 6,34·10-7 | 2,80 | |||
| 2,00·10-5 | 1,41 | |||
| 6,32·10-5 | 12,82 | |||
| 2,00·10-4 | 49,57 | |||
| 41в |  | 6,35·10-8 | -2,33 | 1400 |
| 2,00·10-7 | 1,19 | |||
| 2,00·10-5 | 1,33 | |||
| 6,32·10-5 | 13,85 | |||
| 2,00·10-4 | 49,34 | |||
| 44 |  | 6,35·10-8 | -1,57 | 1300 |
| 2,00·10-7 | 3,03 | |||
| 2,00·10-5 | 13,20 | |||
| 6,32·10-5 | 21,11 | |||
| 2,00·10-4 | 50,08 | |||
| 45 |  | 6,35·10-8 | -2,62 | 1100 |
| 2,00·10-7 | 3,66 | |||
| 2,00·10-5 | 14,56 | |||
| 6,32·10-5 | 22,42 | |||
| 2,00·10-4 | 52,15 | |||
| Зидовудин | 2,00·10-4 | 90 | 750 | |
испытаниями противоопухолевой активности синтезированные нами соединения были подвергнуты в NCI скринингу на ВИЧ-1. Лимфоциты Т-4 (клеточная линия СEM) смешивали с ВИЧ-1 в соотношениях 1:20. Раствор испытуемых веществ в ДМСО добавляли к равному объему среды, содержащей зараженные или незараженные клетки. Культуры инкубировали 6 или 7 дней при 37°С в атмосфере, содержащей 5% диоксида углерода. Затем добавляли индикатор. Количество лимфоцитов определяли спектрофотометрически и, кроме того, живые клетки рассматривали и считали под
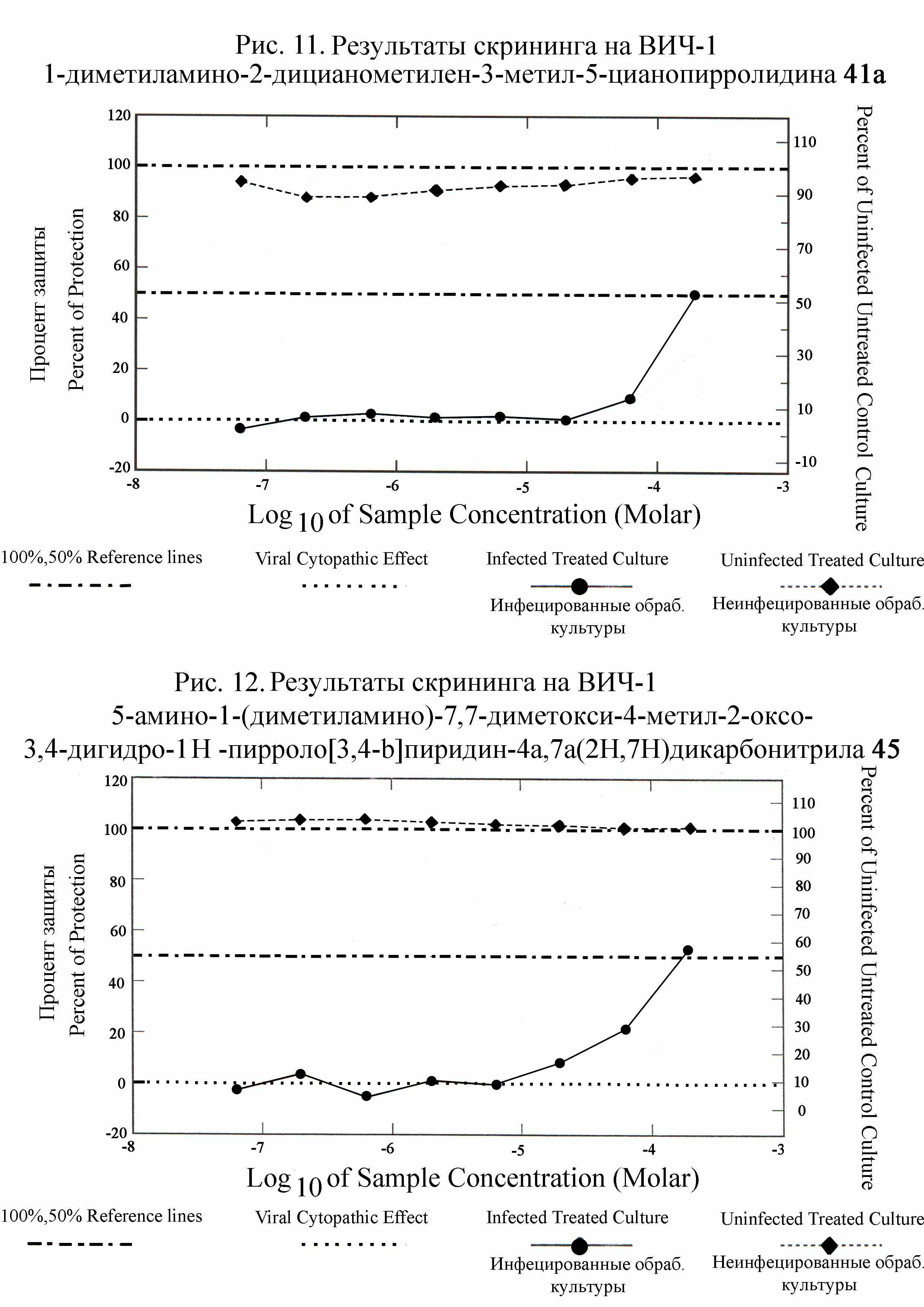
микроскопом. Установлено, что почти у всех соединений цитопатический эффект на ВИЧ-1 отсутствует. Подавление вирусной репродукции обнаружено для 1-диметиламино-2-дицианометилен-5-цианопирролидинов 41 и 5-амино-1-(диметиламино)-4-метил-3,4-дигидро-1Н-пирроло[3,4-b]пири-дин-4а,7а(2Н,7Н)дикарбонитрилов 44, 45. Процент защиты у них при концентрации 2,0·10-4М ~ 50% (табл.6; рис. 11,12). Пирролидины 41 и дигидропирролопиперидины 44, 45 по сравнению с зидовудином в 1,5 ÷ 2 раза менее токсичны. Это новые классы анти-ВИЧ активных соединений. От других синтезированных на основе ТЦЭ карбо- и гетероциклов 2, 4, 6, 8, 13, 15, 17, 21, 24, 26, 29, 30, 31, 34, 35, 36, 40, 42, 43, 46, 47, 48, неактивных на ВИЧ-1, их отличает наличие двух или трех нитрильных групп и N,N-диметилгидразинного фрагмента. Приведенные данные указывают на целесообразность дальнейших исследований по поиску новых анти-ВИЧ активных средств среди ди- и трицианозамещенных азотсодержащих гетероциклов, в структуре которых есть фрагмент N,N-диметилгидразина.
3.3. Антимикробная активность
Известно, что некоторые противоопухолевые и противомикробные препараты являются структурными аналогами, например тетрациклины. Следовательно, существует определенная вероятность обнаружения среди антинеопластиков соединений с антимикробной активностью. Об антимикробных свойствах цианосодержащих соединений известно на примерах цианогенных глюкозидов (Phytochemistry, 1998). Кроме того, следует учитывать, что многие лекарственные вещества, в том числе противоопухолевые и противомикробные, дают побочные эффекты и их широкое применение ведет к распространению устойчивых форм микроорганизмов. Вероятность появления таких форм можно уменьшить проведением химиотерапии с использованием новых препаратов. Фармакологическому скринингу на наличие антимикробной активности были подвергнуты представители всех классов синтезированных соединений. Исследования проводили методом двукратных серийных разведений в мясо-пептонном бульоне на эталонных штаммах золотистого стафилококка (Staphylococcus aureus), стрептококка (Streptococcus) дифтероидов (Df), синегнойной палочки (Ps. aeruginosa). Результаты опытов учитывали после 18-20 ч выдержки контрольных и опытных образцов в термостате при 36-37 0С. Регистрировали наличие или отсутствие роста бактериальных культур за счет бактериостатического действия соединения. За действующую дозу принимали минимальную ингибирующую концентрацию соединения (МИК, мкг/мл), которая задерживает рост бактериальных культур. В качестве эталона сравнения использовали этакридина лактат, фурацилин. Исследования показали (табл.7), что наивысшую антимикробную активность (МИК 155-310 мкг/мл) имеют карбо- и гетероциклы содержащие четыре цианогруппы – циклогексаноны 4, 6, 8 (st. aureus, strept.), циклопропаны 15 (st. aureus), циклобутаны 17, 37 (st. аureus, Df), бицикло[3.2.1]октан-1,8,8-триол 24
Табл. 7. Противомикробная активность и острая токсичность
синтезированных соединений
| Соеди-нение | Минимальная ингибирующая концентрация, МИК, мкг/ мл | Токсич-ность, ЛД50*, мг/ кг | |||
| Staphylo-coccus aureus | Strepto-coccus | Psend. аeruginosa | Дифте-роиды | ||
| 2а | 625 | 625 | 625 | 625 | 500 |
| 2к | 625 | 625 | 625 | 625 | 500 |
| 4в | 310 | 625 | 625 | 625 | 500 |
| 6 | 310 | 310 | 625 | 1250 | 800 |
| 8а | 310 | 625 | 625 | 625 | 700 |
| 13а | 1250 | 2500 | 2500 | 2500 | 750 |
| 13к | 1250 | 1250 | 625 | 625 | 700 |
| 15а | 310 | 625 | 625 | 625 | 950 |
| 15ж | 310 | 625 | 625 | 625 | 850 |
| 17б | 310 | 625 | 625 | 310 | 1100 |
| 21 | 625 | 625 | 2500 | 1250 | 550 |
| 24 | 310 | 625 | 625 | 310 | 350 |
| 26 | 1250 | 1250 | 2500 | 625 | 450 |
| 29г | 625 | 2500 | 625 | 1250 | 550 |
| 29н | 625 | 2500 | 625 | 1250 | 500 |
| 31 | 1250 | 1250 | 2500 | 625 | 600 |
| 34б | 625 | 625 | 1250 | 625 | 550 |
| 35а | 2500 | 2500 | 2500 | 2500 | 600 |
| 36а | 625 | 625 | 625 | 1250 | 400 |
| 37 | 310 | 625 | 625 | 310 | 600 |
| 40а | 625 | 625 | 625 | 625 | 350 |
| 41а | 1250 | 625 | 625 | 1250 | 1500 |
| 42а | 310 | 625 | 625 | 1250 | 1600 |
| 42б | 155 | 310 | 310 | 625 | 1500 |
| 43а | 310 | 625 | 1250 | 1250 | 1700 |
| 43б | 155 | 310 | 625 | 625 | 1650 |
| 43в | 155 | 155 | 310 | 310 | 1600 |
| 45 | 2500 | 2500 | 2500 | 2500 | 1100 |
| 46а | 1250 | 1250 | 625 | 625 | 550 |
| 47а | 1250 | 625 | 625 | 625 | 450 |
| 48а | 1250 | 625 | 625 | 625 | 750 |
| Этакр. лактат | 2000 | - | - | - | - |
| Фура-цилин | 310 | 310 | 155 | 155 | 600 |
* Для белых беспородных крыс-самцов, массой 250 г
(st. аureus, Df), циклопентаны 42 (st. aureus, strept., psend. aeru.), пиперидин-2-оны 43 (st. aureus, strept., psend. aeru., Df.). С увеличением углеродной цепи алкильных заместителей R1, R2 в рядах соединений 42, 43 их антимикробная активность увеличивается. В целом антимикробная активность тетрацианозамещенных карбо- и гетероциклов близка к активности этакридина лактата и фурацилина, но соединения 4, 6, 8, 17, 24, 42, 43 менее токсичны (табл.7). Соединения, содержащие в своем составе меньшее число нитрильных групп антимикробный эффект проявляют слабее, их МИК от 625 до 2500 мкг/мл (табл.7). Установленная закономерность зависимости антимикробной активности цианосодержащих карбо- и гетероциклов от их строения может быть использована в дальнейшем поиске новых антимикробных веществ, прежде всего в направлении синтеза неизвестных ранее 1,1,2,2-тетрацианозамещенных циклических соединений.
Выводы
- В ряду органических нитрилов выявлены соединения, обладающие наиболее высокой химической и биологической активностью – это ТЦУ.
- Наличие четырех нитрильных групп у 5-оксо-1,1,2,2-циклогексантетракарбонитрилов придает им способность легко присоединять по карбонильной группе воду и образовывать устойчивые при хранении диолы, у которых в кислой среде, при комнатной температуре, протекает необычно легкий внутримолекулярный гидролиз одной аксиальной цианогруппы до 1,2,2-трициано-5-оксо-1-циклогексанкарбокс-амидов и гетероциклизация последних за счет CONH2···C=O взаимодействия в 5-гидрокси-7-оксо-6-азабицкло[3.2.1]октан-1,2,2-трикарбонит-рилы.
- Заместители α-Cl, β-Br, а также карбонильная группа в α- или δ-положении у алканонов ориентируют реакции циклоприсоединения их к ТЦЭ с образованием соответственно трех-, четырех-, пяти- и шестичленных тетрацианозамещенных алициклов.
- Найдено, что наиболее подходящими реагентами для модификации кетонов в том числе природных и биологически активных, через ОАТ в карбо- и гетероциклы являются альдегиды. Реакции ОАТ с альдегидами позволяют быстро, в мягких условиях и с высокими выходами получить цианосодержащие производные пиранов, циклопентенов и 1-азапенталенов.
- Необычно легкая дециклизация 1-(2,2-диалкилгидразино)-2,2,3,3-тетрацианоциклопентанов по связи С1-С2, фиксируемая методом ЯМР1Н даже при -60°С, обусловлена близким расположением сильных электроноакцепторного и электронодонорного фрагментов – соответственно тетрацианоэтильного и N,N-диалкилгидразинного. На основе этого эффекта разработаны новые подходы к труднодоступным биологически активным полицианосодержащим N,N-диалкилгидразино- и N,N-диал-киламинозамещенным циклопентенам, пирролидинам, циклопентанам и пиперидин-2-онам.
- Наличие у карбо- и гетероциклов 1,1,2,2-тетрацианоэтильного фрагмента обуславливает их значительные антимикробные свойства и более высокую, чем у известных препаратов противоопухолевую активность по отношению к опухолевым клеткам рака предстательной железы, рака почек, рака кишечника, рака яичников.
- Установлены основные фрагменты молекул, определяющие вид фармакологического действия, которые можно отнести к фармакофорным. Носителем противоопухолевой и антимикробной активности в карбо- и гетероциклах является 1,1,2,2-тетрацианоэтильный фрагмент, эффект которого усиливается структурной составляющей N,N-диалкилгидразина. Носитель анти-ВИЧ активности в цианозамещенных азотсодержащих гетероциклах – фрагмент N,N-диметилгидразина.
- Для углубленных фармакологических исследований предлагаются 1-(2,2-диметилгидразоно)-4-метил-2,2,3,3-тетрацианоциклопентан и 1-диметиламино-5,5,6,6-тетрациано-4-метилпиперидин-2-он, проявляющие широкий спектр противоопухолевого действия, более активные и менее токсичные, чем известные препараты.
